由干细胞制备心肌细胞的方法和组合物及其用途与流程
本申请要求2010年6月13日提交的、名称为“干细胞高效分化为心房和心室的心肌细胞的方法”的中国专利申请201010207603.0的优先权。上述中国专利申请的公开内容通过引用整体并入。
技术领域:
本申请涉及用于提高干细胞的心肌分化效率以及促进干细胞形成心房肌细胞和心室肌细胞的新组合物和方法,以及所述干细胞分化的心房肌细胞、心室肌细胞本身及其应用,例如用于心脏损伤修复与筛选治疗心脏损伤的新疗法。
背景技术:
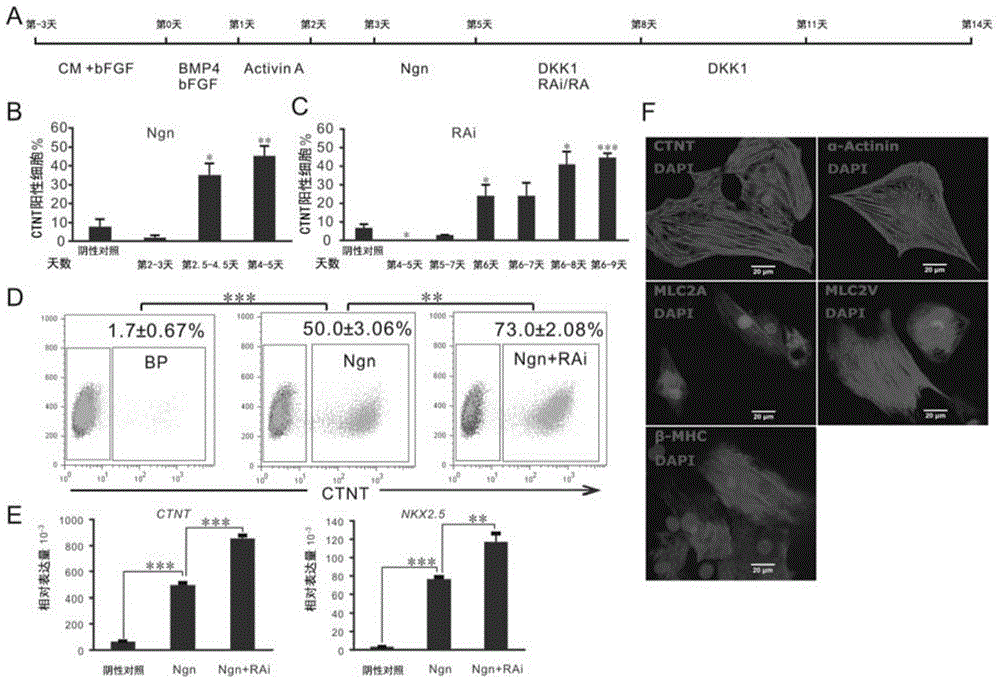
:利用现有的技术从人类胚胎干细胞(hESCs)分化心肌细胞只能获得非特异性分化的由胚胎心房样心肌、心室样心肌以及起搏细胞亚型组成的混合心肌细胞6-9。猪移植研究表明,植入这样的由人类胚胎干细胞分化的混合心肌细胞具有起搏活性,这种活性使心肌细胞移植具有导致室性心律失常的潜在风险10。因此,hESCs分化得到的心肌细胞的这种心肌亚型异质性阻碍了hESCs在心肌修复中的应用1。为引导hESCs分化为所需的心肌亚型,必须揭开心肌亚型特化的分子调控机制。尽管已确定多种生长因子如ActivinA、骨形态发生蛋白4(BMP4)、wnt-3a、碱性成纤维细胞生长因子(bFGF)以及dickkopf同系物1(DKK1)可促进心脏发生并用于多种hESC心肌分化方案7,8,11,至今仍没有证据表明这些或其它生长因子在hESC分化期间调节心肌亚型特化。确定心肌亚型特化的主要调节因素是降低hESC衍生心肌细胞群体异质性的关键,这对于其以后在再生医学中或作为药物测试系统的应用很重要6,12。中胚层和心脏发育期间,骨形态发生蛋白(BMP)信号被严密控制。在小鼠胚胎中,BMP拮抗剂头蛋白(Noggin)短暂但强表达于E7.5至E8.0日龄胚胎的新月形生心区13。Dkk1,一种心脏发育强效诱导物8,1415,协同增强BMP拮抗剂在爪蟾胚胎的非心源性中胚层特化心脏组织16。已经表明,以BMP4长期处理hESCs将诱导滋养层样细胞分化17,而短期处理可起始中胚层形成18。综合来看,这些结果提示,中胚层形成后抑制BMP信号可以促进心脏的发育。维甲酸(Retinoicacid,RA)信号制约着心脏祖细胞池,且在斑马鱼胚胎中可以利用RA的抑制剂BMS-89453将心区附近侧板中胚层的非心肌前体细胞诱导分化成心肌细胞19,同时RA还调节心脏的前后轴极化20。鸡胚胎实验揭示在胚胎发育的4-6HH阶段心房前体组织经移植可以发育成心室,反之亦然21,22。4HH阶段心原性组织的RA处理激活了心房特异性基因AMHC1在原定发育成为心脏流出道组织的前组细胞中表达23。并且,在小鼠和鸡胚胎中,关键时期抑制RA信号引起发育具有过大心室和变小或缺失心房的胚胎,并且外源性加入RA导致胚胎心脏发育成过大的心房和过小或缺失的心室5,24。此外,小鼠胚胎干细胞研究提示维甲酸促进心房相关基因的表达25。技术实现要素:一方面,本发明提供了一种用于提高干细胞的心肌分化效率的方法,所述方法包括在干细胞的分化起始之后,或干细胞心肌分化起始之后抑制BMP信号。在一个特定的实施方式中,本发明提供了用于提高干细胞的心肌分化效率的方法,所述方法包括将已分化形成中胚层的干细胞与骨形态发生蛋白(BMP)拮抗剂相接触,据此所述与BMP拮抗剂相接触的干细胞的心肌分化效率高于未与BMP拮抗剂相接触的干细胞。还提供了由上述方法产生的心肌细胞。进一步提供了包含已分化形成中胚层并经外源性BMP拮抗剂处理的干细胞的组合物。另一方面,本发明提供了用于促进由干细胞形成心室肌细胞的方法,所述方法包括抑制已分化形成中胚层的干细胞内的维甲酸信号通路。还提供了由上述方法产生的心室肌细胞。进一步提供了包含已分化形成中胚层并经抑制维甲酸信号通路的外源性试剂处理的干细胞的组合物。又一方面,本发明提供了用于促进由干细胞形成心房肌细胞的方法,所述方法包括刺激或不抑制已分化形成中胚层的干细胞内的维甲酸信号通路。还提供了由上述方法产生的心房肌细胞。进一步提供了包含已分化形成中胚层并经刺激维甲酸信号通路的外源性试剂处理的干细胞的组合物。又一方面,本发明提供了由干细胞生成心室肌细胞的方法,所述方法包括:1)将干细胞与试剂如bFGF和BMP4相接触以起始干细胞分化;2)经所述试剂如bFGF和BMP4处理的干细胞与另一种试剂如激活素A(ActivinA)相接触以形成中胚层;3)已分化形成中胚层的干细胞与BMP拮抗剂例如Noggin相接触,以提高所述干细胞的心肌分化效率;4)抑制经BMP拮抗剂如Noggin处理的干细胞内的维甲酸信号通路以促进心室肌细胞形成;以及5)经BMP拮抗剂如Noggin处理的干细胞与wnt抑制剂例如DKK1相接触,使所述干细胞分化为心室肌细胞。还提供了由上述方法产生的心室肌细胞。又一方面,本发明提供了由干细胞生成心室肌细胞的方法,所述方法包括:1)将干细胞与bFGF和BMP4相接触;2)经bFGF和BMP4处理的干细胞与ActivinA相接触;3)经ActivinA处理的干细胞与Noggin相接触;4)抑制经Noggin处理的干细胞内的维甲酸信号通路;以及5)经Noggin处理的干细胞与DKK1相接触。还提供了由上述方法产生的心室肌细胞。又一方面,本发明提供了由干细胞生成心房肌细胞的方法,所述方法包括:1)将干细胞与试剂如bFGF和BMP4相接触以起始干细胞分化;2)经所述试剂如bFGF和BMP4处理的干细胞与另一种试剂如ActivinA相接触以形成中胚层;3)已分化形成中胚层的干细胞与BMP拮抗剂例如Noggin相接触,以提高所述干细胞的心肌分化效率;4)刺激或不抑制经Noggin处理的干细胞内的维甲酸信号通路以促进心房肌细胞形成;以及5)经Noggin处理的干细胞与DKK1相接触使所述干细胞分化为心房肌细胞。还提供了由上述方法产生的心房肌细胞。又一方面,本发明提供了由干细胞生成心房肌细胞的方法,所述方法包括:1)将干细胞与bFGF和BMP4相接触;2)经bFGF和BMP4处理的干细胞与ActivinA相接触;3)经ActivinA处理的干细胞与Noggin相接触;4)刺激或不抑制经Noggin处理的干细胞内的维甲酸信号通路;以及5)经Noggin处理的干细胞与DKK1相接触。还提供了由上述方法产生的心房肌细胞。又一方面,本发明提供了用于治疗心脏损伤或紊乱的药物组合物,所述药物组合物包括有效量的由上述方法产生的心肌细胞,以及任选的药学上可接受的载体或赋形剂。又一方面,本发明提供了用于治疗受试者如人类的心脏损伤或紊乱的方法,所述方法包括给有此治疗需要或期望的受试者施用有效量的上述药物组合物。又一方面,本发明提供了用于鉴定心肌细胞调节剂的方法,所述方法包括:1)经上述方法产生的心肌细胞与测试物质相接触,并检测测试物质对所述心肌细胞特性的影响;2)检测未与所述测试物质相接触的心肌细胞的特性;据此,与测试物质相接触的心肌细胞特性不同于未与测试物质相接触的心肌细胞特性,鉴定了所述测试物质是心肌细胞特性的调节剂如刺激剂或抑制剂。附图说明图1展示了Noggin(Ngn)和RA抑制剂促进hESC心肌分化。(A)人类ESCs分化为心肌细胞系方案的概述。(B)第14天CTNT+细胞的频率;在指定时间间隔添加Ngn的心肌诱导培养物;基础方案(BP)用作对照。(C)在指定时间间隔添加RA抑制剂(RAi)的心肌诱导培养物在第14天的CTNT+细胞频率;BP用作对照。(D)以BP作为对照的培养物中CTNT+细胞的流式细胞分析;在第4天和第5天添加Ngn的BP培养物,以及在第4天和第5天添加Ngn并从第6天至第8天添加RAi的BP培养物(Ngn+RAi)。(E)如(D)中所指定的BP、Ngn处理以及Ngn+RAi处理的培养物在第14天的定量RT-PCR基因表达分析,以GADPH归一化的平均表达量如图所示。(F)心肌诱导培养物的免疫染色分析。其中所显示的线表示三组独立实验平均值的标准差。CM,条件培养基。与BP对照比较或其它方式显示的P值,*P<0.05,**P<0.005,***P<0.0005。图2展示了已分化心肌细胞的形态和搏动率。(A)第14天培养物的CTNT+细胞的流式细胞分析,由基础方案分化,并在第4天和第5天增添Ngn处理,以及第6天至第8天的RA(Ngn+RA)或RAi(Ngn+RAi)处理。(B)以ImageJ软件测量的经Ngn+RA(n=35)和Ngn+RAi(n=31)处理的60日龄培养物的单个心肌细胞大小的统计分析。(C)60日龄已分化培养物(n=4)的搏动率(搏动/分钟)的统计分析。(D)60日龄已分化培养物的单个细胞的免疫染色。图3展示了Ngn+RA和Ngn+RAi诱导的hESC衍生心肌细胞的特征。(A)Ngn+RA和Ngn+RAi培养物中的irx4基因表达动力学的定量RT–PCR分析。以GAPDH归一化的平均表达量如图所示,其中所显示的线表示三组独立实验平均值的标准差。***P<0.0005。(B)60日龄Ngn+RA和Ngn+RAi诱导的培养物的免疫染色,证明了MLC-2V在Ngn+RAi处理培养物的大多数CTNT阳性细胞中表达而不在Ngn+RA处理培养物的那些细胞中表达。(C)60日龄Ngn+RA和Ngn+RAi处理培养物的免疫印迹(Westernblotting),表明即使CTNT在两种培养物中均匀表达,MLC-2V在Ngn+RAi处理培养物中高表达但不表达于Ngn+RA处理的培养物。图4展示了Ngn+RA和Ngn+RAi诱导的心肌细胞的动作电位(AP)形态及Ca2+释放特性。(A)在hESC衍生的心肌细胞中观察到三种主要类型的APs:起搏样、心房样以及心室样APs。通过应用硝苯地平,心室样AP的持续时间大大降低(B,左侧);未观察到硝苯地平对心房样AP持续时间的显著影响(B,右侧)。(C)标明了由Ngn+RAi和Ngn+RA培养物记录的AP类型的百分数。(D)由Ngn+RA培养物(左)和Ngn+RAi培养物(右)中的心肌细胞记录的典型Ca2+图像。从所述图像获取荧光剖面图像(箭头所示位置)。由Ngn+RA和Ngn+RAi处理培养物中心肌细胞记录的典型Ca2+释放事件的特性总结于(E)中(检测到Ngn+RA处理培养物中18个细胞的98次触发,以及Ngn+RAi处理培养物中14个细胞的348次触发)。与Ngn+RAi培养物相比,*P<0.05。电生理研究中应用的所有细胞是60-90日龄的。N样,起搏AP;A样,心房样AP;V样,心室样AP。图5展示了不同的维甲酸处理培养物中的MLC-2v表达。(A)经Noggin+RA、Noggin单独以及Noggin+RAi处理的60日龄培养物以MLC-2v和cTNT双染色。(B)经Noggin+RA、Noggin单独以及Noggin+RAi处理60日龄培养物的MLC-2v、cTNT和β-actin的免疫印迹。图6展示了不同处理培养物中的心脏基因表达。经Noggin+RA、Noggin单独以及Noggin+RAi处理60日龄培养物的MLC-2a、ANF、β-MHC和β-actin的免疫印迹。发明详述定义除非另有界定,本文所应用的所有技术和科技术语与本领域普通技术人员通常所理解的具有相同含义。本发明所引用的所有专利、专利申请(公开的或未公开的)以及其它出版物在此通过引用整体并入。如果本节中阐述的定义与在此通过引用并入的专利、申请、已公开申请及其它出版物所阐述的相矛盾或其它方式的不一致,本节中所设置的定义优先于在此通过引用并入的定义。如本文所应用的,“一个”指“至少一个”或“一个或多个”。如本文所应用的,“哺乳动物”指任意种类的哺乳动物。通常,本文所应用的术语“哺乳动物”指代人类、人类受试者或人类患者。如本文所应用的,“用于治疗特定疾病的化合物的有效剂量”是足以改善或以某些方式减轻所述疾病相关症状的剂量。该剂量可作为单剂量施用或根据治疗方案施用,只要它是有效的。所述剂量可以治愈所述疾病,但通常为改善所述疾病的症状而施用。可能需要重复施用以获得所需的症状改善。如本文所应用的,“治疗”指某种状况、紊乱或疾病症状的任意方式的改善或其它有益改变。治疗还可以涵盖本文所述组合物的任意药学应用。如本文所应用的,通过施用特定药物组合物的特定状况的症状“改善”是指,可归结于或与所述组合物施用相关的无论是永久或者临时的、持久或短暂的任意减少。如本文所应用的,“通过重组方式生产”指应用重组核酸方法的生产方法,所述重组核酸方法依赖于表达克隆核酸所编码蛋白的已知分子生物学方法。如本文所应用的,术语“受试者”不限于特定的物种或样品类型。例如,术语“受试者”可以指患者,并且通常是人类患者。然而,该术语并不限于人类并因而涵盖各种哺乳动物物种。如本文所应用的,“药学上可接受的盐、酯或其它衍生物”包括任意种类的盐、酯或衍生物,其可方便地由本领域技术人员应用已知用于此类衍生化和生产可施用给动物或人类而不具有实质毒性作用并且或者是药物学活性或者是前药的化合物的方法而制备。如本文所应用的,“前药”是一种在体内施用时代谢为或者转化为所述化合物的生物学、药物学或治疗等活性形式的化合物。为生产前药,修饰所述药物活性化合物使得所述活性化合物可通过代谢过程再生。所述前药可被设计为改变药物的代谢稳定性或输送特征,以掩盖副作用或毒性,以改善药物的味道或改变药物的其它特征或特性。一旦知晓某种药物学活性化合物,本领域技术人员凭借药物动力学过程以及药物体内代谢的知识,能够设计所述化合物的前药(参见例如,Nogrady(1985)MedicinalChemistryABiochemicalApproach,OxfordUniversityPress,NewYork,第388-392页)。如本发明所应用的,“测试物质(或候选化合物)”指已有化学定义的化合物(如有机分子、无机分子、有机/无机分子、蛋白质、肽、核酸、寡核苷酸、脂类、多糖类、糖类、或这些分子的杂合物例如糖蛋白等等)或化合物的混合物(如测试化合物的文库、天然提取物或培养物上清等等),其在PTH拮抗剂上的作用通过本文公开和/或要求的方法测定。如本发明所应用的,高通量筛选(HTS)指测试大量样品、例如针对疾病靶的具有多种化学结构的样品,以鉴定“命中”的过程(参见例如,Broach等,Highthroughputscreeningfordrugdiscovery,Nature,384:14-16(1996);Janzen等,Highthroughputscreeningasadiscoverytoolinthepharmaceuticalindustry,LabRoboticsAutomation:8261-265(1996);Fernandes,P.B.,Letterfromthesocietypresident,J.Biomol.Screening,2:1(1997);Burbaum等,Newtechnologiesforhigh-throughputscreening,Curr.Opin.Chem.Biol.,1:72-78(1997))。HTS操作是高度自动化以及计算机化的,以处理样品制备、分析步骤以及大容量数据的后续处理。提高干细胞的心肌分化效率的方法和组合物及其生产的心肌细胞一方面,本发明提供了一种用于提高干细胞的心肌分化效率的方法,所述方法包括已分化形成中胚层的干细胞与骨形态发生蛋白(BMP)拮抗剂相接触,由此所述与BMP拮抗剂相接触的干细胞的心肌分化效率高于未与BMP拮抗剂相接触的干细胞。还提供了由上述方法生产的心肌细胞。进一步提供了包含已分化形成中胚层并经外源性BMP拮抗剂处理的干细胞的组合物。该方法可用于提高任意适宜干细胞的心肌分化效率。例如,该方法可用于提高全能、多能、专能、寡能或单能干细胞的心肌分化效率。在另一例子中,该方法可用于提高胚胎干细胞、诱导的多能干细胞、胎儿干细胞或成人干细胞的心肌分化效率。在又一例子中,该方法可用于提高哺乳动物干细胞例如人类干细胞的心肌分化效率。在又一例子中,该方法可用于提高人类胚胎干细胞或人类诱导多能干细胞的心肌分化效率。所述干细胞可通过任意适宜方法获得、制备和/或保持。例如,小鼠ES细胞可在明胶层上生长并需要白血病抑制因子(LIF)的存在。人类ES细胞可在小鼠胚胎成纤维细胞(MEFs)饲养层上生长并可能需要碱性成纤维细胞生长因子(bFGF或FGF-2)的存在(参见例如,ChambersI,ColbyD,RobertsonM等,(2003)."FunctionalexpressioncloningofNanog,apluripotencysustainingfactorinembryonicstemcells".Cell113(5):643–55)。干细胞如人类胚胎干细胞通常由数种转录因子和细胞表面蛋白所确定。例如,转录因子Oct-4、Nanog以及Sox2形成确保抑制导致分化的基因以及保持多能性的核心调节网络。通常用于鉴定hES细胞的细胞表面抗原是糖脂SSEA3和SSEA4以及硫酸角质素抗原Tra-1-60和Tra-1-81。通常缩写为iPS细胞或iPSCs的诱导多能干细胞是一种衍生自非多能干细胞、通常是成人体细胞的经诱导特定基因“强制”表达的人工多能干细胞。各种基因或其组合可用于由成人体细胞诱导iPS细胞。例如,Oct-3/4以及Sox基因家族(Sox1,Sox2,Sox3和Sox15)的某些成员可用于由成人体细胞诱导iPS细胞。其它基因,包括Klf家族(Klf1,Klf2,Klf4和Klf5)的某些成员、Myc家族(C-myc,L-myc,和N-myc)、Nanog和LIN28可用于增加诱导效率。可以通过任意适宜方法将各种基因或其编码蛋白递送入所述成人体细胞。例如各种基因可通过病毒转染系统例如逆转录病毒系统、慢病毒系统或腺病毒系统,或不含任何病毒转染系统的质粒递送入所述成人体细胞。或者,可将所述基因编码的蛋白直接递送入所述成人体细胞,如以某些蛋白质重复处理而通过聚精氨酸锚引导进入所述细胞。所述干细胞可通过任意适宜处理或试剂诱导分化形成中胚层。在一个例子中,通过未分化干细胞与碱性成纤维细胞生长因子(bFGF)、BMP4和/或ActivinA相接触,所述干细胞分化以形成中胚层。在另一例子中,通过未分化干细胞与碱性成纤维细胞生长因子(bFGF)、BMP4和ActivinA相接触,所述干细胞分化以形成中胚层。所述干细胞可经bFGF、BMP4和ActivinA以任意适宜顺序处理。例如,通过未分化干细胞与ActivinA接触前与碱性成纤维细胞生长因子(bFGF)和BMP4相接触,所述干细胞分化以形成中胚层。在另一例子中,通过未分化干细胞与wnt-3a(Tran,T.H等.Wnt3a-inducedmesodermformationandcardiomyogenesisinhumanembryonicstemcells.StemCells27,1869-1878(2009))或一种作用或功能类似于wnt-3a的小分子例如Bio或CHIR99021相接触,所述干细胞分化以形成中胚层。任意适宜的BMP拮抗剂可用于该方法以提高干细胞的心肌分化效率。例如,可应用BMP4拮抗剂。在另一例子中,所述BMP拮抗剂是Noggin。在又一例子中,所述BMP拮抗剂是Chordin,Tsg、DAN家族成员(Yanagita,M.BMPantagonists:theirrolesindevelopmentandinvolvementinpathophysiology.CytokineGrowthFactorRev16,309-317,(2005)),BMP可溶性受体例如BMPR1A和BMPR1B,或一种作用或功能类似于BMP拮抗剂的小分子例如Dorsomorphin(Hao,J等.Dorsomorphin,aselectivesmallmoleculeinhibitorofBMPsignaling,promotescardiomyogenesisinembryonicstemcells.PLoSOne3,e2904(2008))。该方法可进一步包括在所述干细胞中抑制维甲酸信号通路。可通过任意适宜处理或试剂抑制干细胞中的维甲酸信号通路。在一个例子中,通过所述干细胞与维甲酸拮抗剂、维甲酸受体拮抗剂或维甲酸X受体拮抗剂相接触而抑制维甲酸信号通路。在另一例子中,通过所述干细胞与泛视黄酸受体拮抗剂如BMS-189453相接触而抑制维甲酸信号通路。在又一例子中,通过所述干细胞与BMS-453、AGN194310、ANG193109、Ro41-5253、SR11335、9-顺式视黄酸或抑制维甲酸合成的小分子例如双硫仑和柠檬醛相接触而抑制维甲酸信号通路。在又一例子中,通过减少或消耗干细胞培养基中的维生素A而抑制维甲酸信号通路。该方法可用于提高干细胞的心肌分化效率至合适程度。在一个例子中,与BMP拮抗剂相接触的干细胞的心肌分化效率,比未与BMP拮抗剂相接触的干细胞的心肌分化效率高至少约30%。在特定的具体实施方式中,与BMP拮抗剂相接触的干细胞的心肌分化效率,是未与BMP拮抗剂相接触的干细胞的心肌分化效率的约40%、50%、60%、70%、80%、90%、100%、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更高。在一个特定例子中,所述干细胞是人类胚胎干细胞或人类诱导多能干细胞,所述BMP拮抗剂是Noggin,并且与BMP拮抗剂相接触的干细胞的心肌分化效率是约10%、20%、30%、40%、50%、60%、70%或80%。在另一特定例子中,所述干细胞是人类胚胎干细胞或人类诱导多能干细胞,所述BMP拮抗剂是Noggin,并且与BMP拮抗剂相接触的干细胞的心肌分化效率是约60%、70%、80%、90%、95%或100%。该方法可进一步包括所述干细胞与wnt抑制剂相接触以使所述干细胞分化为心肌细胞。可应用任意适宜的wnt抑制剂。在一个例子中,所述wnt抑制剂是dickkopf同系物1(DKK1)。还提供了通过上述方法生产的心肌细胞。进一步提供了包含已分化形成中胚层并经外源性BMP拮抗剂处理的干细胞的组合物。促进心室肌细胞形成的方法和组合物及其生产的心室肌细胞另一方面,本发明提供了促进干细胞向心室肌细胞分化的方法,其中所述方法包括抑制已分化形成中胚层的干细胞内的维甲酸信号通路。该方法可用于促进心室肌细胞由任意适宜干细胞形成。在一个例子中,该方法可用于促进心室肌细胞由全能、多能、专能、寡能或单能干细胞形成。在另一例子中,该方法可用于促进心室肌细胞由胚胎干细胞、诱导的多能干细胞、胎儿干细胞或成人干细胞形成。在又一例子中,该方法可用于促进心室肌细胞由哺乳动物干细胞例如人类干细胞形成。在又一例子中,该方法可用于促进心室肌细胞由人类胚胎干细胞或人类诱导多能干细胞形成。所述干细胞可通过任意适宜处理或试剂诱导以分化形成中胚层。在一个例子中,通过未分化干细胞与碱性成纤维细胞生长因子(bFGF)、BMP4和/或ActivinA相接触,所述干细胞被诱导分化以形成中胚层。在另一例子中,通过未分化干细胞与碱性成纤维细胞生长因子(bFGF)、BMP4和ActivinA相接触,所述干细胞被诱导分化以形成中胚层。所述干细胞可经bFGF、BMP4和ActivinA以任意适宜顺序处理。例如,通过未分化干细胞与ActivinA接触前与碱性成纤维细胞生长因子(bFGF)和BMP4相接触,所述干细胞可被诱导分化以形成中胚层。在另一例子中,通过未分化干细胞与wnt-3a(Tran,T.H等.Wnt3a-inducedmesodermformationandcardiomyogenesisinhumanembryonicstemcells.StemCells27,1869-1878(2009))或一种作用或功能类似于wnt-3a的小分子例如Bio或CHIR99021相接触,所述干细胞可分化形成中胚层。该方法可进一步包括所述干细胞与BMP拮抗剂相接触以提高心肌分化效率。任意适宜的BMP拮抗剂可用于该方法。例如,可应用BMP4拮抗剂。在另一例子中,所述BMP拮抗剂是Noggin。在又一例子中,所述BMP拮抗剂是Chordin,Tsg、DAN家族成员(Yanagita,M.BMPantagonists:theirrolesindevelopmentandinvolvementinpathophysiology.CytokineGrowthFactorRev16,309-317,(2005)),BMP可溶性受体例如BMPR1A和BMPR1B,或一种作用或功能类似于BMP拮抗剂的小分子例如Dorsomorphin(Hao,J等.Dorsomorphin,aselectivesmallmoleculeinhibitorofBMPsignaling,promotescardiomyogenesisinembryonicstemcells.PLoSOne3,e2904(2008))。可通过任意适宜处理或试剂抑制干细胞中的维甲酸信号通路。在一个例子中,通过所述干细胞与维甲酸拮抗剂、维甲酸受体拮抗剂或维甲酸X受体拮抗剂相接触而抑制维甲酸信号通路。在另一例子中,通过所述干细胞与泛视黄酸受体拮抗剂如BMS-189453相接触而抑制维甲酸信号通路。在又一例子中,通过所述干细胞与BMS-453、AGN194310、ANG193109、Ro41-5253、SR11335、9-顺式视黄酸或抑制维甲酸合成的小分子例如双硫仑和柠檬醛相接触而抑制维甲酸信号通路。在又一例子中,通过减少或消耗干细胞培养基中的维生素A而抑制维甲酸信号通路。在一个特定例子中,所述干细胞是人类胚胎干细胞或人类诱导多能干细胞,所述BMP拮抗剂是Noggin,并且通过所述干细胞与BMS-189453接触抑制维甲酸信号通路。该方法进一步包括所述干细胞与wnt抑制剂相接触以使干细胞分化为心室肌细胞。可应用任意适宜的wnt抑制剂。例如,所述wnt抑制剂是dickkopf同系物1(DKK1)。在一个具体实施方式中,本发明提供了一种由干细胞产生心室肌细胞的方法,所述方法包括:1)将干细胞与试剂如bFGF和BMP4相接触以起始干细胞分化;2)经所述试剂如bFGF和BMP4处理的干细胞与另一种试剂如ActivinA相接触以形成中胚层;3)已分化形成中胚层的干细胞与BMP拮抗剂例如Noggin相接触,以提高所述干细胞的心肌分化效率;4)抑制经BMP拮抗剂如Noggin处理的干细胞内的维甲酸信号通路以促进心室肌细胞形成;以及5)经BMP拮抗剂如Noggin处理的干细胞与wnt抑制剂例如DKK1相接触,使所述干细胞分化为心室肌细胞。还提供了由上述方法产生的心室肌细胞。在另一具体实施方式中,本发明提供了一种由干细胞产生心室肌细胞的方法,所述方法包括:1)将干细胞与bFGF和BMP4相接触;2)经bFGF和BMP4处理的干细胞与ActivinA相接触;3)经ActivinA处理的干细胞与Noggin相接触;4)抑制经Noggin处理的干细胞内的维甲酸信号通路;以及5)经Noggin处理的干细胞与DKK1相接触。还提供了由上述方法产生的心室肌细胞。还提供了由上述方法产生的心室肌细胞。所述心室肌细胞可以有一种心室特定基因例如IRX-4或MLC-2v表达水平升高、胚胎心室样动作电位(AP)和/或心室肌细胞的典型Ca2+火花模式。进一步提供了包含已分化形成中胚层并经抑制干细胞内维甲酸信号通路的外源性试剂处理的干细胞的组合物。所述外源性试剂可以是任意适宜的抑制干细胞内维甲酸信号通路的试剂。在一个例子中,所述抑制干细胞内维甲酸信号通路的外源性试剂是泛视黄酸受体拮抗剂如BMS-189453。在另一个例子中,通过所述干细胞与BMS-453、AGN194310、ANG193109、Ro41-5253、SR11335、9-顺式维甲酸或抑制维甲酸合成的小分子例如双硫仑和柠檬醛相接触以抑制维甲酸信号通路。促进心房肌细胞形成的方法和组合物及其生产的心房肌细胞在又一方面,本发明提供了一种促进心房肌细胞由干细胞形成的方法,所述方法包括刺激或不抑制已分化形成中胚层的干细胞的维甲酸信号通路。该方法可用于促进任意适宜干细胞向心房肌细胞的分化形成。该方法可用于促进心房肌细胞由全能、多能、专能、寡能或单能干细胞形成。在另一例子中,该方法可用于促进心房肌细胞由胚胎干细胞、诱导的多能干细胞、胎儿干细胞或成人干细胞形成。在又一例子中,该方法可用于促进心房肌细胞由哺乳动物干细胞例如人类干细胞形成。在又一例子中,该方法可用于促进心房肌细胞由人类胚胎干细胞或人类诱导多能干细胞形成。所述干细胞可通过任意适宜处理或试剂诱导以分化形成中胚层。在一个例子中,通过未分化干细胞与碱性成纤维细胞生长因子(bFGF)、BMP4和/或ActivinA相接触,所述干细胞被诱导分化以形成中胚层。在另一例子中,通过未分化干细胞与碱性成纤维细胞生长因子(bFGF)、BMP4和ActivinA相接触,所述干细胞被诱导分化以形成中胚层。所述干细胞可经bFGF、BMP4和ActivinA以任意适宜顺序处理。例如,通过未分化干细胞与ActivinA接触前与碱性成纤维细胞生长因子(bFGF)和BMP4相接触,所述干细胞可被诱导分化以形成中胚层。在另一例子中,通过未分化干细胞与wnt-3a(Tran,T.H等.Wnt3a-inducedmesodermformationandcardiomyogenesisinhumanembryonicstemcells.StemCells27,1869-1878(2009))或一种作用或功能类似于wnt-3a的小分子例如Bio或CHIR99021相接触,所述干细胞可被诱导分化以形成中胚层。该方法可进一步包括所述干细胞与BMP拮抗剂相接触以提高心肌分化效率。任意适宜的BMP拮抗剂可用于该方法。例如,可应用BMP4拮抗剂。在另一例子中,所述BMP拮抗剂是Noggin。在又一例子中,所述BMP拮抗剂是Chordin,Tsg、DAN家族成员(Yanagita,M.BMPantagonists:theirrolesindevelopmentandinvolvementinpathophysiology.CytokineGrowthFactorRev16,309-317,(2005)),BMP可溶性受体例如BMPR1A和BMPR1B,或一种作用或功能类似于BMP拮抗剂的小分子例如Dorsomorphin(Hao,J等.Dorsomorphin,aselectivesmallmoleculeinhibitorofBMPsignaling,promotescardiomyogenesisinembryonicstemcells.PLoSOne3,e2904(2008))。可通过任意适宜处理或试剂刺激干细胞中的维甲酸信号通路。在一个例子中,通过所述干细胞与维甲酸或维生素A相接触而刺激干细胞中的维甲酸信号通路。在另一例子中,通过所述干细胞与维甲酸受体激动剂例如LG100268和LGD1069相接触而刺激干细胞中的维甲酸信号通路。在一个特定的例子中,所述干细胞是人类胚胎干细胞或人类诱导多能干细胞,所述BMP拮抗剂是Noggin,并且通过所述干细胞与维甲酸或维生素A相接触刺激维甲酸信号通路。该发明可以进一步包括所述干细胞与wnt抑制剂相接触以使所述干细胞分化为心房肌细胞。可应用任意适宜的wnt抑制剂。在一个例子中,所述wnt抑制剂是dickkopf同系物1(DKK1)。在一个具体实施方式中,本发明提供了一种用于由干细胞产生心房肌细胞的方法,所述方法包括:1)将干细胞与试剂如bFGF和BMP4相接触以起始干细胞分化;2)经所述试剂如bFGF和BMP4处理的干细胞与另一种试剂如ActivinA相接触以形成中胚层;3)已分化形成中胚层的干细胞与BMP拮抗剂例如Noggin相接触,以提高所述干细胞的心肌分化效率;4)刺激或不抑制经Noggin处理的干细胞内的维甲酸信号通路以促进心房肌细胞形成;以及5)经Noggin处理的干细胞与DKK1相接触使所述干细胞分化为心房肌细胞。还提供了由上述方法产生的心房肌细胞。在另一具体实施方式中,本发明提供了一种用于由干细胞生成心房肌细胞的方法,所述方法包括:1)将干细胞与bFGF和BMP4相接触;2)经bFGF和BMP4处理的干细胞与ActivinA相接触;3)经ActivinA处理的干细胞与Noggin相接触;4)刺激或不抑制经Noggin处理的干细胞内的维甲酸信号通路;以及5)经Noggin处理的干细胞与DKK1相接触。还提供了由上述方法产生的心房肌细胞。还提供了由上述方法生产的心房肌细胞。在一个例子中,心房肌细胞可具有胚胎心房样动作电位(AP)和/或心房肌细胞典型的Ca2+火花模式。进一步提供了包含已分化形成中胚层并经刺激所述干细胞内维甲酸信号通路的外源性试剂处理的干细胞的组合物。可应用任意适宜的外源性试剂刺激干细胞内的维甲酸信号通路。在一个例子中,所述刺激干细胞内维甲酸信号通路的外源性试剂是维甲酸或维生素A。心肌细胞的药物组合物及其用途所述心肌细胞可用于任何合适的目的。一方面,本发明提供了一种用于治疗心脏损伤或紊乱的药物组合物,其中所述药物组合物包含有效量的经上述方法生产的心肌细胞,以及任选的药学上可接受载体或赋形剂。在一个具体实施方式中,所述药物组合物包含心房肌细胞和心室肌细胞的混合物。在另一个具体实施方式中,所述药物组合物包含至少约50%,优选至少约60%、70%、80%、90%、95%、99%或100%的心房肌细胞。在又一个具体实施方式中,所述药物组合物包含至少约50%,优选至少约60%、70%、80%、90%、95%、99%或100%的心室肌细胞。另一方面,本发明提供了一种用于治疗受试者如人类的心脏损伤或紊乱的方法,其中所述方法包含给有此需要或期望的受试者施用有效量的上述药物组合物。所述心肌细胞的配方、剂量以及施用途径,是否主要是心房肌细胞、主要是心室肌细胞或者是心房肌细胞与心室肌细胞的混合物,优选的药物组合物形式,可通过本领域已知的方法确定(参见例如,Remington:TheScienceandPracticeofPharmacy,AlfonsoR.Gennaro(编辑)MackPublishingCompany,1997年4月;TherapeuticPeptidesandProteins:Formulation,Processing,andDeliverySystems,Banga,1999;以及PharmaceuticalFormulationDevelopmentofPeptidesandProteins,Hovgaard和Frkjr(编辑),Taylor&Francis,Inc.,2000;MedicalApplicationsofLiposomes,Lasic和Papahadjopoulos编辑),ElsevierScience,1998;TextbookofGeneTherapy,Jain,Hogrefe&HuberPublishers,1998;Adenoviruses:BasicBiologytoGeneTherapy,第15卷,Seth,LandesBioscience,1999;BiopharmaceuticalDrugDesignandDevelopment,Wu-Pong和Rojanasakul(编辑),HumanaPress,1999;TherapeuticAngiogenesis:FromBasicSciencetotheClinic,第28卷,Dole等(编辑),Springer-VerlagNewYork,1999)。在特定的具体实施方式中,所述心肌细胞可以与内皮细胞、平滑肌细胞和/或成纤维细胞组合或配制,并移植入心脏。所述细胞或组织补片可通过直接注射至梗死区移植,以导管注射或作为心脏补片通过手术移植。优选地,所述心肌细胞由待治疗受试者的干细胞形成。另外,优选所述内皮细胞、平滑肌细胞和/或成纤维细胞也从待治疗受试者获得或衍生,如从待治疗受试者的干细胞形成。所述心肌细胞可被配制用于任意适宜的施用途径。在一个例子中,所述心肌细胞通过手术或细胞移植来施用。在任意给定案例中的最适施用途径取决于待治疗状况的性质和严重程度,以及取决于待应用特定心肌细胞的性质。所述心肌细胞可单独施用。或者并且更好,所述心肌细胞与药学上可接受的载体或赋形剂共施用。任意适宜的药学上可接受载体或赋形剂可用于该发明(参见例如,Remington:TheScienceandPracticeofPharmacy,AlfonsoR.Gennaro(编辑)MackPublishingCompany,1997年4月)。该方法可单独应用。或者,该方法可用于与适于预防、治疗或延迟心脏损伤、疾病或紊乱的其它试剂组合。此种其它试剂可以在所述心肌细胞施用之前、同时或之后应用。例如,所述心肌细胞可以与此种其它试剂共施用。根据本发明,单独或与其它试剂、载体或赋形剂组合的所述心肌细胞可被配制用于任意适宜施用途径,例如手术或细胞移植。所述方法可应用用于单剂量形式施用的配方,在安瓿中或多剂量容器中,具有添加的防腐剂。所述配方可采用例如在油性或水性载体中的悬浮液、溶液或乳液的形式,并且可含有配制剂例如悬浮剂、稳定剂和/或分散试剂。或者,所述活性成分可以是在使用前与合适载体、无菌无热原水或其它溶剂组合的粉末形式。可用于本发明应用的药学上可接受的组合物及其施用方法包括但不限于美国专利5,736,154;6,197,801B1;5,741,511;5,886,039;5,941,868;6,258,374B1;以及5,686,102所描述的那些。治疗或预防中治疗剂量的大小随待治疗状况的严重程度及施用途径变化。所述剂量并且也许剂量频率也根据年龄、体重、状况以及单个患者的反应而变化。应当注意的是,主治医生应当知晓依据毒性或不良反应如何以及何时终止、中止或调整疗法以降低剂量。反之,如果临床反应不足,医生也应当知晓如何以及何时调整治疗至更高水平(排除毒副反应)。可以应用任意适宜的施用途径。制剂形式包括片剂、锭剂、扁囊剂、分散液、悬浮液、溶液、胶囊、贴片等等。参见Remington’sPharmaceuticalSciences。在特定应用中,单独或与其它试剂组合的心肌细胞可根据传统药物配制技术,在紧密混合物中作为活性成分与药学载体或赋形剂例如β-环糊精以及2-羟基-丙基-β-环糊精组合。所述载体可采用合适的给药所需的广泛制剂形式。在制备用于胃肠外制剂形式诸如静脉注射或滴注的组合物时,可应用本领域技术人员已知的类似水、二醇类、油、缓冲液、糖、防腐剂、脂质体等等的药物基质。此类胃肠外组合物的例子包括但不限于5%w/v的葡萄糖、生理盐水或其它溶液。单独或与其它待施用试剂组合的心肌细胞的总剂量可以以约1x103至1x1010细胞范围的小瓶液体施用,如1x103、1x104、1x105、1x106、1x107、1x108、1x109或1x1010细胞,或1x103至1x1010细胞范围内的任意子区间。本发明还提供了执行本发明治疗方案的试剂盒。这种试剂盒包含一个或多个容器内的药学可接受形式的单独或与其它试剂组合的治疗有效量心肌细胞。优选的药物形式是与无菌生理盐水、葡萄糖溶液或缓冲溶液或其它药学可接受无菌液体相组合。或者,所述组合物可以是冻干或干燥的,在这种情况下,所述试剂可选地进一步包含容器内的药学上可接受溶液,优选无菌的,以重新组成复合物而形成注射用溶液。示例性的药学上可接受溶液是生理盐水和葡萄糖溶液。在另一个具体实施方式中,本发明的试剂盒进一步包含用于注射所述组合物的优选无菌形式包装的针或注射器,和/或包装的酒精垫。可选地包括由医生或病人施用组合物的说明书。心肌细胞的其它应用所述心肌细胞可用于任何合适的目的。在一个具体实施方式中,本发明提供了用于鉴定心肌细胞调节剂的方法,所述方法包括:1)经上述方法产生的心肌细胞与测试物质相接触,并检测测试物质对所述心肌细胞特性的影响;2)检测未与所述测试物质相接触的心肌细胞的特性;据此,与测试物质相接触的心肌细胞特性不同于未与测试物质相接触的心肌细胞特性,鉴定了所述测试物质是心肌细胞特性的调节剂如刺激剂或抑制剂。在一个例子中,与测试物质接触心肌细胞的特性相对于未与测试物质接触心肌细胞特性的增长,鉴定了所述测试物质是心肌细胞特性的刺激剂。在另一例子中,与测试物质接触心肌细胞的特性相对于未与测试物质接触心肌细胞特性的降低,鉴定了所述测试物质是心肌细胞特性的抑制剂。所述方法可以以任何适当的形式进行。优选所述方法以高通量筛选(HTS)形式进行。实施例摘要尽管细胞移植研究已提示心肌梗塞治疗潜力的前景,无法获得用于移植的相对均匀的心室肌细胞是心肌修复临床治疗发展的主要障碍1。人类胚胎干细胞(hESC)是心肌细胞的有前景的来源。在此,我们报道了维甲酸信号调节hESCs心肌分化期间的心房肌细胞与心室肌细胞的分化命运。我们发现,Noggin和维甲酸受体拮抗剂BMS-189453(RAi)显著增加hESCs的心肌分化效率2。通过比较Noggin+RAi处理培养物与Noggin+RA处理培养物调查维甲酸功能,我们的结果显示,在Noggin+RAi处理培养物中,心室特异性基因IRX-4的表达水平得到根本提升3,而另一种心室特异性标记MLC-2v4,5,在Noggin+RAi处理培养物的大多数心肌细胞中表达,但不表达于Noggin+RA处理培养物。流式细胞分析及电生理研究提示,在64±0.88%(平均值±均数标准误差)心肌分化效率情况下,Noggin+RAi处理培养物中83%的心肌细胞具有胚胎心室样动作电位(AP);然而,在50±1.76%心肌分化效率情况下,Noggin+RA处理培养物中94%的心肌细胞具有胚胎心房样APs。两种不同处理培养物中心肌细胞Ca2+火花模式及特性的图形研究进一步确证了这些结果。这些发现证明了维甲酸信号指定了hESCs的心房肌细胞与心室肌细胞分化,并且相对均匀的胚胎心房样肌细胞及心室样肌细胞群可通过特异性调节Noggin及维甲酸信号由hESCs高效分化产生。总结尽管细胞移植研究已提示心肌梗塞治疗潜力的前景,无法获得用于移植的相对均匀的心室肌细胞是心肌修复临床治疗发展的主要障碍1。人类胚胎干细胞(hESC)是心肌细胞的有前景的来源。在此,我们报道了维甲酸信号调节hESCs心肌分化期间的心房肌细胞与心室肌细胞的分化命运。我们发现,Noggin和维甲酸受体拮抗剂BMS-189453(RAi)显著增加hESCs的心肌分化效率2。通过比较Noggin+RAi处理培养物以及Noggin+RA处理培养物调查维甲酸功能,我们的结果显示,在Noggin+RAi处理培养物中,心室特异性基因IRX-4的表达水平得到根本提升3,而另一种心室特异性标记MLC-2v4,5,在Noggin+RAi处理培养物的大多数心肌细胞中表达,但不表达于Noggin+RA处理培养物。流式细胞分析及电生理研究提示,在64±0.88%(平均值±均数标准误差)心肌分化效率情况下,Noggin+RAi处理培养物中83%的心肌细胞具有胚胎心室样动作电位(AP);然而,在50±1.76%心肌分化效率情况下,Noggin+RA处理培养物中94%的心肌细胞具有胚胎心房样APs。两种不同处理培养物中心肌细胞Ca2+火花模式及特性的图形研究进一步确证了这些结果。这些发现证明了维甲酸信号指定了hESCs的心房肌细胞与心室肌细胞分化,并且相对均匀的胚胎心房样肌细胞及心室样肌细胞群可通过特异性影响BMP与维甲酸信号级联由hESCs高效分化产生。材料和方法hESCs的维持培养和分化。WiCell研究所来源的未分化hESC细胞系H7如前所述培养在基底膜涂层平板上37。在基础的心肌诱导方案中,未分化hESCs以1-5x105细胞/cm2的密度植于明胶涂层平板上,并以小鼠胚胎成纤维细胞条件培养基培养3天直至完全融合。为起始细胞分化,所述培养基更换为添加B27(Invitrogen)的RPMI1640(Invitrogen)。在第1天以25ng/mlBMP4和6ng/mlbFGF、第2天以100ng/mlactivinA、并且在第6-11天以200ng/mlDKK1(R&DSystems)处理细胞。第11天后每3天更换一次培养基(图1)。在图1A-C所指定的时间点向细胞培养液添加250ng/mlNoggin、1μMRA(Sigma)或1μMRAi。通常在第10-11天观察自发跳动的集群。在第14天以CTNT抗体染色和流式细胞仪分析心肌分化效率。hESC分化产生心肌细胞的单细胞制备。在低Ca2+溶液中洗涤60-90日龄的分化培养物,并随后在酶溶液中37℃孵育20分钟。通过在KB溶液中室温轻轻振摇40分钟完成解离。分离的细胞在添加10%FBS的DMEM中重悬,并转移至0.1%明胶涂层盖玻片上,并随后保留在孵育箱,37℃,5%CO2。所述低Ca2+溶液组合物是(单位为mM)120NaCl、5.4KCl、5MgSO4、5丙酮酸钠、20葡萄糖、20牛磺酸、10HEPES。以NaOH调节pH至7.3。KB溶液含有(单位为mM)85KCl、30K2HPO4、5MgSO4、1EGTA、2Na2ATP、5丙酮酸钠、20葡萄糖、20牛磺酸、5肌酸,以KOH调节至pH7.3。电生理测量以及Ca2+共聚焦图像。室温下应用Axon200B放大器(AxonInstruments),心肌细胞的动作电位记录于全细胞膜片钳。数据在20kHz数字化并在2kHz过滤,并且通过PClamp9.0分析。膜片钳移液器(2-4MΩ电阻)中装满含有(为mM)50KCl、60K-Aspartate、1MgCl2、3Na2ATP、10EGTA、10mMHEPES的细胞内液,以KOH调节至pH7.3。普通台氏液(Tyrode’ssolution)用作细胞外溶液并且含有(为mM)140NaCl、KCl、1CaCl2、1MgCl2、10葡萄糖、10HEPES,以NaOH调节至pH7.4。对于Ca2+共聚焦图像,心肌细胞与Fluo-4AM(10μM/L;分子探针)在室温共孵育10分钟,并随后以细胞外缓冲液灌注约30分钟。在装配有氩离子激光器(488nm)的LeicaSP5共聚焦显微镜上应用1.25NA油浸物镜以40x放大倍数进行Ca2+图像研究。应用线扫描记录自发的Ca2+火花以及Ca2+瞬变,0.5ms每行获取。应用MATLAB7.1软件(MathWorks)和ImageJ(Scioncorp)处理和分析图像。Ca2+火花的检测标准设置为3.8×SD,并应用用于ImageJ的Sparkmaster插件进行Ca2+火花的自动计数38。流式细胞术。分化的细胞群以0.25%胰蛋白酶-EDTA解离为单个细胞,其随后以抗人CTNT抗体(R&DSystems)和山羊抗小鼠FITC偶联第二抗体(SantaCruz)在添加0.5%BSA和0.1%皂素(Sigma)的PBS中4℃固定及染色。染色的细胞保存在4%多聚甲醛中用于后续的定量分析。应用FACScalibur(BectonDickinson)收集数据并以FlowJo软件(Treestar)分析。实时RT–PCR。应用Qiagen公司的RNeasyPlusMini试剂盒由已分化hESC细胞24孔板的单孔中提取总RNA。然后,1μg的总RNA以SuperScriptIIIFirst-Strand合成系统(Invitrogen)逆转录。应用rTaqDNA聚合酶(Takara)进行RT-PCR。实时PCR应用2xQuantiFastSYBRGreenIPCRMasterMix(Qiagen)在RotorGene6200实时PCR仪(Corbett)上一式三份进行,退火温度为60℃。每种基因的表达以GAPDH基因表达标准化。表2中列出了引物序列。免疫荧光。60日龄的分化培养物以0.25%胰蛋白酶-EDTA消化,并且所述细胞置于明胶涂层盖玻片上5天,以使完全贴附发生。随后细胞在4%多聚甲醛中固定,并与第一抗体小鼠抗人CTNT(R&Dsystems)、小鼠抗人α-辅肌动蛋白(Sigma)、小鼠抗人β-MHC(ATCC)、小鼠抗人MLC-2a(SynapticSystems)或兔抗人MLC-2v(ProteinTechGroup)孵育。需要时,应用与DyLight488偶联的山羊抗小鼠第二抗体(SantaCruzBiotechnology)以及与Tritc偶联的山羊抗兔第二抗体(SantaCruzBiotechnology)。在细胞核以4',6-二脒-2-苯基吲哚(DAPI,Sigma)染色后,可应用Olympus显微镜系统X51或OlympusLSCMFV1000观察并记录免疫荧光图像。免疫印迹(Westernblotting)。60日龄分化细胞24孔板的一个孔以RIPA裂解缓冲液(Biomiga)裂解用于免疫印迹。印迹与小鼠抗人CTNT、小鼠抗人β-MHC、兔抗人MLC-2v、山羊抗ANF、小鼠抗人MLC-2a、小鼠抗人β-actin、兔抗磷酸化smad1/5/8以及兔抗samd1/5/8分别孵育,并随后与HRP缀合的山羊抗小鼠或抗兔抗体孵育。表1由hESC衍生心肌细胞记录的AP参数.表1由hESC衍生心肌细胞记录的AP参数。数据为平均值±标准误差。n表示测试细胞数。Vmax,AP增长的最大速率;APA,AP振幅;APD90,90%再极化时测得的AP持续时间;MDP,最大舒张电位。*P<0.05与起搏比较;#P<0.05互相比较;$P<0.01互相比较;以及互相比较。表2用于qPCR的引物序列.基因正向引物反向引物TmNXK2.5Acctcaacagctccctgactctataatcgccgccacaaactctcc60℃CTNTTtcaccaaagatctgctcctcgctttattactggtgtggagtgggtgtgg60℃IRX4Ttccgttctgaagcgtggtctgaagcaggcaattattggtgt60℃GAPDHGaaatcccatcaccatcttccagggagccccagccttctccatg60℃结果基于以往的研究,我们猜想hESC分化起始之后BMP通路的抑制以及维甲酸信号的阻断促进了心脏发生;维甲酸信号还调节hESCs的心房与心室分化。为证实这些猜想,我们尝试在不同时间间隔内将Noggin、RA及其抑制剂RAi加入培养的向心肌分化的人胚胎干细胞中,并探讨它们在心脏发生以及hESC细胞心肌分化过程中对的心肌亚型特化上的影响。我们的结果显示,利用Noggin和RAi对BMP和RA信号抑制可以显著促进干细胞向心肌细胞分化,并且维甲酸信号调控hESCs向心房肌细胞与心室肌细胞的特化。本方法不仅揭示了心肌亚类特化的调控机制,而且还提供了将hESCs定向分化成相对均匀胚胎心房样肌细胞及心室样肌细胞的方法。Noggin和RA拮抗剂BMS189453促进已分化hESCs的心脏发生。为探讨心肌分化中Noggin的功能,第2-5天以不同时间间隔系统地向心肌细胞分化hESC培养物添加Noggin,所述培养物是由我们实验室开发的方案生产的(参见发明详述的方法部分)。结果显示,当第2天和第3天之间存在Noggin时,心肌分化被轻微抑制,但在第2.5天和第4.5天之间被显著促进。第4天和第5天之间达到最高心肌分化效率(图1B)。磷酸化Smad1,5,8的免疫印迹表明,Noggin降低了BMP信号的活性(未显示数据)。因此,分化起始后BMP信号的抑制促进了hESCs的心脏发生。以往发现证明RA信号限制胚胎心脏祖细胞生成,提示通过抑制RA信号可以提高hESCs向心肌细胞分化的效率。维生素A,既RA合成的底物,以及RALDH2,负责RA合成的酶24,均存在于我们的干细胞培养物(未显示数据),提示在干细胞培养物RA信号可能已被激活。我们通过在图1C所示的时间点向我们的第4-9天间的干细胞心肌分化培养物添加RAi,从而测试了RA抑制在促进hESC心肌分化上的影响。流式细胞分析显示,当RAi在第6-9天间加入后,心肌分化显著提高(图1C),证明RA信号抑制促进了hESCs的心肌分化。接下来,我们结合了第4天和第5天的Noggin处理,以及第6-8天的RAi处理。第14天培养物中CTNT+细胞的流式细胞分析显示,仅以Noggin处理,分化效率为50%±3.06%(平均值±平均数标准误),而当以RAi和Noggin同时处理时,分化效率增加至73%±2.08%(图1D)。这一结果也得到了对第14天培养物的定量RT-PCR分析实验结果的确认。Noggin+RAi处理培养物中的CTNT及NKX2.5表达水平显著高于仅以Noggin处理的培养物(图1E)。免疫染色表明了包括CTNT、α-辅肌动蛋白、MLC-2a、MLC-2v和β-MHC的典型心脏标志物在培养细胞中表达(图1F)。调节维甲酸信号诱导hESCs分化为两种不同亚型的心肌细胞。由于鸡和小鼠的胚胎研究提示维甲酸信号调节心脏流入及流出区域组织的特化命运5,20-24,我们提出,激活或抑制维甲酸信号诱导已分化hESC心脏祖细胞向心房肌细胞或心室肌细胞的特化命运,并且这种机制可用于有效利用hESC产生的心房样或心室样肌细胞。为证实这种猜想,在平行实验的第6-8天的Noggin处理培养物中加入RA或其拮抗剂RAi(图1A)。在分化14天后,Noggin+RA和Noggin+RAi处理培养物中CTNT+细胞的百分比分别为50.7%±1.76%和64.7%±0.88%(图2A)。虽然分化效率仅有约14%的差异,Noggin+RA处理培养物中的搏动心肌细胞的大小比Noggin+RAi处理培养物中的小(图2B,D)。Noggin+RA处理培养物中心肌细胞的搏动速率也比Noggin+RAi处理培养物中的快(图2C以及表1),提示这两种不同培养物中存在两种不同亚型的心肌细胞。接下来,我们检测了两种培养物中的心室特异性表达基因IRX4和MLC-2v的表达。定量RT-PCR显示Noggin+RAi处理的培养物中,IRX4表达在第8天开始上升,并且到第14天,其比Noggin+RA处理培养物中的高10倍(图3A)。60日龄培养物的免疫染色显示,MLC-2v在经Noggin+RAi处理的大多数CTNT+细胞中表达,但在Noggin+RA处理的培养物中不表达(图3B),与免疫的结果印迹相一致,提示着尽管CTNT在这两种培养物中表达水平相似,但是仅在Noggin+RAi处理的培养物中有MLC-2v高表达(图3C)。我们还通过免疫染色和免疫印迹比较了Noggin+RAi处理、Noggin处理及Noggin+RA处理培养物中的cTNT及MLC-2v的表达。结果表明,Noggin单独处理的培养物中仅约35%的cTNT阳性细胞同时表达MLC-2v,以及经免疫印迹检测到MLC-2v微弱表达(图5)。这些结果表明Noggin+RAi处理培养物中的大多数心肌细胞是胚胎心室样肌细胞,而在Noggin+RA处理培养物中分化的心肌细胞是不表达MLC-2v的胚胎起搏心肌细胞或心房样心肌细胞。我们还通过免疫印迹检测了RA和RAi处理培养物中β-MHC、MLC-2a以及心房营养因子(ANF)的表达,并且结果显示,β-MHC在两种培养物中均等表达,但MLC-2a和ANF在RA处理培养物中的表达水平高于RAi处理培养物中的表达水平(图6)。电生理特性鉴定了由另一种维甲酸信号诱导的胚胎心房样及心室样肌细胞群。由于哺乳动物系统中缺乏内源性的早期心房肌细胞的特异性基因标记5,我们选择应用电生理特征以严格鉴定这两种心肌亚群。基于AP特性的形态及分类(表1)6,26,在我们的研究中观察到三种主要类型的AP(起搏、心房样以及心室样)(图4A)。然而,Noggin+RA处理以及Noggin+RAi处理培养物之间的三种主要类型APs的比例不同;Noggin+RAi处理培养物中83%的心肌细胞(n=23)具有心室样APs(图4A,C),其APs的持续时间可通过硝苯吡啶--一种钙通道抑制剂来缩短(图4B,左侧),而Noggin+RA处理培养物中94%的心肌细胞(n=19)展示为心房样AP,并且所述AP的持续时间不能被硝苯吡啶所缩短(图4A,B右侧以及C)。这些结果证明Noggin+RA处理的培养物中的大多数心肌细胞是胚胎心房样肌细胞,以及Noggin+RAi处理的培养物中的大多数心肌细胞是胚胎心室样肌细胞。有趣的是,在Noggin+RA以及Noggin+RAi处理的培养物中,我们都没有观察到以往研究报道的高百分数的具有起搏APs的心肌细胞6,9。在心房与心室肌细胞中,心肌细胞Ca2+信号基本单位--Ca2+火花中存在重要的动力学差异。心房肌细胞中的Ca2+火花显著地比心室肌细胞中的更大且更持久28,29。图像研究的结果提示,在Noggin+RAi处理的培养物中,87.5%(14/16)的测试细胞展示了相对低振幅、上升时间快、半衰期衰减短以及小尺寸的Ca2+火花,典型的心室样肌细胞Ca2+火花特征(图4D,E)。另一方面,在Noggin+RA处理的培养物中,81.8%(18/22)的测试细胞展示了更高振幅、上升时间慢、半衰期衰减长以及更大尺寸的Ca2+火花(图4D,E),提示Noggin+RA处理培养物中的心肌细胞是心房样肌细胞。两种不同处理培养物中Ca2+释放的动力学研究以及具有两种模式的心肌细胞的比例吻合并支持以往基于AP表型的心肌亚型分类。讨论我们的结果显示,心肌分化起始后BMP信号的抑制促进了hESCs的心脏发生。这与显示分化起始前施用Noggin促进了心脏发生的小鼠胚胎干细胞研究部分地一致13。Noggin处理细胞与非处理细胞的进一步比较揭示,粒细胞集落刺激因子(G-CSF)促进了小鼠胚胎干细胞衍生的正在发育的心肌细胞的增殖30。Noggin支持hESCs的未分化增殖31,并且BMP4是小鼠胚胎干细胞自我更新所需的32。这些不同的自我更新机制可能是在人类及小鼠胚胎干细胞的心肌分化研究中所观察到的差异的原因。尽管免疫印迹揭示了ANF与MLC-2a的差异表达,两种基因均表达于60日龄的Noggin+RA及Noggin+RAi处理的培养物(图6)。这与Rosenthal博士的研究结果相一致,其表明在小鼠系统中没有早期心房特异性标记。取而代之的,他们应用接近840bp的鹌鹑SMyHC3启动子标记心脏发育最早期的窦房组织(sino-atrialtissue)5。鸡胚胎和小鼠胚胎的以往研究已提出,RA信号决定着窦房细胞的命运,而心室命运在缺乏RA的情况下指定20。我们的研究显示,阻断RA信号诱导了心室特异性标记MLC-2v在大多数hESC衍生的心肌细胞中表达,并且这些细胞具有心室肌细胞典型的APs和Ca2+火花。外源性RA处理引导着hESCs分化为保留心房样APs以及大的Ca2+火花或Ca2+瞬变的心肌细胞。我们的结果证明了维甲酸信号的激活或抑制指示了已分化hESCs的向心房肌细胞与心室肌细胞的特化。与我们的结果不同,以往研究显示,RA增强了由小鼠胚胎干细胞衍生的心室肌细胞的发育33。这可能代表了这两个研究中应用的分化培养体系上的差异,拟胚体过程与平板培养体系,以及接纳RA的时间。由hESC衍生心肌细胞异质性所引起的室性心律失常的潜在风险是hESCs在心脏修复应用上的主要障碍1,6,10。由hESCs产生的相对均质心室肌细胞在心肌修复中的应用具有降低这种风险的巨大潜力,解除了基于心肌修复策略开发hESC的主要障碍。组织工程的最新进展显示小鼠心室祖细胞可应用遗传标记途径从小鼠胚胎干细胞衍生物中分离出来,并用于产生功能性心室肌34,提示了人类功能性心室心脏肌肉可通过由hESCs直接分化的胚胎心室样肌细胞产生。通过一个成分确定的培养体系并且无须遗传操作,我们开发的直接分化步骤可以便捷地应用于心肌修复的临床研究。基于心肌修复开发hESC的另一挑战是快速产生移植所需大量心室肌细胞的生物技术的开发。我们的研究证实了通过减少拟胚体步骤,胚胎心房样及心室样肌细胞由hESCs有效分化,所述拟胚体步骤是通常用于胚胎干细胞心肌分化中的耗时步骤。如果与诱导多能干细胞(iPS)技术组合35,36,心房样与心室样肌细胞的程序性分化不仅可用于开发个性心脏修复的安全细胞来源,还可以开发提供心房或心室遗传疾病的细胞模型。参考文献:1Chen,H.S.,Kim,C.&Mercola,M.Electrophysiologicalchallengesofcell-basedmyocardialrepair.Circulation120,2496-2508(2009).2Schulze,G.E等.BMS-189453,anovelretinoidreceptorantagonist,isapotenttesticulartoxin.ToxicolSci59,297-308(2001).3Bao,Z.Z.,Bruneau,B.G.,Seidman,J.G.,Seidman,C.E.&Cepko,C.L.Regulationofchamber-specificgeneexpressioninthedevelopingheartbyIrx4.Science283,1161-1164(1999).4Fu,J.D等.Na+/Ca2+exchangerisadeterminantofexcitation-contractioncouplinginhumanembryonicstemcell-derivedventricularcardiomyocytes.StemCellsDev(2009).5Xavier-Neto,J等.Aretinoicacid-inducibletransgenicmarkerofsino-atrialdevelopmentinthemouseheart.Development126,2677-2687(1999).6He,J.Q.,Ma,Y.,Lee,Y.,Thomson,J.A.&Kamp,T.J.Humanembryonicstemcellsdevelopintomultipletypesofcardiacmyocytes:actionpotentialcharacterization.CircRes93,32-39(2003).7Laflamme,M.A等.Cardiomyocytesderivedfromhumanembryonicstemcellsinpro-survivalfactorsenhancefunctionofinfarctedrathearts.NatBiotechnol25,1015-1024(2007).8Yang,L等.HumancardiovascularprogenitorcellsdevelopfromaKDR+embryonic-stem-cell-derivedpopulation.Nature453,524-528(2008).9Zhu,W.Z等.Neuregulin/ErbBSignalingRegulatesCardiacSubtypeSpecificationinDifferentiatingHumanEmbryonicStemCells.CircRes(2010).10Kehat,I等.Electromechanicalintegrationofcardiomyocytesderivedfromhumanembryonicstemcells.NatBiotechnol22,1282-1289(2004).11Tran,T.H等.Wnt3a-inducedmesodermformationandcardiomyogenesisinhumanembryonicstemcells.StemCells27,1869-1878(2009).12Reppel,M等.Effectofcardioactivedrugsonactionpotentialgenerationandpropagationinembryonicstemcell-derivedcardiomyocytes.CellPhysiolBiochem19,213-224(2007).13Yuasa,S等.TransientinhibitionofBMPsignalingbyNoggininducescardiomyocytedifferentiationofmouseembryonicstemcells.NatBiotechnol23,607-611(2005).14Marvin,M.J.,DiRocco,G.,Gardiner,A.,Bush,S.M.&Lassar,A.B.InhibitionofWntactivityinducesheartformationfromposteriormesoderm.GenesDev15,316-327(2001).15Schneider,V.A.&Mercola,M.WntantagonisminitiatescardiogenesisinXenopuslaevis.GenesDev15,304-315(2001).16Korol,O.,Gupta,R.W.&Mercola,M.AnovelactivityoftheDickkopf-1aminoterminaldomainpromotesaxialandheartdevelopmentindependentlyofcanonicalWntinhibition.DevBiol324,131-138(2008).17Xu,R.H等.BMP4initiateshumanembryonicstemcelldifferentiationtotrophoblast.NatBiotechnol20,1261-1264(2002).18Zhang,P等.Short-termBMP-4treatmentinitiatesmesoderminductioninhumanembryonicstemcells.Blood111,1933-1941(2008).19Keegan,B.R.,Feldman,J.L.,Begemann,G.,Ingham,P.W.&Yelon,D.Retinoicacidsignalingrestrictsthecardiacprogenitorpool.Science307,247-249(2005).20Xavier-Neto,J等.Retinoidsignalingandcardiacanteroposteriorsegmentation.Genesis31,97-104(2001).21Patwardhan,V.,Fernandez,S.,Montgomery,M.&Litvin,J.Therostro-caudalpositionofcardiacmyocytesaffecttheirfate.DevDyn218,123-135(2000).22Orts-LlorcaF,J.C.J.Determinationofheartpolarity(arteriovenousaxis)inthechickenembryo.RouxArchEntwick-lungsmechanik113,17(1967).23Yutzey,K.,Gannon,M.&Bader,D.Diversificationofcardiomyogeniccelllineagesinvitro.DevBiol170,531-541(1995).24Hochgreb,T等.AcaudorostralwaveofRALDH2conveysanteroposteriorinformationtothecardiacfield.Development130,5363-5374,(2003).25Gassanov,N等.Retinoidacid-inducedeffectsonatrialandpacemakercelldifferentiationandexpressionofcardiacionchannels.Differentiation76,971-980(2008).26Maltsev,V.A.,Rohwedel,J.,Hescheler,J.&Wobus,A.M.Embryonicstemcellsdifferentiateinvitrointocardiomyocytesrepresentingsinusnodal,atrialandventricularcelltypes.MechDev44,41-50(1993).27Cheng,H.&Lederer,W.J.Calciumsparks.PhysiolRev88,1491-1545(2008).28Woo,S.H.,Cleemann,L.&Morad,M.SpatiotemporalcharacteristicsofjunctionalandnonjunctionalfocalCa2+releaseinratatrialmyocytes.CircRes92,e1-11(2003).29Cleemann,L.,Wang,W.&Morad,M.Two-dimensionalconfocalimagesoforganization,density,andgatingoffocalCa2+releasesitesinratcardiacmyocytes.ProcNatlAcadSciUSA95,10984-10989(1998).30Shimoji,K等.G-CSFpromotestheproliferationofdevelopingcardiomyocytesinvivoandinderivationfromESCsandiPSCs.CellStemCell6,227-237(2010).31Xu,R.H等.BasicFGFandsuppressionofBMPsignalingsustainundifferentiatedproliferationofhumanEScells.NatMethods2,185-190(2005).32Ying,Q.L.,Nichols,J.,Chambers,I.&Smith,A.BMPinductionofIdproteinssuppressesdifferentiationandsustainsembryonicstemcellself-renewalincollaborationwithSTAT3.Cell115,281-292(2003).33Wobus,A.M等.Retinoicacidacceleratesembryonicstemcell-derivedcardiacdifferentiationandenhancesdevelopmentofventricularcardiomyocytes.JMolCellCardiol29,1525-1539(1997).34Domian,I.J等.Generationoffunctionalventricularheartmusclefrommouseventricularprogenitorcells.Science326,426-429(2009).35Takahashi,K等.Inductionofpluripotentstemcellsfromadulthumanfibroblastsbydefinedfactors.Cell131,861-872(2007).36Yu,J等.Inducedpluripotentstemcelllinesderivedfromhumansomaticcells.Science318,1917-1920(2007).37Xu,C等.Feeder-freegrowthofundifferentiatedhumanembryonicstemcells.NatBiotech19,971-974(2001).38Picht,E.,Zima,A.V.,Blatter,L.A.&Bers,D.M.SparkMaster:automatedcalciumsparkanalysiswithImageJ.AmJPhysiolCellPhysiol293,C1073-1081(2007).上述出版物或文件的引用并非意在认可上述任何一项是相关的现有技术,其也不构成对这些出版物或文件的内容或日期的任何认可。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1