醇化合物的制造方法、(甲基)丙烯酸酯的制造方法与流程
技术领域
本发明涉及作为聚合性单体有用的(甲基)丙烯酸酯及其制造方法,作为(甲基)丙烯酸酯的中间体有用的内酯化合物、醇化合物及其制造方法,使用了该(甲基)丙烯酸酯的聚合物及其制造方法,含有该聚合物的抗蚀剂组合物,使用了该抗蚀剂组合物的基板的制造方法,以及新型的(甲基)丙烯酸酯及利用其的聚合物。
本申请基于2011年6月14日在日本申请的日本特愿2011-132183号和2011年9月27日在日本申请的日本特愿2011-210667号要求优先权,并将其内容援引于此。
背景技术:
近年来,在半导体元件、液晶元件的制造中的微细加工的领域中,随着光刻技术的进步,微细化正在迅速发展。作为该微细化的方法,一般采用照射光的短波长化,具体而言,照射光从以往的以g射线(波长:438nm)、i射线(波长:365nm)为代表的紫外线向DUV(Deep Ultra Violet,深紫外线)逐渐变化。目前,KrF准分子激光(波长:248nm)光刻技术被导入市场,正在试图导入实现了更短波长化的ArF准分子激光(波长:193nm)光刻技术。进而,作为新一代的技术,正在研究F2准分子激光(波长:157nm)光刻技术。另外,作为与这些稍有不同的类型的光刻技术,对于使用电子束光刻技术、波长13.5nm附近的极端紫外光(Extreme Ultra Violet light:EUV光)的EUV光刻技术也正在深入研究。
作为对这样的短波长的照射光或电子束为高分辨率的抗蚀剂,提倡含有光产酸剂的“化学增幅型抗蚀剂”,目前,正在深入研究该化学增幅型抗蚀剂的改良和开发。
作为用于化学增幅型抗蚀剂的聚合物,由于高透明性而正在积极开发将(甲基)丙烯酸酯用作单体的丙烯酸系聚合物,为了使抗蚀剂具有各种功能,构成这些聚合物的单体的改良也正在不断发展。近年来,作为能够对抗蚀剂赋予高耐干蚀刻性和底座密合性的聚合性单体,提出了具有降冰片烯内酯骨架的(甲基)丙烯酸酯,公开了各种包括它们的中间体在内的化合物的制造方法(例如专利文献1~3)。
内酯化合物作为医药、农药等功能性化学品的原料而广泛使用。特别是具有活性的碳-碳双键的内酯化合物能够加成例如(甲基)丙烯酸等聚合性羧酸。含有这样得到的含内酯骨架的(甲基)丙烯酸酯作为原料的高分子化合物的抗蚀剂材料由于灵敏度、分辨率、耐蚀刻性优异,因此在利用电子束、远紫外线的微细加工中有用。
作为用于通过分子内具有碳-碳双键的酸酐的还原而以残留碳-碳双键的状态仅将酸酐选择性地进行还原而得到内酯化合物的还原剂和溶剂的组合,例如,已知下述的组合。
(1)硼氢化钠与N,N-二甲基乙酰胺的组合(专利文献4)。
(2)硼氢化钠与乙醇的组合(非专利文献1)。
(3)硼氢化钠与四氢呋喃和醇类的混合溶剂的组合(专利文献5)。
(甲基)丙烯酸酯除了上述抗蚀剂用途以外,还用作各种紫外线固化型或电子束固化型树脂等光固化性树脂组合物的固化性成分。作为利用了该光固化性树脂组合物的用途,可举出塑料、纸、木、无机原料等中的涂料、油墨、粘接剂等。最近,逐步扩大到以半导体、液晶为代表的电子材料领域,以光纤、光学透镜等为代表的光电子领域、进而医疗领域等。
其中,目前为止没有使用将具有降冰片烯内酯骨架的(甲基)丙烯酸酯用作单体而得到的聚合物。
专利文献1:日本特开2002-234882号公报
专利文献2:日本特开2004-359669号公报
专利文献3:日本特开2011-81340号公报
专利文献4:日本特开2002-275215号公报
专利文献5:日本特开2003-146979号公报
非专利文献1:Tetrahedron Letters,1994年,第35卷,第8号,p.1165-1168
技术实现要素:
在具有降冰片烯内酯骨架的(甲基)丙烯酸酯中,特别是在降冰片烯骨架的桥头位具有氧原子、硫原子等杂原子的(甲基)丙烯酸酯对光产酸剂的分散、曝光时酸的扩散的控制容易,作为构成用于化学增幅型抗蚀剂的聚合物的聚合性单体而有用。但是,用专利文献1和2中记载的方法制造这样的(甲基)丙烯酸酯时,存在得不到目标化合物,即便得到其收率也非常低等问题。具体而言,在专利文献1记载的方法中,使降冰片烯内酯化合物在酸催化剂存在下加成低级羧酸,将得到的酯进行水解从而得到醇,将其进行(甲基)丙烯酸酯化而得到目标聚合性单体。在专利文献2记载的方法中,通过使降冰片烯内酯化合物加成(甲基)丙烯酸而得到目标聚合性单体。在这些方法中,在加成低级羧酸或(甲基)丙烯酸的工序中需要高温(例如85~120℃)下的加热,因此,降冰片烯内酯化合物由逆Diels-Alder反应等而分解,得不到对应的加成物。
另外,在专利文献3的实施例1中记载了将具有降冰片烯内酯骨架的酸酐化合物用NaBH3进行处理,使得到的内酯体与BH3-THF配位化合物反应而形成羟基内酯体,使其进行酯化反应而制造包含降冰片烯内酯骨架的(甲基)丙烯酸酯的例子。
但是,在该方法中,作为中间体的羟基内酯体的反应收率低至50%,用色谱法进行纯化。因此,产量少,费工夫。
关于内酯化合物的制造方法,上述(3)的硼氢化钠与四氢呋喃和醇类的混合溶剂的组合在还原酸酐而得到内酯化合物时的反应收率优异。但是,在利用该(3)的组合的酸酐的还原中,例如,副生成下式 表示的二醇体。
对于二醇体的副生成,专利文献5中没有任何记载。对包含二醇体的内酯化合物加成(甲基)丙烯酸等聚合性羧酸而合成含有内酯骨架的(甲基)丙烯酸酯时,生成二醇体的2个羟基与(甲基)丙烯酸的羧酸反应而得到的二酯化体。如果将包含二酯化体的含有内酯骨架的(甲基)丙烯酸酯用于原料而合成高分子化合物,则由于二酯化体与其他单体共聚而高分子化合物的一部分交联。包含这样的高分子化合物的抗蚀剂材料有增加瑕疵(显影缺陷)的可能性。
本发明是鉴于上述情况而进行的,提供以高收率制造作为(甲基)丙烯酸酯的中间体而有用的、杂质少的醇化合物的方法、以及利用该方法制造包含降冰片烯内酯骨架的(甲基)丙烯酸酯的方法。
本发明提供抑制醇体的副生成并以高收率制造具有碳-碳双键的内酯化合物的方法、以及利用该方法制造醇化合物的方法。
本发明提供杂质的含量少且包含降冰片烯内酯骨架的醇化合物。
本发明提供杂质的含量少且包含降冰片烯内酯骨架的(甲基)丙烯酸酯、使用了该(甲基)丙烯酸酯的聚合物及其制造方法、包含该聚合物的抗蚀剂组合物、以及使用该抗蚀剂组合物制造形成有图案的基板的方法。
本发明提供具有降冰片烯内酯骨架和(甲基)丙烯酰氧基的新型化合物以及使用其的新型聚合物。
本发明为以下的<1>~<20>。
<1>一种醇化合物的制造方法,其特征在于,是制造下述通式(D)表示的醇化合物的方法,
具有硼氢化反应工序和酸处理工序,所述硼氢化反应工序是在溶剂中使下述通式(C)表示的化合物与选自乙硼烷和硼烷配位化合物中的 硼化剂反应而得到反应液,所述酸处理工序是将该反应液进行过氧化氢处理后,加入酸而使得pH为0.5~4。
[式中,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基。]
<2>根据<1>所述的醇化合物的制造方法,其中,作为上述硼化剂,使用硼烷-二甲基硫醚配位化合物或硼烷-1,2-二甲氧基乙烷配位化合物。
<3>根据<1>或<2>所述的醇化合物的制造方法,其中,具有离析工序,上述离析工序是将上述酸处理工序后的反应液调整为pH5~9而进行重结晶,从而离析上述通式(D)表示的醇化合物。
<4>一种内酯化合物的制造方法,其特征在于,将下述式(1)表示的化合物用硼氢化钠进行还原来制造下述式(2)表示的内酯化合物和/或下述式(3)表示的内酯化合物的方法中,相对于下述式(1)表示的化合物,所述硼氢化钠的使用量为0.7~0.95倍摩尔。
[式中,R11~R16各自独立地表示氢原子、甲基或乙基;A11和A12均为氢原子、或者连结而形成-CH2-、-CH2CH2-、-O-、或-S-。]
<5>根据<4>所述的内酯化合物的制造方法,其中,上述式(1)表示的化合物为下述式(4)表示的化合物,上述式(2)表示的内酯化合物为下述式(5)表示的内酯化合物,上述式(3)表示的内酯化合物 为下述式(6)表示的内酯化合物。
[式中,R11~R16各自独立地表示氢原子、甲基或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基。]
<6>根据<1>~<3>中任一项所述的醇化合物的制造方法,其中,还具有利用<4>或<5>所述的内酯化合物的制造方法而制造上述通式(C)表示的化合物的工序。
<7>一种(甲基)丙烯酸酯的制造方法,具有以下工序:通过<1>~<3>中任一项所述的醇化合物的制造方法,由下述通式(C)表示的化合物得到下述通式(D)表示的醇化合物的工序,以及通过酯化反应由下述通式(D)表示的化合物而得到下述式(A)表示的(甲基)丙烯酸酯的工序。
[式中,R1表示氢原子或甲基,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基。]
<8>根据<7>所述的(甲基)丙烯酸酯的制造方法,其中,还具有利用<4>或<5>所述的内酯化合物的制造方法而制造上述通式(C)表示的化合物的工序。
<9>一种下述通式(D)表示的醇化合物,作为杂质,下述通式(ii)表示的化合物的含量小于9质量%。
[式中,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基。]
<10>一种下述通式(A)表示的(甲基)丙烯酸酯,作为杂质,下述通式(iii)表示的化合物的含量小于9质量%。
[式中,R1表示氢原子或甲基,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基,R1表示丙烯酰基或甲基丙烯酰基。]
<11>一种(甲基)丙烯酸酯,是下述通式(A’)表示的(甲基)丙烯酸酯(A’),在利用高效液相色谱法得到的色谱图中,保存时分解而产生甲基丙烯酸的分子量308的杂质(X)的峰面积相对于所述(甲基)丙烯酸酯(A’)的峰面积为0.3%以下。
<12>一种(甲基)丙烯酸酯,是下述通式(A’)表示的(甲基)丙烯酸酯(A’),相对于(甲基)丙烯酸酯(A’),甲基丙烯酸的含量为0.04倍摩尔以下,并且在利用高效液相色谱法得到的色谱图中,保存时分解而产生甲基丙烯酸的分子量308的杂质(X)的峰面积相对于上述(甲基)丙烯酸酯(A’)的峰面积为0.3%以下。
[式中,R1表示氢原子或甲基。]
<13>一种下述通式(A)表示的(甲基)丙烯酸酯,作为杂质,下述通式(v)表示的化合物的含量小于9质量%。
[式中,R1表示氢原子或甲基,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基,R2表示氢原子、丙烯酰基、或甲基丙烯酰基。]
<14>一种聚合物,是使1种以上的单体进行聚合而得到的聚合物,上述单体包含<10>~<13>中任一项所述的(甲基)丙烯酸酯。
<15>一种聚合物,是使2种以上的单体进行聚合而得到聚合物,上述单体包含<10>~<13>中任一项所述的(甲基)丙烯酸酯和其以外的(甲基)丙烯酸酯。
<16>一种聚合物的制造方法,具有使包含<10>~<13>中任一项所述的(甲基)丙烯酸酯的单体进行聚合的工序。
<17>一种抗蚀剂组合物,含有<14>或<15>所述的聚合物、以及通过活性光线或放射线的照射而产生酸的化合物。
<18>一种形成有图案的基板的制造方法,包括以下工序:将<17>所述的抗蚀剂组合物涂布在基板的被加工面上而形成抗蚀膜的工序、对该抗蚀膜进行曝光的工序、和将经曝光的抗蚀膜用显影液进行显影的工序。
<19>下述通式(iii)表示的化合物。
式中,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基,R1表示丙烯酰基或甲基丙烯酰基。]
<20>一种聚合物,是将<19>所述的化合物用作单体而得到的。
根据本发明,能够以高收率制造作为(甲基)丙烯酸酯的中间体有用的醇化合物,使用该醇化合物能够以良好的效率制造包含降冰片烯内酯骨架的(甲基)丙烯酸酯。
根据本发明,能够抑制二醇体的副生成而制造具有碳-碳双键的内酯化合物。
根据本发明,能够得到杂质的含量少、包含降冰片烯内酯骨架的醇化合物。
根据本发明,能够得到杂质的含量少、包含降冰片烯内酯骨架的(甲基)丙烯酸酯,通过使用该(甲基)丙烯酸酯而能得到性能良好的聚合物、抗蚀剂组合物。使用该抗蚀剂组合物,能够良好地制造形成有图案的基板。
根据本发明,能够得到具有降冰片烯内酯骨架和(甲基)丙烯酰氧基的新型化合物和使用其的新型聚合物。
附图说明
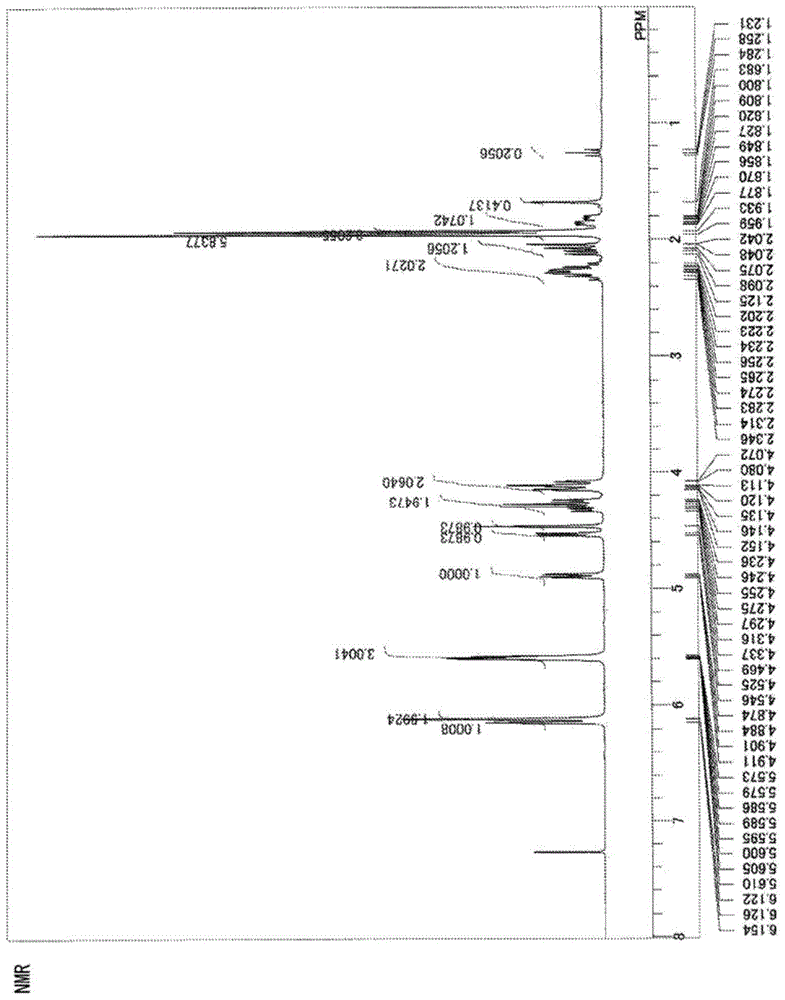
图1是实施例中得到的化合物(iii-1)的1H-NMR光谱
图2是实施例中得到的化合物(iii-1)的MS光谱。
具体实施方式
以下,详细说明本发明。
应予说明,在本说明书中,“(甲基)丙烯酸”意味着丙烯酸或甲基丙烯酸。
以下,有时将通式(A)简称为式(A)(对于其他式也同样)。有时将式(A)表示的化合物称为化合物(A)(对于其他式表示的化合物也同样)。
<醇化合物的制造方法(I)>
说明通式(D)表示的醇化合物(D)的制造方法的实施方式。
本实施方式的醇化合物(D)的制造方法具有以下工序:在溶剂中使通式(C)表示的内酯化合物(C)与硼化剂反应而得到反应液的硼氢化反应工序,过氧化氢处理工序,酸处理工序。
[式中,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基。]
在式(C)、(D)中,A1~A6优选各自独立地表示氢原子或甲基。一分子中的甲基和乙基的总数可以为0~6个中的任意一个,在将具有来自化合物(D)的结构单元的聚合物用作抗蚀剂用树脂时,优选为0~2个,特别优选为0~1个。X优选为氧原子或亚甲基。
内酯化合物(C)可以用公知的方法制造。优选利用后述的内酯化合物的制造方法(II)制造内酯化合物(C),使用该内酯化合物(C)进行本方式的硼氢化反应工序。
〔硼氢化反应工序〕
硼氢化反应使用选自乙硼烷和硼烷配位化合物中的硼化剂来进行。作为优选的硼化剂,可举出乙硼烷、硼烷-二甲基硫醚配位化合物、硼烷-1,2-二甲氧基乙烷配位化合物(以下表示为硼烷-DME配位化合物)、硼烷-THF配位化合物、硼烷-四氢吡喃配位化合物等。其中,从反应速度、抑制副产物的观点考虑,优选硼烷-二甲基硫醚配位化合物、硼烷-DME配位化合物。
就硼化剂的使用量而言,为了完成硼氢化反应,以硼原子换算,相对于内酯化合物(C),优选使用0.5摩尔当量以上,为了抑制副产物,相对于内酯化合物(C),优选为2.0摩尔当量以下。
硼化剂可以将预先合成的硼化剂进行离析而使用,也可以使用在体系中产生的硼化剂。在体系中产生硼化剂的方法是公知的,例如,作为产生硼烷配位化合物的方法,可举出使硼氢化钠与0.5倍摩尔的浓硫酸或硫酸二甲酯在希望形成配位化合物的溶剂的存在下反应的方法。
作为进行本工序的硼氢化反应的方法,在预先将内酯化合物(C)溶解于溶剂而得到的溶液中滴加离析的硼化剂的方法,或滴加在体系中产生的硼化剂的方法;向离析或体系中产生的硼化剂滴加使内酯化合物(C)预先溶解于溶剂而得到的溶液的方法;或者,在希望形成硼烷配位化合物的溶剂(DME等)中加入内酯化合物(C)和硼氢化钠,滴加硫酸或硫酸二甲酯的方法等。
预先溶解内酯化合物(C)的溶剂只要是与硼化剂不发生反应的溶剂,就没有特别限定,从内酯化合物(C)的溶解性、操作性容易出发,因此优选DME、四氢呋喃(以下表示为THF)。
用上述任意方法进行的情况下,在滴加时发热,但为了不使反应失控,因此优选以将滴加时的被滴加反应液的温度保持在40℃以下、优选为-10~30℃的速度进行滴加。
〔过氧化氢处理工序〕
硼氢化反应结束后的反应液中包含内酯化合物(C)的硼氢化物。通过将该硼氢化物进行过氧化氢处理,能够得到醇化合物(D)。
过氧化氢处理可以利用作为由硼氢化物得到醇的方法公知的方法来实施,可以举出根据情况,在硼氢化反应结束后的反应液中添加水后,在碱存在下,进行过氧化氢处理的方法。
〔酸处理工序〕
另外,在硼氢化反应中,副生成式(i)表示的化合物,其一部分形成为式(ii)表示的化合物。
在本工序中,通过硼氢化反应结束后进行酸化处理,由式(i)表示的化合物得到醇化合物(D)。具体而言,对硼氢化反应结束后的反应液进行上述过氧化氢处理后,向其中加入酸,使pH为0.5~4。从处理速度的方面考虑,pH优选调整为3以下,更有选调整为2以下。从处理后的中和时的碱使用量方面考虑,pH优选调整为0.8以上,更优选调整为1以上。
在本工序中,作为在反应液中添加的酸,例如,可举出无机酸(盐酸、硫酸、硝酸、磷酸等)、酸性离子交换树脂等。这些可以单独使用1种,也可以并用2种以上。从操作的容易性等方面考虑,优选硫酸。
式(i)、(ii)中的A1~A6和X包括优选方式在内与式(D)中的A1~A6和X分别相同。
〔离析工序〕
对于从酸化处理后的反应液取出醇化合物(D)的方法,没有特别限定,由于醇化合物(D)在水中的溶解性高,优选馏去反应中使用的溶剂后,添加有机溶剂,使副生成的硫酸钠析出,过滤后再次馏去有机溶剂。
作为此时使用的有机溶剂,例如可举出丙酮、甲醇、乙醇、乙腈等。由于水分影响后述的工序(3)的酯化反应,从与水的共沸能力高、容 易从醇化合物(D)中除去的方面考虑,优选乙醇。
提供到工序(3)的醇化合物(D)的水分量优选为5000ppm以下,更优选2000ppm以下。该水分量可以根据共沸的有机溶剂的量、共沸次数来调整。共沸的有机溶剂的量、共沸次数没有特别限定,适当选择即可。另外,该水分量可利用卡尔费休水分测定仪进行测定。
在离析工序的优选方式中,将上述酸处理工序后的反应液调整为pH5~9而进行重结晶,离析醇化合物(D)。该pH的值更优选6~8。将pH调节到上述范围的方法例如可举出利用氨、氨水、碱金属和碱土金属的氧化物、氢氧化物、碳酸盐、碳酸氢盐等进行中和。从纯化时的收率方面考虑,更优选利用氨、氨水进行中和。
<醇化合物>
根据本实施方式,通过在硼氢化反应后进行酸处理工序,能够得到杂质的含量低的醇化合物(D)。
在本说明书中,醇化合物(D)中的杂质的含量是在醇化合物(D)纯度90质量%以上的干燥粉体中的含量。
具体而言,能够得到化合物(ii)的含量小于9质量%、优选为6质量%以下的醇化合物(D)。该醇化合物(D)优选实质上不含有化合物(i)。
该醇化合物中的杂质的含量可以通过利用了紫外检测器(UV检测器)的高效液相色谱法(HPLC)而求出。在本说明书中“实质上不含有”是指检测限以下。利用了紫外检测器(UV检测器)的液体色谱法的检测限通常为0.01质量%以下。
这样的杂质极少的醇化合物特别优选作为用于合成抗蚀剂用聚合物的原料。
应予说明,化合物(D)、化合物(i)、(ii)可以存在异构体,在本说明书中,它们的含量是各异构体的含量的合计值。
<内酯化合物的制造方法(II)>
对制造下式(2)或(3)表示的内酯化合物的方法的实施方式进行 说明。
本实施方式的内酯化合物的制造方法是将式(1)表示的化合物用硼氢化钠进行还原,制造式(2)表示的内酯化合物和式(3)表示的内酯化合物中的一方或双方的方法。
(式中,R11~R16各自为氢原子、甲基或乙基;A11和A12均为氢原子、或者连结而形成-CH2-、-CH2CH2-、-O-、或-S-。)
具体而言,具有下述工序(a)~工序(c)。
(a)将下述式(1)表示的化合物用硼氢化钠进行还原,得到下述式(7)表示的化合物和或下述式(8)表示的化合物的工序(还原工序)。
(b)在上述工序(a)中得到的反应液中加入pH调节剂,从而将未反应的硼氢化钠进行分解而停止反应,并且得到下述式(2)表示的内酯化合物和或下述式(3)表示的内酯化合物的工序(pH调节工序)。即通过该pH调节工序,进行(7)表示的化合物或下述式(8)表示的化合物的闭环反应。
(c)根据需要,进行从上述工序(b)中得到的反应液中萃取内酯化合物、水清洗等处理的工序(纯化工序)。
〔工序(a)〕
(式(1)表示的化合物)
作为式(1)表示的化合物,例如可举出下述化合物。
作为式(1)表示的化合物,从以良好的反应收率进行反应的方面考虑,优选式(4)表示的化合物。
在式(4)中,R11~R16各自独立地表示氢原子、甲基或乙基。X表示氧原子、硫原子、亚甲基、或亚乙基,优选氧原子或亚甲基。
作为式(4)表示的化合物,例如可举出5-降冰片烯-2,3-二羧酸酐、2-甲基-5-降冰片烯-2,3-二羧酸酐、4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3,5-二酮等。
式(1)表示的化合物可以由1,3-二烯与马来酸酐的狄尔斯-阿德尔加成反应来合成。
作为1,3-二烯,可举出1,3-丁二烯、环戊二烯、1-甲基环戊二烯、1,3-二甲基环戊二烯、1-乙基环戊二烯、1-乙基-3-甲基环戊二烯、1,3-二乙基环戊二烯、1,3-环己二烯、1-甲基-1,3-环己二烯、1,3-二甲基-1,3-环己二烯、1-乙基-1,3-环己二烯、1-乙基-3-甲基-1,3-环己二烯、1,3-二乙基-1,3-环己二烯、呋喃、1-甲基呋喃、1,3-二甲基呋喃、1-乙基呋喃、1-乙基-3-甲基呋喃、1,3-二乙基呋喃等。1,3-二烯根据目标产物而适当确定即可。另外,作为式(1)表示的化合物,也可以使用市售品。
(硼氢化钠)
作为硼氢化钠,可以使用市售的试剂。从提高转化率(提高反应收率)方面考虑,相对于式(1)表示的化合物的1摩尔,硼氢化钠的使用量为0.7摩尔以上,优选为0.8摩尔以上。从抑制二醇体的副生成的方面考虑,相对于式(1)表示的化合物1摩尔,硼氢化钠的使用量为0.95摩尔以下,优选为0.9摩尔以下。
(溶剂)
利用式(1)表示的化合物的硼氢化钠的还原,通常在溶剂中进行。
在本方式中,作为溶剂,例如可举出醇类(甲醇、乙醇、丙醇、异 丙醇、1-丁醇、2-丁醇、异丁醇、叔丁醇等)、醚类(二乙基醚、甲基-叔丁基醚、异丙醚、四氢呋喃、二甲氧基乙烷等)、酯类(乙酸乙酯、γ-丁内酯等)、腈类(乙腈等)、酰胺类(N,N-二甲基甲酰胺、N,N-二甲基乙酰胺等)、烃类(甲苯、二甲苯、己烷等)等。溶剂可以单独使用1种,也可以混合2种以上使用。
作为溶剂,从反应速度快、硼氢化钠和式(1)表示的化合物的溶解性高、抑制二醇体的副生成的方面考虑,优选四氢呋喃、甲醇、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、四氢呋喃与醇类的混合溶剂、二甲氧基乙烷与醇类的混合溶剂,从能以高反应收率得到目标内酯化合物的方面、充分抑制二醇体的副生成的方面考虑,特别优选四氢呋喃与甲醇的混合溶剂、二甲氧基乙烷与醇类的混合溶剂。
混合溶剂的使用量根据醇类的种类而适当确定,通常,从反应速度方面考虑,相对于硼氢化钠1摩尔,优选为0.1摩尔以上,更优选为0.5摩尔以上。从硼氢化钠的稳定性方面考虑,相对于硼氢化钠1摩尔,混合溶剂的使用量优选为20摩尔以下,更优选为10摩尔以下。
从反应速度方面考虑,相对于式(1)表示的化合物1质量份,溶剂的使用量优选为100质量份以下,更优选为33质量份以下,进一步优选为20质量份以下。从抑制反应液的粘性恶化的方面考虑,相对于式(1)表示的化合物1质量份,溶剂的使用量优选为0.5质量份以上,更优选为1质量份以上,进一步优选为1.5质量份以上。
(还原反应)
工序(a)中的还原反应例如可以通过在反应器中装入硼氢化钠和溶剂,向其中连续或间歇地滴加溶解于溶剂的式(1)表示的化合物而进行。另外,也可以通过在反应器中装入式(1)表示的化合物和溶剂,向其中连续或间歇地滴加硼氢化钠或其悬浮液而进行。
应予说明,并用2种以上溶剂而使用时,各个溶剂可以分别滴加,也可以混合而加入。
(反应条件)
最佳的反应温度根据原料溶液的滴加速度、浓度而发生变化,从反 应速度方面考虑,反应温度通常优选为-50℃以上,更优选为-40℃以上,进一步优选为-30℃以上。从防止副反应方面考虑,反应温度优选为100℃以下,更优选为70℃以下,进一步优选为40℃以下。
从容易控制温度的方面考虑,滴加时间优选为0.1小时以上,更优选为0.2小时以上,进一步优选为0.5小时以上。从抑制反应液的粘性恶化的方面考虑,滴加时间优选为30小时以下,更优选为20小时以下,进一步优选为10小时以下。该滴加时间优选为0.1~30小时,更优选为0.2~20小时,进一步优选为0.5~10小时。
根据需要,可以在滴加结束后设置20小时以内的熟化时间。
反应应尽可能避免水分的混入而进行。为此,优选使反应器和原料溶液的接收容器预先为非活性气体气氛。作为非活性气体,只要是不阻碍反应的顺利进行的气体即可,可举出氦气、氮气、氩气等。
〔工序(b)〕
(pH调节剂)
作为pH调节剂,至少可以使用酸。作为酸,例如可举出无机酸(盐酸、硫酸、硝酸、磷酸等)、酸性离子交换树脂等。pH调节剂可以单独使用1种,也可以并用2种以上。作为pH调节剂,从大量合成的操作容易性等方面考虑,优选硫酸。
将pH调节剂与水混合而进行滴加时,从更高效地进行分子内环化反应的方面考虑,混合物中的pH调节剂的浓度(质量百分率)优选为0.1质量%以上,更优选为5质量%以上。从防止发泡的方面考虑,pH调节剂的浓度(质量百分率)优选为70质量%以下,更优选为50质量%以下。
该pH调节剂的浓度优选为0.1~70质量%,更优选为5~50质量%。
(pH调节剂的添加)
在工序(b)中,向工序(a)中得到的反应液中添加pH调节剂和水,使该反应液的水相为酸性而停止还原反应。pH调节剂的使用量根 据pH调节剂添加后的水相的pH(20℃的pH)适当调节。从抑制内酯化合物的水解体生成的方面考虑,该pH优选为4.0以下,更优选为3.0以下,进一步优选为2.0以下。另外,该pH为0.1以上。由此,能够得到式(2)表示的内酯化合物和或式(3)表示的内酯化合物。从进行有效的酸的除去的方面考虑,该pH优选为1.0以上。
该pH调节剂添加后的水相的pH优选为0.1~4.0,更优选为1.0~3.0,进一步优选为1.0~2.0。
pH调节剂的添加结束后,优选根据需要设置0.01小时以上且50小时以内的保持时间。由此,能够更高效地进行分子内环化反应。该保持时间更优选为0.1~40小时。
(内酯化合物)
作为式(2)表示的内酯化合物或式(3)表示的内酯化合物,例如可举出下述化合物。
作为式(2)表示的内酯化合物,从收率良好的方面考虑,优选式(5)表示的内酯化合物。作为式(3)表示的内酯化合物,从收率良好 的方面考虑,优选为式(6)表示的内酯化合物。
在式(5)中,R11~R16各自独立地表示氢原子、甲基或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基。
〔工序(c)〕
内酯化合物的萃取可以使用溶解该内酯化合物的有机溶剂来实施。
作为萃取中使用的有机溶剂,可举出醚类(二甲基醚、甲基-叔丁基醚、异丙醚等)、酮类(甲基正丙酮、甲基正丁基酮、甲基异丁酮等)、芳香族烃类(甲苯、二甲苯等)、酯类(乙酸乙酯等)等。有机溶剂可以单独使用1种,也可以混合2种以上使用。
有机溶剂的使用量没有特别限定,从萃取效率方面考虑,优选相对于内酯化合物为0.05倍量以上且20倍以下。
萃取可以实施多次。
如果用水清洗反应液或萃取液,则能够减少作为pH调节剂使用的酸等。
得到反应液或萃取液后,可以利用蒸馏、重结晶、色谱法等方法纯化目标内酯化合物。纯度高时不一定需要进行纯化,例如,也可以通过浓缩萃取液而得到目标内酯化合物。
〔作用效果〕
以上说明的本方式的内酯化合物的制造方法中,通过使硼氢化钠的使用量相对于式(1)表示的化合物为0.7~0.95倍摩尔,从而能够抑制二醇体的副生成,并且以高收率制造具有碳-碳双键的内酯化合物。具 体而言,利用本发明的内酯化合物的制造方法,能够将二醇体的副生成抑制到小于1质量%。
在这样的抑制了二醇体的副生成的具有碳-碳双键的内酯化合物中加成(甲基)丙烯酸等聚合性羧酸来合成含有内酯骨架的(甲基)丙烯酸酯时,二酯化体的副生成得到抑制,能够以高收率制造含有内酯骨架的(甲基)丙烯酸酯。并且,能够得到由于二酯化体与其他单体进行共聚、高分子化合物的一部分发生交联而引起的瑕疵(显影缺陷)大幅降低的抗蚀剂材料。
由本实施方式的制造方法得到的具有碳-碳双键的内酯化合物作为用于抗蚀剂材料的高分子化合物的原料即含有内酯骨架的(甲基)丙烯酸酯的原料而有用。
(二醇体)
在本发明的内酯化合物的制造方法中,副生成得到抑制的二醇体是下述式(9)表示的化合物。
式中,R11~R16、A11和A12与式(1)相同。
作为式(9)表示的化合物,例如可举出下述化合物。
<(甲基)丙烯酸酯的制造方法>
对(甲基)丙烯酸酯(A)的制造方法的实施方式进行说明。
本实施方式的制造方法是下述通式(A)表示的(甲基)丙烯酸酯的制造方法,包括下述工序(1)~(3)。
工序(1):由下述通式(B)表示的化合物(有时也称为酸酐化合物(B))通过还原反应而得到下述通式(C)表示的化合物(有时也称为内酯化合物(C))工序。
工序(2):由内酯化合物(C)通过硼氢化反应而得到下述通式(D)表示的化合物(有时也称为醇化合物(D))的工序。
工序(3):由醇化合物(D)通过酯化反应而得到式(A)表示的化合物(A)的工序。
[式中,R1表示氢原子或甲基,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基。]
在式(A)~(D)中,优选A1~A6各自独立地表示氢原子或甲基。一分子中的甲基和乙基的总数可以为0~6个中的任意一个,在将具有来自化合物(D)的结构单元的聚合物用作抗蚀剂用树脂时,优选为0~2个,特别优选为0~1个。X优选为氧原子或亚甲基。
[工序(1)(还原工序)]
工序(1)是由酸酐化合物(B)通过还原反应而得到内酯化合物(C)的工序。
本工序优选通过上述的内酯化合物的制造方法(II)进行。应予说明,式(B)相当于在式(1)中A11与A12连结的情况。
或者也可以通过以下的内酯化合物的制造方法(III)进行。
〔内酯化合物的制造方法(III)〕
酸酐化合物(B)可以用例如马来酸酐与呋喃等1,3-二烯的Diels-Alder反应等公知的方法容易地进行合成。另外,也能够使用市售品。1,3-二烯与上述内酯化合物的制造方法(II)相同。
还原反应是利用还原剂来进行的。作为在本工序中使用的还原剂,可举出金属氢化物、金属氢配位化合物等。作为这些化合物,没有特别限定,例如可举出硼烷·二甲基硫醚、二异丁基氢化铝、硼氢化钠、硼氢化锂、硼氢化钾、硼氢化锌、三仲丁基硼氢化锂、三仲丁基硼氢化钾、三乙基硼氢化锂、氢化铝锂、三叔丁氧基氢化铝锂、双(甲氧基乙氧基)氢化铝钠等。其中,从抑制副反应和容易操作的方面考虑,优选硼氢化钠。
作为还原剂的使用量,为了使反应结束,相对于酸酐化合物(B)优选为0.5摩尔当量以上,为了抑制副反应,相对于酸酐化合物(B)优选为1.5摩尔当量以下。更优选为0.7~0.95摩尔当量。
还原反应通常在溶剂的存在下实施。作为用于还原反应的溶剂,优选非质子性极性溶剂。作为非质子性极性溶剂,例如可举出甲醇、乙醇等醇系溶剂,二乙基醚、四氢呋喃、二甲氧基乙烷、二甘醇二甲醚、三甘醇二甲醚等醚系溶剂,乙酸乙酯、γ-丁内酯等酯系溶剂,乙腈等腈系溶剂,N,N-二甲基甲酰胺(DMF)、N,N-二甲基乙酰胺(DMAc)、N-甲基吡咯烷酮等酰胺系溶剂,甲苯、己烷等烃系溶剂,二甲基亚砜等。这些可以使用1种,也可以将2种以上混合而使用。
作为非质子性极性溶剂,从酸酐化合物(B)的还原反应迅速进行的方面考虑,优选含有选自DMF、DMAc中的至少1种,特别优选含有DMAc。
通过酸酐化合物(B)的还原反应,能够得到下述通式(E)表示的化合物(内酯化合物(C)的内酯环开环的化合物。以下,表示为化合物(E))。因此,为了得到内酯化合物(C),需要用酸进行闭环反应。
即,在工序(1)中,通过进行酸酐化合物(B)的还原反应、和对其反应产物(化合物(E))使用酸进行闭环反应,能够得到内酯化合物(C)。
作为用于闭环反应的酸,可举出硫酸、盐酸、硝酸、磷酸等。另外,还可以使用酸性离子交换树脂。
此时,为了以良好的收率进行闭环,优选酸添加后的反应溶液的20℃时的pH为2.0以下。
[式中,X表示氧原子、硫原子、亚甲基、或亚乙基。]
为了从这样得到的反应溶液中取出内酯化合物(C),通常,利用有机溶剂进行萃取。此时使用的有机溶剂只要是能够与水分离且溶解内酯化合物(C)的溶剂,就没有特别限定,例如可举出甲基异丁酮(MIBK)、环己酮、叔丁基甲基醚(MTBE)等。
对于内酯化合物(C),可以将馏去了用于萃取的溶剂的产物直接用于下述工序,也可以进行纯化后用于以下工序。纯化方法没有特别限定,可以从柱色谱法、晶析、蒸馏等通常的纯化方法中适当选择。
[工序(2)(硼氢化工序)]
工序(2)是由内酯化合物(C)通过硼氢化反应而得到醇化合物(D)的工序。
本工序通过上述醇化合物的制造方法(I)来进行。
[工序(3)(酯化工序)]
酯化工序是由在工序(2)中得到的醇化合物(D)通过酯化反应而得到化合物(A)的工序。
酯化反应的方法只要是通常进行的公知的酯化反应就可以没有问题地进行,没有特别限定,例如可举出在酸催化剂或缩合剂的存在下使(甲基)丙烯酸与醇化合物(D)反应的方法,在碱存在下使(甲基)丙烯酰卤或(甲基)丙烯酸酐与醇化合物(D)反应的方法,在金属催化剂存在下使(甲基)丙烯酸的低级烷基酯与醇化合物(D)反应而进行酯交换的方法等。
从收率方面考虑,优选在碱存在下使(甲基)丙烯酰卤或(甲基)丙烯酸酐与醇化合物(D)反应的方法,在金属催化剂存在下使(甲基)丙烯酸的低级烷基酯与醇化合物(D)反应而进行酯交换的方法,从着色少的方面以及杂质的生成量少的方面考虑,更优选使(甲基)丙烯酸酐与醇化合物(D)反应的方法。
得到的化合物(A)可以适当纯化而使用。作为纯化的方法,没有特别限定,可举出柱色谱法、晶析等。
在优选的方式中,优选将酯化反应后的反应液溶解于非极性溶剂,用碱水溶液和/或水进行清洗后,进行重结晶。
重结晶后,进一步添加极性低的溶剂,则从收量增加的方面考虑而优选。
例如,作为进行重结晶时的非极性溶剂,优选使用甲苯,其后,作为极性更低的溶剂,己烷或庚烷。
<(甲基)丙烯酸酯>
根据本实施方式,在工序(3)中,通过由在工序(2)中得到的醇化合物(D)制造化合物(A),能够得到杂质的含量低的(甲基)丙烯酸酯(A)。
具体而言,能够得到式(iii)表示的化合物的含量小于9质量%、优选为6质量%以下的(甲基)丙烯酸酯(A)。
在本说明书中,(甲基)丙烯酸酯(A)中的式(iii)的含量是将不 包括式(iii)的(甲基)丙烯酸酯(A)设为100质量%时的含有比例。
[式中,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基,R1表示丙烯酰基或甲基丙烯酰基。]
式(iii)中的A1~A6和X包括优选方式在内与式(A)中的A1~A6和X各自相同。
(甲基)丙烯酸酯中的化合物(iii)的含量可以利用高效液相色谱法(HPLC)而求出。
应予说明,在化合物(iii)中可以存在异构体,在本说明书中,作为(甲基)丙烯酸酯中的杂质的化合物(iii)的含量是这些异构体的含量的合计值。
认为化合物(iii)来自化合物(ii)。因此,通过使用作为杂质的化合物(ii)的含量少的醇化合物来制作(甲基)丙烯酸酯,能够得到作为杂质的化合物(iii)的含量少的(甲基)丙烯酸酯。
式(iii)表示的化合物由于是3官能,所以在制造聚合物时发生交联。如果该交联发生得多,则得不到按照设计的分子量分布。
如后述的实验例所示,在作为单体的一部分使用(甲基)丙烯酸酯(A)而得到的聚合物中,相对于(甲基)丙烯酸酯(A),化合物(iii)的含量为9质量%以上时,聚合物的平均分子量显著增大。即,通过使作为杂质的化合物(iii)的含量相对于(甲基)丙烯酸酯(A)小于9质量%,能够良好地减少聚合物制造中的杂质带来的影响。
另外,根据本实施方式,能够得到如下的(甲基)丙烯酸酯(A’),该(甲基)丙烯酸酯(A’)是式(A’)表示的(甲基)丙烯酸酯(A’),在利用高效液相色谱法(HPLC)得到的色谱图中,保存时分解而产生 甲基丙烯酸的分子量308的杂质(X)的峰面积相对于目标产物(甲基)丙烯酸酯(A’)的峰面积为0.3%以下,优选为0.2%以下。
式(A’)中的R1与式(A)中的R1相同。
上述杂质(X)是在以下的HPLC条件下在16.8分钟附近被检测出的化合物。
柱:Zorbax XDB-C18 3.5μm、2.1mm×150mm(Agilent Technologies株式会社制)。
流动相:水/乙腈梯度90/10→0/100(30分钟)。
检测器:UV(210nm)。
HPLC色谱图中的峰面积与含量相关。
“保存时分解而产生甲基丙烯酸”是指将(甲基)丙烯酸酯(A’)在例如-100℃以上、分解温度以下的温度范围、优选为-20~10℃中保存,利用HPLC测定分子量308的杂质(X)与甲基丙烯酸的含量的经时变化时,杂质(X)的含量经时性地减少,并且甲基丙烯酸的含量经时性地增加。
该杂质(X)推定为下述式(iv)表示的化合物。
就含有该杂质(X)的(甲基)丙烯酸酯(A’)而言,将其用作单体而得到的聚合物容易成为含有甲基丙烯酸作为杂质的聚合物。特别是 化学增幅型的抗蚀剂用聚合物的情况下,如果含有甲基丙烯酸,则容易成为作为抗蚀剂的性能降低的一个原因。
通过降低(甲基)丙烯酸酯(A’)中的杂质(X)的含量,能够得到性能优异的(甲基)丙烯酸酯(A’)。
另外,根据本实施方式,能够得到如下的(甲基)丙烯酸酯,该(甲基)丙烯酸酯是式(A’)表示的(甲基)丙烯酸酯(A’),相对于(甲基)丙烯酸酯(A’),甲基丙烯酸的含量为0.04倍摩尔以下,并且在利用高效液相色谱法得到的色谱图中,保存时分解而产生甲基丙烯酸的分子量308的杂质(X)的峰面积相对于上述(甲基)丙烯酸酯(A’)的峰面积为0.3%以下,优选为0.2%以下。
通过减少(甲基)丙烯酸酯(A’)中的杂质(X)与甲基丙烯酸的含量的合计量,能够得到性能优异的(甲基)丙烯酸酯(A’)。
另外,根据本实施方式,可以得到作为杂质的式(v)表示的化合物的含量小于9质量%、优选为6质量%以下的(甲基)丙烯酸酯(A)。
在本说明书中,(甲基)丙烯酸酯(A)中的化合物(v)的含量是在(甲基)丙烯酸酯(A)的纯度90质量%以上的干燥粉体中的含量。
在式(v)中,A1~A6各自独立地表示氢原子、甲基、或乙基,X表示氧原子、硫原子、亚甲基、或亚乙基,R2表示氢原子、丙烯酰基、或甲基丙烯酰基。
式(v)表示的化合物的含量是式(ii)表示的化合物与式(iii)表示的化合物的合计量。
(甲基)丙烯酸酯中的化合物(ii)或化合物(iii)的含量可以利用高效液相色谱法(HPLC)而求出。
应予说明,化合物(v)中可以存在异构体,在本说明书中,(甲基) 丙烯酸酯中的作为杂质的化合物(v)的含量是这些异构体的含量的合计值。
通过降低(甲基)丙烯酸酯中的式(v)表示的化合物的含量,能够得到性能优异的(甲基)丙烯酸酯。
<聚合物(P)>
对聚合物(P)的实施方式进行说明。
本实施方式的聚合物(P)是使1种以上的单体聚合而得到的聚合物,上述单体包含上述杂质的含量为特定的量以下的(甲基)丙烯酸酯(A)或(A’)中的1种以上。
该杂质的含量为特定的量以下的(甲基)丙烯酸酯(A)或(A’)是指上述化合物(iii)的含量为特定的量以下的(甲基)丙烯酸酯(A)、上述杂质(X)的含量为特定的量以下的(甲基)丙烯酸酯(A’)、上述杂质(X)与甲基丙烯酸的合计的含量为特定的量以下的(甲基)丙烯酸酯(A’)、或化合物(v)的含量为特定的量以下的(甲基)丙烯酸酯(A)。
聚合物(P)可以是均聚物,也可以是共聚物。共聚物可以是无规共聚物,也可以是交替共聚物,也可以是嵌段共聚物。
为共聚物的情况下,是使2种以上的单体聚合而得到的聚合物,优选上述单体包含上述杂质的含量为特定的量以下的(甲基)丙烯酸酯(A)或(A’)中的1种以上。
本实施方式的聚合物(P)例如优选用于抗蚀剂组合物、特别是用于化学增幅型抗蚀剂组合物。以下,对聚合物(P)为用于化学增幅型抗蚀剂组合物的共聚物的情况进行说明。
化学增幅型抗蚀剂组合物用树脂要求利用酸可溶于碱水溶液的性质和耐干蚀刻性。具有来自上述式(A)表示的(甲基)丙烯酸酯的结构单元的聚合物具有利用酸可溶于碱水溶液的性质和高的耐干蚀刻性,进而还具有优异的在有机溶剂中的溶解性。另外,还可以向这样的聚合物中导入具有通过酸的作用而脱离的官能团的结构、环状烃基等具有高的耐干蚀刻性的结构。
作为具有通过酸的作用而容易脱离的官能团的结构,例如,可举出利用乙酰基、叔丁基、四氢吡喃基、甲基金刚烷基、乙基金刚烷基等而保护了羟基、羧基的结构。
为了导入具有通过酸的作用而容易脱离的官能团的结构、或具有高的耐干蚀刻性的结构,将上述式(A)所示的单体和具有这样的结构的单体进行共聚即可。
作为具有这样的结构的单体,例如,可以使用目前为止作为化学增幅型抗蚀剂组合物用树脂的原料单体而已知的单体。用于本实施方式的聚合物(P)的原料单体可以通过用于光刻法的光源而任意地进行选择。
例如,将KrF准分子激光、电子束作为光源时,考虑其较高的耐蚀刻性,优选使用将上述式(A)表示的单体与对羟基苯乙烯或其衍生物共聚而得到的聚合物(P)。此时,来自上述式(A)所示的单体的结构单元相对于聚合物(P)的全部结构单元的比例优选为1~50摩尔%,更优选为1~25摩尔%。
将ArF准分子激光作为光源时,优选将上述式(A)表示的单体与具有环状烃基的单体共聚而得到的聚合物(P)。通过将具有环状烃基的单体共聚,容易得到高的光线透射率、高的耐蚀刻性。
此时,聚合物(P)中的来自上述式(A)所示的单体的结构单元的比例优选为1~50摩尔%,更优选为1~25摩尔%。
其中,优选将上述式(A)所示的单体、具有环状烃基的单体和具有亲水性官能团的单体共聚而得到的丙烯酸系共聚物,将上述式(1)所示的单体、具有环状烃基的单体和马来酸酐共聚而得到的丙烯酸系共聚物,或者将上述式(A)所示的单体、具有环状烃基的单体和具有γ-丁内酯结构等内酯结构的单体共聚而得到的丙烯酸系共聚物。已知将具有环状烃基的单体和具有亲水性官能团的单体共聚而得到的丙烯酸系共聚物、将具有环状烃基的单体和马来酸酐共聚而得到的丙烯酸系共聚物、或者将具有环状烃基的单体和具有内酯结构的单体共聚而得到的丙烯酸系共聚物作为ArF准分子激光光刻法用树脂而优选。通过在这样的聚合物中导入上述式(A)所示的单体单元,能够得到耐干蚀刻性提高、干蚀刻后的抗蚀剂表面龟裂少的优异的抗蚀剂图案。
具有环状烃基的单体单元对含有其的聚合物赋予高耐干蚀刻性。特别是含有因酸而脱离的保护基团(环状烃基可以直接成为保护基团)的单体单元还能够赋予使用了波长193nm的ArF准分子激光的光刻法时的高灵敏度。根据需要,具有环状烃基的单体单元可以为1种,也可以为2种以上。
作为具有环状烃基的单体单元,优选(甲基)丙烯酸环己酯、(甲基)丙烯酸异冰片酯、(甲基)丙烯酸金刚烷酯、(甲基)丙烯酸三环癸烷基酯、(甲基)丙烯酸二环戊二烯基酯、以及在这些单体的环状烃基上具有烷基、羟基、羧基等取代基的衍生物。
具有亲水性官能团的单体单元对含有其的聚合物赋予对基板的密合性。特别是含有因酸而脱离的保护基团的单体单元还能够赋予使用了波长193nm的ArF准分子激光的光刻法时的高灵敏度。作为亲水性官能团,例如,可举出羧基、羟基、氰基、甲氧基、氨基、烷基取代醚基(优选为碳原子数4以下的烷基取代醚基)、δ-戊内酯基、γ-丁内酯基等。应予说明,对于上述的亲水性官能团,虽然也有通常隶属于疏水性的基团,但只要在光刻法工序中能够得到必要的亲水性即可,因此可以包括上述基团。根据需要,具有亲水性官能团的单体单元可以为1种,也可以为2种以上。
作为具有亲水性官能团的单体单元,优选(甲基)丙烯酸、具有末端羟基的(甲基)丙烯酸酯、具有烷基取代醚基的(甲基)丙烯酸酯、具有δ-戊内酯基的(甲基)丙烯酸酯、具有γ-丁内酯基的(甲基)丙烯酸酯、以及在不包括(甲基)丙烯酸的这些单体的亲水性官能团上具有烷基、羟基、羧基、氰基等取代基的衍生物。
具有内酯结构的单体单元对含有其的聚合物赋予高耐干蚀刻性和对基板的密合性。根据需要,具有内酯结构的单体单元可以为1种,也可以为2种以上。
作为具有内酯结构的单体单元,优选4~8元环的α-亚甲基内酯、以及在该内酯环碳上具有烷基、羟基、羧基等取代基的衍生物。
作为化学增幅型抗蚀剂组合物用树脂,优选由来自化合物(A)的结构单元1~60摩尔%、来自具有环状烃基的单体的结构单元1~60摩 尔%、来自具有亲水性官能团的单体的结构单元1~60摩尔%、以及来自具有内酯结构的结构单元1~60摩尔%构成的丙烯酸系共聚物。
用作化学增幅型抗蚀剂组合物用树脂的聚合物(P)的情况下,聚合物(P)的质均分子量没有特别限定,优选为1000~100000,更优选为3000~30000。质均分子量越大,越具有耐干蚀刻性提高而抗蚀剂形状变好的趋势,另外,质均分子量越小,越具有在抗蚀剂溶液中的溶解性提高而分辨率提高的趋势。
<聚合物(P)的制造方法>
本实施方式的聚合物(P)可以利用公知的聚合方法而制造,但从能够简便地制造的方面考虑,预先利用将预先在有机溶剂中溶解单体和聚合引发剂而得到的单体溶液滴加于保持在恒定温度的有机溶剂中的、所谓的滴加聚合方法而制造。
作为用于滴加聚合方法的有机溶剂,没有特别限定,优选对于单体和得到的共聚物均能溶解的溶剂,例如,可举出1,4-二烷、异丙醇、丙酮、四氢呋喃、乳酸乙酯等。应予说明,有机溶剂的使用量没有特别限定,可以适当确定。
作为用于滴加聚合方法的聚合引发剂,没有特别限定,例如,可举出偶氮二异丁腈、2,2’-偶氮双(2,4-二甲基戊腈)等偶氮化合物,过氧化苯甲酰等有机过氧化物等。另外,也可以将正丁基硫醇、正辛基硫醇等硫醇类用作链转移剂。应予说明,聚合引发剂和链转移剂的使用量没有特别限定,可以适当确定。
滴加聚合方法中的聚合温度没有特别限定,通常,优选为50~150℃的范围。滴加时间没有特别限定,通常,优选为6小时以上。另外,进而优选滴加结束后将其温度保持1~3小时左右,使聚合完成。
通过滴加聚合方法而制造的聚合物溶液根据需要用四氢呋喃、1,4-二烷等良溶剂稀释到适当的溶液粘度后,滴加于庚烷、甲醇、水等大量的不良溶剂中而使聚合物析出。然后,滤出该析出物,充分干燥而得到本实施方式的聚合物(P)。
将聚合溶液滴加于大量的不良溶剂中而使聚合物析出的工序被称 为再沉淀,为了除去聚合溶液中残留的未反应的单体、聚合引发剂等,非常有效。如果这些未反应物等原样残留,则有可能对抗蚀剂性能造成不良影响,因此优选尽可能除去。该再沉淀工序也有时根据情况并不需要。
<抗蚀剂组合物>
对抗蚀剂组合物的实施方式进行说明。
本实施方式的抗蚀剂组合物是含有上述聚合物(P)(上述实施方式的化学增幅型抗蚀剂组合物用树脂)和通过活性光线或放射线的照射而产生酸的化合物的化学增幅型抗蚀剂组合物。聚合物(P)可以为1种,也可以并用2种以上。
对于抗蚀剂组合物(不包括溶剂),聚合物(P)的含量没有特别限定,优选为70~99.8质量%。
用于本实施方式的抗蚀剂组合物的光产酸剂可以从能够作为抗蚀剂组合物的产酸剂而使用的产酸剂中任意选择。光产酸剂可以使用1种,也可以并用2种以上。
作为光产酸剂,例如可举出盐化合物、磺酰亚胺化合物、砜化合物、磺酸酯化合物、醌二叠氮化合物、重氮甲烷化合物等。其中,优选锍盐、碘盐、膦盐、重氮盐、吡啶盐等盐化合物。
光产酸剂的使用量可以根据所使用的光产酸剂的种类等而适当决定,通常,相对于聚合物(P)100质量份,优选为0.1~20质量份,更优选为0.5~10质量份。如果光产酸剂的使用量在上述范围的下限值以上,则容易使因曝光而产生的酸的催化剂作用带来的化学反应充分发生。另外,如果为上述范围的上限值以下,则抗蚀剂组合物的稳定性提高,容易使涂布组合物时的涂布不均、显影时的浮渣等的发生充分减少。
用于本实施方式的抗蚀剂组合物的溶剂可以根据目的而任意选择,溶剂的选择有时受到树脂的溶解性以外的理由,例如,涂膜的均一性、外观或安全性等的制约。
本实施方式中,作为通常使用的溶剂,例如,可举出2-戊酮、2-己酮等直链状酮类,环戊酮、环己酮等环状酮类,丙二醇单甲醚乙酸酯、 丙二醇单乙基醚乙酸酯等丙二醇单烷基乙酸酯类,乙二醇单甲基醚乙酸酯、乙二醇单乙基醚乙酸酯等乙二醇单烷基醚乙酸酯类,丙二醇单甲基醚、丙二醇单乙基醚等丙二醇单烷基醚类,乙二醇单甲基醚、乙二醇单乙基醚等乙二醇单烷基醚类,二乙二醇二甲基醚、二乙二醇二乙基醚等二乙二醇烷基醚类,乙酸乙酯、乳酸乙酯等酯类,环己醇、1-辛醇等醇类,碳酸亚乙酯、γ-丁内酯等。这些溶剂可以使用1种,也可以并用2种以上。
溶剂的使用量根据形成的抗蚀膜的厚度而不同,通常,相对于聚合物(P)(抗蚀剂用聚合物)100质量份,优选100~10000质量份的范围。
进而,本实施方式的抗蚀剂组合物中可以根据需要配合表面活性剂、淬灭剂、增敏剂、防光晕剂、保存稳定剂、消泡剂等公知的各种添加剂。这些添加剂的配合量没有特别限定,适当确定即可。
<形成有图案的基板的制造方法>
对形成有图案的基板的制造方法的实施方式进行说明。
本实施方式的形成有图案的基板的制造方法包括以下工序:将上述实施方式的抗蚀剂组合物在基板的被加工面上进行涂布而形成抗蚀膜的工序、对该抗蚀膜进行曝光的工序、和将经曝光的抗蚀膜使用显影液显影的工序。
具体而言,首先,在形成图案的硅晶片等被加工基板的表面(被加工面)上利用旋涂法等涂布抗蚀剂组合物。然后,将涂布有该抗蚀剂组合物的被加工基板用烘烤处理(预烘烤)等进行干燥,在基板上形成抗蚀膜。
接着,对得到的抗蚀膜介由光掩模照射250nm以下的波长的光(曝光)。用于曝光的光优选220nm以下的波长的光,特别优选ArF准分子激光。
光照射(曝光)后,适当烘烤处理(PEB),将基板浸渍于碱显影液中,将抗蚀膜的曝光部分在显影液中溶解除去(显影)。碱显影液可以使用公知的碱显影液。然后,显影后,将基板用纯水等适当冲洗处理。 这样在被加工基板上形成抗蚀剂图案。
这样,形成有抗蚀剂图案的被加工基板通常进行适当烘烤处理(后烘烤)来强化抗蚀剂,选择性地蚀刻没有抗蚀剂的部分。进行蚀刻后,抗蚀剂通常用剥离剂除去。
<新型化合物>
式(iii)表示的化合物是新型化合物。
在式(iii)中,A1~A6各自独立地为氢原子、甲基或乙基,优选氢原子或甲基。1分子中的甲基和乙基的总数可以为0~6个中的任意一个,用作抗蚀剂用树脂的单体时,优选为0~2个,特别优选0~1个。
X是氧原子、硫原子、亚甲基、或亚乙基,优选氧原子或亚甲基。R1表示丙烯酰基或甲基丙烯酰基。
作为式(iii)表示的化合物,特别优选下述式(iii’)表示的化合物。式中,R1表示丙烯酰基或甲基丙烯酰基。
式(iii)表示的化合物可以通过由酸酐化合物(B)利用还原反应而生成式(ii)表示的化合物(三醇化合物),用将其酯化的方法制造。
作为还原剂,可以使用与上述内酯化合物的制造方法(II)或上述工序1(还原工序)相同的还原剂。在反应活性的方面考虑,优选硼氢化钠。
相对于酸酐化合物(B)1摩尔,还原剂的使用量优选为1~30摩尔、更优选为3~10摩尔。如果还原剂的使用量在上述范围的下限值以上,则目标物的收量降低,如果在上限值以下,则反应后的处理变得繁杂。
用于还原反应的溶剂可以使用与上述内酯化合物的制造方法(II)或上述工序1(还原工序)相同的溶剂。从原料的溶解性方面考虑,特 别优选四氢呋喃与甲醇的混合溶剂、或二甲氧基乙烷与醇类的混合溶剂。
在还原反应中,反应温度优选为-50~100℃,更优选为-30~30℃。
充分进行还原反应后,添加酸进行中和。从得到的反应溶液中取出化合物(ii)的方法可以是萃取、晶析、蒸馏、柱纯化等中的任一种方法。
接着,将化合物(ii)进行酯化而得到化合物(iii)。酯化反应的方法可以与上述工序(3)(酯化工序)同样用通常进行的公知的酯化反应方法来进行。例如,可以采用在碱存在下使(甲基)丙烯酰卤或(甲基)丙烯酸酐与化合物(iii)反应的方法。
<聚合物(Q)>
对将化合物(iii)用作单体的聚合物(Q)的实施方式进行说明。
本实施方式的聚合物(Q)是使1种以上的单体聚合而得到的聚合物,上述单体中的至少1种是化合物(iii)。
聚合物(Q)可以是均聚物,也可以是共聚物。共聚物可以是无规共聚物,也可以是交替共聚物,还可以是嵌段共聚物。
为共聚物的情况下,是使2种以上的单体聚合而得到的聚合物,优选上述单体包含化合物(iii)和其以外的(甲基)丙烯酸酯。
与化合物(iii)共聚的(甲基)丙烯酸酯没有特别限定,可以根据用途等适当选择。
相对于聚合物(Q)的全部结构单元,来自化合物(iii)的单体单元优选为1~100摩尔%,更优选为3~100摩尔%,进一步优选5~100摩尔%。
<聚合物(Q)的制造方法>
本实施方式的聚合物(Q)可以利用公知的聚合方法而制造。可以采用与上述聚合物(P)相同的聚合方法。
具有来自化合物(iii)的结构单元的聚合物(Q)具有优异的固化性、耐水性、挠性、耐碱性,进而通过利用该特异的立体结构,醚键来到聚合物链的外侧,从而能够提高对基底的密合性。另外,通过利用该结构来控制聚合物的异构体比,能够控制聚合物的立构规整性。
实施例
以下,利用实施例详细说明本发明,但本发明不限于此。就用于本实施例的反应试剂和单体而言,对于没有特别记载的反应试剂和单体,不将市售品进行纯化而直接使用。
pH是利用pH计(METTLER TOLEDO公司制SevenEasy KS)而测定的。
{酸酐化合物(B)的制造例}
〔合成例B1〕
在具备滴液漏斗、温度计、氯化钙管、搅拌子的烧瓶中,添加马来酸酐(98.06g、1mmol)、甲苯(400mL),开始搅拌。进而,在20℃滴加呋喃(68.07g、1mmol)后,在20℃搅拌16小时。反应结束后,通过将析出的结晶进行抽滤,得到了酸酐化合物(B-1)(128.58g,收率77.4%)。
{内酯化合物(C)的制造例}
利用以下的测定方法。
(HPLC测定)
作为目标产物的4-氧杂三环[5.2.1.02,6]癸烯-3-酮、作为原料的5-降冰片烯-2,3-羧酸酐、以及作为副产物的(3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的浓度的测定是在下述条件下用HPLC进行的。
柱:Inertsil ODS-3V(4.6φ×250mm)GL Sciences公司制,
流动相:将0.1质量%的磷酸水溶液与乙腈以质量比50:50混合的溶液,
流速:1.0mL/min,
检测器:差示折射率检测器(RI检测器),
柱温:40℃。
作为原料的4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3,5-二酮、作为目标产物的4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3-酮、以及作为副产物的(3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的浓度的测定是在下述条件下用HPLC进行的。
柱:YMC Pack Pro C18(4.6φ×150mm),
流动相:将0.1质量%的磷酸水溶液与MeOH以质量比95:5混合的溶液,
流速:0.5mL/min,
检测器:差示折射率检测器(RI检测器),
柱温:40℃。
5-降冰片烯-2,3-羧酸酐的浓度是利用下述式求出的。
(5-降冰片烯-2,3-羧酸酐的面积)/(5-降冰片烯-2,3-羧酸酐的面积+4-氧杂三环[5.2.1.02,6]癸烯-3-酮的面积+(3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的面积)×100
4-氧杂三环[5.2.1.02,6]癸烯-3-酮的浓度是利用下述式求出的。
(4-氧杂三环[5.2.1.02,6]癸烯-3-酮的面积)/(5-降冰片烯-2,3-羧酸酐的面积+4-氧杂三环[5.2.1.02,6]癸烯-3-酮的面积+(3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的面积)×100
(3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的浓度是利用下述 式求出的。
((3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的面积)/(5-降冰片烯-2,3-羧酸酐的面积+4-氧杂三环[5.2.1.02,6]癸烯-3-酮的面积+(3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的面积)×100
4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3,5-二酮的浓度是利用下述式求出的。
(4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3,5-二酮的面积)/(4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3,5-二酮的面积+4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3-酮的面积+(3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的面积)×100
4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3-酮的浓度是利用下述式求出的。
(4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3-酮的面积)/(4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3,5-二酮的面积+4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3-酮的面积+(3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的面积)×100
((3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的浓度是利用下述式求出的。
((3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的面积)/(4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3,5-二酮的面积+4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3-酮的面积+(3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的面积)×100
(1H-NMR测定)
1H-NMR是如下进行的,即,利用超导FT-NMR(日本电子公司制,JNM-GX270型),将约5质量%的(3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的溶液(氘代氯仿溶液)或(3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的溶液(氘代氯仿溶液)加入直径5mmφ的样品管,以观测频率:270MHz、单脉冲模式进行1H 32次的积算。用作溶剂的氘代氯仿在临制备试样之前开封安瓿瓶而使用。测定温度是在20℃ 进行的。
〔实施例C1〕
在带有容量50mL的带有侧管的滴液漏斗、温度计和逆流冷却器的容量50mL的三颈圆底烧瓶(反应器)中放入磁力搅拌子,一边通入氮气,一边加热干燥。向其中依次放入2.07g的四氢呋喃(以下记为THF)和0.62g(0.016mol)的硼氢化钠。在滴液漏斗中放入3.00g(0.018mol)的5-降冰片烯-2,3-二羧酸酐(式(4)中的R11~R16全部为氢原子、X为亚甲基的化合物)、9.68g的THF、0.59g(0.061mol)的甲醇,并使其溶解。将反应器在冰浴中冷却至5℃,搅拌的同时从滴液漏斗用15分钟滴加原料溶液。在此期间,反应液的温度保持在10~15℃。
滴加结束后,一边将反应液的温度保持在13~17℃,一边继续搅拌,在从滴加结束起30分钟后、90分钟后、150分钟后,将0.2mL的反应液分别取出至10mL量瓶中。称量分别取出的反应液的质量,接着加入0.2mL的30质量%硫酸水溶液,充分搅拌。然后,加入HPLC的流动相,使总量达到10mL,充分搅拌后,用HPLC进行分析。将结果示于表1。
〔实施例C2〕
在实施例C1中,将放入三颈圆底烧瓶(反应器)的THF变更为1.83g,将硼氢化钠变更为0.55g(0.015mol),除此以外,进行与实施例C1相同的反应操作和后处理操作。将结果示于表1。
〔实施例C3〕
在实施例C1中,将放入三颈圆底烧瓶(反应器)的THF变更为2.19g,将硼氢化钠变更为0.65g(0.017mol),除此以外,进行与实施例C1相同的反应操作和后处理操作。将结果示于表1。
〔比较例C1〕
在实施例C1中,将放入三颈圆底烧瓶(反应器)的THF变更为1.60g,将硼氢化钠变更为0.48g(0.013mol),除此以外,进行与实施例C1相同的反应操作和后处理操作。将结果示于表1。
〔比较例C2〕
在实施例C1中,将放入三颈圆底烧瓶(反应器)的THF变更为2.30g,将硼氢化钠变更为0.69g(0.018mol),除此以外,进行与实施例C1相同的反应操作和后处理操作。将结果示于表1。
〔实施例C4〕
在实施例C1中,将放入三颈圆底烧瓶(反应器)的THF变更为6.97g的DME,将硼氢化钠变更为0.70g(0.018mol),将装入滴液漏斗的5-降冰片烯-2,3-二羧酸酐变更为3.40g(0.020mol)的4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3,5-二酮(式(4)中的R11~R16全部为氢原子,X为氧原子的化合物。使用了合成例B1中制造的酸酐化合物B-1),将9.68g的THF变更为39.10g的DME,将0.59g(0.061mol)的甲醇变更为0.66g(0.020mol),除此以外,进行与实施例C1相同的反应操作和后处理操作。将结果示于表2。
〔实施例C5〕
在实施例C4中,将装入三颈圆底烧瓶(反应器)的DME变更为6.19g,将硼氢化钠变更为0.62g(0.016mol),除此以外,进行与实施例C4相同的反应操作和后处理操作。将结果示于表2。
〔比较例C3〕
在实施例C4中,将装入三颈圆底烧瓶(反应器)的DME变更为4.65g,将硼氢化钠变更为0.46g(0.012mol),除此以外,进行与实施例C4相同的反应操作和后处理操作。将结果示于表2。
〔比较例C4〕
在实施例C4中,将装入三颈圆底烧瓶(反应器)的DME变更为7.74g,将硼氢化钠变更为0.77g(0.020mol),除此以外,进行与实施例C4相同的反应操作和后处理操作。将结果示于表2。
〔参考例C1〕
((3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的鉴定)
一边将比较例C1中得到的反应液保持在10~20℃,一边用60分钟滴加30质量%硫酸水溶液6.0g(0.018mol)。滴加结束后,一边将反应液保持在20℃,一边保持1小时,加入12g的甲苯,进行3次萃取。对于甲苯相,用4g的饱和碳酸氢钠水溶液进行一次水洗,进而用4g的水再进行一次水洗。将得到的甲苯相减压浓缩,用柱色谱法进行纯化,得到了0.04g的(3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇。
(3-羟基甲基-双环[2.2.1]-庚-5-烯-2-基)-甲醇的1H-NMR测定结果如下所示。
1.3-1.4ppm 2H(C7-H2),2.5-2.6ppm
2H(C2-H,C3-H),2.8ppm 2H(C1-H,C4-H),3.3-3.7ppm 6H(OH,-O-C-H2),6.0ppm 2H(C5-H,C6-H)
〔参考例C2〕
((3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的鉴定)
使用比较例C2中得到的反应液,除此以外,进行与参考例C1相同的操作,得到了0.05g的(3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇。
(3-羟基甲基-7-氧杂双环[2.2.1]-庚-5-烯-2-基)-甲醇的1H-NMR测定结果如下所示。
1.9-2.0ppm 2H(C2-H,C3-H),3.5-3.6ppm 2H(OH),3.7-3.9ppm 4H(-O-C-H2),4.6-4.7ppm 2H(C1-H,C4-H),6.4ppm 2H(C5-H,C6-H)
[表1]
[表2]
如表1、2所示,确认了还原反应时,相对于上述式(1)表示的化合物,硼氢化钠的使用量为0.7~0.95倍摩尔时(实施例C1~C5),尤其能够将反应结束30分钟后的二醇体的副生成抑制到小于1质量%,并且能够得到充分高的反应收率。另一方面,确认了相对于上述式(1)表示的化合物,硼氢化钠的使用量为1.0倍摩尔时(比较例C2、C4),无法抑制反应结束30分钟后的二醇体的副生成小于1质量%。另外,确认了相对于上述式(1)表示的化合物,硼氢化钠的使用量为0.6倍摩尔时(比较例C1、C3),虽然能够将反应结束30分钟后的二醇体的副生成抑制到小于1质量%,但反应收率低。
{醇化合物(D)的制造例}
在以下的例中,内酯化合物(C-1)是与上述实施例C4同样进行而制造的下述式(C-1)表示的化合物(4,10-二氧杂三环[5.2.1.02,6]癸-8-烯-3-酮)。
〔实施例D1〕
在具备温度计、氯化钙管、搅拌子、氮导入管的烧瓶中加入1.5g(0.01mol)的内酯化合物(C-1)、18g的二甲氧基乙烷,在室温下搅拌30分钟而制成内酯溶液后,冷却,使温度降低至20℃。在该内酯溶液中以该内酯溶液的温度维持20~23℃的速度滴加添加0.56g的BH3·二甲基硫醚配位化合物。添加结束后,将得到的混合物在20℃搅拌1.5小时。以上操作在氮气流下进行。
在这样得到的混合物中添加5质量%的NaOH水溶液7.9g,接着,缓慢添加1.2ml的过氧化氢(30质量%水溶液)。一边将混合物保持在30℃,一边搅拌2小时。然后,一边冷却,一边在反应混合物中添加50质量%硫酸,使pH为1(30℃下的pH),在30℃搅拌1小时。进而,一边冷却,一边滴加28质量%氨水进行中和,使pH为6.5(20℃的pH)后,进行过滤,将滤渣用二甲氧基乙烷进行清洗。
将滤液用下述条件的液体色谱(HPLC)进行分析,结果溶剂以外的成分的面积百分率是,下述式(C-1)表示的化合物为0%、下述式(D-1)表示的化合物为75%、下述式(ii-1)表示的化合物为1%、下述式(i-1)表示的化合物为0%。此外,未检测到硼酸盐、硫酸盐的峰。
(HPLC条件)
柱:Inertsil ODS-3V(4.6φ×250mm)GL Sciences公司制,
流动相:0.1质量%磷酸水溶液/乙腈梯度100/0(5分钟)、100/0→10/90(25分钟),
流速:1.0mL/min,
检测器:紫外检测器(UV检测器),
柱温:40℃。
将滤液用蒸发仪浓缩,添加30g的乙醇,再次浓缩。将该操作重复进行2次后,将浓缩液溶解于30g的乙醇,进行过滤。将滤液浓缩至总量达到4.1g,在70℃使其溶解。以每小时20℃的比例降温至温度20℃,滴加6.3g的异丙醚后,在3℃保持15分钟后,进行过滤,将滤渣用异丙醚清洗。
以上操作是一边搅拌一边进行的。
干燥后的滤渣(醇化合物的干燥品)的重量为1.3g,以面积百分率计,含有99%的式(D-1)表示的化合物,未检测到式(C-1)表示的化合物和式(ii-1)表示的化合物。
〔实施例D2〕
在具备温度计、氯化钙管、搅拌子、氮导入管的烧瓶中加入1.8g(0.012mol)的内酯化合物(C-1)、15ml的四氢呋喃,在室温下搅拌30分钟而制成内酯溶液后冷却,使温度降低至0℃。在该内酯溶液中以该内酯溶液的温度维持0℃的速度滴加添加1M的BH3·四氢呋喃配位化合物4mL。添加结束后,将得到的混合物在0℃搅拌3分钟,在室温搅拌4小时。以上操作在氮气流下进行。
在这样得到的混合物中添加3N的NaOH水溶液4mL,接着,缓慢添加4mL的过氧化氢(30质量%水溶液)。添加后,将反应混合物在50℃搅拌1.5小时。在该反应液中滴加50质量%硫酸,使pH为1(30℃的pH),在30℃搅拌1小时。
将反应液与实施例D1同样用HPLC进行分析,结果,溶剂以外的成分的面积百分率是,式(C-1)表示的化合物为4%、式(D-1)表示的化合物为95%、式(ii-1)表示的化合物为1%、式(i-1)表示的化合物为0%。硼酸盐、硫酸盐的峰与溶剂带来的负峰重叠而检测不到。
一边冷却反应液,一边滴加28质量%氨水,进行中和而使pH为6.5(30℃下的pH)后,进行过滤,将滤渣用二甲氧基乙烷清洗。
将滤液用蒸发仪浓缩,添加30g的乙醇,再次浓缩。将该操作重复进行2次后,使浓缩液溶解于30g的乙醇,进行过滤。将滤液浓缩至总量达到4.1g,在70℃使其溶解。以每小时20℃的比例降温至温度20℃,滴加6.3g的异丙醚后,在3℃保持15分钟后,进行过滤,将滤渣用异丙醚清洗。
以上操作是一边搅拌一边进行的。
干燥后的滤渣的重量为1.3g,以面积百分率计,含有96%的式(D-1)表示的化合物、4%的式(C-1)表示的化合物,未检测到式(ii-1)表示的化合物。
〔比较例D1〕
将直至使式(C-1)表示的化合物与BH3·四氢呋喃配位化合物反应、添加NaOH水溶液和过氧化氢,在50℃搅拌1.5小时的工序与实施例D2同样进行,将得到的反应液用液体色谱进行分析。未进行在该反 应液中加入酸的处理。
其结果,面积百分率是,式(C-1)表示的化合物为3%、式(D-1)表示的化合物为34%、式(ii-1)表示的化合物为1%、式(i-1)表示的化合物为38%。硼酸盐、硫酸盐的峰与溶剂带来的负峰重叠而检测不到。
即,作为目标产物的式(D-1)表示的化合物和作为副产物的式(i-1)表示的化合物包含等量左右。
将该反应混合物用碳酸钾进行饱和,结果发现有2层,分开该2层,用THF萃取水性层。将得到的THF溶液用饱和NaCl清洗,在减压下除去溶剂,生成了白色半固体产物。
用色谱法纯化该白色固体,但无法回收目标产物(化合物(D-1))(使用二氯甲烷95质量%、甲醇5质量%的溶液)。
{(甲基)丙烯酸酯(A)的制造例}
[实施例A1]
<1-1.还原工序>
在具备滴液漏斗、温度计、氯化钙管、搅拌子的烧瓶中添加硼氢化钠(3.43g、90.7mmol)、DMAc(3.43mL),冷却至5℃。另外,将合成例B1中合成的酸酐化合物(B-1)(25.11g、151.1mmol)溶解于DMAc(100mL),从滴液漏斗用1小时进行滴加。此时,被滴加液的内温为15℃以下。在20℃反应4小时后冷却至5℃,一边保持内温为15℃以下,一边缓慢滴加将用99.6mL的水稀释硫酸(36.2g、368.2mmol)而得到的水溶液。在20℃反应2小时,结果,反应液的pH(20℃)为1。将反应液用MIBK(100mL)萃取3次,合并有机层,用20质量%食盐水(100mL)清洗。将得到的有机层用蒸发仪馏去溶剂后,在得到的固体中添加100mL甲苯,加热至40℃,使其溶解。将该溶液以10℃/小时的速度冷却至5℃,从而进行晶析。将析出的结晶过滤,在30℃进行减压干燥的结果,得到了内酯化合物(C-1)(7.1g,收率30.9%)。
<1-2.硼氢化工序>
在具备滴液漏斗、冷却管、温度计、氮气吹入口、搅拌子的烧瓶中添加内酯化合物(C-1)(6.09g、40.0mmol)、硼氢化钠(1.51g、40.0mmol)后,进行氮置换,氮在以后反应中持续流动。一边冷却容器,一边添加DME(80mL)。另外将95质量%硫酸(2.06g、20mmol)称量于滴液漏斗,以内温维持在15℃以下的方式,用30分钟缓慢滴加,滴加结束后,升温至20℃后,继续搅拌4小时。此时,硼氢化钠与硫酸、DME反应,成为B2H6·DME配位化合物而发挥作用。
反应结束后,将反应液冷却至5℃后,添加水(1mL),接着添加3M-NaOH水溶液(5.44mL)。一边以内温为20℃以下的方式进行调节一边在该溶液中缓慢滴加30质量%过氧化氢水(5.44mL),滴加结束后,在50℃加热、搅拌1小时。将反应液冷却至20℃后,添加30质量%硫酸水溶液,使反应液的pH(20℃)为1后,用3M-氢氧化钠水溶液进行中和,使pH为7。将反应液用蒸发仪浓缩后,添加乙腈50mL。由于析出硫酸钠的结晶,所以将其减压过滤而除去后,浓缩滤液。进而将加入乙腈50mL并浓缩的操作重复进行2次,结果,得到了醇化合物(D-1)的粗产物(3.5g,粗收率51.4%)。得到的粗产物的水分为1800ppm。得到的粗产物不进行纯化而用于下一工序。
<1-3.酯化工序>
在具备滴液漏斗、温度计、氯化钙管、搅拌子的烧瓶中添加醇化合物(D-1)的粗产物(0.50g、2.94mmol)、乙腈(3.8mL)、三乙胺(0.33g、3.23mmol),将内温调节至20℃。
缓慢滴加另外计量的甲基丙烯酰氯(0.34g、3.25mmol),在20℃反应4小时。在反应结束后的反应液中添加5.0mL的水后,用乙酸乙酯(5.0mL)萃取3次,合并有机层,用20质量%食盐水清洗。将有机层用蒸发仪浓缩,得到了用硅胶柱色谱法纯化的化合物(A-1)(1.01g、收率72.0%、纯度99质量%)。
[比较例A1]
与实施例A1同样进行还原工序,得到了内酯化合物(C-1)。
在具备滴液漏斗、温度计、球形冷凝管(Dimroth condenser)、搅拌子的烧瓶中添加内酯化合物(C-1)(1.33g、8.74mmol)、甲酸(2.98g、64.9mmol),进行搅拌。一边注意发热一边向其中每次少量地添加另外量取至滴液漏斗中的三氟甲烷磺酸(0.252g、1.68mmol)。加热以使得溶液的内温达到100℃后,在100℃搅拌6小时。其结果,即,采用了在酸催化剂下加成低级羧酸,通过水解得到醇体的制法时,内酯化合物(C-1)完全消失,但完全没有得到作为目标的甲酸加成体。
[比较例A2]
与实施例A1同样进行还原工序,得到了内酯化合物(C-1)。
在具备滴液漏斗、温度计、球形冷凝管、搅拌子的烧瓶中添加内酯化合物(C-1)(1.33g、8.74mmol)、甲基丙烯酸(3.01g、35.0mmol),进行搅拌。一边注意发热一边向其中每次少量地添加另外量取至滴液漏斗中的95质量%硫酸(0.18g、1.75mmol)。加热以使得溶液的内温达到85℃后,在85℃搅拌4小时。其结果,即,采用了不经由醇体而直接进行甲基丙烯酰基化的制法时,内酯化合物(C-1)完全消失,但完全没有得到作为目标的甲基丙烯酸加成体。
[实施例A2]
在具备冷却管、温度计、空气鼓泡口、搅拌子的烧瓶中,将用与实施例D1相同的方法合成的2.2g(0.12mol)的醇化合物(D-1)溶解于9.4g的1,2-二甲氧基乙烷后,加入5mg的二丁基羟基甲苯、3.0g(0.19mol)的甲基丙烯酸酐,并添加0.26g、0.06mol的氧化镁。将反应液一边进行空气鼓泡一边升温至70℃,加热、搅拌8小时。
将该反应液溶解于16g甲苯中,加入0.8mg的4-羟基-2,2,6,6-四甲基哌啶-1-氧自由基,使其溶解后,过滤,减压浓缩至重量为21g。将浓缩液用8g的水清洗后,在此时的水相中再次加入16g的甲苯,回收目标产物。合并两个甲苯相,用8g的饱和碳酸氢钠水溶液清洗2次后,用8g的水清洗3次。加入1mg的4-羟基-2,2,6,6-四甲基哌啶-1氧自由基和2mg的二丁基羟基甲苯后,减压浓缩。
得到了2.2g(收率73%)的目标化合物(A-1)。得到的化合物(A-1)中的分子量308的杂质(X)的峰面积相对于化合物(A-1)的峰面积为0.1%。未检测到甲基丙烯酸。
未检测到甲基丙烯酸。
化合物(A-1)中的分子量308的杂质(X)在以下的条件下进行分析(下同)。该杂质(X)是在16.8分钟附近被检测的化合物。
柱:Zorbax XDB-C18 3.5μm、2.1mm×150mm(Agilent Technologies株式会社制)。
流动相:水/乙腈 梯度 90/10→0/100(30分钟)。
检测器:UV(210nm)。
[实施例A3]
代替用与实施例D1相同的方法合成的醇化合物(D-1)而使用用与实施例D2相同的方法合成的醇化合物(D-1),除此以外,用与实施例A2相同的方法进行反应和纯化。得到了目标化合物(A-1)1.9g(收率63%)。
得到的化合物(A-1)中的分子量308的杂质(X)的峰面积相对于化合物(A-1)的峰面积为0.2%。未检测到甲基丙烯酸。
[实施例A4]
在具备滴液漏斗、温度计、氯化钙管、搅拌子的烧瓶中加入用与实施例D1相同的方法合成的2.2g(0.12mol)的醇化合物(A-1),溶解于9.4g的1,2-二甲氧基乙烷后,添加5mg的二丁基羟基甲苯、2.0g(0.02mol)的三乙胺,将内温调节到5℃。缓慢滴加另外计量的2.1g(0.02mol)的甲基丙烯酰氯,在5℃反应1小时。在反应结束后的反应液中添加19g的水,使过量的甲基丙烯酰氯分解。
用与实施例A2相同的方法进行纯化的结果,得到了1.5g(收率50%)的目标化合物。
得到的化合物(A-1)中的分子量308的杂质(X)的峰面积相对于化合物(A-1)的峰面积为0.3%。未检测到甲基丙烯酸。
{聚合物(P)的制造例}
〔制造例P1、P2、制造例P3〕
使下述式(a)、(d)、(e)、(f)分别表示的单体(a)、(d)、(e)、(f)进行共聚而制造了聚合物(P)。
在制造例P1中,作为单体(a),使用了实施例A2中得到的甲基丙烯酸酯(A-1)。
在制造例P2中,作为单体(a),使用了实施例A3中得到的甲基丙烯酸酯(A-1)。
在制造例P3中,作为单体(a),使用了实施例A4中得到的甲基丙烯酸酯(A-1)。
将各例中使用的单体(a)(甲基丙烯酸酯(A-1))中的分子量308的杂质(X)的含量示于表3。单体(d)、(e)、(f)使用了同一批量的单体。
在具备氮导入口、搅拌器、冷凝器、滴液漏斗和温度计的烧瓶中,在氮气氛下,加入41.2质量份的乳酸乙酯和23.2质量份的γ-丁内酯。将烧瓶放入水浴中,一边搅拌烧瓶内,一边升高水浴的温度,使烧瓶内的液体温度升至80℃。
然后,将下述混合物利用滴液漏斗用4小时滴加到烧瓶内,进而将80℃的温度保持3小时,得到了反应溶液。
(混合物)
下述单体(a)8.09质量份,
下述单体(d)6.97质量份,
下述单体(e)5.78质量份,
下述单体(f)17.82质量份,
乳酸乙酯43.8质量份,
γ-丁内酯46.4份,
二甲基-2,2’-偶氮二异丁酸酯(和光纯药工业公司制,V601(商品名))1.173质量份。
将得到的反应溶液一边搅拌一边滴加到约6倍量的甲醇和水的混合溶剂(甲醇/水=80/20容量比)中,得到了白色的析出物(聚合物(P)) 的沉淀。滤出沉淀,再次,将上述反应溶液投入约6倍量的甲醇和水的混合溶剂(甲醇/水=90/10容量比)中,一边搅拌,一边进行沉淀的清洗。然后,滤出清洗后的沉淀,得到了聚合物湿粉。对在减压下在60℃干燥约36小时而得到的聚合物(P),利用核磁共振分析法(1H-NMR),测定了分别来自单体(a)、(d)、(e)、(f)的结构单元(a)、(d)、(e)、(f)和作为杂质的甲基丙烯酸(MAA)的组成比(单位:摩尔%)。将其结果示于表3。
[表3]
由表3的结果可知,单体(a)中的分子量308的杂质(X)越多,聚合物(P)中包含的由单体的分解而产生的甲基丙烯酸的量越多。特别是制造例P1、P2的该甲基丙烯酸的量少。
{化合物(iii)的制造例}
〔实施例F1〕
在本例子中由式(ii-1)表示的化合物制造了式(iii-1)表示的化合物。
(式(ii-1)表示的化合物的合成)
在具备温度计、氯化钙管、搅拌子的烧瓶中加入11.3g(0.3mol)的硼氢化钠、20g的二甲氧基乙烷,一边搅拌一边冷却至5℃,制成溶解有一部分硼氢化钠的料浆A。在烧杯中放入10g(0.06mol)的式(B-1)表示的化合物和3g的甲醇、100g的二甲氧基乙烷,制成一部分溶解的料浆B。一边将料浆A冷却及搅拌,一边以液体温度不超过10℃的方式一点点地滴加料浆B。将该反应液在室温下搅拌一夜后,一边冷却,一边加入20质量%的硫酸水溶液进行中和(20℃下的pH=6.5)。
用蒸发仪基本除去溶剂和水后,在得到的粉末中添加200g的乙醇,使其悬浮后,进行过滤,浓缩滤液,得到了油状的物质。向其中加入500ml的丙酮,使其一部分溶解,静置而使丙酮相与油相分离。过滤丙酮相并浓缩滤液,将上述操作重复进行6次。
其结果,得到了4.4g的式(ii-1)表示的化合物。在该化合物中含有少量硼酸盐。
(式(iii-1)表示的化合物的合成)
在具备温度计、搅拌子、空气导入管的烧瓶中加入1.7g的式(ii-1)表示的化合物、4.1mg的BHT、9.3g(0.06摩尔)的甲基丙烯酸酐、0.48g(0.12摩尔)的氧化镁,进行搅拌,升温至70℃,反应8小时。然后,冷却至50℃,添加甲醇3.6ml,在50℃搅拌2小时。以上操作是一边使少量的空气鼓泡一边实施的。冷却后过滤,加入2mg的4-羟基-2,2,6,6-四甲基哌啶-1-氧自由基,用蒸发仪浓缩滤液。将浓缩物溶解于15ml的甲苯,用7.5g的水清洗。在此时的水相中加入甲苯进行萃取操作。将两个甲苯相合并,用10ml的饱和碳酸氢钠水溶液清洗6次,用10ml的水清洗2次。浓缩甲苯相,用硅胶柱进行纯化(使用己烷6、乙酸乙酯1的比例的溶液),得到了2.1g的式(iii-1)表示的化合物(油状,液体色谱法中的面积百分率99%)。
图1是本例子中得到的化合物(iii-1)的1H-NMR光谱。
图2是本例子中得到的化合物(iii-1)的MS光谱。
〔实验例1~5〕
为了调查作为杂质含有化合物(iii)时的影响,在作为单体的(甲 基)丙烯酸酯中添加规定量的在实施例F1中制造的化合物(iii-1),制造聚合物。
在本例子中使用的单体是下述式(a)~(d)表示的单体(a)~(d)。
作为单体(a),使用了实施例A1中得到的甲基丙烯酸酯(A-1)。没有检测到单体(a)中的化合物(iii)。作为单体(b),使用了在实施例F1中制造的化合物(iii-1)。单体(c)、(d)使用了同一批量的单体(c)、(d)。
即,在密闭容器中加入1.55份的乳酸乙酯、1.04份的聚合引发剂V-601HP230,使其溶解。在具备氮导入口、搅拌机、冷凝器和温度计的烧瓶中加入12.6质量份的乳酸乙酯、9.4质量份的γ-丁内酯,进而以下表4的组成加入单体,进行30分钟氮鼓泡后,将烧瓶放在水浴中开始升温,使烧瓶内的液体温度为80℃。在该液体中添加聚合引发剂的溶液,进而在80℃保持4小时。以上操作在氮气流下一边搅拌一边实施。
对得到的反应溶液,在下述条件下利用GPC(凝胶渗透色谱)测定重均分子量。将其结果示于表4。
(GPC条件)
柱:Shodex GPC KF-801(昭和电工株式会社制)、2根。
温度:40℃。
流量:1.0ml/min。
流动相:四氢呋喃。
检测器:差示折射率检测器(RI)
另外,在该反应溶液的总量中添加160g的甲醇,使聚合物沉淀。过滤该沉淀而得到聚合物湿粉,在60℃真空干燥36小时而得到聚合物。
将干燥的聚合物溶解于10质量%的2-丁酮和90质量%的丙二醇单甲醚乙酸酯的混合液,在27℃测定浊度(单位:NTU)。
浊度的测定利用Orbeco-Hellige公司制的浊度计(制品名:TB200),测定3次而求出平均值。将结果示于表5。
[表4]
[表5]
由表4、5的结果可知,相对于作为单体(a)的甲基丙烯酸酯(A),作为单体(b)的化合物(iii)的含量为9质量%以上时,聚合物的重均分子量显著变大,浊度也显著增大。
- 还没有人留言评论。精彩留言会获得点赞!