一种副猪嗜血杆菌菌株五价疫苗的制备方法与流程
本发明属于生物领域,具体涉及一种副猪嗜血杆菌菌株。
背景技术:
副猪嗜血杆菌病曾一度被认为是由应激引起的仔猪条件性、散发性疾病,随着养猪工业化、集约化程度的提高,如今其已成为危害仔猪和生长猪最严重的细菌性疾病。
副猪嗜血杆菌主要危害2~28周龄的仔猪和生长猪,以5-8周龄断奶保育仔猪危害最为严重,引起多发性浆膜炎、关节炎等症状,发病率高达15%~90%,死亡率有时可高达90%。起初副猪嗜血杆菌被称为猪嗜血杆菌或猪流感嗜血杆菌,后来证实其生长不需要X因子(血红素和其他卟啉类的物质),因而改名为副猪嗜血杆菌。副猪嗜血杆菌具有多形态性,生长时严格需要NAD或V因子,血清型复杂多样,根据同型细菌外膜蛋白抗原的不同,至少可分为15种血清型,另有20%以上的分离株不能分型;而且不同国家或地区的流行血清型不同,据蔡旭旺等报道,认为我国当前流行的血清型主要有4,5, 12,13型,但不同地方的优势血清型有所不同,所以对病的防控增加难度。根据我国血清流行病学调查和分离菌株的鉴定,以4、5型最为流行,其次是12型、13型。近年来,各副猪嗜血杆菌血清群之间交互免疫力不强,接种的疫苗菌株血清群与当时当地流行的副猪嗜血杆菌病的病原血清群不相符,给副猪嗜血杆菌的预防和治疗带来了一定的难度。
目前国内用于副猪嗜血杆菌病免疫预防的疫苗有勃林格殷格翰动物保健(美国)有限公司生产的副猪嗜血杆菌病灭活疫苗(Z-1517株),西班牙海博莱生物大药厂生产的猪副猪嗜血杆菌病1型和6型灭活疫苗,华中农业大学、武汉科前动物生物制品有限责任公司、中牧实业股份有限公司生产的副猪嗜血杆菌病4型和5型灭活疫苗;这些疫苗的应用起到了一定的预防作用,而该病的病原流行株和多种血清型感染已经使现有疫苗很难达到预期的免疫效果,因此,用于参与制备防治多种血清型副猪嗜血杆菌病原引起的副猪嗜血杆菌病疫苗的合适毒株是从业人员所迫切需要解决的问题。
技术实现要素:
本发明所要解决的技术问题在于提供一种副猪嗜血杆菌菌株五价疫苗的制备方法,所用菌株LYC2为副猪嗜血杆菌菌株 LYC2(Haemophilusparasuis),于2015年07月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为CGMCCNo.11147。
菌株LYD1为副猪嗜血杆菌菌株LYD1,于2015年07月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为CGMCCNo.11143;
菌株LYH5为副猪嗜血杆菌菌株LYH5,于2015年07月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为CGMCCNo.11144;
菌株LY02为副猪嗜血杆菌菌株LY02,于2015年07月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为CGMCCNo.11145;
菌株LYW1为副猪嗜血杆菌菌株LYW1,于2015年07月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为CGMCCNo.11146;
本发明是通过以下技术方案解决上述技术问题的:
2011年,申请人在无菌条件下采集福建省龙岩市永定某猪场中疑似Hps发病仔猪的肺脏、关节积液、气管,并分别划线接种于TSA 培养基,置于37℃恒温培养箱中,烛缸厌氧培养24-48h,将培养获得的菌株进行理化特性与分子学鉴定,最终确定其为副猪嗜血杆菌菌属的一个菌株。
本发明的有益效果在于:提供一种副猪嗜血杆菌菌株 LYC2(Haemophilusparasuis),该菌株能够用于参与制备防治多种血清型的副猪嗜血杆菌引起的疾病的疫苗,最终所制得的疫苗安全性及防治能力均良好。
附图说明
下面参照附图结合实施例对本发明作进一步的描述。
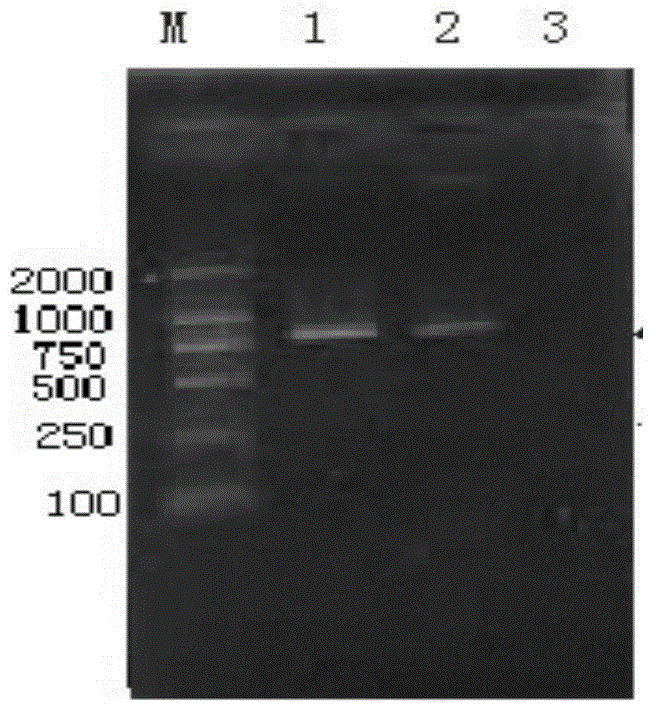
图1是本发明实施例1-5中PCR产物的1.0%琼脂糖凝胶电泳图。
具体实施方式
本发明中副猪嗜血杆菌菌株LYC2(Haemophilusparasuis)是2011 年时将采集自福建省龙岩市永定某猪场中疑似Hps发病仔猪的肺脏、关节积液进行培养得到的菌株。且需要说明的是,本发明中还涉及了其它几个菌株,分别为副猪嗜血杆菌菌株LYD1、副猪嗜血杆菌菌株 LYH5、副猪嗜血杆菌菌株LY02及副猪嗜血杆菌菌株LYW1。
为了对本发明进行详细阐述说明,申请人给出了如下具体实施例为了对本发明进行详细阐述说明,申请人给出了如下具体实施例。
实施例1菌株LYC2的分离与鉴定
1、菌株LYC2的分离:
2012年,申请人在无菌条件下采集福建省泉州市新罗某猪场中疑似Hps发病仔猪的肺脏、关节积液、气管,并分别划线接种于TSA 培养基,置于37℃恒温培养箱中,烛缸厌氧培养24-48h,将培养获得的菌株命名为菌株LYC2。
2、菌株LYC2的鉴定:
初步鉴定:
将所获得的菌株LYC2进行形态学与生化特性的测定,结果如下:呈革兰氏阴性,细小杆菌,具有多种不同的形态,从单个的球杆菌到长的、细长的、以致丝状的菌体;无溶血现象、分离株不产生吲哚,能发酵葡萄糖、果糖、蔗糖,不发酵木糖、L-阿拉伯糖、乳糖、棉子糖,接触酶、尿素酶试验阴性,对甘露糖生化反应不稳定,生长均需要V因子而不需要X因子;因此,可初步认定菌株LYC2属于副猪嗜血杆菌菌属。
进一步鉴定:
提取模板:挑取菌株LYC2的单菌落进行亚克隆培养,用灭菌的双蒸水小心刮洗菌苔并置于1.5mL离心管中,之后于12000rpm下离心30s,弃上清,保留细胞沉淀;接着加入567μLTE悬浮沉淀,用等体积第一抽提液(体积比为25∶24∶1的酚∶氯仿∶异戊醇)抽提,使两相完全混合,冰浴10分钟;然后12000rpm离心10分钟,吸取上清液,等体积第二抽提液(体积比为24∶1的氯仿∶异戊醇)再抽提 1次,至溶液中有絮状的DNA沉淀出现;将DNA沉淀转移到1mL70%乙醇中洗涤,再于65℃干燥箱中干燥2分钟;最后用50-100μLTE 缓冲液(含20μg/mLRNase)溶解DNA沉淀,即为所需的模板,4℃保存备用。
PCR鉴定:委托上海生工生物工程有限公司合成上游引物P1(如 SEQIDNO:1所示):5'-GTGATGAGGAAGGGTGGTGT-3';下游引物P2(如SEQIDNO:2所示):5'-GGCTTCGTCACCCTCTGT-3'。
以本实施例提取所获得模板为模板,且以上述引物(P1/P2)为引物对进行PCR反应,并以现有公认的副猪嗜血杆菌标准菌株为阴性对照:
PCR反应体系(50μL):10×PCRBuffer(Mg2+)5μL, 2.5mmol/LdNTPs4μL,5U/μLTaqDNA聚合酶0.5μL,H2O36.5μL, 10μmol/L上游引物1μL,10μmol/L下游引物1μL,模板2μL;
PCR反应程序为:94℃预变性5min;接着94℃变性30s,58℃退火30s,72℃复性1min,重复30个循环;最后72℃下延伸7min。 PCR产物的检测:将PCR产物用1%的琼脂糖凝胶电泳对PCR产物进行鉴定,以DNAMarkerDL2000作为标准分子量,80V电压、1× TAE缓冲液中电泳20min。
即进行凝胶电泳分离检验,电泳分离检验结果如图1(图1中,M 为DNAladder;1为本实施例待测菌株;2为阴性对照;3为双蒸水空白对照)所示,由图1可知,本实施例待测菌株即菌株LYC2同副猪嗜血杆菌标准菌株一样,均在821bp位置扩增出单一条带,即确认该菌株LYC2与副猪嗜血杆菌标准菌株同属于同一菌属。
依据上述的鉴定,最终确认菌株LYC2属于副猪嗜血杆菌 (Haemophilusparasuis)菌属的一个菌株。
血清型鉴定:将菌株LYC2接种于TSA培养基,37℃培养大量增殖后,于7000r/min下离心取菌体;往菌体中加入9体积倍于菌体的pH7.4PBS缓冲溶液,121℃蒸汽处理2h,再7000r/min离心10min 取上清液并进行琼脂扩散试验,具体根据Keilstein和Rapp— Gabrielson所建立的琼脂扩散试验法鉴定其Hps血清型,鉴定结果为 Hps13型。
实施例2菌株LYD1的分离与鉴定
1、菌株LYD1的分离:
2009年,申请人在无菌条件下采集福建省泉州市新罗某猪场中疑似Hps发病仔猪的肺脏、关节积液、气管,并分别划线接种于TSA 培养基,置于37℃恒温培养箱中,烛缸厌氧培养24-48h,将培养获得的菌株命名为菌株LYD1。
2、菌株LYD1的鉴定:
初步鉴定:
将所获得的菌株LYD1进行形态学与生化特性的测定,其结果与实施例1中的初步鉴定结果一致;因此,可初步认定菌株LYD1同样属于副猪嗜血杆菌菌属。
进一步鉴定:
提取模板:参照实施例1中的提取模板操作以提取菌株LYD1的 DNA作为为所需的模板,4℃保存备用。
PCR鉴定:以本实施例提取所获得模板为模板,且以实施例1 中所述引物(P1/P2)为引物对进行PCR反应,并以现有公认的副猪嗜血杆菌标准菌株为阴性对照:
PCR反应体系(50μL):10×PCRBuffer(Mg2+)5μL, 2.5mmol/LdNTPs4μL,5U/μLTaqDNA聚合酶0.5μL,H2O36.5μL, 10μmol/L上游引物1μL,10μmol/L下游引物1μL,模板2μL;
PCR反应程序为:94℃预变性5min;接着94℃变性30s,58℃退火30s,72℃复性1min,重复30个循环;最后72℃下延伸7min。
PCR产物的检测:将PCR产物用1%的琼脂糖凝胶电泳对PCR 产物进行鉴定,以DNAMarkerDL2000作为标准分子量,80V电压、 1×TAE缓冲液中电泳20min。即进行凝胶电泳分离检验,电泳分离检验结果与实施例1的一致,即如图1所示,则确认该菌株LYD1同样与副猪嗜血杆菌标准菌株同属于同一菌属。
依据上述的鉴定,最终确认菌株LYD1属于副猪嗜血杆菌 (Haemophilusparasuis)菌属的一个菌株。
血清型鉴定:参照实施例1中血清型鉴定操作对菌株LYD1进行血清型鉴定,鉴定结果为Hps1型。
实施例3菌株LYH5的分离与鉴定
1、菌株LYH5的分离:
2011年,申请人在无菌条件下采集福建省龙岩市永定某猪场中疑似Hps发病仔猪的肺脏、关节积液、气管,并分别划线接种于TSA 培养基,置于37℃恒温培养箱中,烛缸厌氧培养24-48h,将培养获得的菌株命名为菌株LYH5
2、菌株LYH5的鉴定:
初步鉴定:
将所获得的菌株LYH5进行形态学与生化特性的测定,其结果与实施例1中的初步鉴定结果一致;因此,可初步认定菌株LYH5同样属于副猪嗜血杆菌菌属。
进一步鉴定:
提取模板:参照实施例1中的提取模板操作以提取菌株LYH5的 DNA作为为所需的模板,4℃保存备用。
PCR鉴定:以本实施例提取所获得模板为模板,且以实施例1 中所述引物(P1/P2)为引物对进行PCR反应,并以现有公认的副猪嗜血杆菌标准菌株为阴性对照:
PCR反应体系(50μL):10×PCRBuffer(Mg2+)5μL, 2.5mmol/LdNTPs4μL,5U/μLTaqDNA聚合酶0.5μL,H2O36.5μL, 10μmol/L上游引物1μL,10μmol/L下游引物1μL,模板2μL;
PCR反应程序为:94℃预变性5min;接着94℃变性30s,58℃退火30s,72℃复性1min,重复30个循环;最后72℃下延伸7min。
PCR产物的检测:将PCR产物用1%的琼脂糖凝胶电泳对PCR 产物进行鉴定,以DNAMarkerDL2000作为标准分子量,80V电压、 1×TAE缓冲液中电泳20min。即进行凝胶电泳分离检验,电泳分离检验结果与实施例1的一致,即如图1所示,则确认该菌株LYH5同样与副猪嗜血杆菌标准菌株同属于同一菌属。
依据上述的鉴定,最终确认菌株LYH5属于副猪嗜血杆菌 (Haemophilusparasuis)菌属的一个菌株。
血清型鉴定:参照实施例1中血清型鉴定操作对菌株LY02进行血清型鉴定,鉴定结果为Hps4型。
实施例4菌株LY02的分离与鉴定
1、菌株LY02的分离:
2012年,申请人在无菌条件下采集福建省龙岩市永定某猪场中疑似Hps发病仔猪的肺脏、关节积液、气管,并分别划线接种于TSA 培养基,置于37℃恒温培养箱中,烛缸厌氧培养24-48h,将培养获得的菌株命名为菌株LY02。
2、菌株LY02的鉴定:
初步鉴定:
将所获得的菌株LY02进行形态学与生化特性的测定,其结果与实施例1中的初步鉴定结果一致;因此,可初步认定菌株LY02同样属于副猪嗜血杆菌菌属。
进一步鉴定:
提取模板:参照实施例1中的提取模板操作以提取菌株LY02的 DNA作为为所需的模板,4℃保存备用。
PCR鉴定:以本实施例提取所获得模板为模板,且以实施例1 中所述引物(P1/P2)为引物对进行PCR反应,并以现有公认的副猪嗜血杆菌标准菌株为阴性对照:
PCR反应体系(50μL):10×PCRBuffer(Mg2+)5μL, 2.5mmol/LdNTPs4μL,5U/μLTaqDNA聚合酶0.5μL,H2O36.5μL, 10μmol/L上游引物1μL,10μmol/L下游引物1μL,模板2μL;
PCR反应程序为:94℃预变性5min;接着94℃变性30s,58℃退火30s,72℃复性1min,重复30个循环;最后72℃下延伸7min。
PCR产物的检测:将PCR产物用1%的琼脂糖凝胶电泳对PCR 产物进行鉴定,以DNAMarkerDL2000作为标准分子量,80V电压、 1×TAE缓冲液中电泳20min。即进行凝胶电泳分离检验,电泳分离检验结果与实施例1的一致,即如图1所示,则确认该菌株LY02同样与副猪嗜血杆菌标准菌株同属于同一菌属。
依据上述的鉴定,最终确认菌株LY02属于副猪嗜血杆菌 (Haemophilusparasuis)菌属的一个菌株。
血清型鉴定:参照实施例1中血清型鉴定操作对菌株LY02进行血清型鉴定,鉴定结果为Hps5型。
实施例5菌株LYW1的分离与鉴定
1、菌株LYW1的分离:
2011年,申请人在无菌条件下采集福建省泉州市新罗某猪场中疑似Hps发病仔猪的肺脏、关节积液、气管,并分别划线接种于TSA 培养基,置于37℃恒温培养箱中,烛缸厌氧培养24-48h,将培养获得的菌株命名为菌株LYW1。
2、菌株LYW1的鉴定:
初步鉴定:
将所获得的菌株LYW1进行形态学与生化特性的测定,其结果与实施例1中的初步鉴定结果一致;因此,可初步认定菌株LYW1 同样属于副猪嗜血杆菌菌属。
进一步鉴定:
提取模板:参照实施例1中的提取模板操作以提取菌株LYW1 的DNA作为为所需的模板,4℃保存备用。
PCR鉴定:以本实施例提取所获得模板为模板,且以实施例1 中所述引物(P1/P2)为引物对进行PCR反应,并以现有公认的副猪嗜血杆菌标准菌株为阴性对照:
PCR反应体系(50μL):10×PCRBuffer(Mg2+)5μL, 2.5mmol/LdNTPs4μL,5U/μLTaqDNA聚合酶0.5μL,H2O36.5μL, 10μmol/L上游引物1μL,10μmol/L下游引物1μL,模板2μL;
PCR反应程序为:94℃预变性5min;接着94℃变性30s,58℃退火30s,72℃复性1min,重复30个循环;最后72℃下延伸7min。
PCR产物的检测:将PCR产物用1%的琼脂糖凝胶电泳对PCR 产物进行鉴定,以DNAMarkerDL2000作为标准分子量,80V电压、 1×TAE缓冲液中电泳20min。即进行凝胶电泳分离检验,电泳分离检验结果与实施例1的一致,即如图1所示,则确认该菌株LYW1 同样与副猪嗜血杆菌标准菌株同属于同一菌属。
依据上述的鉴定,最终确认菌株LYW1属于副猪嗜血杆菌 (Haemophilusparasuis)菌属的一个菌株。
血清型鉴定:参照实施例1中血清型鉴定操作对菌株LYW1进行血清型鉴定,鉴定结果为Hps12型。
实施例6副猪嗜血杆菌五价灭活疫苗的制备
繁殖培养:取上述的菌株LYD1、菌株LYH5、菌株LY02、菌株 LYW1和菌株LYC2并分别划线接种于TSA琼脂平板上,且于5%~ 10%CO2(即培养环境中含有5%~10%质量百分数的CO2)、37℃下培养24~48h,挑取典型菌落并接种于TSB培养基上,置于37℃振荡培养24~48h,即得菌株LYD1的一级种子液、菌株LYH5的一级种子液、菌株LY02的一级种子液、菌株LYW1的一级种子液及菌株 LYC2的一级种子液;取所得菌株LYD1的一级种子液、菌株LYH5 的一级种子液、菌株LY02的一级种子液、菌株LYW1的一级种子液及菌株LYC2的一级种子液并分别划线于TSA琼脂平板上,且于 5%~10%CO2(即培养环境中含有5%~10%质量百分数的CO2)、 37℃下培养24~48h,挑取典型菌落并接种于TSB培养基上,置于37℃振荡培养24~48h,即得菌株LYD1的二级种子液、菌株LYH5 的二级种子液、菌株LY02的二级种子液、菌株LYW1的二级种子液及菌株LYC2的二级种子液;将菌株LYD1的二级种子液、菌株LYH5 的二级种子液、菌株LY02的二级种子液、菌株LYW1的二级种子液及菌株LYC2的二级种子液分别接种至发酵培养基,并于37℃、 180r/min下培养22~24h,得菌株LYD1菌液、菌株LYH5菌液、菌株LY02菌液、菌株LYW1菌液及菌株LYC2菌液;
其中,发酵培养基为半合成培养基,该半合成培养基的配制方法为:取TSB30g溶于去离子水,并定容至1000mL,充分摇匀溶解后于121℃蒸汽灭菌15min,冷却后加入50ml过滤除菌的新生牛血清、 200μL过滤除菌的0.02%NAD即可;
浓缩与灭活:将繁殖培养所得各菌液分别进行浓缩,且菌株LYD1 菌液、菌株LYW1菌液、菌株LYC2菌液均浓缩至菌液中的抗原含量为2.5×109CFU/mL,菌株LYH5菌液、菌株LY02菌液则均浓缩至菌液中的抗原含量为2.0×109CFU/mL;接着将浓缩后的各菌液分别进行灭活;
总混合菌液的制备:取已浓缩、灭活后的菌株LYD1菌液、菌株 LYW1菌液及菌株LYC2菌液并按1:1:1的体积比混合,获得第一混合菌液;取已浓缩、灭活后的菌株LYH5菌液、菌株LY02菌液并按 1:1的体积比混合,获得第二混合菌液;之后将所得第一混合菌液与第二混合菌液按1:1.5的体积比混合则得总混合菌液;
水相配制:按体积份取已灭菌的吐温-804份、无菌检验合格的总混合菌液96份,并导入配液罐中,开启搅拌电机,匀速搅拌至吐温 -80完全溶解,获得水相;
油相配制:按体积份取注射用白油94份、司本-806份并加至油相制备罐中,开启搅拌电机,匀速搅拌,同时开启导热油开关,125℃加热30min,冷却后即得油相;
乳化:取油相1.5体积份置于乳化罐内,开动电机1500-2000r/min 搅拌,同时缓缓加入水相1体积份,再以4000r/min乳化30min;乳化后,取样10ml并以3000r/min离心15min,若不分层则乳化所得乳化液即为所述副猪嗜血杆菌五价灭活疫苗;若有分层现象则将所得乳化液重复乳化直至不分层,最终即得所述副猪嗜血杆菌五价灭活疫苗。
本发明中,TSA琼脂平板的配制方法为:取胰蛋白大豆琼脂40g,加入去离子水定容至1000mL,充分摇匀溶解,121℃高压蒸汽灭菌 15min,冷却后加入50mL过滤除菌的新生牛血清、200μL过滤除菌的0.2g/mLNAD即可。发酵培养基为半合成培养基,该半合成培养基的配制方法为:取TSB30g溶于去离子水,并定容至1000mL,充分摇匀溶解后于121℃高压蒸汽灭菌15min,冷却后加入50ml过滤除菌的新生牛血清、200μL过滤除菌的0.02%NAD即可。TSB培养基的配制方法为:取胰蛋白大豆肉汤即TSB30g溶于去离子水,定容至 1000mL,充分摇匀溶解后121℃蒸汽灭菌15min,加入50ml过滤除菌的新生牛血清、200ul过滤除菌的0.02%NAD即可。
实施例7副猪嗜血杆菌五价灭活疫苗的安全试验
1、副猪嗜血杆菌疫苗对靶动物的一次单剂量接种的安全性试验
采用本发明制备方法即实施例6制备方法01批制得的副猪嗜血杆菌五价灭活疫苗对5头10~15日龄仔猪(购自福建龙岩市某良种猪场)分别进行颈部肌肉注射,注射量为2ml/头,另设生理盐水免疫对照组。以观察试验猪接种疫苗后2周内,试验猪有无过敏,精神、饮食有无异常,注射部位有无红肿现象及仔猪增重情况。试验结果如下表1所示。
表1对非使用日龄靶动物的一次接种安全性试验结果
由表1可知,注射副猪嗜血杆菌五价灭活疫苗后仔猪精神良好,接种后注射部位均未出现红肿现象,且精神、采食均正常;即与生理盐水对照组的仔猪状态基本一致;从而表明本发明所制得的副猪嗜血杆菌疫苗对靶动物的一次单剂量接种是安全的。
2、副猪嗜血杆菌疫苗对靶动物一次超剂量接种的安全性试验
采用本发明制备方法制得3个批次的副猪嗜血杆菌五价灭活疫苗,分别01批、02批、03批;采用该3个批次的疫苗分别对10~ 15日龄健康易感仔猪进行颈部肌肉注射,每个批次注射5头,注射量4ml/头,且每个批次均设生理盐水免疫对照组;观察试验猪接种疫苗后的安全性。结果表明详见表2。
表2副猪嗜血杆菌疫苗超剂量接种的安全性试验
由表2可知,分别注射3个批次副猪嗜血杆菌五价灭活疫苗的 10~15周龄仔猪的注射部位均未出现红肿反应,且精神、采食均正常,与对照组的仔猪无明显差异;从而说明本发明制得的副猪嗜血杆菌五价灭活疫苗一次超剂量接种是安全的。
3、单剂量重复接种安全试验
采用本发明制备方法制得的01批副猪嗜血杆菌五价灭活疫苗对 10~15日龄健康易感仔猪进行疫苗接种,14天后重复接种一次,并以接种生理盐水为对照组;观察疫苗单剂量重复接种对接种猪的安全性。结果详见表3,。
表3试验仔猪单剂量重复安全性试验结果
由表3表明,该疫苗对接种猪无不良影响,无过敏现象,接种部位无红肿等不良反应,接种猪的精神、采食量均正常,仔猪增重与对照组的无明显差异;从而证明本发明副猪嗜血杆菌五价灭活疫苗单剂量重复接种是安全的。
4、怀孕母猪的安全性试验
试验组,采用本发明制备方法制得的副猪嗜血杆菌五价灭活疫苗对产前15天怀孕母猪(在龙岩市某猪场进行)各5头进行颈部肌肉注射,注射量为2ml/头;另设生理盐水免疫对照组。以观察试验猪接种疫苗后2周内,试验猪有无过敏,精神、饮食有无异常,注射部位有无红肿现象,母猪产子情况是否正常。结果显示,试验组产前15天怀孕母猪接种后注射部位均未出现红肿现象,接种第2-3天,体温略升高,第4天,体温恢复正常,精神、采食均正常,所产仔猪均正常,产仔率达96.8;对照试验猪均正常,产仔率为97.2%;从而说明本发明副猪嗜血杆菌五价灭活疫苗对怀孕母猪接种是安全的。
实施例8副猪嗜血杆菌疫苗的药效试验
试验组即免疫组,采用本发明制备方法制得的副猪嗜血杆菌五价灭活疫苗对10~15日龄的健康易感猪25头进行颈部肌肉注射,注射量为2ml/头,21天后,二次免疫,剂量不变,二次免疫后14天,将注射了所述副猪嗜血杆菌五价灭活疫苗的免疫试验猪随机分为5组,分别用副猪嗜血杆菌血清1型、4型、5型、12型和13型菌株攻毒;同时设置生理盐水免疫对照组。结果如表4所示。
表4仔猪攻毒及保护性试验
由表4可知,本发明制备方法制得的副猪嗜血杆菌五价灭活疫苗对副猪嗜血杆菌血清1、5、12型菌株的攻毒免疫率达到100%,对副猪嗜血杆菌血清4、13型的攻毒免疫率为60%;因此,本发明制备方法制得的副猪嗜血杆菌五价灭活疫苗不仅能够同时针对多种血清型的副猪嗜血杆菌引起的疾病进行免疫防治,且具有较好的免疫防治能力。
综上,本发明提供一种副猪嗜血杆菌菌株 LYC2(Haemophilusparasuis),该菌株能够用于参与制备防治多种血清型的副猪嗜血杆菌引起的疾病的疫苗,最终所制得的疫苗安全性及防治能力均良好;此外,还具有成本较为低廉的特点。
- 还没有人留言评论。精彩留言会获得点赞!