一种呋喃二醇胺(含苯环)化合物及其制备方法与流程
本发明属有机合成技术领域,具体涉及一种呋喃二醇胺(含苯环)及其制备方法。
背景技术:
随着化石资源消耗的增长及储量的日益枯竭,可再生资源的开发利用备受关注。生物质是一类储量大、分布广、成本低的可再生资源,以生物质为原料生产化学品将在一定程度上缓解社会发展对化石资源的严重依赖(Chem.Rev.2007,107,2411–2502)。木质纤维素是生物质主要成分,由纤维素(35~50%)、半纤维素(20~35%)和木质素(10~25%)组成。与结构复杂、性质稳定的木质素相比,纤维素、半纤维素易于水解产生葡萄糖为主的碳水化合物。
5-羟甲基糠醛(5-HMF)是近年来备受关注的化学品之一,可由葡萄糖或果糖经脱水反应制得(Science 2006,312,1933–1937;Science 2007,316,1597–1600)。以5-HMF为平台化合物,经氧化、加氢、缩合等反应可制备多种更具附加值的化工产品(Chem.Rev.2011,111,397–417)。如5-HMF加氢可得呋喃二甲醇,呋喃二甲醇可用于制备自愈合聚合物(Macromolecules 2013,46,1794-1802)。
呋喃二醇胺(结构式为)是一种聚合单体,可用于合成聚合物。Andrew P.Dunlop报道了和的合成方法(US 4219485 A 19800826;US 4219486 A 19800826),并指出该类单体可用来合成聚氨酯。
现有呋喃二醇胺合成方法仅有Dunlop报道的两个例子。Andrew P.Dunlop报道的两个单体合成方法是以糠醇为原料,与伯胺、甲醛的三组分Mannich反应。该方法需要使用浓盐酸作为反应介质,浓盐酸对设备会有严重腐蚀,后处理又需要大量碱中和,增加了分离成本。糠醇在强酸环境中不稳定,使得该方法选择性和收率可能很低。
技术实现要素:
针对上述问题,本发明提出一种呋喃二醇胺(含苯环)及其制备方法。
一种呋喃二醇胺(含苯环)化合物,其特征在于该化合物结构式为:
其中:R为苯环邻位、间位或对位的取代基;R为F、Cl、Br、Me、OMe、OEt、OH、H、OAc、Ac、CO2Me、CO2Et、CN、CF3或NO2;n=0、1、2、3或4。
一种呋喃二醇胺(含苯环)的制备方法,通过钌配合物催化,5-羟甲基糠醛与伯胺加氢反应制备;按照以下步骤进行:
称取Ru配合物、5-羟甲基糠醛、伯胺溶于溶剂,以氢气为还原剂,进行加氢还原反应,其中Ru配合物、伯胺物质的量的比为0.005–0.1;氢气压力为10–50bar;反应温度为60–150℃;反应时间为4–24h;伯胺的浓度为0.1–2molL-1;5-羟甲基糠醛与伯胺的物质的量比为1.5–3。
所述钌配合物通式为,RuL2X2或[RuL2(H2O)2]Z2;
L为配体,结构式为:
X=Cl或Br;
Z为配合物阴离子:三氟甲磺酸根(OTf)、硫酸根(SO4)、四氟硼酸根(BF4)、硝酸根(NO3)、六氟磷酸根(PF6)、二(三氟甲烷磺酰)亚胺(NTf2),对甲苯磺酸根(OTs)、高氯酸根(ClO4)、三氟乙酸根(TFA)或乙酸根(OAc)。
所述伯胺结构式为:
R为苯环邻位、间位或对位的取代基;R为F、Cl、Br、Me、OMe、OEt、OH、H、OAc、Ac、CO2Me、CO2Et、CN、CF3或NO2;n=0、1、2、3或4。
所述加氢反应的溶剂为甲醇、乙醇、异丙醇、二氯甲烷、乙酸乙酯、四氢呋喃、水、三氯甲烷、甲苯、1,4-二氧六环、N,N-二甲基甲酰胺、二甲基亚砜、甲基叔丁基醚中的一种或几种混合溶剂。
本发明方法反应条件温和,不需要使用强酸或强碱。而且,合成了多种新的呋喃二醇胺结构。
本发明的有益效果为:本发明报道的呋喃二醇胺(含苯环)均为新化合物,都有作为聚合单体的价值;本发明采用5-羟甲基糠醛为原料,5-羟甲基糠醛来源于生物质,原料广泛。
附图说明
图1为实施例1产物的1H NMR图谱;
图2为实施例1产物的13C NMR图谱;
图3为实施例6产物的1H NMR图谱;
图4为实施例6产物的13C NMR图谱;
图5为实施例7产物的1H NMR图谱;
图6为实施例7产物的13C NMR图谱;
图7为实施例8产物的1H NMR图谱;
图8为实施例8产物的13C NMR图谱;
图9为实施例9产物的1H NMR图谱;
图10为实施例9产物的13C NMR图谱。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围不受实施例的限制,如果该领域的技术熟练人员根据上述本发明内容对本发明做出一些非本质的改进和调整,仍属于本发明的保护范围。
实施例1
称量107.2mg苄胺,12mg Ru催化剂,量取2.0mL乙醇,称量265mg5-HMF,在20mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为10bar,温度为120℃,反应时间为24h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得粘稠状略带黄色液体120mg,收率为41%。
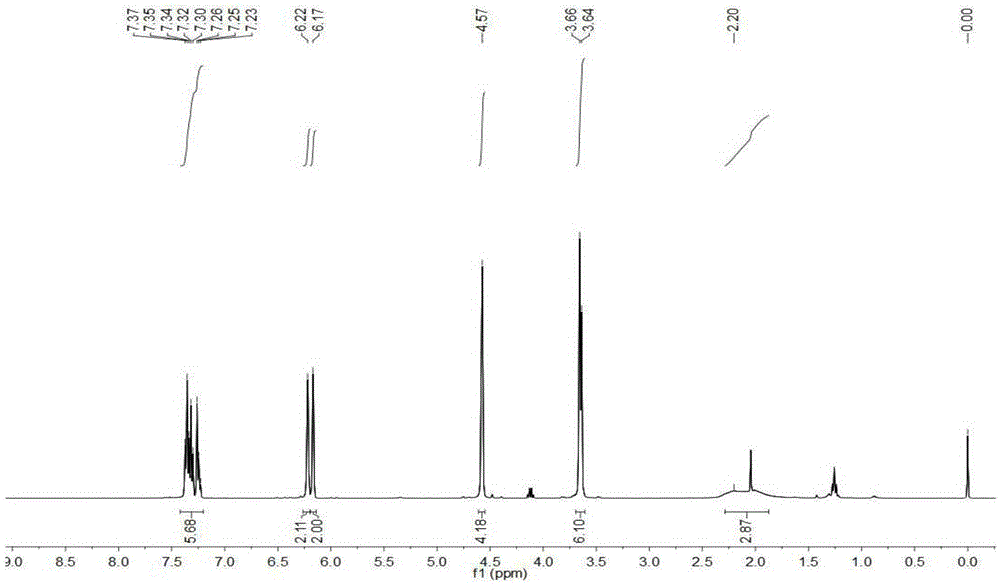
该产物经检测1H NMR和13C NMR图谱如图1、图2所示,数据如下:
1H NMR(400MHz,CDCl3,TMS)δ7.37–7.23(m,5H),6.22–6.17(m,4H),4.57(s,4H),3.66(s,4H),3.64(s,2H),2.20(s,2H);13C NMR(100MHz,CDCl3)δ153.6,152.4,138.6,129.0,128.3,127.1,109.6,108.4,57.5,57.3,49.7。
其结构式为:
实施例2
称量107.2mg苄胺,3.1mg Ru催化剂,量取2.0mL乙醇,称量265mg5-HMF,在20mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为20bar,温度为120℃,反应时间为24h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得粘稠状略带黄色液体104.8mg,收率为32%。经检测,其结构式为
实施例3
称量107.2mg苄胺,61mg Ru催化剂,量取2.0mL乙醇,称量265mg5-HMF,在20mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为20bar,温度为60℃,反应时间为24h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得粘稠状略带黄色液体33mg,收率为10%。经检测,其结构式为
实施例4
称量107.2mg苄胺,12mg Ru催化剂,量取2.0mL乙醇,称量265mg5-HMF,在20mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为20bar,温度为150℃,反应时间为4h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得粘稠状略带黄色液体262mg,收率为80%。经检测, 其结构式为
实施例5
称量107.2mg苄胺,6.1mg Ru催化剂,量取2.0mL乙醇,称量290mg5-HMF,在20mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为20bar,温度为110℃,反应时间为12h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得粘稠状略带黄色液体275mg,收率为84%。经检测,其结构式为
实施例6
称量137.2mg对甲氧基苄胺,6.1mg Ru催化剂,量取3.0mL乙醇,称量290mg 5-HMF,在10mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为25bar,温度为110℃,反应时间为24h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得略带黄色固体325mg,收率为80%。
该产物经检测1H NMR和13C NMR图谱如图3、图4所示,数据如下:
1H NMR(400MHz,CDCl3,TMS)δ7.26(d,J=8.44,2H),6.85(d,J=8.48,2H),6.19(d,J=3.00,2H),6.14(d,J=3.00,2H),4.54(s,4H),3.78(s,3H),3.61(s,4H),3.56(s,2H),2.80(s,2H);13C NMR(100MHz,CDCl3)δ158.7,153.7,152.3,130.33,130.29,113.7,109.7,108.3,57.4,56.7,55.3,49.5。
其结构式为:
实施例7
称量186mg对溴苄胺,6.1mg Ru催化剂,量取3.0mL乙醇,称量290mg5-HMF,在10mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为25bar,温度为110℃,反应时间为24h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得略带黄色固体325mg,收率为80%。
该产物经检测1H NMR和13C NMR图谱如图5、图6所示,数据如下:
1H NMR(400MHz,CDCl3,TMS)δ7.43(d,J=7.96,2H),7.24(d,J=8.04,2H),6.22(d,J=2.64,2H),6.15(d,J=2.64,2H),4.57(s,4H),3.63(s,4H),3.57(s,2H),2.18(s,2H);13C NMR(100MHz,CDCl3)δ153.7,152.2,137.8,131.4,130.6,120.8,109.7,108.4,57.5,56.7,49.7。
其结构式为:
实施例8
称量121mg苯乙胺,6.1mg Ru催化剂,量取3.0mL乙醇,称量290mg5-HMF,在10mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢 气压力为25bar,温度为110℃,反应时间为24h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得略带白色固体308.3mg,收率为90.3%。
该产物经检测1H NMR和13C NMR图谱如图7、图8所示,数据如下:
1H NMR(400MHz,CDCl3,TMS)δ7.26–7.12(m,5H),6.19(d,J=3.00Hz,2H),6.13(d,J=3.04Hz,2H),4.53(s,4H),3.68(s,4H),3.10(s,1H),2.82–2.67(m,4H);13C NMR(100MHz,CDCl3)δ154.0,151.7,140.1,128.8,128.4,126.1,109.8,108.3,57.3,55.3,50.0,33.4。
其结构式为:
实施例9
称量167mg 2,4-二甲氧基苄胺,6.1mg Ru催化剂,量取3.0mL乙醇,称量290mg 5-HMF,在10mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为20bar,温度为110℃,反应时间为12h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得略带颜色固体325.4mg,收率为84%。
该产物经检测1H NMR和13C NMR图谱如图9、图10所示,数据如下:
1H NMR(400MHz,CDCl3,TMS)δ7.30–7.26(m,1H),6.47–6.43(m,2H),6.17(d,J=2.72,2H),6.15(d,J=2.96,2H),4.51(s,4H),3.78(s,3H),3.75(s,3H),3.62(s,6H),3.06(s,2H);13C NMR(100MHz,CDCl3)δ160.0,158.9,153.6,152.5,131.5,118.7,109.5,108.2,104.0,98.5,57.3,55.41,55.35,50.6,49.8。
其结构式为:
实施例10
称量1.07g苄胺,61mg Ru催化剂,量取40mL乙醇,称量2.9mg 5-HMF,在100mL高压釜中混合均匀,体系用10bar氢气置换3次,反应起始氢气压力为50bar,温度为110℃,反应时间为12h。反应结束后减压去除乙醇,残留物采用硅胶柱分离得粘稠状略带黄色液体2.62g,收率为80%。经检测,其结构式为
- 还没有人留言评论。精彩留言会获得点赞!