奥格列汀盐及其晶型、它们的制备方法和药物组合物与流程
本发明涉及药物化学结晶技术领域。具体地,涉及新型的奥格列汀盐及其晶型,还涉及所述奥格列汀盐及其晶型的制备方法、其药物组合物和用途。
背景技术:
奥格列汀(英文名称omarigliptin),是默沙东公司开发的一种超长效二肽基肽酶-iv抑制剂,用于治疗2型糖尿病,给药方式为口服每周一次。2014年12月,默沙东向日本药品和医疗器械局(pmda)提交了实验性降糖药omarigliptin的新药申请,标志着全球首个监管申请。
奥格列汀化学名称为(2r,3s,5r)-2-(2,5-二氟苯基)-5-[2-(甲基磺酰基)-2,6-二氢吡咯并[3,4-c]吡唑-5(4h)-基]四氢-2h-吡喃-3-胺,其化学结构式如下所示:
专利文献wo2010/056708a1公开了奥格列汀及其制备方法、药物组合物和用途。
专利文献wo2013/003249al公开了奥格列汀的四种晶型(晶型i、晶型ii、晶型iii和晶型iv)及其制备方法,并通过核磁共振氢谱图、x-射线粉末衍射图、红外光谱图和差示扫描量热分析图对四种晶型进行了表征。据该专利文献称,在高于13℃时,奥格列汀晶型i是最稳定的晶型。
本发明人在研究过程中发现上述已知的奥格列汀的晶型i、晶型ii、晶型iii和晶型iv有水溶性小、溶解速度慢、结晶度低、晶型稳定性差的缺点。
鉴于现有技术尚存不足,本领域仍需要开发新型的奥格列汀盐及其晶型。
技术实现要素:
本发明的目的是提供新型的奥格列汀盐及其晶型。与已知的奥格列汀及其晶型相比,本发明的奥格列汀盐及其晶型具有至少一种更优越的性能,例如:溶解度高、溶解速度快、结晶度高、结晶形态好、晶型稳定性好、贮存稳定性好、有利的加工与处理特性等。
为了实现本发明目的,本发明采用以下技术方案:本发明提供新型的奥格列汀盐及其晶型,包括奥格列汀马来酸盐晶型1、奥格列汀己二酸盐及其晶型1、奥格列汀对氨基苯甲酸盐及其晶型1;本发明还提供所述新型的奥格列汀盐及其晶型的制备方法、其药物组合物和用途。
本发明的内容之一是提供奥格列汀马来酸盐晶型1及其制备方法。
所述奥格列汀马来酸盐晶型1,其结构式如下:
经1h-nmr测定,所述奥格列汀马来酸盐晶型1是奥格列汀和马来酸以约1:1摩尔比形成的化合物。
采用cu-kα辐射,所述奥格列汀马来酸盐晶型1以2θ角度表示的x-射线粉末衍射图具有以下特征峰:11.5±0.2°、15.3±0.2°、16.2±0.2°、18.3±0.2°和19.9±0.2°处有特征峰。
进一步地,所述奥格列汀马来酸盐晶型1以2θ角度表示的x-射线粉末衍射图具有以下特征峰:11.5±0.2°、12.3±0.2°、15.3±0.2°、16.2±0.2°、18.3±0.2°、19.9±0.2°、23.2±0.2°、24.2±0.2°、26.0±0.2°和31.6±0.2°。
更进一步地,所述奥格列汀马来酸盐晶型1以衍射角2θ角度表示的x-射线粉末衍射图具有以下特征峰及其相对强度:
非限制性地,所述奥格列汀马来酸盐晶型1的一个典型实例具有如图1所示的x-射线粉末衍射图谱。
所述奥格列汀马来酸盐晶型1的制备方法,采用下述方法中的任意一种:
(1)混合奥格列汀的甲醇溶液和马来酸的甲醇溶液,其中奥格列汀与马来的摩尔比为1:1~1:2,搅拌形成浆液,去除溶剂,得到奥格列汀马来酸盐,进而在选自c1-c5醇、c3-c4酮或其混合物的溶剂中形成奥格列汀马来酸盐溶液,将奥格列汀马来酸盐溶液挥发至干,得到所述奥格列汀马来酸盐晶型1;
所述c1-c5醇可以是甲醇、乙醇、异丙醇、正丙醇、丁醇、仲丁醇或其混合物,所述c3-c4酮可以是丙酮、丁酮或其混合物;优选地,所述溶剂为乙醇或丙酮;
优选地,所述奥格列汀马来酸盐溶液的浓度为室温下其在所述溶剂中溶解度的0.5~1倍;
优选地,方法(1)于室温下进行;
(2)混合奥格列汀的甲醇溶液和马来酸的甲醇溶液,其中奥格列汀与马来的摩尔比为1:1~1:2,搅拌形成浆液,去除溶剂,得到奥格列汀马来酸盐,进而将奥格列汀马来酸盐在选自c1-c5醇、c3-c4酮、c3-c6酯、c4-c6醚、c6-c7烷烃或其混合物的溶剂中形成悬浮液,搅拌析晶,得到所述奥格列汀马来酸盐晶型1;
所述c1-c5醇可以是甲醇、乙醇、异丙醇、正丙醇、正丁醇、异丁醇、仲丁醇、戊醇或其混合物,所述c3-c4酮可以是丙酮、丁酮或其混合物,所述c3-c6酯可以是乙酸甲酯、乙酸乙酯、乙酸丁酯、乙酸异丙酯或其混合物,所述c4-c6醚可以是乙醚、异丙醚、甲基叔丁基醚或其混合物;所述c6-c7烷烃可以是正己烷、甲基环己烷、正庚烷或其混合物;优选地,所述溶剂选自异丙醇、丁酮、乙酸乙酯、乙酸异丁酯、甲基叔丁基醚、甲基环己烷或正庚烷;
优选地,所述悬浮液中奥格列汀马来酸盐与溶剂的重量体积比为5mg/ml至50mg/ml;
优选地,所述搅拌析晶的时间为8-72小时,更优选为8-16小时;
优选地,方法(2)在室温下进行。
上述奥格列汀马来酸盐晶型1的制备方法中,所述“搅拌”采用常规技术完成,例如磁力搅拌和机械搅拌。搅拌速度为50~1800转/分,优选300~900转/分。
上述奥格列汀马来酸盐晶型1的制备方法中,所述“去除溶剂”采用常规技术完成,例如过滤、离心或旋蒸。过滤的具体操作:将欲分离的样品 置于滤纸上,减压抽滤。离心的具体操作:将欲分离的样品置于离心管中,之后高速旋转直至固体全部沉至离心管底部,离心速率例如为6000转/分钟。旋蒸的具体操作:将装有浆液的容器置于旋蒸仪中,在室温至溶剂沸点的水浴温度下(优选30~50℃),小于大气压的压力下(优选小于0.08mpa),以10~180转/分的转速(优选50~100转/分)将溶剂除尽。
上述奥格列汀马来酸盐晶型1的制备方法中,经析晶得到的奥格列汀马来酸盐晶型1,采用本领域的常规方法进行分离和干燥。“分离”例如过滤、离心。“干燥”例如鼓风干燥、减压干燥,优选压力小于0.09mpa下的减压干燥。干燥温度为室温~50℃,干燥时间约10~72小时。
本发明的奥格列汀马来酸盐晶型1具有以下有益特性:
1)与已知的奥格列汀晶型i相比,本发明的奥格列汀马来酸盐晶型1在温度较低条件下(如5~10℃)具有更好的晶型稳定性。
2)与已知的奥格列汀晶型i相比,本发明的奥格列汀马来酸盐晶型1在水中具有更好的溶解度和更快的溶解速度。
3)本发明的奥格列汀马来酸盐晶型1在温度25℃、相对湿度60%的条件下保存6个月,其纯度和晶型都保持不变。
上述有益特性表明:与已知的奥格列汀晶型i相比,本发明的奥格列汀马来酸盐晶型1具有晶型稳定性好、水溶性较好和化学稳定性好的优点。奥格列汀马来酸盐晶型1适合固体制剂应用,有利于提高药物的生物利用度,有利于对抗药物制造和存储过程中因时间、温度、湿度等因素引起的含量不均、纯度降低等问题,降低由此带来的疗效下降风险,也有利于制剂制备中的准确定量以及后期的运输和储存。
本发明的内容之二是提供奥格列汀己二酸盐及其晶型1,以及它们的制备方法。
所述奥格列汀己二酸盐,其结构式如下:
经1h-nmr测定,所述奥格列汀己二酸盐是奥格列汀和己二酸以约1:1摩尔比形成的化合物。
所述奥格列汀己二酸盐的制备方法,包括以下步骤:分别形成奥格列汀 和己二酸在c1-c5醇或c3-c4酮中的溶液,奥格列汀与己二酸的摩尔比为1:0.5~1:2,混合两种溶液,搅拌形成浆液,进而去除溶剂,得到所述奥格列汀己二酸盐;
所述c1-c5醇可以是甲醇、乙醇、异丙醇、正丙醇、正丁醇、仲丁醇或其混合物,所述c3-c4酮可以是丙酮、丁酮或其混合物;优选地,所述c1-c5醇为甲醇,所述c3-c4酮为丙酮;
优选地,所述奥格列汀与己二酸的摩尔比为1:1~1:1.5;
优选地,所述奥格列汀溶液的浓度为室温下其在所述c1-c5醇或c3-c4酮中的溶解度的0.5~1倍,所述己二酸溶液的浓度为室温下其在所述c1-c5醇或c3-c4酮中的溶解度的0.5~1倍;
优选地,所述搅拌的时间为0.5-1小时;
优选地,所述制备方法在室温下进行。
上述奥格列汀己二酸盐的制备方法中,所述“搅拌”、“去除溶剂”都采用常规技术完成,具体内容参见本申请文本之前的描述。
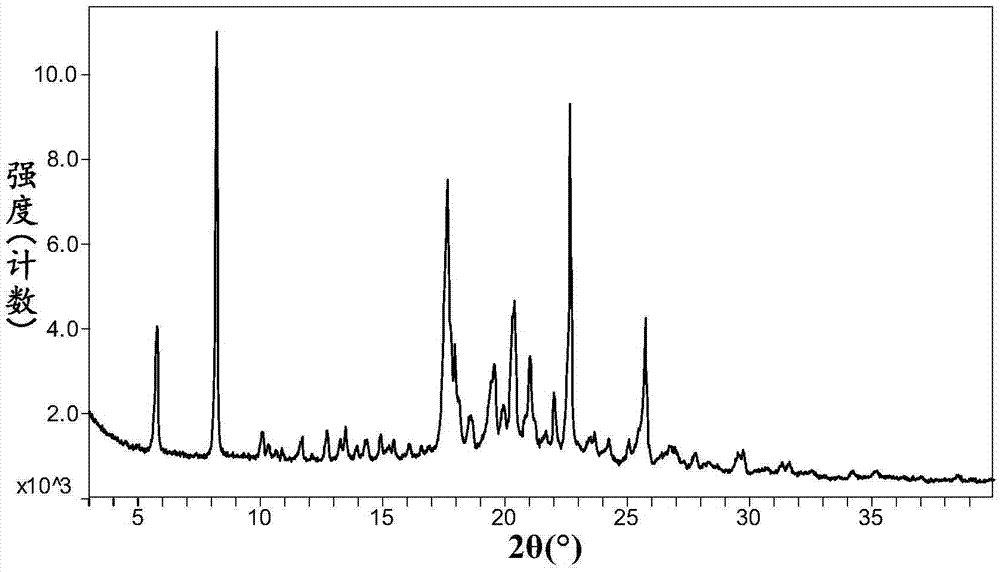
在一个优选实施方案中,所述奥格列汀己二酸盐是奥格列汀己二酸盐晶型1,采用cu-kα辐射,其以2θ角度表示的x-射线粉末衍射图具有以下特征峰:5.8±0.2°、8.2±0.2°、17.7±0.2°、18.0±0.2°、20.4±0.2°和22.7±0.2°。
进一步地,所述奥格列汀己二酸盐晶型1以2θ角度表示的x-射线粉末衍射图具有以下特征峰:5.8±0.2°、8.2±0.2°、17.7±0.2°、18.0±0.2°、19.6±0.2°、20.4±0.2°、21.0±0.2°、22.0±0.2°、22.7±0.2°和25.7±0.2°。
更进一步地,所述奥格列汀己二酸盐晶型1以2θ角度表示的x-射线粉末衍射图具有以下特征峰及其相对强度:
非限制性地,所述奥格列汀己二酸盐晶型1的一个典型实例具有如图2所示的x-射线粉末衍射图谱。
所述奥格列汀己二酸盐晶型1的制备方法,采用下述方法中的任意一种:
(1)将本发明前述的奥格列汀己二酸盐或根据本发明前述制备方法得到的奥格列汀己二酸盐在选自c1-c5醇、c3-c4酮或其混合物的溶剂中形成溶液,溶液挥发至干,得到所述奥格列汀己二酸盐晶型1;
所述c1-c5醇可以是甲醇、乙醇、异丙醇、正丙醇、丁醇、仲丁醇或其混合物,所述c3-c4酮可以是丙酮、丁酮或其混合物;优选地,所述溶剂为乙醇或丙酮;
优选地,所述奥格列汀己二酸盐溶液的浓度为室温下其在所述溶剂中溶解度的0.5~1倍;
优选地,方法(1)在室温下进行;
(2)将本发明前述的奥格列汀己二酸盐或根据本发明前述制备方法得到的奥格列汀己二酸盐在选自c1-c5醇、c3-c4酮、c3-c6酯、c4-c6醚、c6-c7烷烃或其混合物的溶剂中形成浆液,搅拌析晶,得到所述的奥格列汀己二酸盐晶型1;
所述c1-c5醇可以是甲醇、乙醇、异丙醇、正丙醇、正丁醇、异丁醇、仲丁醇、戊醇或其混合物,所述c3-c4酮可以是丙酮、丁酮或其混合物,所述c3-c6酯可以是乙酸甲酯、乙酸乙酯、乙酸丁酯、乙酸异丙酯或其混合物,所述c4-c6醚可以是乙醚、异丙醚、甲基叔丁基醚或其混合物;所述c6-c7烷烃可以是正己烷、甲基环己烷、正庚烷或其混合物;优选地,所述溶剂选自异丙醇、丁酮、乙酸乙酯、乙酸异丙酯、甲基叔丁基醚、甲基环己烷或正庚烷;
优选地,所述浆液中奥格列汀己二酸盐的重量体积比为5mg/ml至200mg/ml;
优选地,所述搅拌析晶的时间为8-72小时,更优选为8-16小时;
优选地,方法(2)在室温下进行。
上述奥格列汀己二酸盐晶型1的制备方法中,经析晶得到的奥格列汀己二酸盐晶型1,采用本领域的常规方法进行分离和干燥。具体内容参见本申请文本之前的描述。
本发明的奥格列汀己二酸盐及其晶型1具有以下有益特性:
1)与已知的奥格列汀晶型i相比,本发明的奥格列汀己二酸盐晶型1在温度较低条件下(如5~10℃),具有更好的晶型稳定性。
2)与已知的奥格列汀晶型i相比,本发明的奥格列汀己二酸盐及其晶型1在水中具有更好的溶解度和更快的溶解速度。
3)本发明的奥格列汀己二酸盐及其晶型1在温度25℃、相对湿度60%的条件下保存6个月,其纯度和晶型都保持不变。
上述有益特性表明:与已知的奥格列汀晶型i相比,本发明的奥格列汀己二酸盐及其晶型1具有晶型稳定性好、水溶性好和化学稳定性好的优点,适合固体制剂应用,有利于提高药物的生物利用度,有利于更好地对抗药物制造和存储过程中因时间、温度、湿度等因素引起的含量不均、纯度降低等问题,降低由此带来的疗效下降风险,也有利于制剂制备中的准确定量以及后期的运输和储存。
本发明的内容之三是提供奥格列汀对氨基苯甲酸盐及其晶型1、以及它们的制备方法。
所述奥格列汀对氨基苯甲酸盐的结构式如下:
经1h-nmr测定,所述奥格列汀对氨基苯甲酸盐是奥格列汀和对氨基苯甲酸以约1:1摩尔比形成的化合物。
所述奥格列汀对氨基苯甲酸盐的制备方法,包括以下步骤:分别形成奥格列汀和对氨基苯甲酸在c1-c5醇或c3-c4酮中的溶液,其中奥格列汀与对氨基苯甲酸的摩尔比为1:1~1:2,混合两种溶液,搅拌形成浆液,进而去除溶剂,得到所述奥格列汀对氨基苯甲酸盐;
优选地,所述c1-c5醇为甲醇,所述c3-c4酮为丙酮;
优选地,所述奥格列汀溶液的浓度为室温下其在所述c1-c5醇或c3-c4酮中的溶解度的0.5~1倍,所述对氨基苯甲酸溶液的浓度为室温下其在所述c1-c5醇或c3-c4酮中的溶解度的0.5~1倍;
优选地,所述搅拌的时间为0.5-1小时;
优选地,所述制备方法在室温下进行。
上述奥格列汀对氨基苯甲酸盐的制备方法中,所述“搅拌”、“去除溶剂”都采用常规技术完成,具体内容参见本申请文本之前的描述。
在一个优选实施方案中,所述奥格列汀对氨基苯甲酸盐是奥格列汀对氨基苯甲酸盐晶型1,采用cu-kα辐射,其以2θ角度表示的x-射线粉末衍射图具有以下特征峰:14.0±0.2°、16.7±0.2°、18.5±0.2°、20.1±0.2°和22.4±0.2°。
进一步地,所述奥格列汀对氨基苯甲酸盐晶型1以2θ角度表示的x-射线粉末衍射图具有以下特征峰:5.6±0.2°、14.0±0.2°、16.7±0.2°、17.0±0.2°、17.4±0.2°、18.5±0.2°、20.1±0.2°、21.6±0.2°、22.4±0.2°和27.2±0.2°。
更进一步地,所述奥格列汀对氨基苯甲酸盐晶型1以2θ角度表示的x-射线粉末衍射图具有以下特征峰及其相对强度:
非限制性地,所述奥格列汀对氨基苯甲酸盐晶型1的一个典型实例具有如图3所示的x-射线粉末衍射图谱。
所述奥格列汀对氨基苯甲酸盐晶型1的制备方法,采用下述方法中的任意一种:
1)将本发明前述的奥格列汀对氨基苯甲酸盐或根据本发明前述制备方法得到的奥格列汀对氨基苯甲酸盐在选自c1-c5醇、c3-c4酮或其混合物的溶剂中形成溶液,溶液挥发至干,得到所述奥格列汀对氨基苯甲酸盐晶型1;
所述c1-c5醇可以是甲醇、乙醇、异丙醇、正丙醇、正丁醇、异丁醇、仲丁醇、戊醇或其混合物,所述c3-c4酮可以是丙酮、丁酮或其混合物;优选地,所述溶剂选自乙醇或丙酮;
优选地,所述奥格列汀对氨基苯甲酸盐溶液的浓度为室温下其在所述有机中的溶解度的0.5~1倍;
优选地,方法(1)在室温下进行;
2)将本发明前述的奥格列汀对氨基苯甲酸盐或根据本发明前述制备方法得到的奥格列汀对氨基苯甲酸盐在选自c1-c5醇、c3-c4酮、c3-c6酯、c4-c6醚、 c6-c7烷烃或其混合物的溶剂中形成浆液,搅拌析晶,得到所述的奥格列汀对氨基苯甲酸盐晶型1;
所述c1-c5醇可以是甲醇、乙醇、异丙醇、正丙醇、正丁醇、异丁醇、仲丁醇、戊醇或其混合物,所述c3-c4酮可以是丙酮、丁酮或其混合物,所述c3-c6酯可以是乙酸甲酯、乙酸乙酯、乙酸丁酯、乙酸异丙酯或其混合物,所述c4-c6醚可以是乙醚、异丙醚、甲基叔丁基醚或其混合物;所述c6-c7烷烃可以是正己烷、甲基环己烷、正庚烷或其混合物;优选地,所述溶剂选自异丙醇、丁酮、乙酸乙酯、乙酸异丁酯、甲基叔丁基醚、甲基环己烷或正庚烷;
优选地,所述浆液中奥格列汀对氨基苯甲酸盐的重量体积比为5mg/ml至200mg/ml;
优选地,所述搅拌析晶的时间为8-72小时,更优选为8-16小时;
优选地,方法(2)在室温下进行。
上述奥格列汀对氨基苯甲酸盐晶型1的制备方法中,经析晶得到的奥格列汀对氨基苯甲酸盐晶型1,采用本领域的常规方法进行分离和干燥。具体内容参见本申请文本之前的描述。
本发明的奥格列汀对氨基苯甲酸盐及其晶型1具有以下有益特性:
1)与已知的奥格列汀晶型i相比,本发明的奥格列汀对氨基苯甲酸盐晶型1在温度较低条件下(如5~10℃),具有更好的晶型稳定性。
2)与已知的奥格列汀晶型i相比,所述奥格列汀对氨基苯甲酸盐及其晶型1在水中具有更好的溶解度和更快的溶解速度。
3)本发明的奥格列汀对氨基苯甲酸盐及其晶型1在温度25℃、相对湿度60%的条件下保存6个月,其纯度和晶型都保持不变。
上述有益特性表明:与已知的奥格列汀晶型i相比,本发明的奥格列汀对氨基苯甲酸盐及其晶型1具有晶型稳定性好、水溶性好和化学稳定性好的优点,适合固体制剂应用,有利于提高药物的生物利用度,有利于更好地对抗药物制造和存储过程中因时间、温度、湿度等因素引起的含量不均、纯度降低等问题,降低由此带来的疗效下降风险,也有利于制剂制备中的准确定量以及后期的运输和储存。
本发明前述的奥格列汀盐及其晶型的制备方法中,起始原料奥格列汀可以商购获得,也可以根据文献方法合成,例如参照专利文献wo2010/056708a1或wo2013/003249al。
本发明的内容还包括提供一种药物组合物,所述药物组合物包含治疗有效量的药物活性成分选自本发明新型的奥格列汀盐及其晶型或者由本发明制备方法得到的新型的奥格列汀盐及其新晶型,以及至少一种药学上可接受的载体;其中,所述本发明新型的奥格列汀盐及其晶型包括奥格列汀马来酸盐 晶型1、奥格列汀己二酸盐及其晶型1和奥格列汀对氨基苯甲酸盐及其晶型1。此外,所述药物组合物还可以包含奥格列汀的其它可药用的晶型(例如奥格列汀的晶型i、晶型ii、晶型iii和晶型iv)、无定形或盐。
所述药物组合物可为固态、半固态或液态,可制备成合适的剂型例如固体剂型,包括片剂、颗粒剂、散剂、丸剂、粉末和胶囊剂;液体剂型,包括溶液剂、糖浆剂、混悬剂、分散剂和乳剂;可注射制剂,包括溶液剂、分散剂、适于注射前在液体中溶解或悬浮的固体形式例如冻干剂。配方可适于活性成分的快速释放、持续释放或调节释放。可以是常规的、可分散的、可咀嚼的、口腔溶解的或快速熔化的制剂。给药途径包括口服、通过胃喂食管、通过十二指肠喂食管、静脉内、动脉内、肌肉内、皮下、骨内、皮肤内等。
所述药物组合物中药学上可接受的载体或助剂,在固态制剂的情况下包括但不限于:稀释剂,例如淀粉、改性淀粉、乳糖、粉状纤维素、微晶纤维素、无水磷酸氢钙、磷酸三钙、甘露醇、山梨醇、蔗糖等;粘合剂,例如阿拉伯胶、瓜尔胶、明胶、聚乙烯吡咯烷酮、羟丙基纤维素、羟丙基甲基纤维素、聚乙二醇、共聚维酮等;崩解剂,例如淀粉、羧甲基淀粉钠、羟基乙酸淀粉钠、预胶化淀粉、交联聚维酮、交联羧甲基纤维素钠、胶体二氧化硅等;润滑剂,例如硬脂酸、硬脂酸镁、硬脂酸锌、苯甲酸钠、乙酸钠等;助流剂,例如胶体二氧化硅等;复合物形成剂,例如各种级别的环糊精和树脂;释放速度控制剂,例如羟丙基纤维素、羟甲基纤维素、羟丙基甲基纤维素、乙基纤维素、甲基纤维素、甲基丙烯酸甲酯、蜡等。其他药学上可接受的载体或助剂包括但不限于成膜剂、增塑剂、着色剂、调味剂、粘度调节剂、防腐剂、抗氧化剂等。口服片剂中,通常使用的载体或助剂包括糖比如乳糖、蔗糖、甘露醇或山梨醇,纤维素制品比如玉米淀粉、小麦淀粉、明胶、甲基纤维素、羟丙基甲基纤维素、羟甲基纤维素钠和聚乙烯吡咯烷酮,还可以加入润滑剂比如硬脂酸镁、崩解剂比如交联聚乙烯吡咯烷酮,进一步地可对片剂核心进行包衣,例如形成糖衣层;口服胶囊剂中,有用的载体或助剂包括乳糖、高和低分子量聚乙二醇和干玉米淀粉;明胶胶囊剂的情况下,粉末载体例如乳糖、淀粉、纤维素衍生物、硬脂酸镁、硬脂酸与类似物;软胶囊的情况下,活性化合物可以溶解或悬浮于合适的液体中,比如脂肪油、液体石蜡或液体聚乙二醇;当以混悬液口服给药时,所述活性成分与乳化剂和悬浮剂混合;如果需要,可以加入某些甜味剂和/或调味剂和/或着色剂。每一种载体或助剂必须是可接受的,能与配方中的其他成分兼容并且对于病患无害。
所述药物组合物可以使用本领域技术人员公知的方法来制备。制备药物组合物时,将本发明新型的奥格列汀盐及其晶型,以及至少一种药学上可接受的载体相混合,任选地,与一种或多种其他的药物活性成分相混合。固体 制剂可以通过直接混合、制粒等工艺来制备。液体制剂可以通过溶解、分散等工艺来制备。
本发明的内容还包括提供本发明新型的奥格列汀盐及其晶型、由本发明制备方法得到的本发明新型的奥格列汀盐及其晶型或者本发明前述的药物组合物在制备用于治疗2型糖尿病的药物中的用途,其中所述本发明新型的奥格列汀盐及其晶型包括奥格列汀马来酸盐晶型1、奥格列汀己二酸盐及其晶型1和奥格列汀对氨基苯甲酸盐及其晶型1。
本发明的内容还包括提供一种治疗2型糖尿病的方法,所述方法包括给予需要的患者治疗有效量的本发明新型的奥格列汀盐及其晶型,或者由本发明制备方法得到本发明新型的奥格列汀盐及其晶型,或者本发明前述的药物组合物,其中所述本发明新型的奥格列汀盐及其晶型包括奥格列汀马来酸盐晶型1、奥格列汀己二酸盐及其晶型1和奥格列汀对氨基苯甲酸盐及其晶型1。所述患者是指哺乳动物例如人。对于本领域技术人员显而易见的是,施用的剂量和特定的给药方式将根据患者的年龄、体重、饮食、同时使用的药物情况等因素而变化。合适的剂量水平约为0.01-200毫克/公斤体重/天,优选0.01-10毫克/公斤体重/天,更优选0.1-5.0毫克/公斤体重/天。对于口服施用,可以提供含有奥格列汀为0.01毫克、0.05毫克、0.1毫克、0.25毫克、0.5毫克、1.0毫克、1.5毫克、2.5毫克、3毫克、5毫克、10毫克、12.5毫克、15毫克、25毫克、50毫克、100毫克或200毫克的本发明新型的奥格列汀盐及其晶型的片剂或胶囊。本发明新型的奥格列汀盐及其晶型可以每日单剂量、每日分剂量或者单次周剂量给药,例如规格为25mg奥格列汀的口服缓释胶囊,每周一次。
附图说明
图1是奥格列汀马来酸盐晶型1的x射线粉末衍射(xrpd)图
图2是奥格列汀己二酸盐晶型1的x射线粉末衍射(xrpd)图
图3是奥格列汀对氨基苯甲酸盐晶型1的x射线粉末衍射(xrpd)图
图4是制备例1所得的奥格列汀晶型i的x射线粉末衍射(xrpd)图
具体实施方案
通过下述实施例将有助于进一步理解本发明,但是不用于限制本发明的内容。
检测仪器及方法:
x-射线粉末衍射(xrpd)所使用的仪器为brukerd8advancediffractometer,采用铜靶波长为1.54nm的kax-射线,在40kv和40ma的操作条件下、θ-2θ测角仪、mo单色仪、lynxeye探测器。采集软件是diffracplusxrd commander。样品在室温条件下测试,把需要检测的样品放在无反射板上。详细检测条件如下,角度范围:3-40°2θ,步长:0.02°2θ,速度:0.2秒/步。
氢谱数据(1hnmr)采自于brukeravanceiidmx500mhz核磁共振波谱仪。称量一般为1-5mg样品,用0.5mldmso溶解,配成2mg/ml-10mg/ml的溶液。
实施例中所用的各种试剂如无特别说明均为市售购买。
制备例1奥格列汀的制备
参照专利文献cn103702562a实施例7的制备方法制得,具体操作如下:
1)将8.25g酮、9.8g吡唑盐和124mldmac装入500ml的三颈烧瓶(配备顶置式搅拌、n2入口和热电偶)中,并且将所得均相溶液冷却至ti=-10℃。分批添加作为固体的6.94gnabh(oac)3。反应在ti=-10℃陈化,直至酮消耗符和≥98%的要求。经由缓慢添加用nh4oh(8.3ml)和h2o(16.5ml)的化合物将反应浆料萃灭。将所得浆料加热至ti=50℃,然后冷却至ti=22℃。过滤浆料。将滤饼用5:1dmac:h2o(65ml)进行洗涤,随后用水65ml置换洗涤。将滤饼干燥,直至残留水的量为≤10%。回收10.6g还原胺化产物,灰白色固体。
2)将还原胺化产物(10.35g)和dmac(31ml)和水(41.4ml)装入200ml三颈夹套烧瓶(配备顶置式搅拌、n2入口和热电偶)中,并且将所得浆料在ti=20℃搅拌。经过3.5小时缓慢添加h2so4(12.2ml;12当量)和h2o(20.7ml)的溶液。将所得浆料陈化15小时。然后将溶液冷却至ti=0-5℃。添加nh4oh,直至上清液的ph为10.2。冷却并过滤浆料。将湿滤饼用冷h2o(17.5ml)进行置换洗涤,随后用h2o(17.5ml)洗涤浆料。将回收的固体干燥,得到6.73g奥格列汀固体。
进一步检测表明,制备例1所得的奥格列汀即为专利文献cn103987388a所述的奥格列汀晶型i,其xrpd图谱如图4所示。
实施例1奥格列汀马来酸盐的制备
室温下,将奥格列汀500mg溶于20ml甲醇中,马来酸146mg溶解于5ml甲醇中,混合马来酸的甲醇溶液与奥格列汀的甲醇溶液,搅拌形成浆液,过滤,滤饼室温减压干燥4小时,得到452mg奥格列汀马来酸盐。
实施例2奥格列汀马来酸盐晶型1的制备
室温下,将实施例1中奥格列汀马来酸盐100mg,加入2ml异丙醇形成悬浮液,搅拌析晶16小时,过滤,滤饼室温减压干燥16小时,得到78.6mg奥格列汀马来酸盐晶型1,产率78.6%。
xrpd图谱如图1所示,显示为结晶态,表明奥格列汀马来酸盐晶型1具有良好结晶态。
实施例3奥格列汀马来酸盐晶型1的制备
室温下,将实施例1的奥格列汀马来酸盐100mg溶于10ml乙醇中,溶液挥发至干,得到奥格列汀马来酸盐晶型1。
核磁氢谱数据:1hnmr(d-dmso,500mhz):1.66(q,1h,j=11.7hz),3.03-3.08(t,1h),3.48(s,1h),3.55-3.61(m,1h),3.67-3.94(m,4h),4.21(d,1h,j=11.0hz),4.53(d,1h,j=9.9hz),6.04(s,2h),7.32-7.35(m,3h),7.97(s,1h)。
实施例4奥格列汀马来酸盐晶型1的制备
室温下,将实施例1的奥格列汀马来酸盐20mg溶于1ml丙酮中,溶液挥发至干,得到奥格列汀马来酸盐晶型1。
实施例5奥格列汀马来酸盐晶型1的制备
室温下,将实施例1的奥格列汀马来酸盐50mg,加入1ml丁酮形成悬浮液,搅拌析晶8小时,过滤,滤饼室温减压干燥24小时,得到32mg奥格列汀马来酸盐晶型1,产率64%。
实施例6奥格列汀马来酸盐晶型1的制备
室温下,将实施例1的奥格列汀马来酸盐50mg,加入1.5ml乙酸乙酯形成悬浮液,搅拌析晶24小时,过滤,滤饼室温减压干燥18小时,得到35mg奥格列汀马来酸盐晶型1,产率70%。
实施例7奥格列汀马来酸盐晶型1的制备
室温下,将实施例1的奥格列汀马来酸盐50mg,加入1.0ml乙酸异丙酯形成悬浮液,搅拌析晶24小时,过滤,滤饼室温减压干燥18小时,得到38mg奥格列汀马来酸盐晶型1,产率76%。
实施例8奥格列汀马来酸盐晶型1的制备
室温下,将实施例1的奥格列汀马来酸盐50mg,加入3ml甲基叔丁基醚形成悬浮液,搅拌析晶72小时,过滤,滤饼室温减压干燥24小时,得到36mg奥格列汀马来酸盐晶型1,产率72%。
实施例9奥格列汀马来酸盐晶型1的制备
室温下,将实施例1的奥格列汀马来酸盐50mg,加入10ml正庚烷形成悬浮液,搅拌析晶72小时,过滤,滤饼室温减压干燥24小时,得到33mg奥格列汀马来酸盐晶型1,产率66%。
实施例10奥格列汀马来酸盐晶型1的制备
室温下,将实施例1的奥格列汀马来酸盐50mg,加入6ml甲基环己烷形成悬浮液,搅拌析晶24小时,过滤,滤饼室温减压干燥24小时,得到36mg奥格列汀马来酸盐晶型1,产率72%。
实施例3-10制备的样品具有与实施例2样品相同或相似的xrpd图谱(未示出),说明实施例3-10样品与实施例2样品是相同的晶型。
实施例11奥格列汀己二酸盐的制备
室温下,将奥格列汀500mg溶于20ml甲醇中,己二酸92mg溶于1ml甲醇中,混合己二酸的甲醇溶液与奥格列汀的甲醇溶液,搅拌1小时形成浆液,过滤,滤饼室温减压干燥4小时,得到300mg奥格列汀己二酸盐。
实施例12奥格列汀己二酸盐的制备
室温下,将奥格列汀2000mg溶于50ml丙酮中,己二酸732mg溶于12ml丙酮中,混合己二酸的丙酮溶液与奥格列汀的丙酮溶液,搅拌0.5小时形成浆液,过滤,滤饼室温减压干燥4小时,得到1544mg奥格列汀己二酸盐。
核磁氢谱数据:1hnmr(d-dmso,500mhz):1.40(dd,1h,j=23.4hz,11.6hz),1.45-1.53(m,3h),2.14-2.24(m,3h),2.27-2.37(m,1h),,2.76-2.97(m,2h),3.25(t,1h,j=10.6hz),3.46(s,1h),3.77(d,4h,j=19.5),4.11-4.15(d,2h),7.07-7.30(m,3h),7.92(s,1h)。
实施例13奥格列汀己二酸盐的制备
室温下,将奥格列汀500mg溶于15ml丙酮中,己二酸275mg溶于3ml丙酮中,混合己二酸的丙酮溶液与奥格列汀的丙酮溶液,搅拌0.5小时形成浆液,过滤,滤饼室温减压干燥4小时,得到536mg奥格列汀己二酸盐。
实施例14奥格列汀己二酸盐的制备
室温下,将奥格列汀500mg溶于20ml丙酮中,己二酸366mg溶于2ml丙酮中,混合己二酸的丙酮溶液与奥格列汀的丙酮溶液,搅拌0.5小时形成浆液,过滤,滤饼室温减压干燥4小时,得到480mg奥格列汀己二酸盐。
实施例15奥格列汀己二酸盐晶型1的制备
将实施例12中所得奥格列汀己二酸盐200mg加入20ml乙醇溶清,该溶液室温放置,敞口挥发至干,得到192mg奥格列汀己二酸盐晶型1,产率96%。
xrpd图谱如图2所示,显示为结晶态,表明奥格列汀己二酸盐晶型1具有良好结晶态。
实施例16奥格列汀己二酸盐晶型1的制备
将实施例12中所得奥格列汀己二酸盐20mg加入1.2ml丙酮溶清,该溶液室温放置,敞口挥发至干,得到19.3mg奥格列汀己二酸盐晶型1,产率97%。
实施例17奥格列汀己二酸盐晶型1的制备
将实施例12中所得奥格列汀己二酸盐100mg,加入0.5ml异丙醇形成浆液,室温搅拌析晶8小时,过滤,滤饼室温减压干燥24小时,得到88mg奥格列汀己二酸盐晶型1,产率88%。
实施例18奥格列汀己二酸盐晶型1的制备
将实施例12中所得奥格列汀己二酸盐100mg,加入0.5ml丁酮形成浆液,室温搅拌析晶8小时,过滤,滤饼室温减压干燥24小时,得到70mg奥格列汀己二酸盐晶型1,产率70%。
实施例19奥格列汀己二酸盐晶型1的制备
室温下,将实施例12中奥格列汀己二酸盐50mg,加入1ml乙酸乙酯形成浆液,搅拌析晶16小时,过滤,滤饼室温减压干燥24小时,得到40mg奥格列汀己二酸盐晶型1,产率80%。
实施例20奥格列汀己二酸盐晶型1的制备
室温下,将实施例12中奥格列汀己二酸盐50mg,加入1.2ml乙酸异丙酯形成浆液,搅拌析晶24小时,过滤,滤饼室温减压干燥24小时,得到38mg奥格列汀己二酸盐晶型1,产率76%。
实施例21奥格列汀己二酸盐晶型1的制备
室温下,将实施例12中奥格列汀己二酸盐50mg,加入2ml甲基叔丁基醚形成浆液,搅拌析晶72小时,过滤,滤饼室温减压干燥24小时,得到42mg奥格列汀己二酸盐晶型1,产率84%。
实施例22奥格列汀己二酸盐晶型1的制备
室温下,将实施例12中奥格列汀己二酸盐50mg,加入10ml正庚烷形成浆液,搅拌析晶72小时,过滤,滤饼室温减压干燥24小时,得到44mg奥格列汀己二酸盐晶型1,产率88%。
实施例23奥格列汀己二酸盐晶型1的制备
室温下,将实施例12中奥格列汀己二酸盐50mg,加入10ml甲基环己烷形成浆液,搅拌析晶48小时,过滤,滤饼室温减压干燥24小时,得到41mg奥格列汀己二酸盐晶型1,产率82%。
实施例16~23制备的样品具有与实施例15样品相同或相似的xrpd图谱(未示出),说明实施例16~23样品与实施例15样品是相同的晶型。
实施例24奥格列汀对氨基苯甲酸盐的制备
室温下,将奥格列汀500mg溶于20ml甲醇中,对氨基苯甲酸172mg溶 于2.5ml甲醇中,混合对氨基苯甲酸的甲醇溶液与奥格列汀的甲醇溶液,搅拌0.5小时形成浆液,过滤,滤饼室温减压干燥4小时,得到484mg奥格列汀对氨基苯甲酸盐。
核磁氢谱数据:1hnmr(d-dmso,500mhz):1.35-1.44(q,1h,j=14.5hz),2.32(m,1h),2.78-2.84(m,1h),2.89-2.95(t,1h),3.23-3.29(t,2h),3.78(d,4h,j=24.0),4.12-4.15(t,1h,j=8.0hz),6.55(d,2h,j=10.5hz),7.17-7.27(m,3h),7.60(d,2h,j=10.0hz),7.95(s,1h)。
实施例25奥格列汀对氨基苯甲酸盐的制备
室温下,将奥格列汀500mg溶于20ml丙酮中,对氨基苯甲酸173mg溶于3ml丙酮中,混合对氨基苯甲酸的丙酮溶液与奥格列汀游离态丙酮溶液,搅拌1小时成浆液,过滤,滤饼室温减压干燥4小时,得到488mg奥格列汀对氨基苯甲酸盐。
实施例26奥格列汀对氨基苯甲酸盐的制备
室温下,将奥格列汀500mg溶于30ml丙酮中,对氨基苯甲酸344mg溶于3ml丙酮中,混合对氨基苯甲酸的丙酮溶液与奥格列汀的丙酮溶液,搅拌1小时成浆液,过滤,滤饼室温减压干燥8小时,得到466mg奥格列汀对氨基苯甲酸盐。
实施例27奥格列汀对氨基苯甲酸晶型1的制备
将实施例24中所得奥格列汀对氨基苯甲酸盐200mg,加入20ml乙醇溶清,该溶液室温放置,敞口挥发至干,得到190mg奥格列汀对氨基苯甲酸盐晶型1,产率98%。
xrpd图谱如图3所示,显示为结晶态,表明奥格列汀对氨基苯甲酸盐晶型1具有良好结晶态。
实施例28奥格列汀对氨基苯甲酸盐晶型1的制备
将实施例24中所得奥格列汀对氨基苯甲酸盐100mg,加入2ml丙酮溶清,该溶液室温放置,敞口挥发至干,得到192mg奥格列汀对氨基苯甲酸盐晶型1,产率90%。
实施例29奥格列汀对氨基苯甲酸盐晶型1的制备
将实施例24中所得奥格列汀对氨基苯甲酸盐100mg,加入0.5ml异丙醇形成浆液,室温搅拌析晶8小时,过滤,滤饼室温减压干燥24小时,得到91mg奥格列汀对氨基苯甲酸盐晶型1,产率91%。
实施例30奥格列汀对氨基苯甲酸盐晶型1的制备
将实施例24中所得奥格列汀对氨基苯甲酸盐100mg,加入2ml丁酮形成浆液,搅拌析晶8小时,过滤,滤饼室温减压干燥24小时,得到82mg奥格列汀对氨基苯甲酸盐晶型1,产率82%。
实施例31奥格列汀对氨基苯甲酸盐晶型1的制备
室温下,将实施例24中所得奥格列汀对氨基苯甲酸盐100mg,加入2ml乙酸乙酯形成浆液,搅拌析晶16小时,过滤,滤饼室温减压干燥24小时,得到76mg奥格列汀对氨基苯甲酸盐晶型1,产率76%。
实施例32奥格列汀对氨基苯甲酸盐晶型1的制备
室温下,将实施例24中所得奥格列汀对氨基苯甲酸盐100mg,加入1.5ml乙酸异丙酯形成浆液,搅拌析晶24小时,过滤,滤饼室温减压干燥24小时,得到80mg奥格列汀对氨基苯甲酸盐晶型1,产率80%。
实施例33奥格列汀对氨基苯甲酸盐晶型1的制备
室温下,将实施例24中奥格列汀对氨基苯甲酸盐50mg,加入2ml甲基叔丁基醚形成浆液,搅拌析晶72小时,过滤,滤饼室温减压干燥24小时,得到43mg奥格列汀对氨基苯甲酸盐晶型1,产率86%。
实施例34奥格列汀对氨基苯甲酸盐晶型1的制备
室温下,将实施例24中奥格列汀对氨基苯甲酸盐50mg,加入10ml正庚烷形成浆液,搅拌析晶72小时,过滤,滤饼室温减压干燥24小时,得到46mg奥格列汀对氨基苯甲酸晶型1,产率92%。
实施例35奥格列汀对氨基苯甲酸盐晶型1的制备
室温下,将实施例24中奥格列汀对氨基苯甲酸盐50mg,加入5ml甲基环己烷形成浆液,搅拌析晶48小时,过滤,滤饼室温减压干燥24小时,得到47mg奥格列汀对氨基苯甲酸晶型1,产率94%。
实施例28~35制备的样品具有与实施例27样品相同或相似的xrpd图谱(未示出),说明实施例28~35样品与实施例27样品是相同的晶型。
实施例36制剂实施例
作为口服药物组合物的一个具体实施方案,100mg效能片剂由129mg的活性成分奥格列汀马来酸盐晶型1、243mg可压淀粉、15mg交联聚维酮和5mg二氧化硅组成。
制备方法:首先将活性成分、可压淀粉和交联聚维酮混合,然后通过二氧化硅润滑混合物,最后将其压制成片剂。
实施例37制剂实施例
作为口服药物组合物的一个具体实施方案,100mg效能片剂由137mg的活性成分奥格列汀己二酸盐晶型1、235mg可压淀粉、15mg交联聚维酮和5mg二氧化硅组成。
制备方法:首先将活性成分、可压淀粉和交联聚维酮混合,然后通过二氧化硅润滑混合物,最后将其压制成片剂。
实施例38制剂实施例
作为口服药物组合物的一个具体实施方案,100mg效能片剂由135mg的活性成分奥格列汀对氨基苯甲酸盐晶型1、237mg可压淀粉、15mg交联聚维酮和5mg二氧化硅组成。
制备方法:首先将活性成分、可压淀粉和交联聚维酮混合,然后通过二氧化硅润滑混合物,最后将其压制成片剂。
实施例39制剂实施例
作为口服药物组合物的一个具体实施方案,25mg效能胶囊由33mg的活性成分奥格列汀马来酸盐晶型1、50mg乙基纤维素、15mg羟丙甲基纤维素、70mg乳糖、30mg微晶纤维素、10mg硬脂酸镁和5mg滑石粉组成。
制备方法:首先将活性成分、乙基纤维素、羟丙甲基纤维素、乳糖和微晶纤维素混合,用75%乙醇制粒,烘干,粉碎,过80目筛,然后加入硬脂酸镁和滑石粉混匀,最后将其灌入3号胶囊。
实施例40制剂实施例
作为口服药物组合物的一个具体实施方案,25mg效能胶囊由35mg的活性成分奥格列汀己二酸盐晶型1、50mg乙基纤维素、15mg羟丙甲基纤维素、70mg乳糖、30mg微晶纤维素、10mg硬脂酸镁和5mg滑石粉组成。
制备方法:首先将活性成分、乙基纤维素、羟丙甲基纤维素、乳糖和微晶纤维素混合,用75%乙醇制粒,烘干,粉碎,过80目筛,然后加入硬脂酸镁和滑石粉混匀,最后将其灌入3号胶囊。
实施例41制剂实施例
作为口服药物组合物的一个具体实施方案,25mg效能胶囊由34mg的活性成分奥格列汀对氨基苯甲酸盐晶型1、50mg乙基纤维素、15mg羟丙甲基纤维素、70mg乳糖、30mg微晶纤维素、10mg硬脂酸镁和5mg滑石粉组成。
制备方法:首先将活性成分、乙基纤维素、羟丙甲基纤维素、乳糖和微晶纤维素混合,用75%乙醇制粒,烘干,粉碎,过80目筛,然后加入硬脂酸镁和滑石粉混匀,最后将其灌入3号胶囊。
对比例1
本发明的奥格列汀盐新晶型与已知的奥格列汀晶型i进行水溶性对比。具体操作如下:
1、水中溶解性试验:取制备例1制备的奥格列汀晶型i、本发明制备的奥格列汀马来酸盐晶型1、奥格列汀己二酸盐晶型1和奥格列汀对氨基苯甲酸盐晶型1各10.0mg作为样品,采用《中国药典》2015版“凡例-项目与要求-十五-(2)”中的溶解度测试方法,将样品分别加入到一定量的25℃±2℃的水中,每隔5分钟强力振摇30秒,观察30分钟内的溶解情况,至无目视可见的溶质颗粒时,即视为完全溶解。结果如表1所示。
2、溶解速度试验:分别取制备例1制备的奥格列汀晶型i、本发明制备的奥格列汀马来酸盐晶型1、奥格列汀己二酸盐晶型1和奥格列汀对氨基苯甲酸盐晶型1各2.0mg作为样品,各加入3ml水至溶清,记录样品的溶解速度。结果如表1所示。
表1水溶性对比试验结果
结果显示:在25℃±2℃的水中,本发明的奥格列汀马来酸晶型1、奥格列汀己二酸盐晶型1和奥格列汀对氨基苯甲酸盐晶型1的目视溶解度分别为5mg/ml、3.3mg/ml和2.5mg/ml,而已知的奥格列汀晶型i的目视溶解度仅为0.8mg/ml,说明本发明的奥格列汀盐新晶型比已知的奥格列汀晶型i具有更好的水溶性;本发明的奥格列汀马来酸晶型1、奥格列汀己二酸盐晶型1和奥格列汀对氨基苯甲酸盐晶型1室温下2mg样品在3ml水中溶清的时间分别为15秒、25秒和40秒,而已知的奥格列汀晶型i室温下2mg样品在3ml水中60秒溶清,说明本发明的奥格列汀盐新晶型比已知的奥格列汀晶型i具有更快的溶解速度;所以,本发明奥格列汀盐新晶型具有更好的水溶性和更快的溶解速度,有利于提高药物的生物利用度。
对比例2
本发明的奥格列汀盐新晶型与已知的奥格列汀晶型i进行晶型稳定性对比。具体操作如下:取制备例1制备的奥格列汀晶型i和本发明制备的奥格列汀马来酸盐晶型1、奥格列汀己二酸盐晶型1以及奥格列汀对氨基苯甲酸盐晶型1各20.0mg作为样品,放置于5~10℃环境下,考察其晶型稳定性。结果见表2。
表2晶型稳定性试验结果
结果显示:在5~10℃环境下,已知的奥格列汀晶型i在放置30天后部分转变为奥格列汀晶型ii,而本发明的奥格列汀马来酸盐晶型1、奥格列汀己二酸盐晶型1和奥格列汀对氨基苯甲酸盐晶型1在放置10-30天后晶型均未发生变化。上述结果说明在本实验条件下,本发明的奥格列汀马来酸盐晶型1、奥格列汀己二酸盐晶型1、奥格列汀对氨基苯甲酸盐晶型1较已知的奥格列汀晶型i更稳定,更适合固体制剂应用。
- 还没有人留言评论。精彩留言会获得点赞!