O‑乙酰化高分子量聚半乳糖醛酸及其作为Vi多糖疫苗的用途的制作方法
技术领域
本公开一般涉及医学领域,具体地涉及微生物学,免疫学和疫苗,更具体地涉及伤寒疫苗。
发明背景
伤寒是一种急性和危及生命的发热性疾病。它是由伤寒沙门氏菌(Salmonella typhi)引起的。据估计,每年发生1600-3300万例新伤寒(typhoid fever)病例和500,000-600,000例死亡。受污染的食物和水是感染的主要来源。在卫生条件差的发展中国家,例如亚洲,非洲和拉丁美洲,感染的风险最高。
细菌在摄食后穿透小肠中的粘膜屏障。然后,它们通过血液循环到达肝和脾并引起疾病。已经使用几种不同的抗生素疗法来治疗伤寒。然而,出现了伤寒沙门氏菌的多药物抗性菌株,并使这些昂贵的治疗无效。因此,广泛使用低成本有效的疫苗仍然是减少伤寒影响的最有效的方式。
目前,有两种类型的可用于防治伤寒的疫苗,以单剂量胃肠外施用的Vi多糖疫苗和口服活减毒Ty21a疫苗。Vi多糖疫苗被许可用于≥2岁龄的人,并提供约70%的保护,持续三年。口服液体活疫苗被许可用于2岁龄以上的人,并在三或四剂后赋予约53-78%的保护。另一种胶囊形式的口服活疫苗被批准用于5岁龄以上的人,并且在四剂后提供相似水平的保护。
许多地区持续出现伤寒的高发病率,以及耐药菌株的增加和扩散,导致WHO在2000年推荐在伤寒为实质性公众健康问题的地区用这些疫苗免疫学龄儿童。在美国,疫苗是昂贵的,并且主要给予旅行者和军事人员。
Vi多糖疫苗基于Vi荚膜多糖(图1)。在C3上被可变O-乙酰化(60-90%;Szu and Bystricky,Enzymol.363:552-567(2003))并且形成保护细菌免受补体介导的裂解和吞噬的荚膜多糖正是(α1-4),2-脱氧-2-N-乙酰半乳糖醛酸。在多年研究后开发Vi疫苗,最终证明Vi多糖是保护性抗原,并且可以用改进的纯化方法产生没有变性的Vi多糖。目前,在美国和欧洲有两种Vi多糖疫苗,由Sanofi-Pasteur制造的一种(Typhim)和由GSK制造的另一种每个疫苗剂量用25μg Vi多糖和作为防腐剂的苯酚配制,并通过肌内或皮下注射施用。在美国推荐每两年再疫苗接种。Vi多糖疫苗也在其他国家,包括印度和中国制造。
这些疫苗通过野生型伤寒沙门氏菌菌株Ty2的大规模发酵和从培养物上清液中沉淀多糖,然后进行进一步的下游纯化步骤(产品插页,Typhim和)来生产。生产技术是在20世纪70年代和20世纪80年代开发的。由于伤寒沙门氏菌是革兰氏阴性细菌,通过内毒素或脂多糖(革兰氏阴性菌的细胞壁组分)对Vi疫苗的污染总是潜在的安全风险。
与大多数基于多糖的疫苗相似的Vi疫苗是T非依赖性抗原,并且在再次疫苗接种时不引发加强或记忆应答(WHO/IVB/12.02)。它对2岁龄以下的婴儿或幼儿无效。因此,通过Vi多糖与蛋白质载体的共价连接开发Vi多糖-蛋白质缀合物疫苗。缀合物疫苗是T依赖性抗原,并且在再次疫苗接种时具有加强效应。
O-乙酰化和分子量是Vi多糖的免疫原性的关键决定因素。研究已经显示,C3上的O-乙酰基的除去降低其免疫原性。Jarvis et al.,J.Bacteriol.94:1406-1410(1967);Szewczyk and Taylor,Infect.Immun.29:539–544(1980);Szu et al.,Infect.Immun.59:4555–4561(1991);Rijpkema et al.,Biologicals.32:11-6(2004)。结构建模显示C3上的大体积非极性O-乙酰基团通过在两侧上成排突出而构成多糖分子的大部分表面,而羧基和N-乙酰基(在C2)基团大多嵌入或位于靠近轴。Szu et al.,Infect.Immun.59:4555–4561(1991)。这与O-乙酰基是显性免疫原性决定簇一致。O-乙酰化的量表示为O-乙酰化程度(DOAc,O-乙酰基/Gal UA的比率[摩尔/摩尔])或乙酰基含量(μmole)/mg多糖。C2处的N-乙酰基也在免疫原性中起重要作用。
研究还显示,Vi多糖的免疫原性在其分子量降低时降低。Martin et al.,J.Bacteriol.94:1411–1416(1967);Szu et al.,Infect.Immun.59:4555–4561(1991)。这与用模型多糖抗原葡聚糖B512(dx)得到的发现一致,指示该多糖抗原的免疫原性随分子量的降低而降低。Gonzalez-Fernandez et al.,Vaccine.26:292-300(2008)。
O-乙酰基含量和分子量是当前Vi疫苗(产品插页,Typhim Vi)的效力指标。有效的Vi多糖疫苗的生产取决于Vi多糖结构的保存。产生有效的Vi多糖的许多早期尝试失败,因为多糖在纯化过程中降解。
植物果胶与Vi多糖共享相同的主链。它们是可变甲基化的α1-4连接的聚半乳糖醛酸(PGA)。来自苹果和柑橘类水果的那些最广泛地用于食品工业中。果胶的甲基化通过甲醇使半乳糖醛酸残基中的羧基酯化而天然发生。具有<50%的甲基化度(DM)的果胶被定义为低甲氧基(LM)果胶,而具有>50%的DM的果胶是高甲氧基(HM)果胶。DM低于10%的LM果胶被认为是PGA。作为最终产物,PGA通常以钠盐形式或聚半乳糖醛酸钠形式制备。因此,术语“聚半乳糖醛酸”在本文中与“聚半乳糖醛酸盐”可互换使用。LM果胶和PGA通常通过在碱性pH条件下HM果胶的去甲基化获得。虽然这些条件除去了甲基,但是它们总是断裂聚合物主链,这导致分子量降低。
商业LM果胶或PGA已经被O-乙酰化以努力分析Vi多糖的抗原性和合成的Vi多糖疫苗的产生。发现所得乙酰化产物与天然Vi多糖具有相同的抗原性。Szewczyk and Taylor,Infect.Immun.29:539–544(1980);Szu et al.,Infect.Immun.62:5545–5549(1994)。然而,它在动物中不是免疫原性的。Szu et al.,Infect.Immun.62:5545–5549(1994)。这归因于与1-2x106Da的天然Vi多糖相比,所使用的商业LM果胶的低分子量(约4x105Da)。同上。多糖抗原的免疫原性对分子量的依赖性已经用其它多糖抗原证明。Gonzalez-Fernandez et al.,Vaccine.26:292-300(2008).。然而,一旦与蛋白质载体缀合,O-乙酰化LM果胶是免疫原性的,虽然其抗体应答水平远低于Vi多糖-蛋白质缀合物的水平。Szu et al.,Infect.Immun.62:5545–5549 1994);Kossaczka et al.,Infect.Immun.67:5806-5810(1997)。因此,需要开发针对伤寒的新型合成Vi多糖疫苗,其是免疫原性的,甚至在不与蛋白质载体缀合的情况下。
发明概述
本公开提供了可用作合成的免疫原性Vi抗原的O-乙酰化高分子量聚半乳糖醛酸(OAc-HPGA)或其药学可接受盐,其具有下列至少一项:(a)大于1x106Da的分子量;(b)每摩尔小于约10%的甲基化程度;和(c)范围为每摩尔约2%至约15%的居间鼠李糖含量(intervening rhamnose content)。本公开进一步提供了制备O-乙酰化多聚半乳糖醛酸或其药学可接受盐的方法,包含其的药物组合物和/或疫苗组合物,以及使用任何前述物质进行的免疫方法。
来自不同植物来源的果胶具有不同的化学和物理特性。来自真芦荟(Aloe vera L.)的高分子量聚半乳糖醛酸(HPGA)(包括其药学可接受盐)已经如美国专利号5,929,051,7,705,135和7,691,986(它们通过引用并入)中所述进行鉴定和制造。真芦荟是一种广泛种植在世界热带和亚热带地区的植物。HPGA具有独特的特征。其具有天然低的甲氧基含量(“DM”<10%),非常高的分子量(>1x106Da)和高的Gal UA(钠盐)含量(>90%)。HPGA的化学和物理性质总结在表1中。HPGA溶于水,但是直接在盐水或缓冲盐水(150mM NaCl)中溶解得较差。与LM果胶一样,它可以与钙离子形成凝胶。当与钙混合时,立即发生凝胶化。HPGA通常具有>99%的纯度并且含有最小量的中性糖和蛋白质(<0.5%)。这些优越的化学和物理性质将HPGA与所有其它现有的果胶或PGA区分开来。
如本文所定义,HPGA是具有至少一个以下特征的高分子量聚半乳糖醛酸:(1)大于1x106Da的分子量,(2)小于约10%/摩尔的甲基化程度,和(3)范围为每摩尔约2%至约15%的居间鼠李糖含量。
如本文所定义,OAc-HPGA是具有至少一个以下特征的O-酰化高分子量聚半乳糖醛酸:(1)大于1x106Da的分子量,(2)小于约10%/摩尔的甲基化程度,和(3)范围为每摩尔约2%至约15%的居间鼠李糖含量。
在本公开的一些实施方案中,HPGA是是在cGMP下从真芦荟植物制造。该制造方法包括切碎植物材料,提取,澄清和0.2μm过滤,然后是如美国专利7,691,986中详细描述的纯化步骤。最终产物是干燥物质。在商业上,所得的HPGA也称为聚合物。上的药物主文件(DMF)于2005年提交给FDA,并每年更新一次新的产品信息。
本公开提供了合成的和免疫原性的Vi抗原,其可以用作新的伤寒疫苗,在安全性,有效性和成本方面具有优于现有Vi疫苗的显著优点。合成的Vi抗原,O-乙酰化的高分子量聚半乳糖醛酸(OAc-HPGA,例如GelSite-OAcTM)或其药学可接受盐通过新型高分子量聚半乳糖醛酸(HPGA,例如,)的O乙酰化产生。上文讨论的HPGA新性质使其成为通过O-乙酰化合成的Vi多糖类似物的理想底物。
OAc-HPGA,例如GelSite-OAcTM通过化学方法以非常高的产率(重量产率>100%)产生。其在O-乙酰基/Gal UA[摩尔/摩尔](在C2或C3位置处>100%或>50%(摩尔/摩尔))的比率上或在每mg多糖的乙酰基含量(μmole)(>4.6μmole/mg)上具有高度O-乙酰化(DOAc)和高分子量(>1x106Da),因此超过了当前Vi疫苗的效力规格。GelSite-OAcTM与Vi多糖具有相似或基本上相同的抗原性,并且自身具有高度免疫原性。更重要的是,这种合成抗原在用致死剂量的活伤寒沙门氏菌攻击的动物中是完全保护的。此外,OAc-HPGA拥有加强效应或记忆免疫应答,在第二次免疫时显示出超过2倍的抗体滴度上升。这在多糖抗原中是非常独特的,并且潜在地使其在不与蛋白质载体缀合的情况下在2岁龄以下的人中有效。
因此,本公开的目的是提供具有以下至少一种的O-乙酰化高分子量聚半乳糖醛酸(OAc-HPGA)或其药学可接受盐:
(a)大于1x106Da的分子量,
(b)每摩尔小于约10%的甲基化程度,和
(c)范围为每摩尔约2%至约15%的居间鼠李糖含量。
在一些实施方案中,OAc-HPGA或其药学可接受盐具有大于1x106Da的分子量。
在一些实施方案中,OAc-HPGA或其药学可接受盐的O-乙酰化程度(DOAc)在C2或C3位置处大于100%,或大于50%。
在一些实施方案中,OAc-HPGA具有大于1x106Da的分子量,小于约10%/摩尔的甲基化度,和在C2或C3位置处大于100%的O-乙酰化程度,或大于50%的O-乙酰化程度。
在一些实施方案中,OAc-HPGA是合成的免疫原性Vi抗原。
在一些实施方案中,OAc-HPGA或其药学可接受盐具有与Vi多糖疫苗基本上相同的抗原性并且是免疫原性的。
在一些实施方案中,OAc-HPGA或其药学可接受盐在第二次免疫时诱导抗体滴度的2倍或更大的升高。
在一些实施方案中,OAc-HPGA或其药学可接受盐在不与蛋白质载体缀合的情况下在2岁龄以下的人中作为合成的免疫原性Vi抗原是有效的。
在一些实施方案中,OAc-HPGA或其药学可接受盐作为针对伤寒的疫苗是有效的。
本公开进一步提供了生产OAc-HPGA的方法,其掺入本公开的HPGA的独特性质以简化方法并确保高回收率或产率。可以从基于植物的起始材料(例如)大量生产OAc-HPGA(例如,GelSite-OAcTM)。
因此,本公开的另一个目的是提供O-乙酰化的高分子量聚半乳糖醛酸(OAc-HPGA)或其药学可接受盐,其通过包括使高分子量聚半乳糖醛酸(HPGA)或其盐与乙酸和乙酸酐的混合物反应的方法形成,其中HPGA具有以下至少一种:
(a)大于1x106Da的分子量,
(b)每摩尔小于约10%的甲基化程度,和
(c)范围为每摩尔约2%至约15%的居间鼠李糖含量。
本公开的另一个目的是提供制备OAc-HPGA或其药学可接受盐的方法,包括使高分子量聚半乳糖醛酸(HPGA)或其盐与乙酸酸和乙酸酐的混合物反应,其中HPGA具有以下的至少一种:
(a)大于1x106Da的分子量,
(b)每摩尔小于约10%的甲基化程度,和
(c)范围为每摩尔约2%至约15%的居间鼠李糖含量。
在一些实施方案中,该方法还包括在与乙酸和乙酸酐的混合物反应之前与HPGA或其盐形成酸凝胶。
在一些实施方案中,该方法还包括使HPGA或其盐与高氯酸反应。
在一些实施方案中,在该方法中使用的HPGA源自真芦荟。
本公开的另一个目的是提供通过根据任何所述方法的方法形成的OAc-HPGA或其药学可接受盐。
本公开的另一目的是提供包含本公开的OAc-HPGA或其药学可接受盐的药物组合物,其任选地包含至少一种药学可接受赋形剂。
在一些实施方案中,药物组合物还包含蛋白质载体。
在一些实施方案中,蛋白质载体与OAc-HPGA缀合。
本公开的另一个目的是提供针对伤寒免疫受试者的方法,包括向有需要的受试者施用有效量的OAc-HPGA或其药学可接受盐。
在一些实施方案中,本公开还提供了通过向动物或人施用O-乙酰化多聚半乳糖醛酸(OAc-HPGA)来诱导针对伤寒沙门氏菌的保护性免疫应答的方法。例如,本公开提供了针对伤寒沙门氏菌和/或伤寒免疫受试者的方法,包括向有需要的受试者施用有效量的根据本公开的任何前述项的OAc-HPGA或其药学可接受盐或药物组合物。
在一些实施方案中,药物组合物的施用诱导抗体应答。
在一些实施方案中,药物组合物的施用在第二次免疫时诱导抗体滴度的2倍或更大的升高。
本公开的目的是提供OAc-HPGA或其药学可接受盐或药物组合物的用途,其用作具有与Vi多糖疫苗基本上相同的抗原性并且为免疫原性的合成的免疫原性Vi抗原。
本公开的另一个目的是提供OAc-HPGA或其药学可接受盐或药物组合物在制备用于针对伤寒的疫苗接种的药物中的用途。
本公开还提供了用任选地包含至少一种药学可接受赋形剂的用OAc-HPGA配制的伤寒疫苗。OAc-HPGA可以任选地与蛋白质载体缀合,以潜在地进一步增强其免疫原性。
可以将1kg OAc-HPGA以25-50μg/剂量有效地制备2000-4000万剂疫苗。它是基于植物的,并且因此不含内毒素(脂多糖,LPS),其是从革兰氏阴性细菌,如伤寒沙门氏菌纯化的疫苗中最危险的污染物。与现有的Vi多糖疫苗相比,OAc-HPGA可以是安全得多,不太昂贵和更有效的疫苗。经济优势还使得在全世界,特别是在发展中国家的流行地区扩大伤寒疫苗的生产和使用变得更容易且更负担得起。
附图说明
图1显示了Vi多糖,HPGA(例如)和OAc-HPGA(GelSite-OAcTM)的结构。显示了Vi多糖,HPGA和OAc-HPGA的碱性半乳糖醛酸(Gal UA)残基。
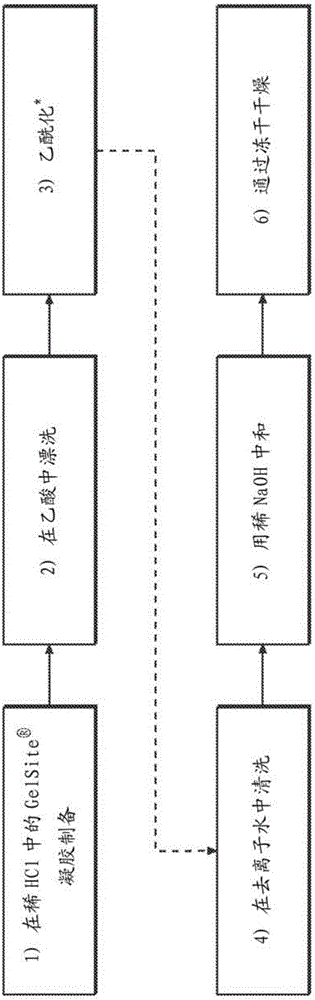
图2显示了用于生产OAc-HPGA(GelSite-OAcTM)的O-乙酰化方法。星号表示任选使用少量高氯酸作为催化剂。
图3显示了和GelSite-OAcTM与葡聚糖标准品一起的大小排阻层析谱。使用的葡聚糖标准品为1.597、214.8和39.9kDa。
图4显示了O-乙酰化多聚半乳糖醛酸(GelSite-OAcTM)的抗原性,如在免疫扩散测定中测试。每孔接受20μl多糖(200μg/ml)或参考血清(中心孔)。将琼脂糖板在湿室中保持过夜。如下充满孔:1)2)O-乙酰化聚半乳糖醛酸1x;3)O-乙酰化多聚半乳糖醛酸2x;4)O-乙酰化多聚半乳糖醛酸3x;和C)Vi多糖。
图5显示了DOAc对免疫应答GelSite-OAcTM的任何作用。以2.5μg/小鼠用具有不同DOAc的Vi疫苗或GelSite-OAcTM免疫Balb/c小鼠两次,间隔4周。使用Vi多糖(A)或GelSite-OAcTM(B)作为抗原测量特异性IgG。
图6显示了GelSite-OAcTM的任何剂量依赖性效应。用GelSite-OAcTM(DOAc,1.75)以不同的指示剂量免疫Balb/c小鼠两次,间隔6周。使用Vi多糖(A)或GelSite-OAc(B)作为抗原,通过ELISA测量特异性IgG。
图7显示了任何交叉反应性。来自不同研究组的合并血清样品与(A),GelSite-OAcTM(B)或Vi多糖(C)反应。
图8显示了交叉加强效应。使用Vi多糖(A)或GelSite-OAcTM(B)测量特异性IgG抗体。
图9显示了IgG亚类分布。通过ELISA测量不同亚类的特异性IgG抗体。通过终点确定(高于背景的2倍,≥0.2OD)滴度。用Vi多糖(A)或GelSite-OAc TM(B)作为抗原测量抗体。
图10显示了针对用活伤寒沙门氏菌进行的致死攻击的保护。以2.5μg/小鼠用具有不同DOAc的Vi疫苗或GelSite-OAcTM免疫Balb/c小鼠两次,间隔4周。在第二次免疫后第2周,用100LD 50的伤寒沙门氏菌攻击动物。A,%存活;B,平均体重。
图11显示了DOAc与GelSite-OAcTM的免疫原性的相关性。用具有不同DOAc的GelSite-OAcTM以2.5μg/小鼠免疫Balb/c小鼠(n=6)两次,间隔4周。使用Vi多糖(A)或GelSite-OAcTM(B)作为抗原测量在第一次和第二次免疫后第2周(w2)收集的单个血清样品中的特异性IgG。
图12显示了DOAc与GelSite-OAcTM的保护的相关性。用具有不同DOAc的GelSite-OAc TM以2.5μg/小鼠免疫Balb/c小鼠(n=6)两次,间隔4周。在第二次免疫后第3周用100LD 50的伤寒沙门氏菌攻击动物。A,%存活;B,平均体重。
发明详述
O-乙酰化方法基于Schweiger(1964)描述的方法。由于其高分子量,HPGA(例如)在低pH(约pH2.0)下形成凝胶,这消除了制备钙沉淀物的需要,其为由Schweiger,J.Org.Chem.29:2973–2975(1964)描述的方法的初始步骤。这允许以固体或珠形式的HPGA(例如)的乙酰化,所述固体或珠形式允许在乙酰化过程中容易处理和回收。在乙酰化反应结束时,通过将酸性pH增加至中性pH来溶解OAc-HPGA珠。由于方法的简单性和乙酰基的加入,乙酰化过程是高效的,产率>100%。
然而,乙酰化可以通过其它方法实现,包括由Carson and Maclay,J.Am.Chem.Soc.68:1015-1017(1946)描述的方法。
术语“O-乙酰化”或“O-乙酰化的”是指在糖残基的C2和C3位置处添加乙酰基。当每个糖残基的C2和C3位都被乙酰化时,达到最大的O-乙酰化程度(200%)。
所得的OAc-HPGA(例如GelSite-OAcTM)在C2或C3位置处具有至少130%或100%,或至少65%或50%的O-乙酰化程度(DOAc),和高分子量(>1.0x106Da),因此非常类似于天然Vi多糖(在C3处60-90%O-乙酰化和1-2x106Da)。通过延长反应时间,可以容易地将DOAc提高至≥175%。由于添加乙酰基,OAc-HPGA也具有增加的分子量。
目前获得许可的Vi疫苗的效力指标是O-乙酰基含量(≥2μmol O-乙酰基[在C3]/mg)和Vi多糖的分子量(50%的≥2.5x104Da的多糖)(WHO生物标准化专家委员会,1993年)。因此,OAc-HPGA容易满足并且超过当前Vi疫苗(>2.5μmol在C2或C3处O-乙酰基/mg和70%的≥1x106Da的多糖,表2和图3)的两种效力指标。
与HPGA(例如)不同,OAc-HPGA(例如,GelSite OAcTM)不再与钙形成凝胶。也不同于HPGA,OAc-HPGA可以直接溶解在盐水或缓冲盐水(150mM NaCl)中。这些结果指示O-乙酰化改变了HPGA的基本化学和功能性质,并且所得产物OAc-HPGA是新的化学实体。
如参考抗-V1多糖血清所示,OAc-HPGA是抗原性的(图4)。它具有与Vi多糖相同的抗原性。重要的是,没有获得与HPGA的反应,指示OAc-HPGA不与其未乙酰化的亲本分子交叉反应。
OAc-HPGA,例如GelSite-OAcTM,在小鼠中是免疫原性的(图5)。可以通过ELISA用Vi多糖或OAc-HPGA作为抗原检测特异性抗体。以前,发现乙酰化LM果胶在小鼠中不是免疫原性的,这归因于与天然Vi多糖相比其低分子量(4x105Da)。Szu et al.Infect.Immun.62:5545–5549(1994)。OAc-HPGA具有高得多的分子量(>1x106Da),其可能部分地造成其免疫原性。再次,未观察到与其亲本分子(HPGA)的交叉反应性,这指示由OAc-HPGA诱导的特异性抗体针对O乙酰基,Vi多肽的最关键的免疫原性决定子。
显著地,OAc-HPGA拥有加强效应或记忆免疫应答,在第二次免疫时显示出超过2倍的抗体滴度增加。对于并行测试的Vi疫苗(Typhim),没有观察到这种加强效应。已知多糖抗原是T非依赖性的,并且缺乏免疫记忆或加强效应。记忆或加强免疫应答仅用多糖抗原实现,所述多糖抗原通过将它们与蛋白质载体缀合得到。因此,OAc-HPGA在没有任何缀合的情况下自身拥有加强效应中是高度独特的,这可能是由于其新的化学性质。此外,不仅用GelSite-OAcTM,而且将Vi疫苗作为第二剂可诱导加强效应。这进一步证实了OAc-HPGA和Vi多糖之间的结构相似性。这种加强效应潜在地使其在不与蛋白质载体缀合的情况下在2岁龄以下的人中有效。
术语“加强效应”与“记忆免疫应答”可互换使用,是指在第二次免疫或再疫苗接种后,免疫应答增加约2倍。
OAc-HPGA在用致死剂量的活伤寒沙门氏菌攻击的动物中是完全保护的,指示由其诱导的免疫应答针对伤寒沙门氏菌是保护的。总之,这些发现指示,OAc-HPGA可以潜在被开发为新的伤寒Vi疫苗,与目前的Vi疫苗相比,在制造,成本,记忆反应和在不与蛋白质缀合的情况下在2岁以下的人中的潜在有效性方面具有明显的优势。OAc-HPGA可以使用来自植物来源的丰富的高质量HPGA通过简单化学方法大量生产。可以将每kg OAc-HPGA以每剂25-50μg多糖有效地制备2000-4000万剂疫苗。作为植物来源,OAc-HPGA不含有内毒素或LPS,其是革兰氏阴性细菌如伤寒沙门氏菌的细胞壁组分,并且是从这些细菌纯化的疫苗中最危险的污染物。因此,这种合成疫苗可以比目前的许可Vi疫苗更安全和不太昂贵。经济优势使得在全世界,特别是在发展中国家的流行地区扩大伤寒疫苗的生产和使用变得更容易和更负担得起。此外,OAc-HPGA可用于开发缀合疫苗,其可以甚至更有免疫原性并且对2岁龄以下儿童有保护作用。
实施例
实施例1:聚合物的O-乙酰化
评估用于的O-乙酰化的两种不同的方法:一种由Carson和Maclay(1946)描述,而另一种由Schweiger(1964)描述。这两种方法都能够将乙酰化。发现Schweiger方法更有效并且更好地适合的独特性质和用于获得O-乙酰化产物。Schweiger方法不使用甲酰胺或吡啶。取而代之,它使用少量的高氯酸作为催化剂。此外,通过Schweiger方法的整个过程在室温下进行。因此,选择Schweiger方法并修改用于的乙酰化。
方法。从Schweiger方法修改的方法包括6个简单的步骤(图2)。与原始的Schweiger方法相比,它通过的两种不同性质(酸凝胶化和其酸形式在水中的不溶性)大大简化。第一步是通过在稀释的HCl中然后在冰醋酸中漂洗将底物或从钠盐形式转化成其酸形式。的新性质之一是它在低pH下有效地凝胶化,形成可以耐受下游步骤的强酸凝胶珠或股(strand)。原始的Schweiger方法首先在酸洗步骤之前制备钙沉淀。因此,对于的O-乙酰化,这不是必需的,并且被消除。乙酰化后,在去离子水中洗涤凝胶珠或股,以在没有任何损失的情况下除去乙酰化试剂,因为酸形式的乙酰化的不溶于水。洗涤后,然后通过用NaOH中和来溶解乙酰化的所述中和将其从酸转化为钠盐。除了最后的干燥步骤外,整个过程可以在一天内完成。
使用的所有试剂均获自Sigma Chemical Co.(St.Louis,MO)。下面简要描述基于1克量级的基本过程。
将溶于水的溶液(200ml,5mg/ml;总共1克)滴入1升0.1M HCl中以产生凝胶珠。回收凝胶珠,并在100ml乙酸中洗涤三次,每次15分钟。将凝胶珠悬浮在200ml乙酸/乙酸酐(1:1)混合物中。在搅拌期间,在2小时内逐渐加入2ml高氯酸(70%),其中在0,30分钟,60分钟和90分钟以0.1ml部分加入0.5ml。然后用不锈钢过滤器在120分钟回收凝胶珠,并用水充分洗涤。将它们悬浮在300ml水中并通过用0.1M NaOH调节pH至约7溶解,然后用乙醇沉淀并在真空下干燥。
方法评价。该方法已经关于包括产率和DOAc的关键参数进行了评价。
1)产率。重量产率一致高于100%。此类高产率保证了有效的生产,并使原料和试剂的使用最大化。它与以下事实一致:加入乙酰基增加的分子量,并且该方法可以以最小的损失进行。酸凝胶珠粒的直径至少为2mm,并且在乙酰化过程中可以容易地回收。
2)O-乙酰化程度(DOAc)。DOAc是GelSite-OAcTM的关键参数。乙酰化过程是高效的,在仅一轮反应后产生>130%的DOAc。DOAc可以通过乙酰化反应的持续时间以及所使用的乙酸酐的浓度来控制。伴随反应时间的增加,同时保持添加高氯酸的相同的30分钟间隔,DOAc可以进一步增加。已经获得高达175%或7.5μmole/mg的DOAc。当C2和C3位点都完全被乙酰化时,最大DOAc为200%。另一方面,通过将乙酸酐的浓度降低至反应混合物的约10%,也可以获得较低的DOAc(例如80%),因此允许产生具有甚至更宽范围DOAc的GelSite-OAcTM,以用于评价。
3)分子量。乙酰化后,分子量一致增加(表2和图3)。这与向添加乙酰基一致,并且指示该方法不引起亲本分子的降解,因此确保保留最终产物GelSite-OAcTM的高分子量。
4)酸凝胶化。在稀释的HCl中形成强酸凝胶对于乙酰化过程的效率是重要的。观察到低分子量的商业PGA仅能形成软凝胶,其在下游过程期间崩解。因此,的高分子量对于方法效率至关重要。
5)高氯酸。通过加入少量高氯酸作为催化剂引发乙酰化。发现20%高氯酸与70%高氯酸一样有效。此外,在具有1克上文讨论的的反应混合物中,仅使用0.125ml的20%高氯酸可以容易地获得高DOAc(>100%)。此外,还发现当在相同量的高氯酸下使用时,溶于乙酸的1%高氯酸同样有效。70%高氯酸是强酸。因此,使用1%或20%的高氯酸使危险试剂的使用最小化,提高了方法安全性。
6)干燥。在该方法结束时,可以通过冷冻干燥容易地干燥GelSite-OAcTM,因此消除了乙醇沉淀的使用。
实施例2:乙酰化GelSite聚合物的表征
1.分子量
使用具有葡聚糖标准品的HPLC SEC(大小排阻层析)来测定GelSite-OAcTM的分子量。现在通常使用更先进的HPLC-MALLS(多角度激光散射)方法测定聚合物如多糖的分子量。然而,采用这种具有葡聚糖标准品的HPLC SEC,因为其在公开的文献中最广泛用于研究Vi多糖,并且用于Vi疫苗效力测量,因此允许结果与先前报道的那些直接可比。简言之,串联使用Shodex OH pak SB-806HQ(300x8mm),Shodex OHpak SB-805HQ(300x8mm)和Shodex OHpak SB-804HQ(300x8mm)柱,用0.1M乙酸铵和200ppm叠氮化钠作为流动相,流速为0.5ml/min。与葡聚糖标准品(Phenomenex broad MWD,8种标准品,10-200kDa)相比,报道了峰顶点的分子量值(图3)。在所有检验的批次中,发现GelSite-OAcTM的分子量与起始的分子量相同或更高(>2x106Da)(表2)。这与通过加入乙酰基增加分子量一致。
2.O-乙酰化程度(DOAc)
使用由Hestrin,J.Biol.Chem.180:249-261(1949)描述的方法,其中进行了修改。所有试剂均获自Sigma Chemical Co(St.Louis,MO),包括乙酰胆碱,盐酸羟胺和氯化铁。在96孔板中进行测定法。以约0.2mg/ml(w/v)一式两份测试样品。使用乙酰胆碱作为标准品。DOAc表示为乙酰基与Gal UA残基的摩尔比或百分比,或μmole/mg-用于当前Vi疫苗的DOAc规格的单位。Gal UA含量基于产品释放测试结果。
基于上述初始方法条件,获得具有134%-153%的DOAc的GelSite-OAcTM,其对应于在C2或C3位置处的67%-76%(表2)。DOAc也可以基于μmole/mg表示(表2)。通过将乙酰化反应时间延长,可以进一步提高DOAc至高达175%或在C2或C3位置处的87.5%,接近理论最大值200%,。另一方面,通过调节反应条件或降低反应混合物中乙酸酐的浓度,也可以获得较低的DOAc如80%(实施例5)。
3.钙凝胶化
通过将和GelSite-OAcTM溶液与钙溶液混合来测定和GelSite-OAcTM在钙存在下凝胶化的能力。因此,将约0.2%(w/v)样品溶液(2-3ml)与0.5-1ml的1%氯化钙溶液直接混合。溶液立即形成凝胶,而用GelSite-OAcTM没有发生凝胶形成。通过整个样品溶液变成凝胶并且其不再能够自由流动来指示凝胶形成。GelSite-OAcTM溶液在与氯化钙混合后保持为自由流动的溶液。
此外,与不同,GelSite-OAcTM可以直接溶解于盐水或缓冲盐水(150mM NaCl)中。这些结果指示O-乙酰化改变了的基本化学和功能性质,并且所得产物GelSite-OAcTM是新的化学实体。
4.抗原性
如Szu et al.Infect.Immun.62:5545–5549(1994)所述,在1%琼脂糖中进行免疫扩散测定。来自弗氏柠檬酸杆菌(Citrobacter freundii)的参考Vi多糖抗原和针对伤寒沙门氏菌的参考驴血清获自National Institute of Child Health and Human Development(NICHD)。GelSite-OAcTM与参考血清形成阳性沉淀线(图4)。沉淀线的强度随着DOAc的增加而增加,如用Carson和Maclay方法在1、2和3轮乙酰化后获得的样品所示(图4)。GelSite-OAcTM与Vi多糖共享相同或基本上相同的抗原性,如通过来自GelSite-OAcTM和Vi多糖的沉淀线的合并所证明的;没有观察到与未乙酰化的的反应(图4)。如本文所用,术语“与Vi多糖的相同或基本相同的抗原性”是指GelSite-OAcTM与抗-V1多糖血清或抗体反应。例如,如图4中看到和上面讨论,在Szu等人的免疫扩散测定法中,GelSite-OAcTM与参考血清形成阳性沉淀线,其与Vi多糖的免疫扩散测定沉淀线合并。
5.与Vi多糖和疫苗的比较
GelSite-OAcTM在C2或C3位置处具有>130%(5.58μm/mg)或>65%(2.79μm/mg)的O-乙酰化程度(在这两个O-乙酰化位点之间均匀分布的假设下),和>1x106Da的分子量(表2)。天然Vi多糖具有1-2x106Da的分子量和C3位60-90%的O-乙酰化程度(Szu和Bystricky,2003)。因此,基于DOAc和分子量(免疫原性的两个关键决定因素),GelSite-OAcTM非常类似于Vi多糖。
目前的许可Vi疫苗的效力指标是Vi多糖的O-乙酰化含量(≥2μmole/mg[在C3])和分子量(多糖的50%≥2.5x104Da)(WHO生物标准化专家委员会,1993;Keitel等,1994)。凭借在C2或C3位置处容易具有>2.5μmol/mg(>65%)的DOAc和≥1x106Da的分子量(对于≥70%多糖)(表2和图3),GelSite-OAcTM超过两种效力规格。
实施例3:O-乙酰化(GelSite-OAcTM)的免疫原性
与许可的Vi疫苗(TyphimSanofi-Pasteur)相比,在Balb/c小鼠中检查GelSite-OAcTM的免疫原性。通过在右后肢肌内注射,以指定的剂量用50μl PBS中的GelSite-OAcTM或Typhim Vi疫苗免疫小鼠组(n=10)。将动物免疫2次,间隔4周,并且每两周收集血清样品。
如前所述,在96孔板中通过ELISA测量特异性抗体。Szu et al.,Enzymol.363:552-567(2003)。来自NICHD和国际疫苗研究所(IVI)的Vi多糖被用作包被ELISA板的抗原,两者都是伤寒研究中的公知机构。参考血清是从NICDH获得的40个ELISA单位/ml的超免疫小鼠血清。使用CDC ELISA程序(http://www.cdc.gov/ncidod/dbmd/bimb/elisa.htm)确定抗体滴度,其中参照血清作为标准品。
1.DOAc和抗原剂量的影响
DOAc的影响:测试具有不同DOAc(136%,155%,或175%摩尔/摩尔,或5.6、6.5或7.5μmole/mg)的三个GelSite-OAcTM样品。结果显示,发现特异性IgG应答的水平与DOAc相关:DOAc越高,免疫应答越高(图5)。这在第一次免疫后尤其如此,无论是使用Vi抗原(图5A)还是合成抗原GelSite-OAcTM(图5B)测量特异性IgG。具有最低DOAc(136%)的GelSite-OAcTM在大多数时间点时一致产生最低滴度。具有155%或175%DOAc的GelSite-OAcTM样品表现出非常相似的反应水平,提示具有155%或175%DOAc的GelSite-OAcTM可同样有效。通过用低至80%的DOAc评价GelSite-OAcTM,进一步证明在免疫应答上的这种DOAc依赖性影响(实施例5)。
抗原剂量的影响:还使用具有175%DOAc的GelSite-OAcTM,在四种不同剂量水平(1、2.5、5和10μg)下测试GelSite-OAcTM抗原剂量的影响。用Vi或GelSite-OAcTM测量的抗体应答是抗原剂量依赖性的,特别是在第二次免疫后(图6)。
与Vi疫苗的比较:与Vi疫苗相比,具有155%或175%DOAc的GelSite-OAcTM一致地诱导相当或更高的抗体滴度,除了第一次免疫之后和当用Vi抗原测量时的时间点外(图5和图6)。当用GelSite-OAcTM抗原测量时,由GelSite-OAcTM诱导的特异性抗体滴度比由Vi疫苗诱导的特异性抗体滴度高多达10倍。这可能是由于在GelSite-OAcTM的情况下存在更高的DOAc或更多的乙酰基。总之,这些结果指示当与Vi疫苗相比时,GelSite-OAcTM是高度免疫原性的。
2.交叉反应性
由GelSite-OAcTM诱导的抗体的特异性通过与其亲本分子反应与Vi多糖和GelSite-OAcTM相比较评估。在第二次免疫后第8周收集的合并血清样品进行的抗原剂量依赖性实验(图6)的结果显示在图7中。以1:40的低起始稀释度测试血清样品,并且测试中也包括从NICDH获得的参考血清(以1:2000起始稀释度)。在GelSite-OAcTM的任何剂量水平下都没有观察到与的反应(图7A),而针对GelSite-OAcTM获得高饱和水平的反应(图7B)。这些结果与通过上述免疫扩散试验获得的结果一致。它们指示,针对GelSite-OAcTM产生的反应针对GelSite-OAcTM上的O-乙酰基基团。这已通过使用具有不同DOAc(134%-175%)的GelSite-OAc TM作为的抗原的ELISA中进一步证实,其显示抗体应答水平与DOAc相关。
3.加强效应
在进行的所有动物实验中,在第二次免疫时,用GelSite-OAcTM一致地观察到独特的加强效应或记忆免疫应答。如图5和6所示,与第一次免疫后的最高滴度相比,针对Vi或GelSite-OAcTM抗原测量的所有三个GelSite-OAcTM组的滴度在第二次免疫后增加至少2倍且高达>4倍,并且变得比Vi疫苗的那些高得多。用Vi疫苗没有观察到此类加强效应。用具有宽范围的DOAc的GelSite-OAcTM进行的进一步评价显示,在低至100%的DOAc可以获得增强效果和完全保护(实施例5)。
为了进一步证实这种新的加强效应,进行交叉加强实验,其中首先用一种抗原免疫动物,然后用相同或不同的抗原进行两次加强免疫(图8)。结果显示,用GelSite-OAcTM引发的所有动物在用GelSite-OAcTM或Vi疫苗进行第二次免疫时显示出加强效应(图8)。当用Vi多糖测量时,用Vi疫苗获得的加强水平高于用GelSite-OAcTM获得的加强水平(图8A)。这可以反映基于O-乙酰基的加强和诱导针对Vi多糖的其他部分的抗体的累加效应。
仅用Vi疫苗引发和加强的动物没有显示加强效应。用Vi疫苗引发并用GelSite-OAcTM加强的那些确实显示出加强效应,虽然程度较小,并且只有当测量到针对GelSite-OAcTM的抗体时才可检测到(图8B)。在第三次免疫时没有观察到进一步的加强效应。这些结果一起显示,可以发生与Vi多糖的交叉加强,特别是当GelSite-OAcTM用于引发免疫时,因此进一步证实GelSite-OAcTM的新加强效应及其与Vi多糖的结构相似性。
4.IgG亚类
GelSite-OAcTM的独特加强效应提示其可能是T依赖性抗原。T-依赖性免疫应答的特征之一是在多糖缀合物疫苗的情况下在加强免疫后或与纯多糖抗原相比的亚类改变或转换。因此,将在第一次和第二次免疫后第2周收集的合并血清样品用于通过ELISA检查IgG亚类(IgG1,IgG2a,IgG2b,IgG3)和IgM的分布。注射GelSite-OAcTM的动物在一次或两次免疫后展现高水平的IgG1(图9)。第二次免疫后,所有IgG的滴度增加≥2倍。在第二次免疫之后,观察到IgG1,IgG2a和IgG2b的滴度的更大的增加,其中IgG2a展现出最高幅度滴度增加(图9)。此IgG亚类谱提示,aTh2-偏好的T细胞活化可以参与针对GelSite-OAcTM的应答。反应类似于用Vi-缀合物疫苗(An等人,2012)和肺炎链球菌(Streptococcus pneumonia)多糖缀合物疫苗(Safari等人,2011)获得的反应。与GelSite-OAcTM不同,Vi疫苗在第二次免疫后展现对于所有IgG亚类相同或降低的滴度,除了IgG2a(其显示2倍的增加)外。用任一种疫苗均未观察到IgM水平的明显变化。
实施例4:O-乙酰化聚合物的保护效果
如先前所述(Park等人,2002),在用活的伤寒沙门氏菌进行的攻击实验中评价由GelSite-OAcTM诱导的特异性免疫应答的保护作用。通过肌内注射两次,以2.5μg/小鼠用具有不同DOAc(136%或155%)的GelSite-OAcTM或Vi疫苗免疫15只6至8周龄雌性Balb/c小鼠的组,相隔四周。对照组接受缓冲溶液。在第二次免疫后第2周,用0.5ml 5%猪胃粘蛋白中的100LD50(1,000CPU/小鼠)细菌对来自每组的10只小鼠腹膜内攻击。所用的细菌是肠炎沙门氏菌亚种(Salmonella enterica subsp)。Enterica serovar typhi(伤寒沙门氏菌)获自ATCC(产品编号19430)。
结果显示所有免疫的动物都受到保护,包括两个GelSite-OAcTM组和Vi疫苗组(图10)。所有未免疫的对照小鼠在三天内死亡。受保护组之间没有差异(图10),指示GelSite-OAcTM与Vi疫苗一样是保护性的。此外,具有136%或155%的DOAc的两个GelSite-OAcTM基团在保护方面没有显示出差异,指示具有136%DOAc的GelSite-OAcTM可以也同样是保护性的。所有受保护的小鼠在攻击后第1-3天经历轻微的体重的短暂减轻(<10%),但后来恢复至正常水平(图10B)。还如上所述,用Vi或GelSite-OAcTM抗原测量特异性抗体,并且得到与图5所示的结果相似的结果。
实施例5:DOAc与免疫原性和保护的进一步相关性
DOAc是GelSite-OAcTM的关键规格。因此,重要的是进一步证明DOAc和保护之间的相关性。因此,产生一系列具有较宽范围的DOAc(80%-153%)的另外的GelSite-OAcTM样品,并在小鼠中筛选免疫原性和保护。结果显示,抗体滴度和保护水平与DOAc呈直接相关增加(图11和12)。具有0%DOAc的未乙酰化的不诱导针对Vi多糖或GelSite-OAcTM的任何可检测的抗体,也未提供任何保护,进一步指示由GelSite-OAcTM诱导的抗体针对O-乙酰基。重要的是,具有80%DOAc的GelSite-OAcTM在第二次免疫后展现出最低的抗体滴度且没有加强效应,并且仅提供部分保护,而具有较高DOAc(≥100%)的其他GelSite-OAcTM产生高得多的抗体滴度(>10倍),具有加强效果,并提供全面保护。另一方面,即使用低抗体滴度(在第二次免疫后针对Vi 0.239U/ml;图11A),具有80%DOAc的GelSite-OAcTM仍提供83%的保护(图12A),提示了由GelSite-OAcTM诱导的抗体是高度保护性的。总之,这些结果提示了具有100%或更高的DOAc的GelSite-OAcTM可以是完全保护性的,并具有加强效应,因此形成用于建立疫苗的DOAc规格的坚实基础。
考虑本文所公开的说明书和实践,本公开的其它实施方案对于本领域技术人员将是显而易见的。意图是说明书和实施例仅被认为是示例性的,本公开的真实范围和精神由所附权利要求书指示。
- 还没有人留言评论。精彩留言会获得点赞!