多特异性抗体构建体的制作方法
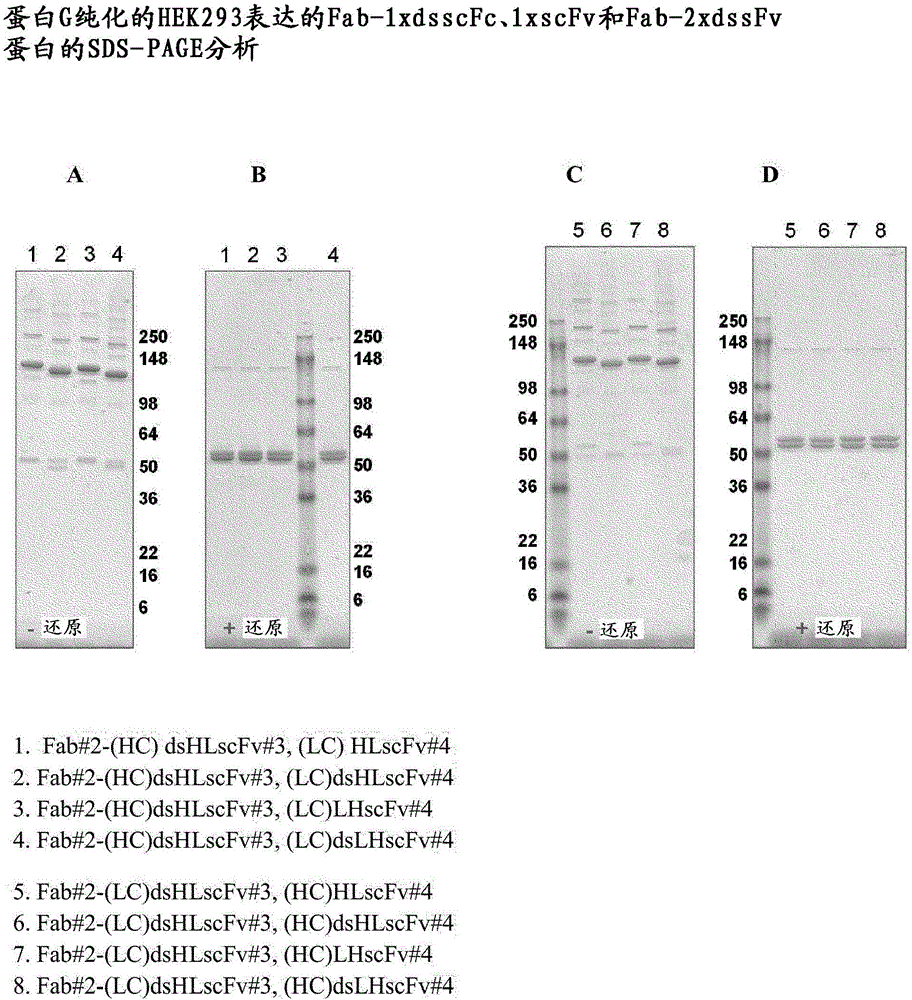
有许多用于产生双特异性抗体的方法,其中许多基于Morrison等最初描述的形式(Coloma和Morrison1997,NatBiotechnol.15,159-163),涉及单链可变片段(scFv)与全抗体例如IgG或与抗体Fab片段的融合,Schoonjans等,2000,JournalofImmunology,165,7050-7057。在Fab-scFv的情况下,用于此类双特异性和三特异性分子的scFv的VH和VL结构域通常通过肽接头保持在一起。然而,对于VH和VL可变结构域的某些组合,肽接头不能赋予scFv足够的稳定性,从而导致可变结构域“呼吸”和混杂的与可变结构域的分子间配对,和从而通过其单链Fv部分形成多聚体的趋势。这在图1中在双特异性分子的上下文中进行了举例说明。本发明人已重新工程化所关注的多特异性抗体分子,以提供具有等同功能性的抗体分子,同时在表达阶段和/或纯化后使多聚化降至最低。这有助于增加获得的“单体”材料的产率,并提供在纯化、浓缩和配制后用于治疗的具有合适稳定性的分子。因此,一方面,提供了多特异性抗体分子,其包含以下部分或由其组成:a)式(I)的多肽链:VH-CH1-X-V1;和b)式(II)的多肽链:VL-CL-Y-V2;其中:VH表示重链可变结构域;CH1表示重链恒定区的结构域,例如其结构域1;X表示键或接头;Y表示键或接头;V1表示dsFv、sdAb、scFv或dsscFv;VL表示轻链可变结构域;CL表示来自轻链恒定区的结构域,例如Cκ;V2表示dsFv、sdAb、scFv或dsscFv;其中V1或V2中的至少一个是dsFv或dsscFv。有利地,本公开内容的多特异性抗体分子使纯化后可见的聚集的量最小化,并使在药物浓度下构建体的制剂中的单体的量最大化,包括在储存时随时间推移保持高单体水平,例如单体可以以总蛋白质的50%、60%、70%或75%或更多,诸如80%或90%或更多,诸如91%、92%、93%、94%、95%、96%、97%、98%、或99%存在。发明详述如本文所用的“多特异性抗体”是指如本文所述的抗体分子,其具有两个或更多个结合结构域,例如两个或三个结合结构域。在一个实施方案中,抗体构建体是三特异性抗体。本文使用的“三特异性抗体”是指具有三个抗原结合部位的抗体分子,其可以独立地结合相同或不同的抗原。在一个实例中,三特异性抗体分子结合两种不同的抗原,即两个结合位点结合相同的抗原,第三结合位点结合第二种不同的抗原。优选地,本发明的特异性抗体分子的三个结合位点独立地结合三种不同的抗原。在一个实施方案中,构建体是双特异性抗体。本文使用的“双特异性分子”是指具有两个抗原结合部位的分子,其可以结合相同或不同的抗原。在一个实施方案中,所有结构域都结合相同的抗原,包括结合抗原上的相同表位或结合抗原上的不同表位。在一个实施方案中,存在三个结合结构域,并且三个结合结构域中的每一个结合不同(独特)的抗原。在一个实施方案中,存在三个结合结构域,并且两个结合结构域结合相同抗原,包括结合相同抗原上的相同表位或不同表位,并且第三结合结构域结合不同(独特)抗原。本文使用的“抗原结合部位”是指分子的一部分,其包含一对可变区,特别是与靶抗原特异性相互作用的同源对。本文使用的结合结构域包括单结构域抗体,即可变区和抗原结合部位。本文所用的“特异性地”是指仅识别其所特异于的抗原的结合部位或结合结构域,或相较于对其所非特异于的抗原的亲和力具有显著更高的对其所特异于的抗原的结合亲和力(例如5倍、6倍、7倍、8倍、9倍、10倍的结合亲和力)的结合部位或结合结构域。结合亲和力可通过标准测定法例如表面等离子体共振(诸如BIAcore)来测量。在一个实施方案中,根据本公开内容的多特异性抗体分子作为分别地式(I)和(II)的重链和轻链的二聚体提供,其中VH-CH1部分与VL-CL部分一起形成功能性Fab或Fab'片段。VH表示可变结构域,例如重链可变结构域。在一个实施方案中,VH表示重链可变结构域。在一个实施方案中,VH是嵌合可变结构域,也就是说其包含源自至少两个物种的组分,例如人构架和非人CDR。在一个实施方案中,VH是人源化的。在一个实施方案中,VH是人的。VL表示可变结构域,例如轻链可变结构域。在一个实施方案中,VL表示轻链可变结构域。在一个实施方案中,VL是嵌合可变结构域,也就是说,其包含源自至少两个物种的组分,例如人构架和非人CDR。在一个实施方案中,VL是人源化的。在一个实施方案中,VH是人源化的。在一个实施方案中,VH是人的。通常VH和VL一起形成抗原结合结构域。在一个实施方案中,VH和VL形成同源对。本文使用的“同源对”是指来自单个抗体的一对可变结构域,其是在体内产生的,即从宿主分离的可变结构域的天然存在的配对。因此,同源对是VH和VL对。在一个实例中,同源对与抗原协同地结合。本文使用的“可变区”是指包含CDR和构架(特别是合适的构架)的抗体链中的区域。用于本公开内容的可变区通常衍生自抗体,其可通过本领域已知的任何方法产生。如本文所用的“衍生自”是指使用的序列或与所用序列高度相似的序列获自原始遗传物质,例如抗体的轻链或重链。本文所用的“高度相似”意指在其全长上为95%相似或更多、诸如96%、97%、98%或99%相似的氨基酸序列。用于本发明的可变区,如上文针对VH和VL所述的,可来自任何合适的来源,并且可以是例如完全人的或人源化的。在一个实施方案中,由VH和VL形成的结合结构域对第一抗原是特异性的。在一个实施方案中,由V1形成的结合结构域对第二抗原是特异性的。在一个实施方案中,由V2形成的结合结构域对第二或第三抗原是特异性的。在一个实施方案中,CH1结构域是来自抗体重链或其衍生物的天然存在的结构域1。在一个实施方案中,轻链中的CL片段是恒定κ序列或恒定λ序列或其衍生物。本文所用的天然存在的结构域的衍生物旨在指其中天然存在的序列中的1、2、3、4或5个氨基酸已经被替换或删除,例如以优化结构域的性质,诸如通过消除不期望的性质但其中保留了结构域的表征性特征。在一个实施方案中,在功能性Fab或Fab'片段中存在一个或多个天然或工程化的链间(即轻链和重链之间)二硫键。在一个实施方案中,“天然”二硫键存在于式(I)和(II)的多肽链中的CH1和CL之间。当CL结构域衍生自κ或λ时,形成键的半胱氨酸的天然位置在人cκ和cλ中为第214位(Kabat编号第4版1987)。CH1中形成二硫键的半胱氨酸的确切位置取决于实际使用的特定结构域。因此,例如在人γ-1中,二硫键的天然位置位于位置233(Kabat编号第4版1987)。已知其它人同种型诸如γ2、3、4、IgM和IgD的形成键的半胱氨酸的位置,例如人IgM、IgE、IgG2、IgG3、IgG4的位置127以及人IgD和IgA2B的重链的位置128。任选地,在式I和II的多肽的VH与VL之间可以存在二硫键。在一个实施方案中,根据本公开内容的多特异性抗体在等同于或对应于天然存在于CH1与CL之间的二硫键的位置处具有二硫键。在一个实施方案中,包含CH1和恒定区诸如CL的恒定区具有处于非天然存在位置的二硫键。这可通过在所需的一个或多个位置处将半胱氨酸引入氨基酸链中来工程化至分子中。该非天然二硫键是CH1与CL之间存在的天然二硫键的补充或替代。天然位置中的半胱氨酸可被不能形成二硫桥的氨基酸诸如丝氨酸替代。工程化的半胱氨酸的引入可以使用本领域已知的任何方法进行。这些方法包括但不限于PCR延伸重叠诱变、定点诱变或盒式诱变(一般参见,Sambrook等,MolecularCloning,ALaboratoryManual,ColdSpringHarbourLaboratoryPress,ColdSpringHarbour,NY,1989;Ausbel等,CurrentProtocolsinMolecularBiology,GreenePublishing&Wiley-Interscience,NY,1993)。定点诱变试剂盒是商购可得的,例如。Site-DirectedMutagenesis试剂盒(Stratagene,LaJolla,CA)。盒式诱变可基于Wells等,1985,Gene,34:315-323进行。或者,突变体可以通过退火、连接和PCR扩增以及重叠寡核苷酸的克隆由全基因合成来制备。在一个实施方案中,CH1和CL之间的二硫键完全不存在,例如链间半胱氨酸可被另一种氨基酸诸如丝氨酸替代。因此,在一个实施方案中,在分子的功能性Fab片段中没有链间二硫键。诸如WO2005/003170的公开内容(通过引用并入本文)描述了如何提供没有链间二硫键的Fab片段。V1表示dsFv、sdAb、scFv或dsscFv,例如dsFv、scFv或dsscFv。V2表示dsFv、sdAb、scFv或dsscFv,例如dsFv,scFv或dsscFv。在一个实施方案中,V1和V2均为dsscFv。在一个实施方案中,V1和V2均为dsFv。当V1和V2均为dsFv时,VH或VL可变结构域对于V1和V2是相同的。在一个实施方案中,V1和V2具有相同的VH可变结构域。在另一个实施方案中,V1和V2具有相同的VL可变结构域。在一个实施方案中,VH和VL可变结构域对于V1和V2是相同的。后者允许交联,这对于一些目标可能是期望的。在一个实施方案中,V1是dsFv,并且V2是scFv。在一个实施方案中,V1是scFv,并且V2是dsFv。在一个实施方案中,V1是dsscFv,V2是dsFv。在一个实施方案中,V1是dsFv,V2是dsscFv。在一个实施方案中,V1是dsscFv,V2是scFv。在一个实施方案中,V1是scFv,V2是dsscFv。在一个实施方案中,V1不是scFv。在一个实施方案中,V2不是scFv。在一个实施方案中,V1和V2均非scFv。因此,一方面,提供了多特异性抗体分子,其包含以下部分或由其组成:a)式(I)的多肽链VH-CH1-X-V1;和b)式(II)的多肽链:VL-CL-Y-V2;其中:VH表示重链可变结构域;CH1表示重链恒定区的结构域,例如其结构域1;X表示键或接头;Y表示键或接头;V1表示dsFv或dsscFv;VL表示轻链可变结构域;CL表示来自恒定区的结构域,例如轻链恒定区结构域,诸如Cκ;V2表示dsFv或dsscFv;本文所用的“单链可变片段”或“scFv”是指包含重链可变结构域(VH)和轻链可变结构域(VL)或由其组成的单链可变片段,其通过VH与VL可变结构域之间的肽接头来稳定。VH和VL可变结构域可处于任何合适的取向,例如VH的C末端可以连接至VL的N末端,或者VL的C末端可以连接至VH的N末端。本文使用的“二硫键稳定的单链可变片段”或“dsscFv”是指通过VH与VL可变结构域之间的肽接头稳定并且还包括VH与VL之间的结构域间二硫键的单链可变片段。本文使用的“二硫键稳定的可变片段”或“dsFv”是指在VH与VL可变结构域之间不包括肽接头而是通过VH与VL之间的结构域间二硫键来稳定的单链可变片段。本文所用的“单结构域抗体”或“sdAb”是指由单个单体可变抗体结构域(诸如VH或VL或VHH)组成的抗体片段。在一个实施方案中,当V1和/或V2是dsFv或dsscFv时,V1和/或V2的可变结构域VH与VL之间的二硫键在下面列出的两个残基之间(除非上下文另有说明,否则Kabat编号用于下面的列表)。当提及Kabat编号时,相关参考文献是Kabat等,1987,SequencesofProteinsofImmunologicalInterest,USDepartmentofHealthandHumanServices,NIH,USA。在一个实施方案中,二硫键在选自包括以下的组的位置中:●VH37+VL95C,参见例如ProteinScience6,781-788Zhu等人(1997);●VH44+VL100,参见例如;Biochemistry335451-5459Reiter等(1994);或JournalofBiologicalChemistry第26卷No.28pp.18327-18331Reiter等(1994);或ProteinEngineering,第10卷no.12pp.1453-1459;Rajagopal等(1997);●VH44+VL105,参见例如JBiochem.118,825-831Luo等(1995);●VH45+VL87参见例如ProteinScience6,781-788Zhu等(1997);●VH55+VL101参见例如FEBSLetters377135-139Young等(1995);●VH100+VL50参见例如Biochemistry291362-1367Glockshuber等(1990);●VH100b+VL49;●VH98+VL46参见例如ProteinScience6,781-788Zhu等(1997);●VH101+VL46;●VH105+VL43参见例如;Proc.Natl.Acad.Sci.USA第90卷pp.7538-7542Brinkmann等(1993);或Proteins19,35-47Jung等(1994),●VH106+VL57参见例如FEBSLetters377135-139Young等(1995)以及位于分子中的可变区对中与其对应的位置。在一个实施方案中,二硫键在位置VH44与VL100之间形成。上面列出的氨基酸对位于有利于被半胱氨酸取代的位置,以使得可以形成二硫键。半胱氨酸可通过已知技术工程化至这些期望的位置中。因此,在一个实施方案中,根据本公开内容的工程化的半胱氨酸是指其中给定氨基酸位置处的天然存在的残基已被半胱氨酸残基替代的位置。工程化的半胱氨酸的引入可使用本领域已知的任何方法进行。这些方法包括但不限于PCR延伸重叠诱变、定点诱变或盒式诱变(一般参见Sambrook等,MolecularCloning,ALaboratoryManual,ColdSpringHarbourLaboratoryPress,ColdSpringHarbour,NY,1989;Ausbel等,CurrentProtocolsinMolecularBiology,GreenePublishing&Wiley-Interscience,NY,1993)。定点诱变试剂盒是商购可得的,例如。Site-DirectedMutagenesis试剂盒(Stratagen,LaJolla,CA)。盒式诱变可以基于Wells等,1985,Gene,34:315-323进行。或者,突变体可通过退火、连接和PCR扩增以及重叠寡核苷酸的克隆由全基因合成来制备。因此,在一个实施方案中,当V1和/或V2是dsFv或dsscFv时,V1的可变结构域VH和VL和/或V2的可变结构域VH和VL可通过两个半胱氨酸残基之间的二硫键连接,其中半胱氨酸残基对的位置选自:VH37和VL95、VH44和VL100、VH44和VL105、VH45和VL87、VH100和VL50、VH100b和VL49、VH98和VL46、VH101和VL46、VH105和VL43以及VH106和VL57。在一个实施方案中,当V1和/或V2是dsFv或dsscFv时,V1的可变结构域VH和VL和/或V2的可变结构域VH和VL可通过两个半胱氨酸残基(一个在VH中并且一个在VL中)之间的二硫键连接,所述半胱氨酸残基在CDR之外,其中半胱氨酸残基对的位置选自VH37和VL95、VH44和VL100、VH44和VL105、VH45和VL87、VH100和VL50、VH98和VL46、VH105和VL43以及VH106和VL57。在一个实施方案中,当V1是dsFv或dsscFv时,V1的可变结构域VH和VL通过两个工程化的半胱氨酸残基(一个在位置VH44上,另一个在VL100上)之间的二硫键连接。在一个实施方案中,当V2是dsFv或dsscFv时,V2的可变结构域VH和VL通过两个工程化的半胱氨酸残基(一个在位置VH44上,另一个在VL100上)之间的二硫键连接。在一个实施方案中,当V1是dsFv、dsscFv或scFv时,V1的VH结构域连接至X。在一个实施方案中,当V1是dsFv、dsscFv或scFv时,V1的VL结构域连接至X。在一个实施方案中,当V2是dsFv、dsscFv或scFv时,V2的VH结构域连接至Y。在一个实施方案中,当V2是dsFv、dsscFv或scFv时,V2的VL结构域连接至Y。本领域技术人员将理解,当V1和/或V2表示dsFv时,多特异性抗体将包含编码不连接于X或Y的相应的游离VH或VL结构域的第三多肽。当V1和V2均为dsFv时,则“游离可变结构域”(即通过二硫键与多肽的其余部分连接的结构域)将是两条链共有的。因此,虽然通过X或Y融合或连接至多肽的实际可变结构域在每条多肽链中可以是不同的,但与其配对的游离可变结构域通常将彼此相同。在一个实施方案中,X是键。在一个实施方案中,Y是键。在一个实施方案中,X和Y均为键。在一个实施方案中,X是接头,优选肽接头,例如用于连接CH1和V1部分的合适的肽。在一个实施方案中,Y是接头,优选肽接头,例如用于连接CL和V2部分的合适的肽。在一个实施方案中,X和Y均为接头。在一个实施方案中,X和Y均为肽接头。本文所用的术语“肽接头”是指包含氨基酸的肽。一系列合适的肽接头将是本领域技术人员已知的。在一个实施方案中,肽接头的长度为50个氨基酸或更少,例如20个氨基酸或更少,诸如约15个氨基酸或更少,诸如长度为9个、10个、11个、12个、13个或14个氨基酸。在一个实施方案中,接头选自序列1至67中所示的序列。在一个实施方案中,接头选自SEQIDNO:1或SEQIDNO:2所示的序列。在一个实施方案中,X具有序列SGGGGTGGGGS(SEQIDNO:1)。在一个实施方案中,Y具有序列SGGGGTGGGGS(SEQIDNO:1)。在一个实施方案中,X具有序列SGGGGSGGGGS(SEQIDNO:2)。在一个实施方案中,Y具有序列SGGGGSGGGGS(SEQIDNO:2)。在一个实施方案中,X具有SEQIDNO:1中给出的序列,Y具有SEQIDNO:2中给出的序列。在一个实施方案中,X具有SEQIDNO:69或70中给出的序列。在一个实施方案中,Y具有SEQIDNO:69或70中给出的序列。在一个实施方案中,X具有SEQIDNO:69中给出的序列并且Y具有SEQIDNO:70中给出的序列。表1:铰链接头序列SEQIDNO:序列3DKTHTCAA4DKTHTCPPCPA5DKTHTCPPCPATCPPCPA6DKTHTCPPCPATCPPCPATCPPCPA7DKTHTCPPCPAGKPTLYNSLVMSDTAGTCY8DKTHTCPPCPAGKPTHVNVSVVMAEVDGTCY9DKTHTCCVECPPCPA10DKTHTCPRCPEPKSCDTPPPCPRCPA11DKTHTCPSCPA表2.柔性接头序列(S)在序列14至18中是任选的。刚性接头的实例包括肽序列GAPAPAAPAPA(SEQIDNO:52)、PPPP(SEQIDNO:53)和PPP。在一个实施方案中,肽接头是白蛋白结合肽。白蛋白结合肽的实例在WO2007/106120中提供并且包括:表3有利地,使用白蛋白结合肽作为接头可以延长多特异性抗体分子的半衰期。在一个实施方案中,当V1是scFv或dsscFv时,存在接头,例如用于连接V1的可变结构域VH与VL的合适的肽。在一个实施方案中,当V2是scFv或dsscFv时,存在接头,例如用于连接V2的可变结构域VH和VL的合适的肽。在一个实施方案中,scFv或dsscFv中的肽接头的长度在约12至25个氨基酸的范围内,诸如15至20个氨基酸。在一个实施方案中,当V1是scFv或dsscFv时,连接V1的可变结构域VH与VL的接头具有序列GGGGSGGGGSGGGGSGGGGS(SEQIDNO:68)。在一个实施方案中,当V2是scFv或dsscFv时,连接V2的可变结构域VH与VL的接头具有序列GGGGSGGGGSGGGGSGGGGS(SEQIDNO:68)。在一个实施方案中,当V1是scFv或dsscFv时,连接V1的可变结构域VH与VL的接头具有序列SGGGGSGGGGSGGGGS(SEQIDNO:69)。在一个实施方案中,当V2是scFv或dsscFv时,连接V2的可变结构域VH与VL的接头具有序列SGGGGSGGGGSGGGGS(SEQIDNO:69)在一个实施方案中,当V1是scFv或dsscFv时,连接V1的可变结构域VH与VL的接头具有序列SGGGGSGGGGTGGGGS(SEQIDNO:70)。在一个实施方案中,当V2是scFv或dsscFv时,连接V2的可变结构域VH与VL的接头具有序列SGGGGSGGGGTGGGGS(SEQIDNO:70)。因此,在一个方面,提供了多特异性抗体分子,其包含以下部分或由其组成:a)式(I)的多肽链:VH-CH1-X-V1;和b)式(II)的多肽链:VL-CL-Y-V2;其中:VH表示重链可变结构域;CH1表示重链恒定区的结构域,例如其结构域1;X表示键或接头;Y表示键或接头;V1表示dsFv、sdAb、scFv或dsscFv;VL表示轻链可变结构域;CL表示来自轻链恒定区的结构域,诸如Cκ;V2表示dsFv、sdAb、scFv或dsscFv;其中V1或V2中的至少一个是dsFv或dsscFv。本公开内容还提供与本文公开的序列具有80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相似性的序列。本文所用的“同一性”表示在比对序列中的任何特定位置上,氨基酸残基在序列之间是相同的。本文所用的“相似性”表示在比对序列中的任何特定位置上,氨基酸残基在序列之间是相似类型的。例如,亮氨酸可以取代异亮氨酸或缬氨酸。通常可以彼此取代的其它氨基酸包括但不限于:-苯丙氨酸、酪氨酸和色氨酸(具有芳香族侧链的氨基酸);-赖氨酸、精氨酸和组氨酸(具有碱性侧链的氨基酸);-天冬氨酸和谷氨酸(具有酸性侧链的氨基酸);-天冬酰胺和谷氨酰胺(具有酰胺侧链的氨基酸);和-半胱氨酸和甲硫氨酸(具有含硫侧链的氨基酸)。可以容易地计算同一性和相似性的程度(ComputationalMolecularBiology,Lesk,A.M.,编辑,OxfordUniversityPress,NewYork,1988;Biocomputing.InformaticsandGenomeProjects,Smith,D.W.,编辑,AcademicPress,NewYork,1993;ComputerAnalysisofSequenceData,Part1,Griffin,A.M.和Griffin,H.G.,编辑,HumanaPress,NewJersey,1994;SequenceAnalysisinMolecularBiology,vonHeinje,G.,AcademicPress,1987,SequenceAnalysisPrimer,Gribskov,M.和Devereux,J.,编辑,MStocktonPress,NewYork,1991,可从NCBI获得的BLAST软件(Altschul,S.F.等,1990,J.Mol.Biol.215:403-410;Gish,W.&States,D.J.1993,NatureGenet.3:266-272.Madden,T.L.等,1996,Meth.Enzymol.266:131-141;Altschul,S.F.等,1997,NucleicAcidsRes.25:3389-3402;Zhang,J.&Madden,T.L.1997,GenomeRes.7:649-656)。用于本发明的多特异性构建体的抗体可以通过本领域已知的任何合适的方法来产生。可以通过使用公知的常规方案将多肽施用于动物优选非人动物来获得针对抗原多肽产生的抗体,其中动物的免疫是必需的,参见例如HandbookofExperimentalImmunology,D.M.Weir(编辑),第4版,BlackwellScientificPublishers,Oxford,England,1986。可以免疫许多温血动物,诸如兔、小鼠、大鼠、绵羊、牛、骆驼或猪。然而,小鼠、兔、猪和大鼠通常是最合适的。单克隆抗体可通过本领域已知的任何方法制备,诸如杂交瘤技术(Kohler和Milstein,1975,Nature,256:495-497)、三源杂交瘤技术、人B细胞杂交瘤技术(Kozbor等1983,ImmunologyToday,4:72)和EBV-杂交瘤技术(Cole等,MonoclonalAntibodiesandCancerTherapy,pp77-96,AlanRLiss,Inc.,1985)。还可使用单淋巴细胞抗体方法,通过克隆和表达从选择用于产生特异性抗体的单个淋巴细胞产生的免疫球蛋白可变区cDNA,通过例如由Babcook,J等1996,Proc.Natl.Acad.Sci.USA93(15):7843-78481;WO92/02551;WO2004/051268和WO2004/106377描述的方法来产生抗体。还可使用本领域已知的各种噬菌体展示方法产生用于本公开内容的抗体,包括由Brinkman等(于J.Immunol.Methods,1995,182:41-50中),Ames等(J.Immunol.Methods,1995,184:177-186),Kettleborough等(Eur.J.Immunol.1994,24:952-958),Persic等(Gene,19971879-18),Burton等(AdvancesinImmunology,1994,57:191-280)以及WO90/02809;WO91/10737;WO92/01047;WO92/18619;WO93/11236;WO95/15982;WO95/20401;和US5,698,426;5,223,409;5,403,484;5,580,717;5,427,908;5,750,753;5,821,047;5,571,698;5,427,908;5,516,637;5,780,225;5,658,727;5,733,743;5,969,108和WO20011/30305公开的方法。在一个实施方案中,根据本公开内容的多特异性分子是人源化的。本文使用的人源化(其包括CDR移植抗体)是指具有来自非人物种的一个或多个互补决定区(CDR)和来自人免疫球蛋白分子的构架区的分子(参见例如US5,585,089;WO91/09967)。将理解,可能仅需要转移CDR的特异性决定残基而不是整个CDR(参见例如,Kashmiri等,2005,Methods,36,25-34)。人源化抗体可任选地进一步包含一个或多个来源于CDR所源自的非人物种的构架残基。如本文所用,术语“人源化抗体分子”是指其中重链和/或轻链含有移植至受体抗体(例如人抗体)的重链和/或轻链可变区构架中的来自供体抗体(例如鼠单克隆抗体)的一个或多个CDR(如果需要的话,包括一个或多个经修饰的CDR)的抗体分子。关于综述,参见Vaughan等,NatureBiotechnology,16,535-539,1998。在一个实施方案中,不是转移整个CDR,而是只将一个或多个来自本文上述的任何一个CDR的特异性决定残基转移至人抗体构架(参见例如,Kashmiri等,2005,Methods,36,25-34)。在一个实施方案中,仅将来自一个或多个本文上述的CDR的特异性决定残基转移至人抗体构架。在另一个实施方案中,仅将来自本文上述的每个CDR的特异性决定残基转移至人抗体构架。当CDR或特异性决定残基被移植时,在考虑CDR所源自的供体抗体的种类/类型后,可使用任何合适的受体可变区构架序列,包括小鼠、灵长类动物和人构架区。合适地,根据本发明的人源化抗体具有包含人受体构架区的可变结构域以及本文提供的一个或多个CDR。可用于本公开内容的人类构架的实例是KOL、NEWM、REI、EU、TUR、TEI、LAY和POM(Kabat等,同上)。例如,KOL和NEWM可用于重链,REI可用于轻链以及EU、LAY和POM可以用于重链和轻链。或者,可使用人种系序列;这些可在以下网址获得:http://www2.mrc-lmb.cam.ac.uk/vbase/list2.php。在本公开内容的人源化抗体分子中,受体重链和轻链不一定需要衍生自相同的抗体,并且如果需要,可包含具有衍生自不同链的构架区的复合链。构架区不需要具有与受体抗体的构架区完全相同的序列。例如,可将不常见的残基改变为该受体链种类或类型的更常见的残基。或者,可改变受体构架区中的选定残基,以使得它们对应于在供体抗体中相同位置处发现的残基(参见Reichmann等1998,Nature,332,323-324)。此类变化应保持在恢复供体抗体亲和力所需的最低程度。用于在受体构架区中选择可能需要改变的残基的方案示于WO91/09967中。构架的衍生物可具有用替代氨基酸(例如用供体残基)替代的1、2、3或4个氨基酸。供体残基是来自供体抗体(即CDR最初所源自的抗体)的残基。供体残基可被源自人受体构架的合适残基(受体残基)替换。在一个实施方案中,本公开内容的多特异性抗体是完全人的,特别是一个或多个可变结构域是完全人的。完全人分子是其中重链和轻链的可变区和恒定区(如果存在)均为人源的,或基本上与人源序列相同,而不必来自相同抗体的那些分子。完全人抗体的实例可包括例如通过上述噬菌体展示方法产生的抗体和由小鼠产生的抗体,在所述小鼠中鼠免疫球蛋白可变区和任选地恒定区基因已被其人对应物替代,如例如在EP0546073、US5,545,806、US5,569,825、US5,625,126、US5,633,425、US5,661,016、US5,770,429、EP0438474和EP0463151中概括地描述的。在一个实施方案中,本公开内容的多特异性抗体分子能够选择性结合两种、三种或更多种不同的目标抗原。在一个实施方案中,被VH/VL或V1或V2形成的抗原结合结构域结合的目标抗原独立地选自结合细胞的蛋白,例如细胞诸细菌细胞、酵母细胞、T细胞、B细胞、内皮细胞或肿瘤细胞上的细胞表面蛋白和可溶性蛋白。目标抗原还可以是任何医学相关蛋白,诸如在疾病或感染期间被上调的那些蛋白,例如受体和/或其相应的配体。抗原的具体实例包括细胞表面受体诸如T细胞或B细胞信号传导受体、共刺激分子、检查点抑制剂、天然杀伤细胞受体、免疫球蛋白受体、TNFR家族受体、B7家族受体、粘附分子、整联蛋白、细胞因子/趋化因子受体、GPCR、生长因子受体、激酶受体、组织特异性抗原、癌抗原、病原体识别受体、补体受体、激素受体或可溶性分子诸如细胞因子、趋化因子、白三烯、生长因子、激素或酶或离子通道、表位、其片段及其翻译后修饰形式。在一个实施方案中,本公开内容的多特异性抗体分子可用于在功能上改变目的抗原的活性。例如,抗体融合蛋白可直接或间接中和、拮抗或激动所述抗原的活性。在一个实施方案中,V1和V2对相同抗原是特异性的,例如结合其中的相同或不同表位。在一个实施方案中,V1对人血清白蛋白是特异性的。在一个实施方案中,V2对人血清白蛋白是特异性的。在一个实施方案中,V1和V2对两种不同抗原是特异性的。在一个实施方案中,V1和V2对相同抗原,例如相同抗原上的相同或不同表位是特异性的。在一个实施方案中,被VH/VL或V1或V2结合的目标抗原提供了募集效应子功能(如补体途径激活和/或效应细胞募集)的能力。效应子功能的募集可以是直接的,因为效应子功能与细胞相关,所述细胞在其表面上带有募集分子。当针对根据本公开内容的分子中的抗原结合结构域(例如V1或V2)的抗原与募集多肽的结合导致例如因子的释放时,可发生间接募集,所述因子进而可以直接或间接募集效应子功能,或可通过激活信号传导途径来进行。实例包括IL2、IL6、IL8、IFNγ、组胺、C1q、调理素以及经典和替代补体激活级联的其它成员,诸如C2、C4、C3-转化酶和C5至C9。如本文所用,“募集多肽”包括FcγR,诸如FcγRI、FcγRII和FcγRIII、补体途径蛋白,诸如但不限于C1q和C3、CD标志蛋白(分化标记簇)或其片段,其保留直接或间接募集细胞介导的效应子功能的能力。募集多肽还包括具有效应子功能的免疫球蛋白分子,例如IgG1、IgG2、IgG3、IgG4、IgE和IgA。在一个实施方案中,根据本公开内容的多特异性抗体分子中的抗原结合结构域(诸如V1或V2或VH/VL)对补体途径蛋白具有特异性,其中C1q是特别优选的。此外,本公开内容的多特异性抗体分子可以用于通过结合于核素螯合蛋白的单结构域抗体螯合放射性核素。此类融合蛋白可用于成像或放射性核素靶向治疗方法。在一个实施方案中,根据本公开内容的分子内的抗原结合结构域(诸如V1或V2或VH/VL)对血清载体蛋白、循环免疫球蛋白分子或CD35/CR1具有特异性,例如用于通过与所述血清载体蛋白、循环免疫球蛋白分子或CD35/CR1结合来为具有对于所述目标抗原的特异性的抗体片段提供延长的半衰期。如本文所用,“血清载体蛋白”包括甲状腺素结合蛋白、转甲状腺素蛋白、α1-酸性糖蛋白、转铁蛋白、纤维蛋白原和白蛋白,或其任何片段。如本文所用,“循环免疫球蛋白分子”包括IgG1、IgG2、IgG3、IgG4、sIgA、IgM和IgD,或其任何片段。CD35/CR1是存在于红细胞上的蛋白质,其半衰期为36天(正常范围为28至47天;Lanaro等,1971,Cancer,28(3):658-661)。在一个实施方案中,VH/VL对其具有特异性的目标抗原是血清载体蛋白,诸如人血清载体,诸如人血清白蛋白。在一个实施方案中,V1对其具有特异性的目标抗原是血清载体蛋白,诸如人血清载体,诸如人血清白蛋白。在一个实施方案中,V2对其具有特异性的目标抗原是血清载体蛋白,诸如人血清载体,诸如人血清白蛋白。在一个实施方案中,VH/VL、V1或V2中仅一个对血清载体蛋白诸如人血清载体诸如人血清白蛋白具有特异性。在一个实施方案中,本公开内容的构建体中的结合部位包含6个CDR,例如SEQIDNO:71(对于CDRH1)、SEQIDNO:72(对于CDRH2)、SEQIDNO:73(对于CDRH3)、SEQIDNO:74(对于CDRL1)、SEQIDNO:75(对于CDRL2)和SEQIDNO:76(对于CDRL3)。在一个实施方案中,所述6个CDRSEQIDNO:71至76在本公开内容的构建体中的位置VH/VL中。在一个实施方案中,所述6个CDRSEQIDNO:71至76在本公开内容的构建体中的位置V1中。在一个实施方案中,所述6个CDRSEQIDNO:71至76在本公开内容的构建体中的位置V2中。在一个实施方案中,所述6个CDRSEQIDNO:71至76在本公开内容的构建体中的位置V1和V2中。在一个实施方案中,所述6个CDRSEQIDNO:71至76在本公开内容的构建体中的位置VH/VL和V1中。在一个实施方案中,所述6个CDRSEQIDNO:71至76在本公开内容的构建体中的位置VH/VL和V2中。在一个实施方案中,本公开内容的构建体中的白蛋白结合部位包含选自SEQIDNO:77和SEQIDNO:78的重链可变结构域和选自SEQIDNO:79和SEQIDNO:80的轻链可变结构域,特别是SEQIDNO:77和79或SEQIDNO:78和80(分别对于重链和轻链)。在一个实施方案中,这些结构域处于本公开内容的构建体中的位置VH/VL中。在一个实施方案中,这些可变结构域处于位置V1中。在一个实施方案中,这些可变结构域处于位置V2中。在一个实施方案中,这些可变结构域处于位置V1和V2中。在一个实施方案中,这些可变结构域处于本公开内容的构建体中的位置VH/VL和V1中。在一个实施方案中,这些可变结构域处于本公开内容的构建体中的位置VH/VL和V2中。当可变结构域处于本公开内容的构建体中的两个位置时,相同的可变结构域对可处于每个位置中,或者可使用两个不同的可变结构对。在一个实施方案中,加工本公开内容的多特异性抗体分子以提供对一种或多种靶抗原的改善的亲和力。此类变体可通过许多亲和力成熟方案获得,包括突变CDR(Yang等J.Mol.Biol.,254,392-403,1995)、链改组(Marks等,Bio/Technology,10,779-783,1992)、大肠杆菌(E.coli)的突变菌株的使用(Low等,J.Mol.Biol.,250,359-368,1996)、DNA改组(Patten等,Curr.Opin.Biotechnol.,8,724-733,1997)、噬菌体展示(Thompson等,J.Mol.Biol.,256,77-88,1996)和有性PCR(Crameri等Nature,391,288-291,1998)。Vaughan等(同上)论述了亲和力成熟的这些方法。本文所用的改善的亲和力在此上下文中是指相对于起始分子的改善。如果需要,可将用于本公开内容的多特异性抗体构建体与一种或多种效应分子缀合。将理解,效应分子可包含单效应分子或两个或更多个连接以形成可连接至本发明的抗体的单一部分的此类分子。当期望获得连接至效应分子的抗体片段时,这可通过标准化学或重组DNA方法来制备,其中将所述抗体片段直接或通过偶联剂连接至效应分子。用于将此类效应分子与抗体缀合的技术是本领域熟知的(参见Hellstrom等ControlledDrugDelivery,第2版,Robinson等编辑,1987,第623-53页;Thorpe等1982,Immunol.Rev.,62:119-58和Dubowchik等1999,PharmacologyandTherapeutics,83,67-123)。具体的化学方法包括例如在WO93/06231、WO92/22583、WO89/00195、WO89/01476和WO03031581中描述的那些方法。或者,当效应分子是蛋白质或多肽时,可使用重组DNA方法实现连接,例如如WO86/01533和EP0392745中所述的。本文使用的术语“效应分子”包括例如生物活性蛋白,例如酶、其它抗体或抗体片段、合成或天然存在的聚合物、核酸及其片段例如DNA、RNA及其片段、放射性核素,特别是放射性碘、放射性同位素、螯合金属、纳米颗粒和报告基团,诸如可通过NMR或ESR光谱法检测的荧光化合物或化合物。其它效应分子可包括螯合放射性核素如111In和90Y、Lu177、铋213、锎252、铱192和钨188/铼188;或药物,诸如但不限于烷基磷酸胆碱、拓扑异构酶I抑制剂、紫杉烷和苏拉明。其它效应分子包括蛋白质、肽和酶。目标酶包括但不限于蛋白水解酶、水解酶、裂合酶、异构酶、转移酶。目标蛋白质、多肽和肽包括但不限于免疫球蛋白、毒素诸如相思豆毒素、蓖麻毒素A、假单胞菌外毒素或白喉毒素、蛋白质诸如胰岛素、α-干扰素、β-干扰素、神经生长因子、血小板衍生生长因子或组织纤溶酶原激活剂、血栓形成剂或抗血管生成剂例如血管他丁或内皮他丁,或生物反应修饰剂诸如淋巴因子、白细胞介素-1(IL-1)、白细胞介素-2(IL-2)、粒细胞巨噬细胞集落刺激因子(GM-CSF)、粒细胞集落刺激因子(G-CSF)、神经生长因子(NGF)或其它生长因子和免疫球蛋白。其它效应分子可包括用于例如诊断的可检测物质。可检测物质的实例包括各种酶、辅基、荧光物质、发光物质、生物发光物质、放射性核素、正电子发射金属(用于正电子发射断层摄影)和非放射性顺磁金属离子。关于可与抗体缀合以用作诊断剂的金属离子,通常参见US4,741,900。合适的酶包括辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶;合适的辅基包括链霉亲和素、抗生物素蛋白和生物素;合适的荧光物质包括伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪胺荧光素、丹磺酰氯和藻红蛋白;合适的发光物质包括鲁米诺;合适的生物发光物质包括荧光素酶、萤光素和水母发光蛋白;合适的放射性核素包括125I、131I、111In和99Tc。在另一个实施方案中,效应分子可在体内增加抗体的半衰期和/或降低抗体的免疫原性和/或增强抗体穿过上皮屏障至免疫系统的递送。该类型的合适效应分子的实例包括聚合物、白蛋白、白蛋白结合蛋白或白蛋白结合化合物,诸如WO05/117984中所述的那些。当效应分子是聚合物时,其通常可以是合成或天然存在的聚合物,例如任选地取代的直链或支链聚亚烷、聚亚烯或聚氧化烯聚合物或支链或非支链多糖,例如同多糖或杂多糖。可存在于上述合成聚合物上的特定任选取代基包括一个或多个羟基、甲基或甲氧基。合成聚合物的具体实例包括任选取代的直链或支链聚(乙二醇)、聚(丙二醇)聚(乙烯醇)或其衍生物,特别是任选取代的聚(乙二醇)如甲氧基聚(乙二醇)或其衍生物。特定的天然存在的聚合物包括乳糖、直链淀粉、葡聚糖、糖原或其衍生物。本文所用的“衍生物”旨在包括反应性衍生物,例如硫醇选择性反应基团,诸如马来酰亚胺等。反应性基团可直接或通过接头片段连接至聚合物。将理解,这种基团的残基在一些情况下将形成作为抗体片段与聚合物之间的连接基团的产物的一部分。聚合物的大小可以根据需要改变,但通常在500Da至50000Da,例如5000至40000Da,诸如20000至40000Da的平均分子量范围内。聚合物大小可以特别地基于产物的预期用途(例如定位至某些组织诸如肿瘤或延长循环半衰期的能力)来选择(关于综述,参见Chapman,2002,AdvancedDrugDeliveryReviews,54,531-545)。因此,例如,当产物旨在离开循环并穿透组织,例如用于治疗肿瘤时,使用小分子量聚合物(例如分子量为约5000Da)可以是有利的。对于其中产物保留在循环中的应用,使用较高分子量(例如分子量在20000Da至40000Da的范围内)的聚合物可以是有利的。合适的聚合物包括聚亚烷基聚合物,诸如聚(乙二醇)或特别是甲氧基聚(乙二醇)或其衍生物,特别是分子量在约15000Da至约40000Da的范围内。在一个实施方案中,用于本公开内容的抗体连接于聚(乙二醇)(PEG)部分。在一个具体实例中,抗体是抗体片段,并且PEG分子可通过位于抗体片段中的任何可用的氨基酸侧链或末端氨基酸官能团(例如任何游离氨基、亚氨基、巯基、羟基或羧基基团)连接。此类氨基酸可以天然存在于抗体片段中,或者可使用重组DNA方法工程化至片段中(参见例如US5,219,996;US5,667,425;WO98/25971、WO2008/038024)。在一个实施方案中,本发明的抗体分子是经修饰的Fab片段,其中修饰是向其重链的C末端添加一个或多个氨基酸以允许效应分子的附接。合适地,额外的氨基酸形成含有效应分子可连接的一个或多个半胱氨酸残基的经修饰的铰链区。多个位点可用于连接两个或更多个PEG分子。合适地,PEG分子通过位于抗体片段中的至少一个半胱氨酸残基的巯基共价连接。连接至经修饰的抗体片段的每个聚合物分子可以共价连接至位于片段中的半胱氨酸残基的硫原子。共价键联通常是二硫键,或者特别地是硫-碳键。当硫醇基团用作适当活化的效应分子的连接点时,可使用例如硫醇选择性衍生物如马来酰亚胺和半胱氨酸衍生物。活化的聚合物可用作制备如上所述的聚合物修饰的抗体片段的起始材料。活化聚合物可以是含有硫醇反应性基团(例如α-卤代羧酸或酯,例如碘乙酰胺、酰亚胺例如马来酰亚胺、乙烯基砜或二硫化物)的任何聚合物。此类起始材料可以商购获得(例如获自Nektar,以前称为ShearwaterPolymersInc.,Huntsville,AL,USA),或者可使用常规化学方法从商购可得的起始材料制备。具体的PEG分子包括20K甲氧基-PEG-胺(可从Nektar,以前称为Shearwater;RappPolymere;和SunBio获得)和M-PEG-SPA(可从Nektar,以前称为Shearwater获得)。在一个实施方案中,分子中的F(ab')2、Fab或Fab'是聚乙二醇化的,即具有与其共价连接的PEG(聚(乙二醇)),例如根据EP0948544或EP1090037中公开的方法进行[也参见"Poly(ethyleneglycol)Chemistry,BiotechnicalandBiomedicalApplications",1992,J.MiltonHarris(编辑),PlenumPress,NewYork,"Poly(ethyleneglycol)ChemistryandBiologicalApplications",1997,J.MiltonHarris和S.Zalipsky(编辑),AmericanChemicalSociety,WashingtonDCand"BioconjugationProteinCouplingTechniquesfortheBiomedicalSciences",1998,M.Aslam和A.Dent,GrovePublishers,NewYork;Chapman,A.2002,AdvancedDrugDeliveryReviews2002,54:531-545]。在一个实施方案中,将PEG连接至铰链区中的半胱氨酸。在一个实例中,PEG修饰的Fab片段具有共价连接至经修饰的铰链区中的单个巯基的马来酰亚胺基团。赖氨酸残基可共价连接至马来酰亚胺基团,赖氨酸残基上的每个胺基团可连接至分子量为约20,000Da的甲氧基聚(乙二醇)聚合物。因此,与Fab片段连接的PEG的总分子量可以为约40,000Da。特定的PEG分子包括N,N'-双(甲氧基聚(乙二醇)MW20,000)修饰的赖氨酸的2-[3-(N-马来酰亚胺基)丙酰胺基]乙基酰胺,也称为PEG2MAL40K(可从Nektar,以前称为Shearwater获得)。PEG接头的替代来源包括提供GL2-400MA2(其中下面结构中的m为5)和GL2-400MA(其中m为2)的NOF且n为约450:也就是说每个PEG为约20,000Da。以下类型的其它可选PEG效应分子可从DrReddy、NOF和Jenkem获得:在一个实施方案中,提供了通过链中的氨基酸226处或附近(例如,通过重链的氨基酸226)(按顺序编号)的半胱氨酸氨基酸残基连接的PEG化(例如利用本文所述的PEG)的抗体分子。在一个实施方案中,提供了编码本公开内容的分子的多核苷酸序列,诸如DNA序列。在一个实施方案中,提供了编码本公开内容的分子的一种或多种,例如两种或更多种,或三种或更多种多肽组分的多核苷酸序列,所述多肽组分为例如:a)式(I)的多肽链:VH-CH1-X-V1;和b)式(II)的多肽链:VL-CL-Y-V2;其中:VH表示重链可变结构域;CH1表示重链恒定区的结构域,例如其结构域1;X表示键或接头;Y表示键或接头;V1表示dsFv、sdAb、scFv或dsscFv;VL表示轻链可变结构域;CL表示来自轻链恒定区的结构域,例如Cκ;V2表示dsFv、sdAb、scFV或dsscFv;其中V1或V2中的至少一个是dsFv或dsscFv。在一个实施方案中,多核苷酸诸如DNA包含在载体中。本领域技术人员将理解,当V1和/或V2表示dsFv时,多特异性抗体将包含编码不连接于X或Y的相应的游离VH或VL结构域的第三多肽。因此,本发明的多特异性蛋白可由一个或多个、两个或更多个或三个或更多个多核苷酸编码,并且这些多核苷酸可被掺入一个或多个载体中。可利用来构建载体的一般方法、转染方法和培养方法是本领域技术人员公知的。在这方面,参考“CurrentProtocolsinMolecularBiology”,1999,F.M.Ausubel(编辑),WileyInterscience,NewYorkandtheManiatisManualproducedbyColdSpringHarborPublishing。还提供了包含一个或多个克隆性或表达载体的宿主细胞,所述载体包含编码本发明多特异性蛋白的一个或多个DNA序列。任何合适的宿主细胞/载体系统可用于表达编码本发明的抗体分子的DNA序列。可以使用细菌,例如大肠杆菌和其它微生物系统,或者也可以使用真核例如哺乳动物宿主细胞表达系统。合适的哺乳动物宿主细胞包括CHO、骨髓瘤、NSO骨髓瘤细胞和SP2细胞、COS细胞或杂交瘤细胞。本公开内容还提供了用于产生根据本公开内容的多特异性蛋白质的方法,包括在适于导致从编码本发明的多特异性蛋白质的DNA表达蛋白质的条件下培养含有本发明的载体的宿主细胞,并分离所述多特异性蛋白。为了产生包含重链和轻链的产物,可用两种载体(编码轻链多肽的第一载体和编码重链多肽的第二载体)转染细胞系。或者,可使用单一载体,所述载体包括编码轻链和重链多肽的序列。在一个实例中,可用两种载体转染细胞系,每种载体编码本发明抗体分子的多肽链。当V1和/或V2是dsFv时,细胞系可用三种载体转染,每种载体编码本发明的多特异性蛋白的多肽链。在一个实施方案中,用两种载体转染细胞系,每种载体编码选自以下的不同多肽:a)式(I)的多肽链:VH-CH1-X-V1;b)式(II)的多肽链:VL-CL-Y-V2;其中:VH表示重链可变结构域;CH1表示重链恒定区的结构域,例如其结构域1;X表示键或接头;Y表示键或接头;V1表示dsFv、sdAb、scFv或dsscFv;VL表示轻链可变结构域;CL代表来自轻链恒定区的结构域,例如Cκ;V2表示dsFv、sdAb、scFV或dsscFv;其中V1或V2中的至少一个是dsFv或dsscFv。在一个实施方案中,当V1是dsFv并且V1的VH结构域连接至X时,可用编码V1的VL结构域的第三载体转染细胞系。在一个实施方案中,当V1是dsFv并且V1的VL结构域连接至X时,可用编码V1的VH结构域的第三载体转染细胞系。在一个实施方案中,当V2是dsFv且V2的VH结构域连接于Y时,可用编码V2的VL结构域的第三载体转染细胞系。在一个实施方案中,当V2是dsFv并且V2的VL结构域连接于Y时,可用编码V2的VH结构域的第三载体转染细胞系。在一个实施方案中,当V1和V2均为dsFv且V2的VL结构域连接于Y且V1的VL结构域连接于X时,可用编码V1和V2的共同VH结构域的第三载体转染细胞系。在一个实施方案中,当V1和V2均为dsFv且V2的VH结构域连接于Y并且V1的VH结构域连接于X时,可以用编码V1和V2的共同VL结构域的第三载体转染细胞系。将理解,可以改变转染入宿主细胞中的每种载体的比例,以优化多特异性抗体产物的表达。在使用两种载体的一个实施方案中,载体的比率可以是1:1。在使用三种载体的一个实施方案中,载体的比率可以是1:1:1。将理解,本领域技术人员能够通过转染后的蛋白质表达水平的常规测试找到最佳比例。可选择地或另外地,来自每个载体的多特异性构建体的每条多肽链的表达水平可通过使用相同或不同的启动子来控制。将理解,两个或更多个多肽组分或当存在时三个多肽组分可由单个载体中的多核苷酸编码。还将理解,当两个或更多个特别是三个或更多个多肽组分由单个载体中的多核苷酸编码时,每个多肽组分的相对表达可因对编码本公开内容的多肽组分的每个多核苷酸使用不同的启动子而变化。在一个实施方案中,载体包含在单个启动子控制下编码本发明的多特异性抗体分子的两个或当存在时三个多肽链的单个多核苷酸序列。在一个实施方案中,载体包含编码本公开内容的多特异性抗体分子的两个或当存在时三个多肽链的单个多核苷酸序列,其中编码每个多肽链的每个多核苷酸序列处于不同启动子的控制之下。根据本公开内容的多特异性蛋白质从宿主细胞以良好水平表达。因此,抗体和/或片段的性质似乎是优化的并且有利于商业加工。有利地,本公开内容的多特异性抗体分子使纯化后看到的聚集的量最小化,并且使药物浓度下构建体的制剂中的单体的量最大化,例如单体可以以总蛋白质的50%、60%、70%或75%或更多,诸如80或90%或更多,诸如91%、92%、93%、94%、95%、96%、97%、98%或99%或更多存在。在一个实例中,本公开内容的多特异性抗体分子的纯化样品在4℃下储存28天后保持大于98%或99%的单体性。在一个实例中,在磷酸缓冲盐水(PBS)中的5mg/ml的本公开内容的多特异性抗体分子的纯化样品在4℃下储存28天后保持大于98%的单体性。本公开内容的抗体分子和包含其的组合物可用于治疗,例如治疗和/或预防病理病况。本公开内容还提供了包含本公开内容的抗体分子与一种或多种药学上可接受的赋形剂、稀释剂或载体的组合的药物或诊断组合物。因此,提供了本公开内容的抗体用于治疗和用于制造药物(特别地用于本文公开的适应症)的用途。组合物通常将作为通常包括药学上可接受的载体的无菌药物组合物的一部分提供。本公开内容的药物组合物可另外包含药学上可接受的佐剂。本公开内容还提供了制备药物或诊断组合物的方法,其包括将本公开内容的抗体分子与一种或多种药学上可接受的赋形剂、稀释剂或载体一起添加和混合。抗体分子可以是药物或诊断组合物中的唯一活性成分,或者可伴有其它活性成分,包括其它抗体成分,例如抗IL-1β、抗T细胞、抗IFNγ或抗LPS抗体,或非抗体成分例如黄嘌呤。其它合适的活性成分包括能够诱导耐受的抗体,例如抗CD3或抗CD4抗体。在另一个实施方案中,将根据本公开内容的抗体、片段或组合物与另外的药物活性剂组合使用。药物组合物适当地包含治疗有效量的本发明的抗体分子。本文所用的术语“治疗有效量”是指治疗、改善或预防靶疾病或病况或表现出可检测的治疗或预防效果所需的治疗剂的量。对于任何抗体,最初可在细胞培养测定或动物模型中,通常在啮齿动物、兔、狗、猪或灵长类动物中估计治疗有效量。动物模型还可用于确定施用的适当浓度范围和途径。此类信息然后可用于确定用于在人中施用的有用剂量和途径。用于人受试者的精确的治疗有效量将取决于疾病状态的严重性、受试者的一般健康状况、受试者的年龄、体重和性别、饮食、施用时间和频率、药物组合、反应敏感性和对治疗的耐受性/反应。该量可以通过常规实验确定并且在临床医生的判断范围内。通常,治疗有效量为0.01mg/kg至50mg/kg,例如0.1mg/kg至20mg/kg。或者,剂量可以是每日1至500mg,诸如每日10至100mg、200mg、300mg或400mg。药物组合物可方便地以含有预定量的本发明的活性剂的单位剂量形式提供。可将组合物单独地施予患者,或者可将其与其它试剂、药物或激素组合(例如同时、顺序或分开)施予患者。施用本公开内容的抗体分子的剂量取决于待治疗的病症的性质、存在的炎症的程度以及抗体分子是被预防性使用还是用于治疗现有病症。剂量的频率将取决于抗体分子的半衰期和其效应的持续时间。如果抗体分子具有短的半衰期(例如2至10小时),则其可能有必要每天给予一个或多个剂量。或者,如果抗体分子具有长的半衰期(例如2至15天),则可能仅需要每天给予一次剂量,每周一次或甚至每1或2个月一次。药学上可接受的载体本身不应诱导对接受组合物的个体有害的抗体的产生,并且不应是有毒的。合适的载体可以是大的、缓慢代谢的大分子,诸如蛋白质、多肽、脂质体、多糖、聚乳酸、聚乙醇酸、多聚氨基酸、氨基酸共聚物和无活性病毒颗粒。可使用药学上可接受的盐,例如无机酸盐,诸如盐酸盐、氢溴酸盐、磷酸盐和硫酸盐,或有机酸的盐,诸如乙酸盐、丙酸盐、丙二酸盐和苯甲酸盐。治疗组合物中的药学上可接受的载体可另外含有液体,诸如水、盐水、甘油和乙醇。另外,辅助物质,诸如润湿剂或乳化剂或pH缓冲物质,可存在于此类组合物中。此类载体使得药物组合物能够配制成片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液和悬浮液,以供患者摄取。适合的施用形式包括适于肠胃外施用的形式,例如通过注射或输注,例如通过弹丸注射或连续输注。当产品用于注射或输注时,其可采用在油性或水性媒介物中的悬浮液、溶液或乳液的形式,并且其可含有配制剂,诸如悬浮剂、防腐剂、稳定剂和/或分散剂。或者,抗体分子可呈干燥形式,用于在使用前用合适的无菌液体重建。一旦配制,本发明的组合物可以直接施用于受试者。待治疗的受试者可以是动物。然而,在一个或多个实施方案中,所述组合物适于施用于人受试者。在一个实施方案中,在根据本公开内容的制剂中,最终制剂的pH不类似于抗体或片段的等电点的值,因为如果制剂的pH为7,则为8-9或以上的pI可以是适当的。虽然不希望受理论束缚,但据认为这可能最终提供具有改善的稳定性的最终制剂,例如抗体或片段保留在溶液中。本公开内容的药物组合物可通过任何数量的途径施用,包括但不限于口服、静脉内、肌内、动脉内、髓内、鞘内、心室内、透皮、经皮(例如参见WO98/20734)、皮下、腹膜内、鼻内、肠内、局部、舌下、阴道内或直肠途径。无针注射器也可用于施用本发明的药物组合物。通常,治疗组合物可被制备为注射剂,作为液体溶液或悬浮液。也可制备适于在注射前溶解或悬浮在液体媒介物中的固体形式。优选地,皮下、通过吸入或局部地施用本发明的抗体分子。组合物的直接递送通常通过皮下、腹膜内、静脉内或肌肉内注射完成,或被递送到组织的间隙空间。也可将组合物施用至特定目标组织中。剂量治疗可以是单剂量方案或多剂量方案。将理解,组合物中的活性成分将是抗体分子。因此,其将易于在胃肠道中降解。因此,如果通过使用胃肠道的途径施用组合物,则组合物将需要含有保护抗体免于降解但一旦其已从胃肠道吸收就释放抗体的试剂。药学上可接受的载体的详尽讨论可在Remington'sPharmaceuticalSciences(MackPublishingCompany,N.J.1991)中获得。在一个实施方案中,制剂作为用于局部施用(包括吸入)的制剂提供。合适的可吸入的制剂包括可吸入粉剂,含有气体推进剂的计量气雾剂或不含气体推进剂的可吸入溶液(例如可喷雾溶液或悬浮液)。根据本公开内容的含有活性物质的可吸入粉剂可仅由上述活性物质或由上述活性物质与生理上可接受的赋形剂的混合物组成。这些可吸入粉剂可包括单糖(例如葡萄糖或阿拉伯糖)、二糖(例如乳糖,蔗糖,麦芽糖)、寡糖和多糖(例如葡聚糖),多元醇(例如山梨醇,甘露醇,木糖醇),盐(例如氯化钠,碳酸钙)或这些彼此的混合物。适宜使用单糖或二糖,特别地但不排他地以其水合物的形式使用乳糖或葡萄糖。用于在肺中沉积的颗粒需要小于10微米例如1-9微米,例如0.1至5μm,特别是1至5μm的粒度。活性剂(例如抗体或抗体片段)的粒度具有首要的重要性。可用于制备可吸入气雾剂的气体推进剂是本领域已知的。合适的气体推进剂选自烃类例如正丙烷、正丁烷或异丁烷以及卤代烃例如甲烷、乙烷、丙烷、丁烷、环丙烷或环丁烷的氯化和/或氟化的衍生物。上述气体推进剂可以独自地或以其混合物使用。特别合适的气体推进剂是选自TG11、TG12、TG134a和TG227的卤代烷衍生物。在上述卤代烃中,TG134a(1,1,1,2-四氟乙烷)和TG227(1,1,1,2,3,3,3-七氟丙烷)及其混合物是特别适合的。含气体推进剂的可吸入气雾剂还可含有其它成分如共溶剂、稳定剂、表面活性剂(表面活化剂)、抗氧化剂、润滑剂和用于调节pH的装置。所有这些成分是本领域已知的。根据本发明的含气体推进剂的可吸入气雾剂可含有按重量计高达5%的活性物质。根据本发明的气雾剂含有例如按重量计0.002至5%,按重量计0.01至3%,按重量计0.015%至2%,按重量计0.1至2%,按重量计0.5至2%或按重量计0.5%至1%的活性物。可选择地,至肺的局部施用还可以是通过液体溶液或悬浮液制剂的施用,例如采用装置诸如喷雾器,例如连接至压缩器的喷雾器(例如,由PariRespiratoryEquipment,Inc.,Richmond,Va.制造的连接至PariMaster(R)压缩器的PariLC-JetPlus(R)喷雾器)。在一个实施方案中,制剂被提供为含有用于通过喷雾递送的单位剂量的分离的安瓿。在一个实施方案中,抗体以冻干形式提供,用于重建或可选择地作为悬浮液制剂。本公开内容的抗体可分散在溶剂中,例如以溶液或悬浮液的形式进行递送。所述抗体可悬浮于适当的生理溶液中,例如生理盐水、药学上可接受的溶剂或缓冲溶液。本领域中已知的缓冲溶液可含有每1ml水中0.05mg至0.15mg依地酸二钠、8.0mg至9.0mg氯化钠、0.15mg至0.25mg聚山梨醇酯、0.25mg至0.30mg无水柠檬酸、以及0.45mg至0.55mg柠檬酸钠以获得约4.0至5.0的pH。如前所述,悬浮液可从例如冻干抗体制备。治疗性悬浮液或溶液制剂还可包含一种或多种赋形剂。赋形剂是本领域熟知的,并且包括缓冲剂(例如,柠檬酸盐缓冲剂,磷酸盐缓冲剂,乙酸盐缓冲剂和碳酸氢盐缓冲剂)、氨基酸、尿素、醇、抗坏血酸、磷脂、蛋白(例如,血清白蛋白)、EDTA、氯化钠、脂质体、甘露醇、山梨醇和甘油。溶液或悬浮液可以封装在脂质体或可生物降解的微球体中。制剂通常将采用无菌制造工艺以基本上无菌的形式来提供。这可包括产生和过滤灭菌用于所述制剂的缓冲溶剂溶液,在无菌缓冲溶剂溶液中无菌悬浮抗体,和通过本领域技术人员熟悉的方法将制剂分配到无菌容器中。根据本公开内容的可喷雾制剂可以例如提供为包装在箔膜中的单个剂量单位(例如,密封的塑料容器或小瓶)。每个小瓶含有一定体积例如2ml的溶剂/溶液缓冲液中的单位剂量。本公开内容的抗体被认为是适合于通过喷雾输送。还可预见的是,本发明的抗体可以通过使用基因疗法来施用。为了实现此,将在适当的DNA元件控制下编码抗体分子的重链和轻链的DNA序列引入到患者,以使得抗体链从所述DNA序列表达并在原位装配。病理状况或病症可以例如选自感染(病毒,细菌,真菌和寄生物),与感染相关的内毒素休克,关节炎如类风湿性关节炎,哮喘例如重度哮喘,慢性阻塞性肺疾病(COPD),盆腔炎,阿尔茨海默氏病,炎性肠病,克罗恩病,溃疡性结肠炎,阴茎纤维性海绵体炎,腹腔疾病,胆囊疾病,藏毛症,腹膜炎,银屑病,血管炎,手术粘连,中风,I型糖尿病,莱姆病,脑膜脑炎,自身免疫性葡萄膜炎,免疫介导的中枢和周围神经系统的炎性疾病例如多发性硬化症、狼疮(如系统性红斑狼疮)和格-巴二氏综合征,特应性皮炎,自身免疫性肝炎,纤维化性肺泡炎,格雷夫斯氏病,IgA肾病,特发性血小板减少性紫癜,美尼尔氏病,天疱疮,原发性胆汁性肝硬化,结节病,硬皮病,韦氏肉芽肿病,其它自体免疫疾病,胰腺炎,创伤(手术),移植物抗宿主病,移植排斥,心脏疾病包括缺血性疾病例如心肌梗死以及动脉粥样硬化,血管内凝血,骨吸收,骨质疏松症,骨关节炎,牙周炎和胃酸过少(hypochlorhydia)。本公开内容还提供了用于治疗或预防疼痛,特别是与炎症有关的疼痛的根据本发明的多特异性抗体分子。因而提供了用于治疗的根据本公开内容的多特异性抗体和采用其进行治疗的方法。在一个实施方案中,提供了用于纯化多特异性抗体(特别是根据本发明的抗体或片段)的方法。在一个实施方案中,提供了用于纯化多特异性抗体(特别是根据本发明的抗体或片段)的方法,其包括以下步骤:以非结合模式进行阴离子交换层析,以使得杂质保留在柱子上并且抗体被保持在未结合部分中。所述步骤可以例如在pH约6-8下进行。方法还可包括使用阳离子交换层析的初始捕获步骤,例如在约4至5的pH下进行。方法还可包括额外的层析步骤以确保产物和过程相关的杂质被适当地从产物流中解析出来。纯化过程还可包括一个或多个超滤步骤,例如浓缩和渗滤步骤。如上文所用的“纯化的形式”意指至少90%的纯度,例如91,92,93,94,95,96,97,98,99%w/w或更纯。基本上不含内毒素通常意指1EU/mg抗体产物或更低例如0.5或0.1EU/mg产物的内毒素含量。基本上不含宿主细胞蛋白质或DNA通常意指视情况而定,400μg/mg抗体产物或更低例如100μg/mg或更低,特别是20μg/mg的宿主细胞蛋白质和/或DNA含量。本发明的抗体分子还可用于诊断,例如用于疾病状态的体内诊断和成像。在一个实施方案中,提供了选择根据本发明的多特异性蛋白质构建体的方法,包括:a)当V1或V2是关于给定可变区对的dsscFv时,测定单体多特异性蛋白的产率b)当在(a)中测试的V1或V2中的任一个是关于相同可变区对的dsFv时,测定单体多特异性蛋白的产率,以及c)比较(a)和(b)中获得的单体的产率,并选择具有最高单体产率的多特异性蛋白。通常,该方法的步骤(a)和(b)中的“可变区对”是VH和VL对。通常VH和VL一起形成抗原结合结构域V1或V2。因此,该方法允许在本发明的构建体中以dsscFv和dsFv形式测试VH和VL对,并且在步骤(c)中选择最多单体的构建体。通常在该方法的步骤(a)和(b)中,在纯化后,诸如在亲和层析之后测定产率。单体产率可以使用任何合适的方法,诸如尺寸排阻层析法来测定。在本说明书的上下文中的“包含”旨在意指包括。在技术上合适的情况下,可以组合本发明的实施方案。在本文中将实施方案描述为包括某些特征/元素。本公开内容还扩展至由所述特征/元素组成或基本上由所述特征/元件组成的单独实施方案。诸如专利和专利申请的技术参考文献通过引用并入本文。本文具体地和明确地引述的任何实施方案可单独地或与一个或多个另外的实施方案组合地形成否定声明的基础。本公开内容进一步通过参考附图的以下实施例仅以举例说明的方式来进行描述,其中:附图说明图1显示本公开内容的Fab-2xdsscFv和Fab-dsscFv-dsFv构建体。图2显示蛋白G纯化的、HEK293表达的Fab-1xdsscFv、1xscFv和Fab-2xdsscFv蛋白的SDS-PAGE分析。图3显示了蛋白G纯化的、HEK293表达的Fab-1xdsscFv、1xscFv和Fab-2xdsscFv蛋白的G3000SEHPLC分析。图4显示纯化的HEK293表达的Fab-2xdsscFv#3蛋白的SDS-PAGE分析。图5显示纯化的HEK293-表达的Fab-2xdsscFv#3蛋白的S200SEHPLC分析图6显示本公开内容的各种蛋白G纯化的Fab-dsscFv-dsFv构建体的SDS-PAGE分析。(A)Fab-dsscFv-dsscFv样品。(B)Fab-dsscFv-dsFv样品图7显示本公开内容的蛋白G纯化的Fab-dssFv-dsFv构建体的G3000SEHPLC分析。图8显示根据本公开内容的各种构建体在还原条件下的SDS-PAGE分析。图9显示单体Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的G3000SE-HPLC时程分析图10显示蛋白质-G纯化的EXPiHEK表达的Fab-2xscFv和Fab-2xdsscFv形式的SDS-PAGE分析实施例针对抗原1的抗体片段标记为#1针对抗原2的抗体片段标记为#2针对抗原3的抗体片段标记为#3针对抗原4的抗体片段标记为#4实施例1:Fab-2xdsscFv构建在哺乳动物细胞中表达的质粒通过使用柔性接头SGGGGSGGGGS[本文也称为S,2xG4S](SEQIDNO:2)将scFv#3和scFv#4融合至#2轻链的Km3同种异型人κ恒定区的C-末端,或通过使用柔性接头SGGGGTGGGGS[在本文中也称为S,G4T,G4S](SEQIDNO:1)将scFv#3和scFv#4融合至#2重链的γ1同种型人γ-1CH1恒定区的C-末端,来构建用于表达Fab#2-(HC)dsscFv#3,(LC)dsscFv#4和Fab#2-(LC)dsscFv#3,(HC)dsscFv#4(参见图1)的质粒。另外,在vL#3/vL#4和vH#3/vH#4的构架区中的选定残基处将点突变引入DNA序列。引入突变(重链G44C和轻链G100C)以在Fv#3的重链与轻链之间产生链间二硫键。引入突变(重链G44C和轻链Q100C)以在Fv#4的重链与轻链之间产生链间二硫键。化学制造编码scFv#4和dsscFv#4(vHvL和vLvH取向)的基因片段,并如上所述将其融合至Fab#2以产生:质粒e1:轻#2-(SGGGGSGGGGS[SEQIDNO:2])-vL#4-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO68])-vH#4;质粒f1:轻#2-(SGGGGSGGGGS[SEQIDNO:2])-dsvL#4-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-dsvH#4;质粒e2:轻#2-(SGGGGSGGGGS[SEQIDNO:2])-vH#4-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-vL#4;质粒f2:轻#2-(SGGGGSGGGGS[SEQIDNO:2])-dsvH#4-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-dsvL#4;质粒g1:重#2-(SGGGGTGGGGS[SEQIDNO:1])-vL#4-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-vH#4;质粒h1:重#2-(SGGGGTGGGGS[SEQIDNO:1])-dsvL#4-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-dsvH#4;质粒g2:重#2-(SGGGGTGGGGS[SEQIDNO:1])-vH#4-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-vL#4;和质粒h2:重#2-(SGGGGTGGGGS[SEQIDNO:1])-dsvH#4-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-dsvL#4。pND1质粒(Fab#2重-(SGGGGTGGGGSSEQIDNO:1)-dsvH#3-(GGGGSGGGGSGGGGSGGGGSSEQIDNO:68)-dsvL#3)[质粒i]是已可用的。从pND1切下编码dsHLscFv#3的基因片段,并如上所述将其与轻链#2融合以产生:轻#2-(SGGGGSGGGGSSEQIDNO:2)-dsvH#3-(GGGGSGGGGSGGGGSGGGGSSEQIDNO:68)-dsvL#3[质粒j]。将所有Fab融合形式克隆入在HCMV-MIE启动子和SV40EpolyA序列控制下的哺乳动物表达载体。Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的HEK293表达使用Invitrogen的293fectin转染试剂根据制造商的说明书用相关质粒转染HEK293细胞。如表4所示混合质粒以表达不同的构建体:表4用于转染的质粒的比例为1:1。将总共50μg质粒DNA与125μl293fectin+4.25mlOptimem培养基在室温下孵育20分钟。然后将混合物添加至以1x106个细胞/ml处于悬浮液中的50mlHEK293细胞中,并在37℃下振荡孵育。在第10天通过以1500g离心以除去细胞来收集上清液,并将上清液通过0.22μm过滤器。通过蛋白-GHPLC测定表达水平。表5显示蛋白质-GHPLC测定的结果。如可看到的,所有构建体的表达水平彼此相当,覆盖11-23μg/ml的范围。用星号(*)标示的那些在单独的转染中表达,因此LC-scFv#3、HC-scFv#4的绝对表达水平不能与HC-scFv#3、LC-scFv#4比较。表5抗体构建体表达水平(μg/ml)Fab#2(HC)dsHLscFv#3,(LC)HLscFv#423Fab#2(HC)dsHLscFv#3,(LC)dsHLscFv#418Fab#2(HC)dsHLscFv#3,(LC)LHscFv#421Fab#2(HC)dsHLscFv#3,(LC)dsLHscFv#420Fab#2(LC)dsHLscFv#3,(HC)HLscFv#413*Fab#2(LC)dsHLscFv#3,(HC)dsHLscFv#412*Fab#2(LC)dsHLscFv#3,(HC)LHscFv#412*Fab#2(LC)dsHLscFv#3,(HC)dsLHscFv#411*HEK293表达的Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的蛋白质-G纯化使用10kDa分子量截留离心浓缩器将~50mlHEK293上清液浓缩~25倍至~2ml。将浓缩的上清液应用于在20mM磷酸盐、40mMNaClpH7.4中平衡的1mlHiTrap蛋白-GFF柱(GEHealthcare)。柱子用20mM磷酸盐、40mMNaClpH7.4洗涤,结合的物质用0.1M甘氨酸/HClpH2.7洗脱。收集洗脱峰,并用2MTris/HClpH8.5将pH调节至~pH7.0。将pH调节的洗脱液浓缩,并使用10kDa分子量截留离心浓缩器将缓冲液交换到PBSpH7.4中。蛋白G纯化的HEK293表达的Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的SDS-PAGE分析将样品(2μg)用PBS稀释至9.75μl的体积,向其中加入3.75μl4xLDS样品缓冲液和1.5μl100mMN-乙基马来酰亚胺(非还原样品)或1.5μl10xNuPAGE还原剂(还原样品)。将样品涡旋,在70℃孵育10分钟,冷却并以12500rpm离心30秒。将制备的样品加载至4-20%丙烯酰胺Tris/甘氨酸SDS凝胶上,并在125V恒定电压下运行~100分钟。使用SeeBluePlus2(LifeTechnologies)分子量梯。凝胶用InstantBlue蛋白染料(Expedeon)染色并用蒸馏水脱色。还原和非还原性SDS-PAGE后的预期条带大小示于表6中。表6:对于所有蛋白质,预期非还原性凝胶在~100kDa处显示条带,而还原性凝胶预期在~50kDa处显示双峰,在两条带中具有相等的染色。对于所有Fab-1xdsscFv-1xscFv和Fab-2xdsscFv蛋白,还原性SDS-PAGE凝胶显示的带型表明构建体在迁移位置和染色强度两方面都正确表达,具有~50kDa处的双峰(图2B,D)。另外的最上方的次要带与未还原的全长蛋白一致。如所预期的,在非还原性凝胶上观察到二硫键连接的多聚体(图2A,C),其在还原条件下消失(图2B,D)。非还原性凝胶上~50kDa处的次带(图2A,C)可能与Fab区中重链与轻链之间不完全的ds键形成一致。蛋白G纯化的、HEK293表达的Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的G3000SE-HPLC分析在纯化后3天将10μg纯化的蛋白质样品(100μl0.1mg/ml稀释在PBS中的原液)注射至TSKGelG3000SWXL,7.8x300mm柱(Tosoh)上,并以1ml/min用等度梯度的200mM磷酸盐pH7.0显影。通过在280nm的吸光度检测信号。结果示于图3中。如从图3可看到的,在蛋白-G纯化后,Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式是83-89%的单体。虽然所有样品在测定中具有相似的单体水平,但含有缺乏Fv二硫键的scFv的那些样品处于动态平衡。这意味着在这些样品的测定中测量的单体百分比取决于样品的浓度,更浓的样品产生更高的单体百分比,更低浓度的样品产生更低的单体百分比。相反,其中两种scFv都含有二硫化物的样品是稳定的,并且不处于动态平衡中。因此,在测定中测量的单体百分比不随样品浓度的变化而变化。由于Fab-2xdsscFv形式中的单体和多聚体是稳定的,并且不处于动力学平衡,因此可以容易地进一步纯化样品以增加单体百分比。即使当给定制剂中构建体的浓度增加时,纯化的单体样品也将保持单体,由此使得构建体非常适合用于药物制剂。相比之下,Fab-2xscFv在纯化后可作为单体经历scFv结构域的vL与vH之间的分子间动态结构域交换。因此除了形成二聚体、三聚体、高级结构和聚集体的风险增加之外,难以观察到这样的分子,因为在分析方法期间使用的稀释步骤后非聚集形式可以解析为单体。因此,Fab-2xdsscFv在药物组合物的分析期间提供额外的清晰度。Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的CHOS表达用相关质粒通过电穿孔法以1L规模转染CHOS细胞。如表7所示混合质粒以表达蛋白质。使培养物在补充有2mMGlutaMAX的CD-CHO培养基中生长,并在37℃、8%CO2、140rpm下孵育24小时,随后在32℃下再孵育13天。在转染后第4天,向培养物中加入终浓度为3mM的丁酸钠。在转染后第14天,通过离心收获培养物上清液,并进行0.22μm过滤灭菌。通过蛋白GHPLC测量表达滴度(表8)。表7:表8:抗体构建体表达水平(μg/ml)Fab#2-(LC)dsHLscFv#3,(HC)HLscFv#415Fab#2-(LC)dsHLscFv#3,(HC)dsHLscFv#417Fab#2-(LC)dsHLscFv#3,(HC)LHscFv#418Fab#2-(LC)dsHLscFv#3,(HC)dsLHscFv#416CHO表达的Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的蛋白质-G纯化使用10kDa分子量截留Amicon搅拌池将1LCHO上清液浓缩~25倍至~40ml。将浓缩的上清液加载至具有蛋白G柱和作为运行缓冲液的PBS的AKTAExpressPurification系统上。结合的物质用0.1M甘氨酸/HClpH2.7洗脱,并用2MTris/HClpH8.5将pH调节至~pH7.0。然后使用10kDa分子量浓缩器浓缩洗脱的物质,将所得浓缩物加载至Superdex柱(GEHealthcare)上,用PBS作为运行缓冲液进行凝胶过滤。收集各洗脱峰并通过大小排阻HPLC分析以测定单体级分。将最终的单体蛋白质在PBS中浓缩至5mg/ml,并在4℃下储存。蛋白G纯化的CHOS表达的Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的单体级分的SDS-PAGE分析将样品(2μg)用PBS稀释至9.75μl的体积,向其中加入3.75μl4xLDS样品缓冲液和1.5μl100mMN-乙基马来酰亚胺(非还原样品)或1.5μl10xNuPAGE还原剂(还原样品)。将样品涡旋,在70℃孵育10分钟,冷却并以12500rpm离心30秒。将制备的样品加载至4-20%丙烯酰胺Tris/甘氨酸SDS凝胶上,并在125V恒定电压下运行~100分钟。使用Mark12(LifeTechnologies)分子量梯。凝胶用InstantBlue蛋白染料(Expedeon)染色并用蒸馏水脱色。还原和非还原SDS-PAGE后的预期条带大小示于表9中。表9:对于所有蛋白质,预期非还原性凝胶在~100kDa处显示条带,而还原性凝胶预期在~50kDa处显示双峰,其中在两条带中具有相等的染色。对于所有Fab-1xdsscFv-1xscFv和Fab-2xdsscFv蛋白,还原性SDS-PAGE凝胶显示的带型表明构建体是单体的,并且在迁移位置和染色强度两方面都正确表达,具有~50kDa的双峰(图8B,D)。另外的最上方的次要条带与非还原的全长蛋白质一致(图8B,D)。对于所有蛋白质,非还原性凝胶在~100kDa处显示条带,指示全长蛋白质(图8A,a)。非还原性凝胶上~50kDa的次要条带(图8A,b)可能与Fab区中重链与轻链之间不完全的二硫键形成一致。单体Fab-1xdsscFv-1xscFv和Fab-2xdsscFv形式的G3000SE-HPLC时程分析将5mg/ml的抗体形式的纯化单体在4℃下储存在PBS中,并在纯化后第4天、第14天和第28天进行分析。将样品在PBS中稀释至10μg,并注射至TSKGelG3000SWXL,7.8x300mm柱(Tosoh)上,并用200mM磷酸盐pH7.0的等度梯度以1ml/min显影。通过在280nm的吸光度检测信号。结果示于图9中。在纯化后第4天,Fab-2xdsscFv的分析表明,大部分蛋白质在实验开始时是单体的(实线),并且在时间过程中保持单体和稳定,其中<1%被界定为多聚体(二聚体、三聚体、更高阶和大的聚集体)。另一方面,对于被观察到随时间线性增加的Fab-1xdsscFv-1xscFv,检测到更高的多聚化发生率(虚线)。事实上,在以VL/VH取向上含有非二硫化物稳定的scFv的形式中,多聚化的普遍性似乎更加明显。然而,清楚的是,含有缺乏Fv二硫化物的scFv的形式在储存期间处于动态平衡,并且比被二硫化物稳定的scFv更易于多聚化。事实上,即使当给定制剂中蛋白质的浓度增加时,包含均被二硫化物稳定的scFv的形式仍显示保持单体。这使得在储存期间形成更高阶多聚体或大聚集体的风险极其需要是不显著的情况下,其中两个scFv均含有Fv二硫化物的构建体理想地适合用于药物制。实施例2:Fab-2xdsscFv(双价的,具有两个相同的dsscFv)构建在哺乳动物细胞中表达的质粒通过使用柔性接头SGGGGSGGGGS[本文也称为S,2xG4S](SEQIDNO:2)将dsscFv#3融合至轻链2#的Km3同种异型人κ轻链恒定区的C末端,或通过使用柔性接头SGGGGTGGGGS[本文也称为S,G4T,G4S](SEQIDNO:1)将dsscFv#3融合至重链#2的γ1同种型人γ-1CH1恒定区的C末端,来构建用于表达Fab#2-(HC)dsscFv#3,(LC)dsscFv#3的质粒(参见图4)。将点突变在vL#3/vL#1和vH#3/vH#1的构架区中的选定残基处引入DNA序列。引入突变(重链G44C和轻链G100C)以在Fv#3的重链与轻链之间产生链间二硫键。pND1质粒(Fab#2重-(SGGGGTGGGGS[SEQIDNO:1)-dsvH#3-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-dsvL#3)[质粒i]是已可用的。从pND1切下编码dsHLscFv#3的基因片段,并如上所述将其与轻链#2融合以产生:轻#2-(SGGGGSGGGGS[SEQIDNO:2])-dsvH#3-(GGGGSGGGGSGGGGSGGGGS[SEQIDNO:68])-dsvL#3[质粒j]。将Fab融合形式克隆入在HCMV-MIE启动子和SV40EpolyA序列控制下的哺乳动物表达载体。Fab-2xdsscFv#3的HEK293表达使用Invitrogen的293fectin转染试剂根据制造商的说明书用相关质粒转染HEK293细胞。如表10所示混合质粒以表达蛋白质:表10用于转染的质粒的比例为1:1。将总共50μg质粒DNA与125μl293fectin+4.25mlOptimem培养基在室温下孵育20分钟。然后将混合物添加至以1x106个细胞/ml处于悬浮液中的50mlHEK293细胞中,并在37℃下振荡孵育。在第10天通过以1500g离心以除去细胞来收集上清液,并将上清液通过0.22μm过滤器。通过蛋白-GHPLC测定表达水平。表11显示蛋白-GHPLC测定的结果。表达水平为20μg/ml。表11抗体构建体表达水平(μg/ml)Fab#2(HC)dsHLscFv#3,(LC)dsHLscFv#320纯化HEK293表达的Fab-2xdsscFv#3使用30kDa分子量截留离心浓缩器将~50mlHEK293上清液浓缩~25倍至~2ml。将浓缩的上清液纯化并进一步浓缩,并使用30kDa分子量截留离心浓缩器交换缓冲液到PBSpH7.4中。蛋白G纯化的HEK293表达的Fab-2xdsscFv#3的SDS-PAGE分析将样品(2μg)用PBS稀释至9.75μl的体积,向其中加入3.75μl4xLDS样品缓冲液和1.5μl100mMN-乙基马来酰亚胺(非还原样品)或1.5μl10xNuPAGE还原剂(还原样品)。将样品涡旋,在70℃孵育10分钟,冷却并以12500rpm离心30秒。将制备的样品加载至4-20%丙烯酰胺Tris/甘氨酸SDS凝胶上,并在125V恒定电压下运行~100分钟。使用SeeBluePlus2(LifeTechnologies)分子量梯。凝胶用InstantBlue蛋白质染料(Expedeon)染色并用蒸馏水脱色。还原和非还原性SDS-PAGE后的预期条带大小示于表12中。表12:预期非还原性凝胶在~100kDa处显示条带,而还原性凝胶预期在~50kDa处显示双峰,其中在两条带中具有相等的染色。还原性SDS-PAGE凝胶显示的带型表明构建体在迁移位置和染色强度方面都正确定表达,具有~50kDa的双峰(图4B),然而还观察到一些另外的次要种类,可能归因于与标准的蛋白G介导的纯化方法(其通常用于Fab的纯化)相对的次最佳纯化方案。二硫化物连接的多聚体在非还原性凝胶上可见(图4A),其在还原条件下消失(图4B)。纯化的HEK293表达的Fab-2xdsscFv#3的S200SE-HPLC分析在纯化后3天将10μg纯化的蛋白质样品(100μl的0.1mg/ml稀释在PBS中的原液)注射至Superdex20010/300GLTricorn柱(GEHealthcare)上,并使用等度梯度的PBSpH7.4以1ml/min进行显影,通过280nm处的吸光度连续检测。结果示于图5中。如可从图5看到的,纯化后,Fab-2xdsscFv#3形式为81%单体。实施例3:Fab-(HC)dsscFv-(LC)dsFv用于在哺乳动物细胞中表达的Fab#2-(HC)dsscFv#3-(LC)dsscFv#1和Fab#2-(HC)dsscFv#3-(LC)dsFv#1(LC-vL连接的)质粒的构建通过使用柔性接头SGGGGSGGGGSGGGGS(SEQIDNO:69)将dsscFv#1(dsvH-4xG4S-dsvL)或dsvL#1融合至轻链#2的Km3同种异型人κ恒定区的C末端以产生:轻#2-(SGGGGSGGGGSGGGGS[SEQIDNO:69])-dsscFv#1[质粒b]和轻#2-(SGGGGSGGGGSGGGGS[SEQIDNO:69])-dsvL#1[质粒c];以及通过使用柔性接头SGGGGSGGGGTGGGGS(SEQIDNO:70)将HLdsscFv#3(dsvH-4xG4S-dsvL)融合至重链#2的γ1同种型人γ-1CH1恒定区的C-末端以产生:重#2-(SGGGGSGGGGTGGGGS[SEQIDNO:70])-dsscFv#3[质粒a],来构建用于表达Fab#2-(HC)dsscFv#3-(LC)dsscFv#1和Fab#2-(HC)dsscFv#3-(LC)dsFv#1(LC-vL连接的)的Fab#2融合蛋白(参见图6)。将点突变(重链G44C和轻链G100C)在vL#3、vH#3、vL#1和vH#1的构架区中的选定残基处引入DNA序列,以在Fv#3和Fv#1的重链与轻链之间产生链间二硫键。将重链和轻链Fab-融合基因克隆入在HCMV-MIE启动子和SV40EpolyA序列控制下的哺乳动物表达载体。化学地制备编码下述的基因:重#2-(SGGGGSGGGGTGGGGS[SEQIDNO:70])-dsscFv#3[质粒a]和dsvH#1游离结构域[质粒d],并将其单独地克隆入在HCMV-MIE启动子和SV40EpolyA序列控制下的哺乳动物表达载体。化学制备编码dsscFv#1和dsvL#1的基因,并将其融合至轻链#2的C末端以产生:轻#2-(SGGGGSGGGGSGGGGS[SEQIDNO:69])-dsscFv#1[质粒b]和轻#2-(SGGGGSGGGGSGGGGS[SEQIDNO:69])-dsvL#1[质粒c]并将整个构建体克隆入在HCMV-MIE启动子和SV40EpolyA序列控制下的哺乳动物表达载体中。Fab#2-(HC)dsscFv#3-(LC)dsscFv#1和Fab#2-(HC)dsscFv#3-(LC)dsFv#1(LC-vL连接的)的HEK293的表达使用Invitrogen的293fectin转染试剂根据制造商的说明书用相关质粒转染HEK293细胞。将质粒如下混合以表达如下表13所示的不同构建体:表13对于2种质粒的组合,用于转染的质粒的比例为1:1,而对于3种质粒的组合,比例为1:1:1。将总共50μg质粒DNA与125μl293fectin+4.25mlOptimem培养基在室温下孵育20分钟。然后将混合物添加至以1x106个细胞/ml处于悬浮液中的50mlHEK293细胞中,并在37℃下振荡孵育。在第10天通过以1500g离心以除去细胞来收集上清液,并将上清液通过0.22μm过滤器。通过蛋白-GHPLC测定表达水平。结果示于表14中。如可看到的,两种构建体的表达水平彼此相当(16-18μg/ml)。文献中已经报道,缺少vL与vH之间的接头或使vL和vH拉在一起的二聚化基序的Fv区域的表达具有比连接的Fv显著更低的表达水平。令人惊讶的是,这在本例的数据中未被观察到,其中在每种类型的构建体的表达水平之间未观察到显著差异。表14:HEK293表达的Fab#2-(HC)dsscFv#3-(LC)dsscFv#1和Fab#2-(HC)dsscFv#3-(LC)dsFv#1(LC-vL连接的)的蛋白-G纯化使用10kDa分子量截留离心浓缩器将~50mlHEK293上清液浓缩~25倍至~2ml。将浓缩的上清液应用于在20mM磷酸盐、40mMNaClpH7.4中平衡的1mlHiTrap蛋白-GFF柱(GEHealthcare)。柱子用20mM磷酸盐、40mMNaClpH7.4洗涤,结合的物质用0.1M甘氨酸/HClpH2.7洗脱。收集洗脱峰,并用2MTris/HClpH8.5将pH调节至~pH7.0。将pH调节的洗脱液浓缩,并使用10kDa分子量截留离心浓缩器交换缓冲液到PBSpH7.4中。蛋白G纯化的HEK293表达的Fab#2-(HC)dsscFv#3-(LC)dsscFv#1和Fab#2-(HC)dsscFv#3-(LC)dsFv#1(LC-vL连接的)的SDS-PAGE分析将样品(2μg)用PBS稀释至体积为9.75μl,向其中加入3.75μl4xLDS样品缓冲液和1.5μl100mMN-乙基马来酰亚胺(非还原样品)或1.5μl10xNuPAGE还原剂(还原样品)。将样品涡旋,在70℃孵育10分钟,冷却并以12500rpm离心30秒。将制备的样品加载至4-20%丙烯酰胺Tris/甘氨酸SDS凝胶上,并在125V恒定电压下运行~100分钟。使用SeeBluePlus2(LifeTechnologies)分子量梯。凝胶用InstantBlue蛋白质染料(Expedeon)染色并用蒸馏水脱色。结果显示在图6中。对于Fab#2-(HC)dsscFv#3-(LC)dsscFv#1,预期非还原性凝胶在~100kDa处显示条带,而还原性凝胶预期显示在~50kDa的双峰,其中在两个带中具有大致相等的染色。对于Fab#2-(HC)dsscFv#3-(LC)dsFv#1(LC-vL连接的),预期非还原性凝胶在~100kDa处显示条带,而还原性凝胶预期显示在~50kDa、~36kDa和~13kDa处的3个条带,从上至下条带的染色比例大致为3:2:1。还原性SDS-PAGE凝胶显示的带型表明构建体在迁移位置和染色强度方面都正确表达。对于Fab-2xdsscFv,非还原性SDS-PAGE凝胶显示与多聚化一致的>200kDa的显著带型(图6A,泳道2),但在Fab-dsscFv-dsFv样品中观察到较少的高分子量种类(图6B,泳道2)。蛋白-G纯化的HEK293表达的Fab#2-(HC)dsscFv#3-(LC)dsscFv#1和Fab#2-(HC)dsscFv#3-(LC)dsFv#1(LC-vL连接的)的G3000SE-HPLC分析纯化后3天将10μg纯化的蛋白质样品(100μl0.1mg/ml稀释在PBS中的原液)注射到TSKGelG3000SWXL,7.8x300mm柱(Tosoh)上,并用等度梯度的200mM磷酸盐pH7.0以1ml/min进行显影。通过280nm处的吸光度检测信号。结果示于图7中。在蛋白-G纯化后,Fab#2-(HC)dsscFv#3-(LC)dsFv#1(LC-vL连接的)为91%单体,而Fab#2-(HC)dsscFv#3-(LC)dsscFv#1为30%单体。已知dsscFv#1特别易于多聚化。假定多聚体通过dsscFv接头(vL#1或vH#1与来自不同多肽链的vH#1或vL#1配对)物理连接,通过用dsFv#1(其不包含scFv接头)替代dsscFv#1,获得的单体百分比显著增加。本领域技术人员因此将理解,取决于dsscFv的多聚化的倾向,在一些情况下,使用dsFv而非dsscFv会是有利的。实施例4Biacore亲和力和抗原靶标的同时结合的证明通过在BIAcoreT100或BIAcore3000上使用CM5传感器芯片(GEHealthcareBio-SciencesAB)和HBS-EP(10mMHEPES(pH7.4),150mMNaCl,3mMEDTA,0.05%v/v表面活性剂P20)运行缓冲液进行的表面等离子体共振术(SPR)来测定Fab#2-(HC)dsHLscFv#3(LC)dsHLscFv#4的相互作用的结合亲和力和动力学参数。所有实验在25℃下进行。使用人F(ab')2特异性山羊Fab(JacksonImmunoResearch)或内部产生的抗人CH1单克隆抗体将抗体样品捕获至传感器芯片表面。捕获抗体的共价固定通过标准胺偶联化学实现至6000-7000响应单位(RU)的水平。在捕获的抗体上分别滴定抗原#2、#3或#4。每个测定循环由首先使用1分钟注射来捕获抗体样品、随后由3分钟抗原注射组成的缔合期、之后监测解离10分钟组成。在每个循环后,捕获表面通过2x1分钟的40mMHCl注射,然后30秒的5mMNaOH注射来再生。使用的流速为10μlmin-1(用于捕获),30μlmin-1(用于缔合和解离期),以及10μlmin-1(用于再生)。通过使用BIAcoreT100Evaluation软件V2.0.1或BIAcore3000BIAEvaluationv3.2将所得传感图与标准1:1结合模型同时全局拟合来测定动力学参数。结果示于表15中。抗体显示预期的在pM-nM范围内的对测试的抗原的亲和力。表15:分析物ka(1/Ms)kd(1/s)KD(M)KD(pM)抗原#25.06E+063.80E-057.51E-127.51抗原#35.54E+066.43E-051.16E-1111.6抗原#47.75E+041.35E-041.74E-091740通过经由固定的抗人IgG-F(ab’)2将三特异性抗体捕获至传感器芯片来评估Fab#2-(HC)dsHLscFv#3(LC)dsHLscFv#4同时结合所有3种抗原的潜力。将每种抗原或抗原#2、#3和#4的混合溶液在捕获的抗体上以3分钟注射滴定。对于独立注射观察到的结合反应和组合反应示于表16中。组合的抗原#2/#3/#4溶液的结合反应等于独立注射的反应的总和。这证实了Fab#2-(HC)dsHLscFv#3(LC)dsHLscFv#4能够同时结合所测试的所有3种抗原。表16:实施例5.Fab-2xscFv和Fab-2xdsscFv形式之间的单体产率的比较用相关质粒通过电穿孔法以50ml规模转染EXpiHEK细胞。如表17所示混合质粒以表达蛋白质。使培养物在ExpiHEK表达培养基中生长,并在37℃下用8%CO2以120rpm孵育16-18小时,然后加入增强子1和2。随后将培养物在37℃下再孵育4天。通过离心收集培养物上清液,并进行0.22μm过滤灭菌。通过蛋白GHPLC测量表达滴度(表18)。表17:表18:EXPiHEK表达的表达Fab-2xscFvFv和Fab-2xdsscFv形式的蛋白G纯化使用10kDa分子量截留浓缩器将上清液浓缩~25倍至~2ml。使用磷酸盐缓冲液pH7.4通过蛋白质GHPLC纯化浓缩的上清液。结合的物质用0.1M甘氨酸/HClpH2.7洗脱,并用2MTris/HClpH8.5将pH调节至~pH7.0。使用10kDa分子量浓缩器浓缩洗脱的物质,并交换缓冲液到PBS中。将纯化的蛋白质在PBS中浓缩至~4-5mg/ml,并在4℃下储存。蛋白G纯化的EXPiHEK表达的Fab-2xscFv和Fab-2xdsscFv形式的SDS-PAGE分析将样品(2μg)用PBS稀释至9.75μl的体积,向其中加入3.75μl4xLDS样品缓冲液和1.5μl100mMN-乙基马来酰亚胺(非还原样品)或1.5μl10xNuPAGE还原剂(还原样品)。将样品涡旋,在70℃孵育10分钟,冷却并以12500rpm离心30秒。将制备的样品加载至4-20%丙烯酰胺Tris/甘氨酸SDS凝胶上,并在125V恒定电压下运行~100分钟。使用Seeblue2(LifeTechnologies)分子量梯。凝胶用InstantBlue蛋白质染料(Expedeon)染色并用蒸馏水脱色。还原和非还原性SDS-PAGE后的预期条带大小示于表19中。表19:对于所有蛋白质,预期非还原性凝胶在~100kDa处显示条带,而还原性凝胶预期在~50kDa处显示双峰,其中在两条带中具有相等的染色。对于所有Fab-2xscFv和Fab-2xdsscFv蛋白,还原性SDS-PAGE凝胶显示的带型表明构建体在迁移位置和染色强度两方面均正确表达,在~50kDa处具有双峰(图10B,a)。另外的最上方的次要带与未还原的全长蛋白一致(图10B,b)。对于所有蛋白质,非还原性凝胶显示在~130kDa处的条带,指示全长蛋白质(图10A,a)。非还原性凝胶上~50kDa处的条带(图10A,b)可能与Fab区中重链与轻链之间不完全的二硫键形成一致。Fab-2xscFv和Fab-2xdsscFv形式的G3000SE-HPLC分析在分析前,将~5mg/ml的纯化抗体蛋白在PBS中于4℃下储存24小时。将等于25μg的浓度的样品注射至TSKGelG3000SWXL,7.8x300mm柱(Tosoh)上,并用等度梯度的200mM磷酸盐pH7.0以1ml/min进行显影。通过280nm处的吸光度检测信号。结果显于表20中。分析表明所有Fab-2xdsscFv蛋白质是>90%单体的。另一方面,对于所有Fab-2xscFv检测到更高的多聚化发生率。显然,与缺乏Fv二硫化物的scFv相比,含有具有Fv二硫化物的scFv的形式呈现更多单体。这表明在选择具有稳定质量和在制造过程中会是有利的属性的治疗性分子方面,优选使用具有含有Fv二硫化物的scFv的形式。表20:形式单体%Fab#4-(LC)HLscFv#5,(HC)HLscFv#651.3Fab#4-(LC)dsHLscFv#5,(HC)dsHLscFv#696.8Fab#4-(LC)HLscFv#7,(HC)HLscFv#880.8Fab#4-(LC)dsHLscFv#7,(HC)dsHLscFv#898.8Fab#4-(LC)HLscFv#9,(HC)LHscFv#1084.9Fab#4-(LC)dsHLscFv#9,(HC)dsLHscFv#1094.3Fab#4-(LC)HLscFv#7,(HC)LHscFv#1053.2Fab#4-(LC)dsHLscFv#7,(HC)dsLHscFv#1090.8序列表<110>UCBBiopharmaSPRL<120>多特异性抗体构建体<130>G0228_WO<160>80<170>PatentInversion3.5<210>1<211>11<212>PRT<213>人工序列<220><223>肽接头<400>1SerGlyGlyGlyGlyThrGlyGlyGlyGlySer1510<210>2<211>11<212>PRT<213>人工序列<220><223>肽接头<400>2SerGlyGlyGlyGlySerGlyGlyGlyGlySer1510<210>3<211>8<212>PRT<213>人工序列<220><223>铰链接头<400>3AspLysThrHisThrCysAlaAla15<210>4<211>11<212>PRT<213>人工序列<220><223>铰链接头<400>4AspLysThrHisThrCysProProCysProAla1510<210>5<211>18<212>PRT<213>人工序列<220><223>铰链接头<400>5AspLysThrHisThrCysProProCysProAlaThrCysProProCys151015ProAla<210>6<211>25<212>PRT<213>人工序列<220><223>铰链接头<400>6AspLysThrHisThrCysProProCysProAlaThrCysProProCys151015ProAlaThrCysProProCysProAla2025<210>7<211>30<212>PRT<213>人工序列<220><223>铰链接头<400>7AspLysThrHisThrCysProProCysProAlaGlyLysProThrLeu151015TyrAsnSerLeuValMetSerAspThrAlaGlyThrCysTyr202530<210>8<211>31<212>PRT<213>人工序列<220><223>铰链接头<400>8AspLysThrHisThrCysProProCysProAlaGlyLysProThrHis151015ValAsnValSerValValMetAlaGluValAspGlyThrCysTyr202530<210>9<211>15<212>PRT<213>人工序列<220><223>铰链接头<400>9AspLysThrHisThrCysCysValGluCysProProCysProAla151015<210>10<211>26<212>PRT<213>人工序列<220><223>铰链接头<400>10AspLysThrHisThrCysProArgCysProGluProLysSerCysAsp151015ThrProProProCysProArgCysProAla2025<210>11<211>11<212>PRT<213>人工序列<220><223>铰链接头<400>11AspLysThrHisThrCysProSerCysProAla1510<210>12<211>7<212>PRT<213>人工序列<220><223>柔性接头<400>12SerGlyGlyGlyGlySerGlu15<210>13<211>6<212>PRT<213>人工序列<220><223>柔性接头<400>13AspLysThrHisThrSer15<210>14<211>6<212>PRT<213>人工序列<220><223>柔性接头<400>14SerGlyGlyGlyGlySer15<210>15<211>11<212>PRT<213>人工序列<220><223>柔性接头<400>15SerGlyGlyGlyGlySerGlyGlyGlyGlySer1510<210>16<211>16<212>PRT<213>人工序列<220><223>柔性接头<400>16SerGlyGlyGlyGlySerGlyGlyGlyGlySerGlyGlyGlyGlySer151015<210>17<211>21<212>PRT<213>人工序列<220><223>柔性接头<400>17SerGlyGlyGlyGlySerGlyGlyGlyGlySerGlyGlyGlyGlySer151015GlyGlyGlyGlySer20<210>18<211>26<212>PRT<213>人工序列<220><223>柔性接头<400>18SerGlyGlyGlyGlySerGlyGlyGlyGlySerGlyGlyGlyGlySer151015GlyGlyGlyGlySerGlyGlyGlyGlySer2025<210>19<211>11<212>PRT<213>人工序列<220><223>柔性接头<400>19AlaAlaAlaGlySerGlyGlyAlaSerAlaSer1510<210>20<211>16<212>PRT<213>人工序列<220><223>柔性接头<220><221>misc_feature<222>(7)..(7)<223>Xaa可以是天然存在的氨基酸<400>20AlaAlaAlaGlySerGlyXaaGlyGlyGlySerGlyAlaSerAlaSer151015<210>21<211>21<212>PRT<213>人工序列<220><223>柔性接头<220><221>misc_feature<222>(7)..(7)<223>Xaa可以是天然存在的氨基酸<220><221>misc_feature<222>(12)..(12)<223>Xaa可以是天然存在的氨基酸<400>21AlaAlaAlaGlySerGlyXaaGlyGlyGlySerXaaGlyGlyGlySer151015GlyAlaSerAlaSer20<210>22<211>26<212>PRT<213>人工序列<220><223>柔性接头<220><221>misc_feature<222>(7)..(7)<223>Xaa可以是天然存在的氨基酸<220><221>misc_feature<222>(12)..(12)<223>Xaa可以是天然存在的氨基酸<220><221>misc_feature<222>(17)..(17)<223>Xaa可以是天然存在的氨基酸<400>22AlaAlaAlaGlySerGlyXaaGlyGlyGlySerXaaGlyGlyGlySer151015XaaGlyGlyGlySerGlyAlaSerAlaSer2025<210>23<211>31<212>PRT<213>人工序列<220><223>柔性接头<220><221>misc_feature<222>(7)..(7)<223>Xaa可以是天然存在的氨基酸<220><221>misc_feature<222>(12)..(12)<223>Xaa可以是天然存在的氨基酸<220><221>misc_feature<222>(17)..(17)<223>Xaa可以是天然存在的氨基酸<220><221>misc_feature<222>(22)..(22)<223>Xaa可以是天然存在的氨基酸<400>23AlaAlaAlaGlySerGlyXaaGlyGlyGlySerXaaGlyGlyGlySer151015XaaGlyGlyGlySerXaaGlyGlyGlySerGlyAlaSerAlaSer202530<210>24<211>13<212>PRT<213>人工序列<220><223>柔性接头<220><221>misc_feature<222>(7)..(7)<223>Xaa可以是天然存在的氨基酸<400>24AlaAlaAlaGlySerGlyXaaSerGlyAlaSerAlaSer1510<210>25<211>28<212>PRT<213>人工序列<220><223>柔性接头<400>25ProGlyGlyAsnArgGlyThrThrThrThrArgArgProAlaThrThr151015ThrGlySerSerProGlyProThrGlnSerHisTyr2025<210>26<211>11<212>PRT<213>人工序列<220><223>柔性接头<400>26AlaThrThrThrGlySerSerProGlyProThr1510<210>27<211>6<212>PRT<213>人工序列<220><223>柔性接头<400>27AlaThrThrThrGlySer15<210>28<211>21<212>PRT<213>人工序列<220><223>柔性接头<400>28GluProSerGlyProIleSerThrIleAsnSerProProSerLysGlu151015SerHisLysSerPro20<210>29<211>15<212>PRT<213>人工序列<220><223>柔性接头<400>29GlyThrValAlaAlaProSerValPheIlePheProProSerAsp151015<210>30<211>15<212>PRT<213>人工序列<220><223>柔性接头<400>30GlyGlyGlyGlyIleAlaProSerMetValGlyGlyGlyGlySer151015<210>31<211>15<212>PRT<213>人工序列<220><223>柔性接头<400>31GlyGlyGlyGlyLysValGluGlyAlaGlyGlyGlyGlyGlySer151015<210>32<211>15<212>PRT<213>人工序列<220><223>柔性接头<400>32GlyGlyGlyGlySerMetLysSerHisAspGlyGlyGlyGlySer151015<210>33<211>15<212>PRT<213>人工序列<220><223>柔性接头<400>33GlyGlyGlyGlyAsnLeuIleThrIleValGlyGlyGlyGlySer151015<210>34<211>15<212>PRT<213>人工序列<220><223>柔性接头<400>34GlyGlyGlyGlyValValProSerLeuProGlyGlyGlyGlySer151015<210>35<211>12<212>PRT<213>人工序列<220><223>柔性接头<400>35GlyGlyGluLysSerIleProGlyGlyGlyGlySer1510<210>36<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>36ArgProLeuSerTyrArgProProPheProPheGlyPheProSerVal151015ArgPro<210>37<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>37TyrProArgSerIleTyrIleArgArgArgHisProSerProSerLeu151015ThrThr<210>38<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>38ThrProSerHisLeuSerHisIleLeuProSerPheGlyLeuProThr151015PheAsn<210>39<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>39ArgProValSerProPheThrPheProArgLeuSerAsnSerTrpLeu151015ProAla<210>40<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>40SerProAlaAlaHisPheProArgSerIleProArgProGlyProIle151015ArgThr<210>41<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>41AlaProGlyProSerAlaProSerHisArgSerLeuProSerArgAla151015PheGly<210>42<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>42ProArgAsnSerIleHisPheLeuHisProLeuLeuValAlaProLeu151015GlyAla<210>43<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>43MetProSerLeuSerGlyValLeuGlnValArgTyrLeuSerProPro151015AspLeu<210>44<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>44SerProGlnTyrProSerProLeuThrLeuThrLeuProProHisPro151015SerLeu<210>45<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>45AsnProSerLeuAsnProProSerTyrLeuHisArgAlaProSerArg151015IleSer<210>46<211>17<212>PRT<213>人工序列<220><223>柔性接头<400>46LeuProTrpArgThrSerLeuLeuProSerLeuProLeuArgArgArg151015Pro<210>47<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>47ProProLeuPheAlaLysGlyProValGlyLeuLeuSerArgSerPhe151015ProPro<210>48<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>48ValProProAlaProValValSerLeuArgSerAlaHisAlaArgPro151015ProTyr<210>49<211>17<212>PRT<213>人工序列<220><223>柔性接头<400>49LeuArgProThrProProArgValArgSerTyrThrCysCysProThr151015Pro<210>50<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>50ProAsnValAlaHisValLeuProLeuLeuThrValProTrpAspAsn151015LeuArg<210>51<211>18<212>PRT<213>人工序列<220><223>柔性接头<400>51CysAsnProLeuLeuProLeuCysAlaArgSerProAlaValArgThr151015PhePro<210>52<211>11<212>PRT<213>人工序列<220><223>刚性接头<400>52GlyAlaProAlaProAlaAlaProAlaProAla1510<210>53<211>4<212>PRT<213>人工序列<220><223>刚性接头<400>53ProProProPro1<210>54<211>11<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>54AspLeuCysLeuArgAspTrpGlyCysLeuTrp1510<210>55<211>11<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>55AspIleCysLeuProArgTrpGlyCysLeuTrp1510<210>56<211>15<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>56MetGluAspIleCysLeuProArgTrpGlyCysLeuTrpGlyAsp151015<210>57<211>20<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>57GlnArgLeuMetGluAspIleCysLeuProArgTrpGlyCysLeuTrp151015GluAspAspGlu20<210>58<211>20<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>58GlnGlyLeuIleGlyAspIleCysLeuProArgTrpGlyCysLeuTrp151015GlyArgSerVal20<210>59<211>21<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>59GlnGlyLeuIleGlyAspIleCysLeuProArgTrpGlyCysLeuTrp151015GlyArgSerValLys20<210>60<211>15<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>60GluAspIleCysLeuProArgTrpGlyCysLeuTrpGluAspAsp151015<210>61<211>18<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>61ArgLeuMetGluAspIleCysLeuProArgTrpGlyCysLeuTrpGlu151015AspAsp<210>62<211>16<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>62MetGluAspIleCysLeuProArgTrpGlyCysLeuTrpGluAspAsp151015<210>63<211>15<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>63MetGluAspIleCysLeuProArgTrpGlyCysLeuTrpGluAsp151015<210>64<211>18<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>64ArgLeuMetGluAspIleCysLeuAlaArgTrpGlyCysLeuTrpGlu151015AspAsp<210>65<211>20<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>65GluValArgSerPheCysThrArgTrpProAlaGluLysSerCysLys151015ProLeuArgGly20<210>66<211>20<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>66ArgAlaProGluSerPheValCysTyrTrpGluThrIleCysPheGlu151015ArgSerGluGln20<210>67<211>11<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>67GluMetCysTyrPheProGlyIleCysTrpMet1510<210>68<211>20<212>PRT<213>人工序列<220><223>白蛋白结合肽<400>68GlyGlyGlyGlySerGlyGlyGlyGlySerGlyGlyGlyGlySerGly151015GlyGlyGlySer20<210>69<211>16<212>PRT<213>人工序列<220><223>柔性接头<400>69SerGlyGlyGlyGlySerGlyGlyGlyGlySerGlyGlyGlyGlySer151015<210>70<211>16<212>PRT<213>人工序列<220><223>柔性接头<400>70SerGlyGlyGlyGlySerGlyGlyGlyGlyThrGlyGlyGlyGlySer151015<210>71<211>10<212>PRT<213>人工的<220><223>CDRH1dAbH1<400>71GlyIleAspLeuSerAsnTyrAlaIleAsn1510<210>72<211>16<212>PRT<213>人工的<220><223>CDRH2dAbH1<400>72IleIleTrpAlaSerGlyThrThrPheTyrAlaThrTrpAlaLysGly151015<210>73<211>13<212>PRT<213>人工的<220><223>CDRH3dAbH1<400>73ThrValProGlyTyrSerThrAlaProTyrPheAspLeu1510<210>74<211>12<212>PRT<213>人工的<220><223>CDRL1dAbL1<400>74GlnSerSerProSerValTrpSerAsnPheLeuSer1510<210>75<211>7<212>PRT<213>人工的<220><223>CDRL2dAbL1<400>75GluAlaSerLysLeuThrSer15<210>76<211>11<212>PRT<213>人工的<220><223>CDRL3dAbL1<400>76GlyGlyGlyTyrSerSerIleSerAspThrThr1510<210>77<211>121<212>PRT<213>人工的<220><223>抗白蛋白抗体的重链可变结构域(无ds)<400>77GluValGlnLeuLeuGluSerGlyGlyGlyLeuValGlnProGlyGly151015SerLeuArgLeuSerCysAlaValSerGlyIleAspLeuSerAsnTyr202530AlaIleAsnTrpValArgGlnAlaProGlyLysGlyLeuGluTrpIle354045GlyIleIleTrpAlaSerGlyThrThrPheTyrAlaThrTrpAlaLys505560GlyArgPheThrIleSerArgAspAsnSerLysAsnThrValTyrLeu65707580GlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCysAla859095ArgThrValProGlyTyrSerThrAlaProTyrPheAspLeuTrpGly100105110GlnGlyThrLeuValThrValSerSer115120<210>78<211>121<212>PRT<213>人工的<220><223>抗白蛋白抗体的重链可变结构域(ds)<400>78GluValGlnLeuLeuGluSerGlyGlyGlyLeuValGlnProGlyGly151015SerLeuArgLeuSerCysAlaValSerGlyIleAspLeuSerAsnTyr202530AlaIleAsnTrpValArgGlnAlaProGlyLysCysLeuGluTrpIle354045GlyIleIleTrpAlaSerGlyThrThrPheTyrAlaThrTrpAlaLys505560GlyArgPheThrIleSerArgAspAsnSerLysAsnThrValTyrLeu65707580GlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCysAla859095ArgThrValProGlyTyrSerThrAlaProTyrPheAspLeuTrpGly100105110GlnGlyThrLeuValThrValSerSer115120<210>79<211>112<212>PRT<213>人工的<220><223>抗白蛋白抗体的轻链可变结构域(无ds)<400>79AspIleGlnMetThrGlnSerProSerSerValSerAlaSerValGly151015AspArgValThrIleThrCysGlnSerSerProSerValTrpSerAsn202530PheLeuSerTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeu354045IleTyrGluAlaSerLysLeuThrSerGlyValProSerArgPheSer505560GlySerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGln65707580ProGluAspPheAlaThrTyrTyrCysGlyGlyGlyTyrSerSerIle859095SerAspThrThrPheGlyGlyGlyThrLysValGluIleLysArgThr100105110<210>80<211>112<212>PRT<213>人工的<220><223>抗白蛋白抗体的轻链可变结构域(ds)<400>80AspIleGlnMetThrGlnSerProSerSerValSerAlaSerValGly151015AspArgValThrIleThrCysGlnSerSerProSerValTrpSerAsn202530PheLeuSerTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeu354045IleTyrGluAlaSerLysLeuThrSerGlyValProSerArgPheSer505560GlySerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGln65707580ProGluAspPheAlaThrTyrTyrCysGlyGlyGlyTyrSerSerIle859095SerAspThrThrPheGlyCysGlyThrLysValGluIleLysArgThr100105110当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺