结合ERBB‑2和ERBB‑3的抗体的制作方法
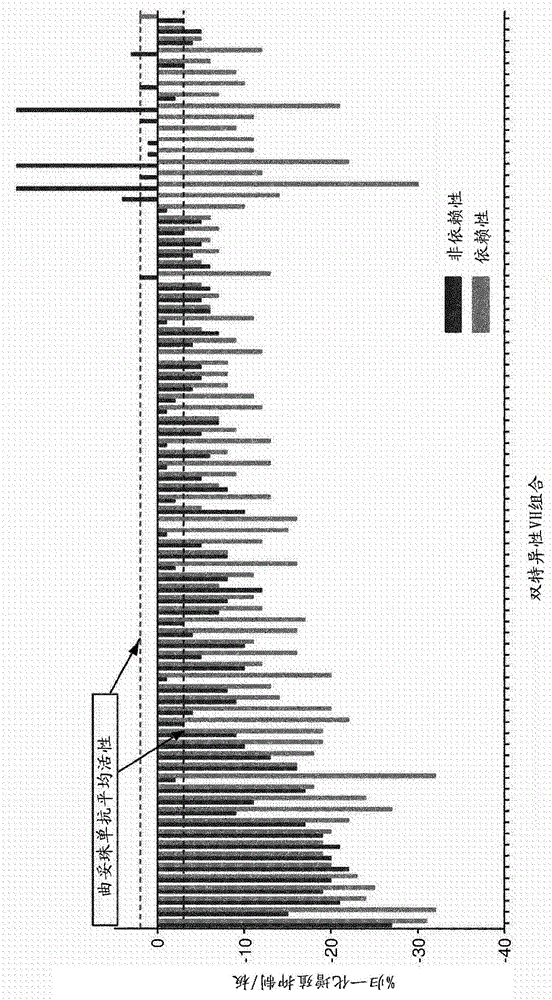
人表皮生长因子受体家族(humanepidermalgrowthfactorreceptorfamily,HER,还统称为ErbB信号传导网络)是跨膜受体酪氨酸激酶(receptortyrosinekinase,RTK)家族。该家族包含表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR)(也被称为ErbB-1(或HER1))以及同源受体ErbB-2(HER2)、ErbB-3(HER3)和ErbB-4(HER4)。这些受体(在Yarden和Pines,2012中综述)在上皮细胞上广泛表达。HER受体或其配体(例如调蛋白(heregulin,HRG)或表皮生长因子(epidermalgrowthfactor,EGF))的上调是人癌症中的频繁事件(Wilson,Fridlyand等,2012)。ErbB-1和ErbB-2的过表达特别地发生于上皮肿瘤中,并且与肿瘤侵袭、转移、对化疗的抗性以及不良预后相关(Zhang,Berezov等,2007)。在正常乳腺中,ErbB-3已被示出在腔内上皮的生长和分化中非常重要。例如,ErbB-3的丢失/抑制导致基底在腔内上皮上的选择性扩张(Balko,Miller等,2012)。配体与RTK胞外结构域的结合诱导受体二聚化,其发生于相同(同源二聚化)和不同(异源二聚化)的受体亚型之间。二聚化可活化胞内酪氨酸激酶结构域,其发生自体磷酸化并继而可活化许多下游的促增殖信号传导途径,包括由促分裂原活化的蛋白激酶(mitogen-activatedproteinkinases,MAPK)和促存活途径Akt介导的那些(在Yarden和Pines,2012中综述)。还没有鉴定出对ErbB-2特异性的内源性配体,因此其被推定为通过异源二聚化来正常地传导信号(Sergina,Rausch等2007)。ErbB-3可通过结合(engagement)其配体而被活化。这些配体包括但不限于神经调节蛋白(neuregulin,NRG)和调蛋白(HRG)。已经鉴定了活化ErbB受体家族信号传导的多种模式。其中有配体依赖性和配体非依赖性的信号传导活化。即使在不存在ErbB-3配体的情况下,过表达的ErbB-2也能够通过ErbB-2:ErbB-3异源二聚体产生致癌信号传导(Junttila,Akita等2009)。ErbB-2活性可被ErbB-2特异性抗体抑制。这样的ErbB-2特异性抗体例如被用于治疗ErbB-2阳性(HER2+)肿瘤。此类治疗的问题是肿瘤经常逃避ErbB-2特异性治疗,并且即使在抑制性抗体的存在下继续生长。已经观测到,ErbB-2阳性肿瘤(例如乳腺、卵巢、子宫颈和胃肿瘤)可通过表现出上调的ErbB-3表达(Ocana,Vera-Badillo等,2013)和/或ErbB-3配体表达(Wilson,Fridlyand等,2012)的肿瘤细胞亚群的选择性生长而逃避治疗。还已经鉴定了ErbB-3受体中的活化性突变。抗ErbB-2单克隆抗体曲妥珠单抗(trastuzumab,赫赛汀(Herceptin))和ErbB-1特异性的西妥昔单抗(cetuximab,爱必妥(Erbitux))在被批准用于临床应用的数种单克隆抗体之中。曲妥珠单抗具有已证明的在转移性乳腺癌中的生存益处(Arteaga,Sliwkowski等,2011)。曲妥珠单抗的精确作用机制尚未被明确地建立。建议的作用模型为RTK信号传导的抑制和抗体依赖性细胞毒性(antibodydependentcellularcytotoxicity,ADCC)的招募。其他已经描述的作用机制包括阻断ErbB-2胞外结构域的蛋白水解性切割、抑制血管发生因子以及增强受体内吞。干扰ErbB-2信号传导的其他试剂已经获得批准或尚在用于治疗乳腺癌及其他ErbB-2过表达癌症的开发中。例如,化合物拉帕替尼(lapatinib)抑制ErbB-1和ErbB-2二者的酪氨酸激酶活性并被用于ErbB-2扩增的乳腺癌的一线治疗。在患有HER2+转移性乳腺癌的患者中,对于曲妥珠单抗(作为单一药剂或者与化疗组合)的抗性通常发生于开始治疗的数月内。只有一部分患有HER2+转移性乳腺癌的患者对单一药剂的曲妥珠单抗有响应,这表明在晚期肿瘤中抗性的新机制(denovomechanism)。这些机制尤其包括来自于其他HER受体家族的信号传导以及来自于HER家族以外的RTK的补偿性信号传导(Thery等,Resistancetohumanepidermalgrowthfactorreceptortype2-targetedtherapies,EurJCancer(2014),Vol.50,Issue5,pages892-901(ttp://dx.doi.org/10.1016/j.ejca.2014.01.003))。例如,与HER2一起的HER3或其配体的过表达导致HER2/HER3异源二聚体的形成和对曲妥珠单抗的获得性抗性。因此,所述抗体曲妥珠单抗被认为在阻断由ErbB-3配体驱动的信号传导中是无效的(Wehrman,Raab等,2006,Junttila,Akita等,2009,Thery等,2014)。最近,单克隆抗体帕妥珠单抗(pertuzumab)基于其额外的5个月的无进展存活益处而被批准与曲妥珠单抗组合使用(Baselga,Cortes等,2012)。帕妥珠单抗还结合ErbB-2,但结合位置与曲妥珠单抗不同。治疗ErbB-2阳性肿瘤的其他策略针对ErbB-3。结合ErbB-3的单克隆抗体具有在临床前研究中经证明的活性(Schoeberl,Faber等,2010)。一些结合ErbB-3的单克隆抗体可抑制多种癌症的增殖和生长。另一种策略涉及结合ErbB-2和ErbB-3受体二者。分子MM-111是含有两条结合ErbB-2和ErbB-3的单链Fv(singlechainFv,scFv)片段的人造生物分子。所述两条scFv与突变的人血清白蛋白(humanserumalbumin,HSA)蛋白质相组合以提高所述分子的半衰期。在临床前试验中,所述分子表现出抑制ErbB-3信号传导和增殖。该作用主要在ErbB-2表达量相对高的ErbB-3阳性细胞系上测量。发明概述本发明提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,并且其中所述抗体能降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能。所述第一抗原结合部位优选存在于包含VH链的可变结构域中,其中所述VH链具有以下VH链的氨基酸序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958(为人源化的MF2971)、MF2971、MF3025、MF2916、MF3991(为人源化的MF3004)、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898,如图16A或图16E中所示。所述第二抗原结合部位优选存在于包含VH链的可变结构域中,其中所述VH链具有以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,如图16B或图16E或图37中所示。在所述可变结构域中的免疫球蛋白轻链优选包含图16C的氨基酸序列。除非另有具体规定,本发明的抗体优选为双特异性抗体。本发明还提供了药物组合物,其包含根据本发明的抗体。还提供了根据本发明的抗体,其还包含标记物(label),优选为用于体内成像的标记物。本发明还提供了用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤或有风险患有所述肿瘤的对象的方法,其包括向所述对象施用根据本发明的双特异性抗体。还提供了根据本发明的双特异性抗体,其用于治疗患有或有风险患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象。发明详述本发明提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述双特异性抗体降低或能降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能。本文中使用的术语“抗原结合部位”是指能够与抗原结合的来自于且优选存在于双特异性抗体上的部位。未经修饰的抗原结合部位通常由抗体的可变结构域形成并且存在于其中。所述可变结构域含有所述抗原结合部位。结合抗原的可变结构域为包含结合抗原的抗原结合部位的可变结构域。在一个实施方案中,本发明的抗体可变结构域包含重链可变区(VH)和轻链可变区(VL)。所述抗原结合部位可存在于组合的VH/VL可变结构域中,或仅在VH区中或仅在VL区中。当所述抗原结合部位仅存在于可变结构域两个区域中的一个中时,对应的可变区可有助于折叠和/或结合可变区的稳定性,而不显著地有助于抗原自身的结合。本文中使用的抗原结合是指抗体与其抗原的典型结合能力。包含结合ErbB-2的抗原结合部位的抗体与ErbB-2结合,并且在除此以外的相同条件下,与相同物种的同源受体ErbB-1和ErbB-4的结合低至少100倍。包含与ErbB-3结合的抗原结合部位的抗体与ErbB-3结合,并且在除此以外的相同条件下,不与相同物种的同源受体ErbB-1和ErbB-4结合。考虑到ErbB家族为细胞表面受体家族,所述结合通常在表达所述受体的细胞上评估。抗体与抗原的结合可以多种方式评估。一种方式是将抗体与抗原(优选为表达所述抗原的细胞)孵育,去除未结合的抗体(优选为通过洗涤步骤)并通过与所结合的抗体结合的标记抗体来检测所结合的抗体。抗原被抗体的结合通常通过抗体的互补区以及抗原和可变结构域二者的特异性三维结构介导,所述三维结构允许这两种结构精确地结合在一起(类似于锁与钥匙的相互作用),这与随机的、非特异性的抗体黏附相反。因为抗体通常识别抗原的表位,且因为这样的表位也可存在于其他化合物中,所以如果这样的其他化合物包含相同的表位,则根据本发明的结合ErbB-2和/或ErbB-3的抗体也可识别其他蛋白质。因此,术语“结合”不排除抗体与其他含有相同表位的蛋白质的结合。这样的其他蛋白质优选不是人蛋白质。本发明中限定的ErbB-2抗原结合部位和ErbB-3抗原结合部位通常不与出生后的人(优选成人)细胞膜上的其他蛋白质结合。根据本发明的双特异性抗体通常能够以至少1x10e-6M的结合亲和力结合ErbB-2和ErbB-3,如在下文中更详细地概述的。本文中使用的术语“干扰结合”意指抗体被导向ErbB-3上的表位,且该抗体与配体竞争与ErbB-3结合。所述抗体可减弱配体结合,当其已经与ErbB-3结合时替换配体,或其可例如通过空间位阻至少部分地阻止配体可与ErbB-3的结合。本文中使用的术语“抗体”意指蛋白质性的分子,优选属于含有一个或更多个结合抗原上表位的可变结构域的免疫球蛋白类蛋白质,其中这样的结构域来自于抗体的可变结构域或与其共享序列同源性。用于治疗用途的抗体优选与待治疗对象的天然抗体尽可能接近(例如用于人对象的人抗体)。抗体的结合可根据特异性和亲和力来表示。特异性决定了哪种抗原或其表位被结合结构域特异性地结合。亲和力为与特定抗原或表位结合强度的量度。特异性结合被限定为以至少1x10e-6M、更优选1x10e-7M、更优选高于1x10e-9M的亲和力(KD)结合。通常来说,用于治疗应用的抗体具有高达1x10e-10M或更高的亲和力。抗体如本发明的双特异性抗体包含天然抗体的恒定结构域(Fc部分)。本发明的抗体通常为双特异性的全长抗体,优选为人IgG亚类。优选地,本发明的抗体为人IgG1亚类。这样的本发明抗体具有良好的ADCC特性,在向人体内施用时具有有利的半衰期,并且存在可提供经修饰重链的CH3工程技术,所述重链在克隆细胞中共表达后优先形成异源二聚体而非同源二聚体。本发明的抗体优选为“全长”抗体。根据本发明的术语“全长”限定为包含基本完整的抗体,然而其并非必须具有完整抗体的所有功能。为避免疑问,全长的抗体含有两条重链和两条轻链。每条链含有恒定区(C)和可变区(V),其可分解成指定为CH1、CH2、CH3、VH和CL、VL的结构域。抗体通过包含于Fab部分中的可变结构域与抗原结合,并且在结合之后可通过恒定结构域(大多为通过Fc部分)与免疫系统的分子和细胞相互作用。术语“可变结构域”、“VH/VL对”、“VH/VL”在本文中可互换使用。根据本发明的全长抗体涵盖其中可存在提供期望特征之突变的抗体。这样的突变不应为任何区的基本部分的缺失。然而,在没有显著改变所得抗体的结合特征的情况下,其中的一个或若干个氨基酸残基缺失的抗体仍被包括在术语“全长抗体”中。例如,IgG抗体在恒定区中可具有1-20个氨基酸残基插入、缺失或其组合。例如,当抗体本身具有低ADCC活性时,通过稍微修饰该抗体的恒定区,该抗体的ADCC活性可被改善(Junttila,T.T.,K.Parsons,等(2010).“SuperiorInvivoEfficacyofAfucosylatedTrastuzumabintheTreatmentofHER2-AmplifiedBreastCancer.”CancerResearch70(11):4481-4489)。因为其有利的半衰期以及因为免疫原性原因需要保持为接近完全自体同源(人)分子,所以全长IgG抗体是优选的。本发明的抗体优选为双特异性IgG抗体,优选为双特异性全长IgG1抗体。IgG1基于其在人中的长循环半衰期而是有利的。为了阻止在人中的任何免疫原性,根据本发明的双特异性抗体优选为人IgG1。术语“双特异性”(bispecific,bs)意为抗体(如上文所限定)的一部分与抗原的一个表位结合,而第二部分与不同的表位结合。所述不同的表位通常存在于不同的抗原上。根据本发明,所述第一和第二抗原事实上为两个不同的蛋白质。优选的双特异性抗体为包含两个不同的单克隆抗体的部分并且因此与两个不同类型的抗原结合的抗体。所述双特异性抗体的一条臂通常含有一个抗体的可变结构域,并且另一条臂含有另一抗体的可变结构域。本发明的双特异性抗体的重链可变区通常彼此不同,而本发明的双特异性抗体中的轻链可变区优选为相同的。其中不同重链可变区与相同的或共同的轻链相组合的双特异性抗体也被称为具有共同轻链的双特异性抗体。因此还提供了根据本发明的双特异性抗体,其中两条臂均包含共同的轻链。优选的双特异性抗体可通过在单一细胞中共表达两种不同的重链和共同的轻链来获得。当使用野生型CH3结构域时,共表达两种不同的重链和共同的轻链将导致三种不同的类型,AA、AB和BB。为了提升期望的双特异性产物(AB)的百分比,可利用CH3工程化,或换言之,可使用具有相容的异源二聚化结构域的重链,如下文中所限定。本文中使用的术语“相容的异源二聚化结构域”是指这样的蛋白质结构域,其被工程化以使经工程化的结构域A’将优先与经工程化的结构域B’形成异源二聚体,并且反之亦然,而在A’-A’之间和B’-B’之间的同源二聚体降低。根据本发明的术语“共同的轻链”是指可相同或具有一些氨基酸序列差异但全长抗体的结合特异性未受影响的轻链。例如,可在本文中使用的共同轻链的限定范围中制备或找到不同但仍然在功能上等同的轻链,例如,通过引入并测试保守性氨基酸的改变、在与重链成对时不参与或仅部分地参与结合特异性的区域中的氨基酸改变等。术语“共同的轻链”、“共同VL”、“单一轻链”、“单一VL”无论是否附加术语“重排的”,在本文中均可互换地使用。本发明的一个方面是使用人轻链作为共同轻链,所述人源轻链可与不同的重链结合以形成具有功能性抗原结合结构域的抗体(WO2004/009618,WO2009/157771,Merchant等,1998和Nissim等,1994)。优选地,所述共同轻链具有生殖系(germline)序列。优选的生殖系序列是频繁地用于人库(repertoire)中并且具有良好的热动力稳定性、收率和可溶性的轻链可变区。优选的生殖系轻链为O12,优选重排的生殖系人κ轻链IgVκ1-39*01/IGJκ1*01或其片段或功能等价物(即相同的IgVκ1-39基因片段但不同的IGJκ基因片段)(根据万维网中在imgt.org的IMGT数据库命名)。因此还提供了根据本发明的双特异性抗体,其中所述共同的轻链为生殖系轻链,优选为包含IgVKl-39基因片段的重排的生殖系人κ轻链,最优选为重排的生殖系人κ轻链IgVKl-39*01/IGJKl*01。术语重排的生殖系人κ轻链IgVKl-39*01/IGJKl*01、IGKV1-39/IGKJ1、huVκ1-39轻链或简称为huVκ1-39在整个本申请中可互换地使用。显然,本领域技术人员将认识到“共同”也指氨基酸序列不相同的轻链的功能等价物。存在许多所述轻链的变体,其中存在不实质上影响功能性结合区之形成的突变(缺失、替换、添加)。本发明的轻链也可以是上文中所规定的轻链,其具有1-5个氨基酸插入、缺失、替换或其组合。还要考虑的是其中VH能够特异性地识别第一抗原并且与所述VH在免疫球蛋白可变结构域中配对的VL能够特异性地识别第二抗原的抗体。所得的VH/VL对将结合抗原1或抗原2。描述于例如WO2008/027236、WO2010/108127和Schaefer等(CancerCell20,472-486,October2011)的这样的所谓的“二合一抗体(two-in-oneantibody)”与本发明的双特异性抗体不同,并且还被称为“二合一”抗体。这样的“二合一”抗体具有相同的臂,并且不是本发明的抗体。本文中使用的术语“ErbB-2”是指在人类中由ERBB-2基因编码的蛋白质。所述基因或蛋白质的替代名称包括CD340、HER-2、HER-2/neu、MLN19、NEU、NGL、TKR1。所述ERBB-2基因经常被称为HER2(来自于人表皮生长因子受体2)。本文中提及ErbB-2时,所提及的是指人ErbB-2。包含结合ErbB-2的抗原结合部位的抗体结合人ErbB-2。所述ErbB-2抗原结合部位依据人和其他哺乳动物种间同源物(ortholog)之间的序列和三级结构相似性,也会结合这样的种间同源物(但不是必然如此)。人ErbB-2蛋白及其编码基因的数据库登录号为(NP_001005862.1、NP_004439.2NC_000017.10NT_010783.15NC_018928.2)。提供该登录号主要是为了提供鉴定ErbB-2作为靶标的其他方法,与抗体结合的ErbB-2蛋白的实际序列可以不同,例如因为在编码基因中的突变(例如发生于一些癌症等中的那些)。所述ErbB-2抗原结合部位结合ErbB-2及其多种变体,例如由一些ErbB-2阳性肿瘤细胞表达的那些。本文中使用的术语“ErbB-3”是指在人中由ERBB-3基因编码的蛋白质。所述基因或蛋白质的替代名称包括HER3、LCCS2、MDA-BF-1、c-ErbB-3、c-erbb-3、erbb-3-S、p180-Erbb-3、p45-sErbb-3和p85-sErbb-3。本文中提及ErbB-3时,所提及的是指人ErbB-3。包含结合ErbB-3的抗原结合部位的抗体结合人ErbB-3。所述ErbB-3抗原结合部位依据人和其他哺乳动物种间同源物之间的序列和三级结构相似性,也结合这样的种间同源物(但不是必然如此)。人ErbB-3蛋白及其编码基因的数据库登录号为(NP_001005915.1NP_001973.2、NC_000012.11NC_018923.2NT_029419.12)。提供该登录号主要是为了提供鉴定ErbB-3作为靶标的其他方法,与抗体结合的ErbB-3蛋白的实际序列可以不同,例如因为在编码基因中的突变(例如发生于一些癌症等中的那些)。所述ErbB-3抗原结合部位结合ErbB-3及其多种变体,例如由一些ErbB-2阳性肿瘤细胞表达的那些。本发明包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体能降低或降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能。在过量ErbB-2的存在下,ErbB-2/ErbB-3异源二聚体可在不存在可检测的针对异源二聚体中ErbB-3链的配体下为表达的细胞提供生长信号。该ErbB-3受体功能在本文中称为配体非依赖性的ErbB-3受体功能。ErbB-2/ErbB-3异源二聚体也在ErbB-3配体的存在下为表达细胞提供生长信号。该ErbB-3受体功能在本文中称为ErbB-3的配体诱导之受体功能。本文中使用的术语“ErbB-3配体”是指结合并活化ErbB-3的多肽。ErbB-3配体的实例包括但不限于神经调节蛋白1(NGR)和神经调节蛋白2、β细胞素(betacellulin)、肝素结合表皮生长因子(heparin-bindingepidermalgrowthfactor)和上皮调节蛋白(epiregulin)。该术语包括天然多肽的有生物学活性的片段和/或变体。在本发明的一个优选实施方案中,ErbB-3的配体诱导之受体功能为ErbB-3配体诱导的ErbB-2和ErbB-3阳性细胞生长。在一个优选的实施方案中,所述细胞为MCF-7细胞(HTB-22TM)、SKBR3(HTB-30TM)细胞、NCI-87(CRL-5822TM)细胞、BxPC-3-luc2细胞(PerkinElmer125058)、BT-474细胞(HTB-20TM)或JIMT-1细胞(DSMZno.:ACC589)。在一个优选的实施方案中,所述ErbB-2和ErbB-3阳性细胞在细胞表面上包含至少50.000个ErbB-2受体。在一个优选的实施方案中,为至少100.000个ErbB-2受体。在一个优选的实施方案中,所述ErbB-2和ErbB-3阳性细胞在细胞表面上包含至少1.000.000个ErbB-2受体。在另一个优选的实施方案中,所述ErbB-2和ErbB-3阳性细胞在细胞表面上包含不超过1.000.000个ErbB-2受体。目前使用的治疗(例如曲妥珠单抗(赫赛汀)和帕妥珠单抗)仅为具有在细胞表面上有超过1.000.000个ErbB-2受体的恶性ErbB-2阳性细胞的患者开出以获得临床响应。具有在细胞表面上有超过1.000.000个ErbB-2受体的ErbB-2阳性肿瘤细胞的患者通常被归类为ErbB-2[+++]。例如利用HercepTestTM和/或HER2FISH(pharmDxTM)将患者分类,二者皆由DakoDenmarkA/S市售;和/或利用测定将患者分类,其由MonogramBiosciences市售。曲妥珠单抗和帕妥珠单抗仅为ErbB-2[+++]患者开出,因为当以曲妥珠单抗和帕妥珠单抗治疗时,具有较低的ErbB-2浓度的患者通常不表现出足够的临床响应。然而,本发明提供了双特异性抗体,其与曲妥珠单抗相比,对于具有较低的ErbB-2受体浓度的细胞也具有改善的结合亲和力。如实施例中所示,利用根据本发明的抗体,具有较低的ErbB-2表达的此类细胞的增殖受到了有效的抵抗。这样的较低的ErbB-2受体浓度存在于被分类为ErbB-2[++]或ErbB-2[+]的患者的恶性细胞上。另外,复发性ErbB-2阳性肿瘤经常具有低于1.000.000个受体/细胞的ErbB-2受体浓度。因此,这样的ErbB-2[++]或ErbB-2[+]患者以及具有复发性ErbB-2阳性肿瘤的患者优选用根据本发明的双特异性抗体进行治疗。因此还提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体,其中所述抗体能降低配体诱导的ErbB-2和ErbB-3阳性细胞生长,所述细胞具有少于1.000.000个ErbB-2细胞表面受体。还提供了用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤或有风险患有所述肿瘤的对象的方法,其中所述肿瘤具有少于1.000.000个ErbB-2细胞表面受体/细胞,所述方法包括向所述对象施用根据本发明的双特异性抗体或药物组合物。本文中还与此一道提供了根据本发明的双特异性抗体,其用于治疗患有或有风险患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象,其中所述肿瘤具有少于1.000.000个ErbB-2细胞表面受体/细胞。根据本发明的所述抗体通常能够降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能,优选配体诱导的生长。根据本发明的所述双特异性抗体优选地包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位。在一个优选的实施方案中,所述第二抗原结合部位对ErbB-3阳性细胞的亲和力等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力,如下文中更详细地阐释的。所述第二抗原结合部位对ErbB-3阳性细胞的亲和力优选低于或等于2.0nM,更优选低于或等于1.39nM,更优选低于或等于0.99nM。所述第一抗原结合部位对ErbB-2阳性细胞的亲和力低于或等于5.0nM,优选低于或等于4.5nM,优选低于或等于4.0nM。在一个优选的实施方案中,根据本发明的所述抗体包含结合ErbB-2结构域I的选自T144、T164、R166、P172、G179、S180和R181的至少一个氨基酸的抗原结合部位,以及位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基。在一个优选的实施方案中,根据本发明的所述抗体优选地包含结合ErbB-3结构域III的选自R426的至少一个氨基酸的抗原结合部位,以及在天然ErbB-3蛋白中位于距离R426在以内的暴露于表面的氨基酸残基。为了确定肿瘤是否为ErbB-3阳性,技术人员可例如确定ErbB-3的扩增和/或免疫组化染色。在活检(biopt)中至少10%的肿瘤细胞应为阳性。所述活检还可含有20%、30%、40%、50%、60%、70%或更多阳性细胞。本文中使用的配体诱导的受体功能降低了至少20%,优选至少30%、40%、50%、60%或至少70%,在一个特别优选的实施方案中,配体诱导的受体功能降低了80%,更优选为90%。优选地,该降低为在本发明的双特异性抗体存在下,通过确定配体诱导的受体功能来确定,并将其与在所述抗体不存在下且除此之外相同的条件下的相同功能进行比较。所述条件至少包含存在ErbB-3配体。所存在的配体量优选为诱导ErbB-2和ErbB-3阳性细胞系最大生长的一半的量。用于该测试的ErbB-2和ErbB-3阳性细胞系优选为MCF-7细胞系(HTB-22TM)、SKBR3细胞系(HTB-30TM)细胞、JIMT-1细胞系(DSMZACC589)或NCI-87细胞系(CRL-5822TM)。用于确定ErbB-3配体诱导的受体功能的测试和/或配体优选为如实施例中所规定的对ErbB-3配体诱导的生长降低的测试。ErbB-2蛋白含有若干结构域(参考见Landgraf,RBreastCancerRes.2007;9(1):202-的图1)。胞外结构域被称为结构域I-IV。本文中所描述的与抗体的抗原结合部位的各结构域结合的位置已经通过作图定位(map)(见实施例)。本发明的具有结合ErbB-2(第一抗原结合部位)的结构域I或结构域IV的抗原结合部位(第一抗原结合部位)的双特异性抗体包含重链可变区,当与多种轻链组合时维持对ErbB-2的显著结合特异性和亲和力。具有结合ErbB-2(第一抗原结合部位)的结构域I或结构域IV的抗原结合部位(第一抗原结合部位)和针对ErbB-3的抗原结合部位(第二抗原结合部位)的双特异性抗体被发现当与包含与ErbB-2另一胞外结构域结合的抗原结合部位(第一抗原结合部位)的双特异性抗体相比时,对降低ErbB-3的配体诱导之受体功能更有效。包含结合ErbB-2的抗原结合部位(第一抗原结合部位)的双特异性抗体是优选的,其中所述抗原结合部位与ErbB-2的结构域I或结构域IV结合。优选地,所述抗原结合部位与ErbB-2的结构域IV结合。具有结合ErbB-2的抗原结合部位(第一抗原结合部位)并且还包含ADCC的双特异性抗体被发现相比不具有显著ADCC活性(特别是体内)的其他ErbB-2结合抗体更有效。因此,表现出ADCC的根据本发明的双特异性抗体是优选的。已经发现,其中所述第一抗原结合部位与ErbB-2结构域IV结合的抗体具有固有的ADCC活性。具有低固有ADCC活性的与结构域I结合的ErbB-2结合抗体可被工程化以增强ADCC活性。Fc区通过与免疫效应细胞(例如巨噬细胞、自然杀伤细胞、B细胞和中性粒细胞)上的不同的受体结合介导抗体功能。这些受体中的一些(例如CD16A(FcγRIIIA)和CD32A(FcγRIIA))活化细胞以建立针对抗原的应答。其他受体(例如CD32B)抑制免疫细胞的活化。通过以更强的选择性与活化受体结合的工程化Fc区(通过引入氨基酸替换),可产生具有抗癌Mab所期望的更强的介导细胞毒性活性的抗体。用于增强抗体ADCC的一种技术是无岩藻糖基化(afucosylation)(见例如Junttila,T.T.,K.Parsons,等(2010).“SuperiorInvivoEfficacyofAfucosylatedTrastuzumabintheTreatmentofHER2-AmplifiedBreastCancer.”CancerResearch70(11):4481-4489)。因此,还提供了根据本发明的双特异性抗体,其为无岩藻糖基化。作为替代或补充,多种其他策略可用于实现ADCC的增强,例如包括糖工程化(glycoengineering)(KyowaHakko/Biowa,GlycArt(Roche)和EurekaTherapeutics)以及诱变(Xencor和Macrogenics),所有这些策略寻求改善Fc与低亲和力的活化FcγRIIIa的结合,和/或降低与低亲和力的抑制性FcγRIIb的结合。存在若干体外的方法用于确定抗体或效应细胞在引起ADCC中的效力。其中有铬-51[Cr51]释放测定、铕[Eu]释放测定和硫-35[S35]释放测定。通常来说,将经标记的表达特定的暴露于表面之抗原的靶细胞系与特异性针对该抗原的抗体孵育。洗涤之后,通常将表达Fc受体CD16的效应细胞与以抗体标记的靶细胞共孵育。随后,通常通过胞内标记物的释放(例如通过闪烁计数器或分光光度法)测量靶细胞裂解。优选的测试在实施例中详述。本发明的一个优势在于以下事实:根据本发明的抗体(例如PB4188)与ErbB-2和ErbB-3阳性细胞的结合导致与曲妥珠单抗相比相同程度的内化。如果使用曲妥珠单抗与帕妥珠单抗的组合,这些抗体的内化被增强。然而,该增强的内化导致了降低的ADCC。因此,导致与曲妥珠单抗相比基本相同程度内化的根据本发明的抗体相对于曲妥珠单抗与帕妥珠单抗的组合是优选的,因为使用这样的抗体,ADCC活性维持得更好。包含结合ErbB-3的抗原结合部位的本发明抗体干扰ErbB-3配体与ErbB-3的结合。这样的抗体对于降低ErbB-2和ErbB-3阳性细胞系上ErbB-3的配体诱导之受体功能更有效,特别是在还包含结合ErbB-2的抗原结合部位的双特异性抗体的情况下。本发明的一些优选实施方案提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第一抗原结合部位结合ErbB-2的结构域I。如实施例中所示,具有这些特征的双特异性抗体能够良好地结合ErbB-2和ErbB-3阳性细胞并抵抗其活性(例如ErbB-3的配体诱导之受体功能和配体诱导的ErbB-2和ErbB-3阳性细胞生长)。此外,包含结合ErbB-2结构域I的第一抗原结合部位的根据本发明的双特异性抗体特别适合用于与现有的抗ErbB-2治疗(如曲妥珠单抗和帕妥珠单抗)组合,因为曲妥珠单抗和帕妥珠单抗结合ErbB-2的不同结构域。曲妥珠单抗结合ErbB-2的结构域IV,且帕妥珠单抗结合ErbB-2的结构域II。因此,结合ErbB-2结构域I的根据本发明的双特异性抗体是优选的,因为其不与曲妥珠单抗和帕妥珠单抗竞争相同表位。另一个优选的实施方案提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体,其中所述第二抗原结合部位结合ErbB-3的结构域III。这样的根据本发明的抗体特别适用于与目前使用的不结合ErbB-3结构域III的抗ErbB-3结合分子(例如结合ErbB-3结构域I的MM-121(MerrimackPharmaceuticals;也称为#Ab6)和RG7116(Roche))的组合治疗,因为之后不同的结合分子不与彼此竞争相同的表位。优选地,提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第一抗原结合部位结合ErbB-2的结构域I并且所述第二抗原结合部位结合ErbB-3的结构域III。这样的抗体特别适用于与不结合ErbB-2结构域I的抗ErbB-2结合分子(例如曲妥珠单抗和帕妥珠单抗),以及与不结合ErbB-3结构域III的抗ErbB-3结合分子(例如MM-121(#Ab6)与RG7116)的组合治疗。一个优选的实施方案提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第一抗原结合部位结合ErbB-2的结构域I并且所述第二抗原结合部位结合ErbB-3的结构域III,并且其中所述抗体能降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能。所述抗体可优选地降低配体诱导的ErbB-2和ErbB-3阳性细胞生长。本发明的另一些实施方案提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第二抗原结合部位对ErbB-3阳性细胞的亲和力(KD)等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。与现有技术的双特异性化合物(其具有比对ErbB-3更高的对ErbB-2的亲和力)(例如来自于MerrimackPharmaceuticals的MM-111)相反,本发明提供了双特异性抗体,其具有ErbB-3特异性臂,该臂所具有的对细胞上ErbB-3的亲和力比ErbB-2特异性臂对细胞上ErbB-2的亲和力更高。这样的双特异性抗体能够更好地结合ErbB-3,即便是低细胞表面ErbB-3浓度也是如此。这提供了这样的优势,即针对ErbB-3的功能活性与现有技术化合物相比得到了增强,意味着这些根据本发明的双特异性抗体能够更好地抵抗ErbB-3活性(例如配体诱导的生长)。本文中使用的术语“亲和力”是指KD值。所述第二抗原结合部位对ErbB-3阳性细胞的亲和力(KD)优选低于或等于2.0nM,更优选低于或等于1.5nM,更优选低于或等于1.39nM,更优选低于或等于0.99nM。在一个优选的实施方案中,所述第二抗原结合部位对SK-BR-3细胞上的ErbB-3的亲和力低于或等于2.0nM,更优选低于或等于1.5nM,更优选低于或等于1.39nM,优选低于或等于0.99nM。在一个实施方案中,所述亲和力在1.39nM-0.59nM范围内。在一个优选的实施方案中,所述第二抗原结合部位对BT-474细胞上的ErbB-3的亲和力低于或等于2.0nM,更优选低于或等于1.5nM,更优选低于或等于1.0nM,更优选低于0.5nM,更优选低于或等于0.31nM,更优选低于或等于0.23nM。在一个实施方案中,所述亲和力在0.31nM-0.15nM范围内。上述亲和力优选使用稳态细胞亲和力测量进行测量,其中将细胞利用放射性标记的抗体在4℃下孵育,其后测量与细胞结合的放射性,如实施例中所述。所述第一抗原结合部位对ErbB-2阳性细胞的亲和力(KD)优选低于或等于5.0nM,更优选低于或等于4.5nM,更优选低于或等于3.9nM。在一个优选的实施方案中,所述第一抗原结合部位对SK-BR-3细胞上的ErbB-2的亲和力低于或等于5.0nM,优选低于或等于4.5nM,更优选低于或等于4.0nM,更优选低于或等于3.5nM,更优选低于或等于3.0nM,更优选低于或等于2.3nM。在一个实施方案中,所述亲和力在3.0nM-1.6nM范围内。在一个优选的实施方案中,所述第一抗原结合部位对BT-474细胞上的ErbB-2的亲和力低于或等于5.0nM,优选低于或等于4.5nM,更优选低于或等于3.9nM。在一个实施方案中,所述亲和力在4.5nM-3.3nM范围内。上述亲和力优选使用稳态细胞亲和力测量进行测量,其中将细胞利用放射性标记的抗体在4℃下孵育,其后测量与细胞结合的放射性,如实施例中所述。在一个优选的实施方案中,提供了根据本发明的双特异性抗体,其中所述双特异性抗体对BT-474细胞的亲和力(KD)低于或等于5.0nM,优选低于或等于4.5nM,更优选低于或等于4.0nM,更优选低于或等于3.5nM,更优选低于或等于3.7nM,优选低于或等于3.2nM。在一个实施方案中,所述亲和力在3.7nM-2.7nM范围内。在一个优选的实施方案中,提供了根据本发明的双特异性抗体,其中所述双特异性抗体对SK-BR-3细胞的亲和力低于或等于5.0nM,优选低于或等于4.5nM,更优选低于或等于4.0nM,更优选低于或等于3.5nM,更优选低于或等于3.0nM,优选低于或等于2.5nM,更优选低于或等于2.0nM。在一个实施方案中,所述亲和力在2.4nM-1.6nM范围内。再次,上述亲和力优选为使用稳态细胞亲和力测量进行测量,其中将细胞利用放射性标记的抗体在4℃下孵育,其后测量与细胞结合的放射性,如实施例中所述。本发明的另一些优选实施方案提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第二抗原结合部位对ErbB-3阳性细胞的亲和力(KD)等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力,并且其中所述抗体能降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能。所述抗体可优选地降低配体诱导的ErbB-2和ErbB-3阳性细胞生长。上述根据本发明的具有对ErbB-3高亲和力的抗体优选地结合ErbB-2的结构域I和/或结合ErbB-3的结构域III。因此还提供了根据本发明的双特异性抗体,其包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第二抗原结合部位对ErbB-3阳性细胞的亲和力(KD)等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。还提供了根据本发明的双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位,其中所述第二抗原结合部位对ErbB-3阳性细胞的亲和力等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。在一个特别优选的实施方案中,提供了根据本发明的双特异性抗体,其包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位,其中所述第二抗原结合部位对ErbB-3阳性细胞的亲和力等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。所述第二抗原结合部位优选地结合ErbB-3结构域III,并且具有针对ErbB-3阳性细胞的亲和力(KD),其低于或等于2.0nM,更优选低于或等于1.5nM,优选低于或等于1.39nM,更优选低于或等于0.99nM。在一个优选的实施方案中,所述第二抗原结合部位结合ErbB-3的结构域III,并且具有针对SK-BR-3细胞上ErbB-3的亲和力,其低于或等于2.0nM,更优选低于或等于1.5nM,优选低于或等于1.39nM,更优选低于或等于0.99nM。在一个实施方案中,所述亲和力在1.39nM-0.59nM范围内。在一个优选的实施方案中,所述第二抗原结合部位结合ErbB-3的结构域III,并且具有针对BT-474细胞上ErbB-3的亲和力,其低于或等于2.0nM,更优选低于或等于1.5nM,更优选低于或等于1.0nM,更优选低于或等于0.5nM,更优选低于或等于0.31nM,更优选低于或等于0.23nM。在一个实施方案中,所述亲和力在0.31nM-0.15nM范围内。所述第一抗原结合部位优选地结合ErbB-2的结构域I,并且具有针对ErbB-2阳性细胞的亲和力(KD),其低于或等于5.0nM,更优选低于或等于4.5nM,更优选低于或等于3.9nM。在一个优选的实施方案中,所述第一抗原结合部位结合ErbB-2的结构域I,并且具有针对SK-BR-3细胞上ErbB-2的亲和力,其低于或等于5.0nM,更优选低于或等于4.5nM,更优选低于或等于4.0nM,更优选低于或等于3.5nM,更优选低于或等于3.0nM,更优选低于或等于2.5nM,更优选低于或等于2.3nM。在一个实施方案中,所述亲和力在3.0nM-1.6nM范围内。所述双特异性抗体对SK-BR-3细胞的亲和力优选低于或等于5.0nM,更优选低于或等于4.5nM,更优选低于或等于4.0nM,更优选低于或等于3.5nM,更优选低于或等于3.0nM,更优选低于或等于2.5nM,更优选低于或等于2.4nM,更优选低于或等于2.0nM。在一个实施方案中,所述亲和力在2.4nM-1.6nM范围内。在一个优选的实施方案中,所述第一抗原结合部位结合ErbB-2的结构域I,并且具有针对BT-474细胞上ErbB-2的亲和力(KD),其低于或等于5.0nM,更优选低于或等于4.5nM,优选低于或等于3.9nM。在一个实施方案中,所述亲和力在4.5nM-3.3nM范围内。所述双特异性抗体对BT-474细胞的亲和力优选低于或等于5.0nM,更优选低于或等于4.5nM,更优选低于或等于4.0nM,更优选低于或等于3.7nM,更优选低于或等于3.2nM。在一个实施方案中,所述亲和力在3.7nM-2.7nM范围内。再次,上述亲和力优选为使用稳态细胞亲和力测量进行测量,其中将细胞利用放射性标记的抗体在4℃下孵育,其后测量与细胞结合的放射性,如实施例中所述。另一个优选实施方案提供了根据本发明的双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述抗体能降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能,其中所述双特异性抗体不显著影响心肌细胞的存活。心脏毒性是ErbB-2靶向治疗中的已知风险因素,并且当曲妥珠单抗与蒽环类联用时,并发症的频率提高,从而诱导心脏应激。例如,多西环素(doxycycline,DOX)与曲妥珠单抗的组合诱导严重的心脏副作用。临床研究已经估算,在乳腺癌的辅助治疗(adjuvantsetting)中接受曲妥珠单抗的患者中的5%到10%发生心功能障碍(Guarneri等,JClinOncol.,1985,3:818-26;EwerMS等,NatRevCardiol2010;7:564-75)。然而,在回顾性的研究中已经证明,在以DOX辅助治疗中使用曲妥珠单抗时,发生无症状心功能障碍的风险事实上高达约25%(Wadhwa等,BreastCancerResTreat2009;117:357-64)。如实施例中所示,本发明提供了抗体,其靶向ErbB-2,并且不影响心肌细胞的存活,或以与曲妥珠单抗和帕妥珠单抗相比显著更低的程度影响心肌细胞的存活。这提供了重要的优势,因为心脏毒性被减弱。这对于未遭受受损的心脏功能的人来说已经是有有利的,并且对于遭受受损的心脏功能的人或者处于其风险中的人来说更是如此,例如遭受充血性心脏衰竭(congestiveheartfailure,CHF)、左心室功能障碍(leftventriculardysfunction,LVD)和/或左心室射血分数(leftventricularejectionfraction,LVEF)降低≥10%的对象,和/或已患有心肌梗死的对象。因此,不显著影响心肌细胞存活的根据本发明的抗体是优选的。在体外,心肌细胞的功能以例如以下方式测量:通过确定心肌细胞存活、通过确定BNP(B型利尿钠肽,其是心脏的生物标志物)、通过确定QT延长,和/或通过确定线粒体膜电位。根据本发明的所述抗体优选地包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位。一个实施方案提供了不显著影响心肌细胞存活的根据本发明的抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第二抗原结合部位对ErbB-3阳性细胞的亲和力等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。所述第二抗原结合部位对ErbB-3阳性细胞的亲和力优选低于或等于2.0nM,更优选低于或等于1.39nM,更优选低于或等于0.99nM。所述第一抗原结合部位对ErbB-2阳性细胞的亲和力优选低于或等于5.0nM,优选低于或等于4.5nM,优选低于或等于4.0nM。在一个优选的实施方案中,不显著影响心肌细胞存活的所述抗体包含:-ErbB-2特异性重链可变区的至少CDR3序列,优选至少CDR1、CDR2和CDR3序列,或至少重链可变区序列,所述重链可变区选自MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示,或与所列举的重链可变区序列有最多15个氨基酸差异,优选最多1、2、3、4、5、6、7、8、9或10个氨基酸差异,更优选最多1、2、3、4或5个氨基酸差异的重链可变区序列;和/或-ErbB-3特异性重链可变区的至少CDR3序列,优选至少CDR1、CDR2和CDR3序列,或至少重链可变区序列,所述重链可变区选自MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示,或与所列举的重链可变区序列有最多15个氨基酸差异,优选最多1、2、3、4、5、6、7、8、9或10个氨基酸差异,更优选最多1、2、3、4或5个氨基酸差异的重链可变区序列。在一个优选的实施方案中,所述抗体为PB4188。本发明的另一方面提供了根据本发明的抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述抗体包含结合ErbB-2结构域I的选自T144、T164、R166、P172、G179、S180和R181的至少一个氨基酸残基以及位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基的抗原结合部位。氨基酸残基编号来自于ProteinDataBank(PDB)ID#1S78。如实施例中所示,结合ErbB-2结构域I之该区的抗体表现出特别良好的结合特征,并且其能够抵抗ErbB-2阳性细胞的活性(例如ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能,和/或配体诱导的此类细胞的生长)。此外,该抗体特别适合用于与目前已知的抗ErbB-2单克隆抗体(如曲妥珠单抗(其结合ErbB-2的结构域IV)和帕妥珠单抗(其结合ErbB-2的结构域II))的组合治疗,因为它们结合ErbB-2的不同结构域。因此,这些抗体可同时使用而不会竞争相同的表位。术语“位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基”是指在一级氨基酸序列中位于与所列举的氨基酸残基相邻的约前五个氨基酸残基以内的并且至少部分暴露于蛋白质外侧从而使其可被抗体结合的氨基酸残基(见例如图21B)。优选地,所述位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的氨基酸残基选自L139、C140、Y141、Q142、D143、I145、L146、W147、K148、D149、L159、T160、L161、I162、D163、N165、S167、R168、A169、C170、H171、C173、S174、P175、M176、C177、K178、C182、W183、G184、E185和S186。优选地,所述抗体包含结合ErbB-2结构域I的选自T144、T164、R166、P172、G179、S180和R181的至少2个或至少3个氨基酸残基以及位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基的抗原结合部位。在一个优选的实施方案中,提供了根据本发明的双特异性抗体,其中所述抗体包含至少结合ErbB-2结构域I的T144、R166和R181的抗原结合部位。另一个实施方案提供了根据本发明的双特异性抗体,其中所述抗体包含至少结合ErbB-2结构域I的T144、R166、P172、G179和R181的抗原结合部位。另一个实施方案提供了根据本发明的双特异性抗体,其中所述抗体包含至少结合ErbB-2结构域I的T144、T164、R166、P172、G179、S180和R181的抗原结合部位。本发明的另一方面提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的抗体,其中所述抗体包含结合ErbB-3结构域III的选自R426的至少一个氨基酸以及在天然ErbB-3蛋白中位于距离R426在以内的暴露于表面的氨基酸残基的抗原结合部位。氨基酸残基编号来自于ProteinDataBank(PDB)ID#4P59。如实施例中所示,结合ErbB-3结构域III之该区的抗体表现出特别良好的结合特征,并且其能够抵抗ErbB-3阳性细胞的活性(例如ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能,和/或配体诱导的此类细胞的生长)。术语“在天然ErbB-3蛋白中位于距离R426在以内的暴露于表面的氨基酸残基”是指在ErbB-3蛋白三级结构中在空间上位于距R426在以内并且至少部分暴露于蛋白质的外侧从而使其可被抗体结合的氨基酸残基。优选地,在天然ErbB-3蛋白中位于距离R426在以内的所述氨基酸残基选自L423、Y424、N425、G427、G452、R453、Y455、E480、R481、L482、D483和K485(见例如图21C和表15)。在一个优选的实施方案中,提供了根据本发明的双特异性抗体,其中所述抗体包含至少结合ErbB-3结构域III的R426的抗原结合部位。优选地,所述抗体包含至少结合ErbB-3结构域III的R426的抗原结合部位。本发明的双特异性抗体优选为无岩藻糖基化以增强ADCC活性。与在正常CHO细胞中生产的相同抗体相比时,本发明的双特异性抗体优选在Fc区包含降低量的N-连接的碳水化合物结构的岩藻糖基化。本发明的双特异性抗体优选用于人。为此,本发明的双特异性抗体优选为人抗体或人源化抗体。人对于多肽的耐受性受到许多不同方面的控制。免疫(无论其是T细胞介导的、B细胞介导的或其他)是被包括在人对多肽耐受性中的变量之一。本发明的双特异性抗体的恒定区优选为人恒定区。所述恒定区可含有一个或更多个、优选为不超过10个、优选为不超过5个与天然人抗体恒定区的氨基酸差异。优选地,所述恒定部分全部来自于天然人抗体。本文中生产的多种抗体来自于人抗体可变结构域文库。因此这些可变结构域为人的。独特的CDR区可来自于人、为合成的或来自于其他生物。当可变区具有的氨基酸序列除了CDR区以外与天然人抗体可变区的氨基酸序列相同时,可认为其为人可变区。本发明抗体中的ErbB-2结合VH、ErbB-3结合VH或轻链的可变区可含有一个或更多个、优选为不超过10个、优选为不超过5个与天然人抗体可变区的氨基酸差异(不计入CDR区氨基酸序列中可能的差异)。在体细胞高频突变的情况下,这样的突变也天然发生。至少就重链可变区而言,抗体可来自于多种动物物种。将例如鼠重链可变区人源化是常见做法。有多种方式可达成此目的,其中有将CDR移植到具有匹配鼠重链可变区3-D结构之3-D结构的人重链可变区中;将鼠重链可变区去免疫化(deimmunization),优选通过从鼠重链可变区中去除已知的或受怀疑的T-或B-细胞表位来完成。所述去除通常通过替换表位中的一个或更多个氨基酸为其他(通常为保守的)氨基酸,以使所述表位的序列被修饰,以使其不再是T-或B-细胞表位。这样的去免疫鼠重链可变区在人中比原鼠重链可变区具有更小的免疫原性。优选地,本发明的可变区或结构域还被人源化,例如经过修饰(veneered)。通过使用修饰技术,易于遭遇免疫系统的外部残基被选择性地替换为人残基以提供包含弱免疫原性或者基本上无免疫原性的经修饰表面的杂交分子。本发明中使用的动物优选为哺乳动物,更优选为灵长类,最优选为人。根据本发明的双特异性抗体优选包含人抗体的恒定区。根据其重链恒定区中的差异,抗体分为五种类别或同种型:IgG、IgA、IgM、IgD、和IgE。这些类别或同种型包含至少一个以对应的希腊字母命名的所述重链。在一个优选的实施方案中,本发明提供了根据本发明的抗体,其中所述恒定区选自IgG、IgA、IgM、IgD和IgE恒定区,更优选地,所述恒定区包含IgG恒定区,更优选IgG1恒定区,优选突变的IgG1恒定区。在自然中会发生IgG1恒定区中的某种变异,例如同种异型G1m1、17以及G1m3,和/或在不改变所得到的抗体的免疫属性的情况下是允许的。通常来说,在恒定区中允许约1-10个氨基酸的插入、缺失、替换或其组合。本发明在一个实施方案中提供了包含结合ErbB-2的可变结构域的抗体,其中所述抗体至少包含选自以下ErbB-2特异性重链可变区的CDR3序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示,或者其中所述抗体包含与VH的CDR3序列有最多3个、优选最多2个、优选不超过1个氨基酸差异的重链CDR3序列,所述VH选自MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示。所述抗体优选至少包含MF1849、MF2971、MF3958、MF3004或MF3991的CDR3序列,最优选至少MF3958的CDR3序列。所述抗体优选至少包含选自以下ErbB-2特异性重链可变区的CDR1、CDR2和CDR3序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示,或与MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898的CDR1、CDR2和CDR3序列有最多3个、优选最多2个、优选最多1个氨基酸差异的重链CDR1、CDR2和CDR3序列。所述抗体优选至少包含MF1849、MF2971、MF3958、MF3004或MF3991的CDR1、CDR2和CDR3序列,最优选至少MF3958的CDR1、CDR2和CDR3序列。本发明还提供了包含结合ErbB-2的可变结构域的抗体,其中所述抗体至少包含选自以下ErbB-3特异性重链可变区的CDR3序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示,或者其中所述抗体包含与VH的CDR3序列有最多3个、优选最多2个氨基酸、优选不超过1个氨基酸差异的重链CDR3序列,所述VH选自MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示。所述抗体优选至少包含MF3178、MF3176、MF3163、MF6058、MF6061或MF6065的CDR3序列,最优选至少MF3178的CDR3序列。所述抗体优选至少包含选自以下ErbB-3特异性重链可变区的CDR1、CDR2和CDR3序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示,或与MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074的CDR1、CDR2和CDR3序列有最多3个、优选最多2个、优选最多1个氨基酸差异的重链CDR1、CDR2和CDR3序列。所述抗体优选至少包含MF3178、MF3176、MF3163、MF6058、MF6061或MF6065的CDR1、CDR2和CDR3序列,最优选至少MF3178的CDR1、CDR2和CDR3序列。本发明在一个实施方案中提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第一抗原结合部位至少包含选自以下的ErbB-2特异性重链可变区的CDR3序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示,或与VH的CDR3序列有最多3个、优选最多2个、优选不超过1个氨基酸差异的重链CDR3序列,所述VH选自MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示,并且其中所述第二抗原结合部位至少包含选自以下的ErbB-3特异性重链可变区的CDR3序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示,或与VH的CDR3序列有最多3个、优选最多2个、优选最多1个氨基酸差异的重链CDR3序列,所述VH选自MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示。所述第一抗原结合部位优选至少包含MF1849、MF2971、MF3958、MF3004或MF3991的CDR3序列,最优选至少MF3958的CDR3序列,并且所述第二抗原结合部位优选至少包含MF3178、MF3176、MF3163、MF6058、MF6061或MF6065的CDR3序列,最优选至少MF3178的CDR3序列。所述第一抗原结合部位优选至少包含选自以下ErbB-2特异性重链可变区的CDR1、CDR2和CDR3序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示,或与MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898的CDR1、CDR2和CDR3序列有最多3个、优选最多2个、优选最多1个氨基酸差异的重链CDR1、CDR2和CDR3序列,并且所述第二抗原结合部位优选至少包含选自以下ErbB-3特异性重链可变区的CDR1、CDR2和CDR3序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示,或与MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074的CDR1、CDR2和CDR3序列有最多3个、优选最多2个、优选最多1个氨基酸差异的重链CDR1、CDR2和CDR3序列,如图16B或图16E或图37中所示。所述第一抗原结合部位优选至少包含MF1849、MF2971、MF3958、MF3004或MF3991的CDR1、CDR2和CDR3序列,最优选至少MF3958的CDR1、CDR2和CDR3序列,并且所述第二抗原结合部位优选至少包含MF3178,MF3176,MF3163,MF6058,MF6061或MF6065的CDR1、CDR2和CDR3序列,最优选至少MF3178的CDR1、CDR2和CDR3序列。一个优选的实施方案提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第一抗原结合部位至少包含MF3958的CDR3序列,或与MF3958的CDR3序列有最多3个、优选最多2个、优选不超过1个氨基酸差异的CDR3序列,并且其中所述第二抗原结合部位至少包含MF3178的CDR3序列,或与MF3178的CDR3序列有最多3个、优选最多2个、优选不超过1个氨基酸差异的CDR3序列。本发明在一个实施方案中提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第一抗原结合部位至少包含MF3958的CDR1、CDR2和CDR3序列,或与MF3958的CDR1、CDR2和CDR3序列有最多3个、优选最多2个、优选最多1个氨基酸差异的CDR1、CDR2和CDR3序列,并且其中所述第二抗原结合部位至少包含MF3178的CDR1、CDR2和CDR3序列,或与MF3178的CDR1、CDR2和CDR3序列有最多3个、优选最多2个、优选最多1个氨基酸差异的CDR1、CDR2和CDR3序列。本发明在一个实施方案中提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第一抗原结合部位至少包含MF3958的CDR3序列,并且其中所述第二抗原结合部位至少包含MF3178的CDR3序列。本发明在一个实施方案中提供了双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中所述第一抗原结合部位至少包含MF3958的CDR1、CDR2和CDR3序列,并且其中所述第二抗原结合部位至少包含MF3178的CDR1、CDR2和CDR3序列。CDR序列可例如为了优化的目的而被有所不同,优选为了改善抗体的结合效力或稳定性。优化可例如通过诱变过程进行,此后优选地检测所得抗体的稳定性和/或结合亲和力,并且优选地选择改善的ErbB-2或ErbB-3特异性CDR序列。技术人员能够很好地产生包含至少一个根据本发明经改变CDR序列的抗体变体。例如,应用保守氨基酸替换。保守氨基酸替换的实例包括将一个疏水性残基(例如异亮氨酸、缬氨酸、亮氨酸或蛋氨酸)替换为另一个疏水性残基,以及将一个极性残基替换为另一个极性残基,例如将精氨酸替换为赖氨酸、谷氨酸替换为天冬氨酸或谷氨酰胺替换为天冬酰胺。本发明在一个实施方案中提供了包含结合ErbB-2的可变结构域的抗体,其中所述可变结构域的VH链包含以下VH链的氨基酸序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958(为人源化MF2971)、MF2971、MF3025、MF2916、MF3991(为人源化MF3004)、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898,如图16A或图16E中所示;或包含以下VH链的氨基酸序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958(为人源化MF2971)、MF2971、MF3025、MF2916、MF3991(为人源化MF3004)、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898,如图16A或图16E中所示,其具有相对于图16A或图16E的上述VH链序列的最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。结合ErbB-2的可变结构域的VH链优选包含以下氨基酸序列:-MF1849;或-MF2971或其人源化版本,其中所述人源化版本优选包含MF3958的氨基酸序列;或-MF3004或其人源化版本,其中所述人源化版本优选包含MF3991的氨基酸序列;如图16A中所示。在一个实施方案中,结合ErbB-2的可变结构域的VH链包含VH链MF1849、或MF2971或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3958、或MF3004或其人源化版本的氨基酸序列,其中所述人源化版本优选为包含MF3991的氨基酸序列,其中所列举的VH序列具有相对于图16A中所示各序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。在一个优选的实施方案中,结合ErbB-2的可变结构域的VH链包含MF3958的氨基酸序列;或包含图16A中所示MF3958的氨基酸序列,其具有相对于VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。包含结合ErbB-2的可变结构域的抗体优选为双特异性抗体,其优选地还包含结合ErbB-3的可变结构域。结合ErbB-3的可变结构域的VH链优选包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,如图16B或图16E或图37中所示;或包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,如图16B或图16E或图37中所示,其具有相对于图16B或图16E或图37的VH链序列最多15个,优选1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。结合ErbB-3的可变结构域的VH链优选包含MF3178、MF3176、MF3163、MF6058、MF6061或MF6065的氨基酸序列;或包含MF3178、MF3176、MF3163、MF6058、MF6061或MF6065的氨基酸序列,其具有相对于图16B或图37的各VH链序列的最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。在一个优选的实施方案中,结合ErbB-3的可变结构域的VH链包含MF3178的氨基酸序列;或包含如图16B中所示MF3178的氨基酸序列,其具有相对于VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。优选地,上述氨基酸插入、缺失和替换不存在于所述CDR3区中。上述氨基酸插入、缺失和替换也优选地不存在于CDR1和CDR2区中。上述氨基酸插入、缺失和替换也优选地不存在于FR4区中。本发明还提供了包含结合ErbB-3的可变结构域的抗体,其中所述可变区的VH链包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,如图16B或图16E或图37中所示,或包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,如图16B或图16E或图37中所示,其具有相对于所述VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。结合ErbB-3的可变结构域的VH链优选包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF6058、MF6061或MF6065;或包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF6058、MF6061或MF6065,其具有相对于所述VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。在一个优选的实施方案中,结合ErbB-3的可变结构域的VH链包含如图16B中所示VH链MF3178的氨基酸序列;或包含如图16B中所示VH链MF3178的氨基酸序列,其具有相对于所述VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。包含结合ErbB-3的可变结构域的抗体优选为双特异性抗体,其优选地还包含结合ErbB-2的可变结构域。结合ErbB-2的可变结构域的VH链优选包含图16A或图16E的VH链的氨基酸序列。结合ErbB-2的可变结构域的VH链优选包含MF1849、或MF2971或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3958、或MF3004或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3991的氨基酸序列,如图16A中所示。在一个实施方案中,所列举的结合ErbB-2的VH序列具有相对于图16A中所示各序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。在一个优选的实施方案中,图16A的所述结合ErbB-2的VH链包含MF3958的氨基酸序列;或包含MF3958的氨基酸序列,其具有相对于所述VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。优选地,上述氨基酸插入、缺失和替换不存在于CDR3区。上述氨基酸插入、缺失和替换也优选地不存在于CDR1和CDR2区。上述氨基酸插入、缺失和替换也优选地不存在于FR4区。还提供了根据本发明的抗体,其中所述抗体包含ErbB-2特异性重链可变区序列,其选自以下重链可变区的序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示,或者其中所述抗体包含与MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898的重链可变区序列有最多15个,优选1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸差异的重链可变区序列。还提供了根据本发明的抗体,其中所述抗体包含ErbB-3特异性重链可变区序列,其选自如下重链可变区序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示,或者其中所述抗体包含与MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074的重链可变区序列有最多15个,优选1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸差异的重链可变区序列。本发明在一个实施方案中提供了包含两个结合ErbB-2的抗原结合部位的抗体,其中至少一个所述抗原结合部位结合ErbB-2的结构域I。优选地,这两个抗原结合部位都结合ErbB-2的结构域I。根据本发明的此类抗体特别适合用于与目前使用的不结合ErbB-2结构域I的抗ErbB-2结合分子的组合治疗,例如曲妥珠单抗(其结合ErbB-2的结构域IV)和帕妥珠单抗(其结合ErbB-2的结构域II),因为之后不同的结合分子不与彼此竞争相同的表位。还提供了包含两个结合ErbB-2的抗原结合部位的抗体,其中至少一个所述抗原结合部位结合ErbB-2的结构域I,并且其中所述至少一个抗原结合部位对ErbB-2阳性细胞的亲和力(KD)低于或等于5.0nM,优选低于或等于4.5nM,更优选低于或等于3.9nM。优选地,这两个抗原结合部位都结合ErbB-2的结构域I。在一个优选的实施方案中,所述至少一个抗原结合部位对SK-BR-3细胞上ErbB-2的亲和力低于或等于5.0nM,优选低于或等于4.5nM,更优选低于或等于4.0nM,更优选低于或等于3.5nM,更优选低于或等于3.0nM,更优选低于或等于2.3nM。在一个实施方案中,所述亲和力在3.0nM-1.6nM范围内。在一个优选的实施方案中,所述至少一个抗原结合部位对BT-474细胞上ErbB-2的亲和力低于或等于5.0nM,优选低于或等于4.5nM,更优选低于或等于3.9nM。在一个实施方案中,所述亲和力在4.5nM-3.3nM范围内。上述亲和力优选为使用稳态细胞亲和力测量进行测量,其中将细胞利用放射性标记的抗体在4℃下孵育,其后测量与细胞结合的放射性,如实施例中所述。本发明还提供了包含两个结合ErbB-2的可变结构域的抗体,其中所述可变结构域的VH链包含以下VH链的氨基酸序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958(为人源化MF2971)、MF2971、MF3025、MF2916、MF3991(为人源化MF3004)、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898,如图16A或图16E中所示;或以下VH链的氨基酸序列:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958(为人源化MF2971)、MF2971、MF3025、MF2916、MF3991(为人源化MF3004)、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898,如图16A或图16E中所示,其具有相对于在图16A或图16E中所示各序列最多15个,优选1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。所述VH优选包含VH链MF1849、或MF2971或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3958、或MF3004或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3991的氨基酸序列,如图16A中所示;或包含VH链MF1849、或MF2971或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3958、或MF3004或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3991的氨基酸序列,如图16A中所示,其具有相对于在图16A中所示各序列最多15个,优选1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。所述抗体的可变结构域优选包含相同的VH链,其优选具有如图16A或图16E中所示序列。具有带有相同VH链的可变结构域的抗体不是双特异性抗体。如有以下情况,则VH链为相同的:VH链包含如图16A或图16E或图37中所示相同VH链序列,或相同VH链序列,但具有相对于图16A或图16E或图37中所示各序列的1、2、3、4或5个氨基酸插入、缺失、替换或其组合。本发明在一个实施方案中提供了包含两个结合ErbB-3的抗原结合部位的抗体,其中至少一个所述抗原结合部位结合ErbB-3的结构域III。优选地,这两个抗原结合部位都结合ErbB-3的结构域III。根据本发明的此类抗体特别适合用于与目前使用的不结合ErbB-3结构域III的抗ErbB-3结合分子的组合治疗,例如MM121(#Ab6)和RG7116(其结合ErbB-3的结构域I),因为之后不同的结合分子不与彼此竞争相同的表位。还提供了包含两个结合ErbB-3的抗原结合部位的抗体,其中至少一个所述抗原结合部位结合ErbB-3的结构域III,并且其中所述至少一个抗原结合部位对ErbB-3阳性细胞的亲和力(KD)低于或等于2.0nM,优选低于或等于1.5nM,更优选低于或等于1.39nM,更优选低于或等于0.99nM。优选地,这两个抗原结合部位都结合ErbB-3的结构域III。在一个优选的实施方案中,所述至少一个抗原结合部位对SK-BR-3细胞上ErbB-3的亲和力低于或等于2.0nM,优选低于或等于1.5nM,更优选低于或等于1.39nM,更优选低于或等于0.99nM。在一个实施方案中,所述亲和力在1.39nM-0.59nM范围内。在一个优选的实施方案中,所述至少一个抗原结合部位对BT-474细胞上ErbB-3的亲和力低于或等于2.0nM,更优选低于或等于1.5nM,更优选低于或等于1.0nM,更优选低于或等于0.5nM,更优选低于或等于0.31nM,更优选低于或等于0.23nM。在一个实施方案中,所述亲和力在0.31nM-0.15nM范围内。再次,上述亲和力优选为使用稳态细胞亲和力测量进行测量,其中将细胞利用放射性标记的抗体在4℃下孵育,其后测量与细胞结合的放射性,如实施例中所述。本发明还提供了包含两个各自结合ErbB-3的可变结构域的抗体,其中所述可变结构域的VH包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,如图16B或图16E或图37中所示;或包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,其具有相对于任何所述VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。所述VH优选包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF6058、MF6061或MF6065;或包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF6058、MF6061或MF6065,其具有相对于任何所述VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。所述VH优选包含VH链MF3178的氨基酸序列;或包含图16B所示VH链MF3178的氨基酸序列,其具有相对于所述MF3178VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。所述抗体的可变结构域优选包含相同的VH链,优选具有如图16B或图16E或图37中所示序列。具有带有相同的VH链的可变结构域的抗体不是双特异性抗体。如有以下情况,则VH链为相同的:VH链包含如图16B或图16E或图37中所示相同VH链序列,或相同VH链序列,但其具有相对于在图16B或图16E或图37中所示VH链序列1、2、3、4或5个氨基酸插入、缺失、替换或其组合。特异性针对ErbB-3的根据本发明的单特异性抗体具有以下优势:与现有技术的化合物(例如MM-121(#Ab6))相比,所述抗体具有针对ErbB-3的更好的功能活性,这意味着根据本发明的这些抗体能够更好地抵抗ErbB-3活性(例如ErbB-3的配体诱导之受体功能和/或配体诱导的ErbB-2和ErbB-3阳性细胞生长)。这例如示于表7和图38中。在一个优选的实施方案中,本发明提供了包含结合ErbB-2的可变结构域的双特异性抗体,其中所述可变结构域的VH链包含:-VH链MF1849、或MF2971或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3958、或MF3004或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3991的氨基酸序列,如图16A中所示;或包含-VH链MF1849或MF2971或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3958、或MF3004或其人源化版本的氨基酸序列,其中所述人源化版本优选包含MF3991的氨基酸序列,如图16A中所示,其具有相对于所述VH最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。根据本实施方案的此类双特异性抗体优选还包含结合ErbB-3的可变结构域。所述结合ErbB-3的可变结构域的VH链优选包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,如图16B或图16E或图37中所示,或最优选包含以下VH链的氨基酸序列:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073或MF6074,如图16B或图16E或图37中所示,其具有相对于图16B或图16E或图37的任意所述VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。所述结合ErbB-3的可变结构域的VH链优选包含图16B中所示VH链MF3178的氨基酸序列;或包含图16B所描述的VH链MF3178的氨基酸序列,其具有相对于图16B的VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。本发明优选地提供了双特异性抗体,其包含结合ErbB-2的可变结构域和结合ErbB-3的可变结构域,其中所述结合ErbB-2的可变结构域VH链包含:-如图16A中所示VH链MF3958的氨基酸序列;或-如图16A中所示VH链MF3958的氨基酸序列,其具有相对于所述VH的最多15个,优选1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合;并且其中所述结合ErbB-3的可变结构域VH链包含:-如图16B中所示VH链MF3178的氨基酸序列;或-如图16B中所示VH链MF3178的氨基酸序列,其具有相对于图16B的VH链序列最多15个,优选1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。本发明优选地提供了双特异性抗体,其包含结合ErbB-2的可变结构域和结合ErbB-3的可变结构域,其中所述结合ErbB-2的可变结构域VH链包含:-如图16A中所示VH链MF3991的氨基酸序列;或-如图16A中所示VH链MF3991的氨基酸序列,其具有相对于所述VH最多15个,优选1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合;并且其中所述结合ErbB-3的可变结构域VH链包含:-如图16B中所示VH链MF3178的氨基酸序列;或-如图16B中所示VH链MF3178的氨基酸序列,其具有相对于图16B的VH链序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合。当与图16中的序列相比时,当VH链相对于图16中所示VH链的氨基酸序列有超过15个氨基酸改变时,该VH链的行为通常开始变得显著地不同。具有相对于图16中所示VH链最多15个,优选为1、2、3、4、5、6、7、8、9或10个氨基酸插入、缺失、替换或其组合的VH链优选具有相对于图16中所示VH链的1、2、3、4或5个氨基酸插入、缺失、替换或其组合,优选1、2、3或4个氨基酸插入、缺失、替换或其组合,优选1、2或3个氨基酸插入、缺失、替换或其组合,更优选1或2个氨基酸的插入、缺失、替换或其组合,并且优选相对于图16中所示VH链的1个氨基酸插入、缺失、替换或其组合。所述一个或更多个氨基酸的插入、缺失、替换或其组合优选地不存在于VH链的CDR1、CDR2和CDR3区。它们也优选地不存在于FR4区。氨基酸替换优选为保守的氨基酸替换。在一个优选的实施方案中,本发明提供了包含如图16D中所示的氨基酸序列的双特异性抗体,或具有相对于图16D的所述序列最多15个,优选为1、2、3、4、5、6、7、8、9或10个,更优选最多1、2、3、4或5个氨基酸插入、缺失、替换或其组合的图16D的双特异性抗体,其中所述最多15个,优选为1、2、3、4、5、6、7、8、9或10个氨基酸替换优选为保守的氨基酸替换。所述插入、缺失、替换或其组合优选地不存在于VH链的CDR3区,优选地不存在于VH链的CDR1、CDR2和CDR3区,并且优选地不存在于FR4区。合理的方法已经向将在人情况下的非人残基含量最小化的方向发展。有多种方法可用于成功地将双特异性抗体的抗原结合性质移植于另一个抗体。抗体的结合性质主要依赖于CDR3区的准确序列,其经常得到与合适的可变结构域整体结构相结合的可变结构域中CDR1和CDR2区序列支持。目前有多种方法可用于将CDR区移植到另一个抗体的合适的可变结构域上。这些方法中的一些在J.C.Almagro1和J.Fransson(2008)FrontiersinBioscience13,1619-1633中综述,其通过引用包含在本文中。因此本发明还提供了人或人源化双特异性抗体,其包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位,其中包含ErbB-2结合部位的可变结构域包含VHCDR3序列,如图16A或图16E中所示,并且其中包含ErbB-3结合部位的可变结构域包含VHCDR3区,如图16B或图16E或图37中所示。包含ErbB-2结合部位的VH可变区优选地包含图16A或图16E中的VH链的CDR1区、CDR2区和CDR3区的序列。包含ErbB-3结合部位的VH可变区优选地包含图16B或图16E或图37中的VH链的CDR1区、CDR2区和CDR3区的序列。CDR移植也可用于生产带有图16或图37的VH的CDR区的VH链,但其具有不同的框架。所述的不同的框架可以来自另一个人VH或不同的哺乳动物。所提到的最多15个,优选为1、2、3、4、5、6、7、8、9或10个氨基酸替换优选为保守氨基酸替换。所述插入、缺失、替换或其组合优选地不存在于VH链的CDR3区,优选地不存在于VH链的CDR1、CDR2或CDR3区,并且优选地不存在于FR4区。包含如图16或图37中所示可变重链序列的可变结构域的轻链优选为生殖系轻链O12,优选重排的生殖系人κ轻链IgVκ1-39*01/IGJκ1*01或其片段或功能衍生物(根据万维网中在imgt.org的IMGT数据库命名)。使用了术语重排的生殖系人κ轻链IgVκ1-39*01/IGJκ1*01、IGKV1-39/IGKJ1、huVκ1-39轻链或简称huVκ1-39。所述轻链可具有1、2、3、4或5个氨基酸插入、缺失、替换或其组合。所提到的1、2、3、4或5个氨基酸的替换优选为保守的氨基酸替换,所述插入、缺失、替换或其组合优选地不存在于VH链的CDR3区,优选地不存在于VH链的CDR1、CDR2或CDR3区或者FR4区。多种方法可用于产生双特异性抗体。一种方法涉及在细胞中表达两种不同的重链和两种不同的轻链,并收集由所述细胞产生的抗体。以该方式生产的抗体将通常含有一系列具有不同重链和轻链组合的抗体,其中一些是所期望的双特异性抗体。双特异性抗体可随后从收集物中纯化。通过所述细胞生产的双特异性抗体与其他抗体的比例可通过多种方式提高。在本发明的一个优选的实施方案中,该比例通过在细胞中表达两个基本相同的轻链,而非两个不同轻链得以提升。这一概念在本领域中也称为“共同轻链”法。当基本相同的轻链与两条不同重链共同作用时,允许形成带有不同抗原结合部位和相伴的不同结合性质的可变结构域,通过所述细胞生产的双特异性抗体与其他抗体的比例相比于两种不同轻链的表达显著地提高。通过所述细胞生产的双特异性抗体的比例可通过相对于两条相同重链配对促使两条不同重链彼此配对来进一步提高。现有技术描述了多种方法,其中可实现这样的重链异源二聚体。一种方法是产生“纽扣入孔(knobintohole)”式双特异性抗体。见美国专利申请20030078385(Arathoon等-Genentech)。另一个且优选的方法描述于美国临时申请61/635,935,其已经由美国正式申请No.13/866,747和PCT申请No.PCT/NL2013/050294(WO2013/157954A1)跟进,其通过引用并入本文。公开了用于从单一细胞中产生双特异性抗体的方法和方式,其中提供的方式相对于形成单特异性抗体更有利于形成双特异性抗体。这些方法也可在本发明中有利地采用。因此本发明提供了用于(从单一细胞中)产生根据本发明的双特异性抗体的方法,其中所述双特异性抗体包含两个能够形成界面的CH3结构域,所述方法包括在所述细胞中提供a)第一核酸分子,其编码包含第一CH3结构域的重链,b)第二核酸分子,其编码包含第二CH3结构域的重链,其中所述核酸分子以用于将包含所述第一和第二CH3结构域的重链优先配对的方式提供,所述方法还包括培养所述宿主细胞并允许表达所述两种核酸分子和从培养物中收获所述双特异性抗体的步骤。所述第一和第二核酸分子可以是相同的核酸分子、载体或基因递送载剂的一部分,并且可以整合在宿主细胞基因组的相同位点上。或者,所述第一和第二核酸分子被分别提供给所述细胞。优选的实施方案提供了用于(从单一细胞中)产生根据本发明的双特异性抗体的方法,其中所述双特异性抗体包含两个能够形成界面的CH3结构域,所述方法包括提供:-细胞,其具有a)编码重链的第一核酸分子,所述重链包含结合ErbB-2且含有第一CH3结构域的抗原结合部位,以及b)编码重链的第二核酸分子,所述重链包含结合ErbB-3且含有第二CH3结构域的抗原结合部位,其中所述核酸分子以用于将所述第一和第二CH3结构域优先配对的方式提供,所述方法还包括培养所述细胞并允许表达所述两种核酸分子和从培养物中收获所述双特异性IgG抗体的步骤。在一个特别优选的实施方案中,所述细胞还具有编码共同轻链的第三核酸分子。所述第一、第二和第三核酸分子可以是相同的核酸分子、载体或基因递送载剂的一部分,并且可以整合在宿主细胞基因组的相同位点上。或者,所述第一、第二和第三核酸分子被分别提供给所述细胞。优选的共同轻链为O12,优选为重排的生殖系人κ轻链IgVκ1-39*01/IGJκ1*01,如上文所述。用于将所述第一和所述第二CH3结构域优先配对的方式优选为在重链编码区的CH3结构域中的对应突变。为了产生基本上只有双特异性抗体的优选突变是第一CH3结构域中的氨基酸替换L351K和T366K(根据Kabat编号),以及第二CH3结构域中的氨基酸替换L351D和L368E,或反之亦然。因此还提供了根据本发明用于产生双特异性抗体的方法,其中所述第一CH3结构域包含氨基酸替换L351K和T366K(根据Kabat编号)并且其中所述第二CH3结构域包含氨基酸替换L351D和L368E,所述方法还包括培养所述细胞并允许表达所述核酸分子和从培养物中收获所述双特异性抗体的步骤。还提供了根据本发明用于产生双特异性抗体的方法,其中所述第一CH3结构域包含氨基酸替换L351D和L368E(根据Kabat编号)并且其中所述第二CH3结构域包含氨基酸替换L351K和T366K,所述方法还包括培养所述细胞并允许表达所述核酸分子和从培养物中收获所述双特异性抗体的步骤。可通过这些方法产生的抗体也是本发明的一部分。所述CH3异源二聚化结构域优选为IgG1异源二聚化结构域。包含所述CH3异源二聚化结构域的重链恒定区优选为IgG1恒定区。在一个实施方案中,本发明提供了编码根据本发明的抗体重链可变区的核酸分子。所述核酸分子(通常为体外分离或重组的核酸)优选地编码如图16A或图16B或图37中所示的重链可变区,或具有1、2、3、4或5个氨基酸插入、缺失、替换或其组合的如图16A或图16B或图37中所示的重链可变区。在一个优选的实施方案中,所述核酸分子包含如图16或图37中所示的序列。在另一个优选的实施方案中,所述核酸分子编码与图16或图37中所示序列相同的氨基酸序列,但因其编码一个或更多个不同的密码子而具有不同的序列。例如,这样的核酸分子是针对抗体生产细胞(如中国仓鼠卵巢(Chinesehamsterovary,CHO)细胞、NS0细胞或PER-C6TM细胞)密码子优化的。本发明还提供了编码图16D或图37的重链的核酸序列。用于本发明中的核酸分子通常但并非唯一地为核糖核酸(ribonucleicacid,RNA)或脱氧核糖核酸(deoxyribonucleicacid,DNA)。对于本领域技术人员,可用替代的核酸。根据本发明的核酸例如包含于细胞中。当所述核酸在所述细胞中表达时,所述细胞产生根据本发明的抗体。因此,本发明在一个实施方案中提供了包含根据本发明的抗体和/或根据本发明的核酸的细胞。所述细胞优选为动物细胞,更优选为哺乳动物细胞,更优选为灵长类细胞,最优选为人类细胞。为达到本发明的目的,合适的细胞为能够包含并且优选能够产生根据本发明的抗体和/或根据本发明的核酸的任何细胞。本发明还提供了包含根据本发明抗体的细胞。优选地,所述细胞(通常为体外的分离或重组的细胞)产生所述抗体。在一个优选的实施方案中,所述细胞为杂交瘤细胞、CHO细胞、NS0细胞或PER-C6TM细胞。在一个特别优选的实施方案中,所述细胞为CHO细胞。还提供了包含根据本发明细胞的细胞的培养物。多个机构和公司已开发出用于大规模生产抗体的细胞系,例如用于临床用途。此类细胞系的非限制实例为CHO细胞、NS0细胞或PER.C6TM细胞。这些细胞也被用于其他目的,如蛋白质的生产。被开发用于工业规模生产蛋白质和抗体的细胞系在本文中还被称为工业细胞系。因此,在一个优选的实施方案中,本发明提供了被开发用于大规模生产抗体的细胞系用于生产本发明抗体的用途。本发明还提供了用于产生抗体的方法,其包括培养本发明的细胞以及从所述培养物中收获所述抗体。优选地,所述细胞在无血清培养基中培养。优选地,所述细胞适于悬浮生长。还提供了可通过用于产生根据本发明抗体的方法获得的抗体。所述抗体优选从培养物的培养基中纯化。优选地,所述抗体亲和纯化。本发明的细胞为例如杂交瘤细胞系、CHO细胞、NS0细胞或已知其用于临床用抗体生产之适宜性的其他细胞类型。在一个特别优选的实施方案中,所述细胞为人细胞。优选地,细胞通过腺病毒E1区或其功能等价物转化。这样的细胞系的优选实例为PER.C6TM细胞系或其等价物。在一个特别优选的实施方案中,所述细胞为CHO细胞或其变体。优选地,变体利用谷氨酰胺合成酶(Glutaminesynthetase,GS)载体系统用于表达抗体。本发明还提供了组合物(优选药物组合物),其包含根据本发明的抗体。所述药物组合物优选地包含(可药用)赋形剂或载体。在一个优选的实施方案中,所述药物组合物包含5-50mM的组氨酸、100-300mM的海藻糖、0.1-03g/L的聚山梨酯20或其组合。pH优选设定为pH=5.5-6.5。在一个优选的实施方案中,所述药物组合物包含25mM的组氨酸、220mM的海藻糖、0.2g/L的聚山梨酯20或其组合。pH优选设定为pH=5.5-6.5,最优选为pH=6。本发明的抗体优选地还包含标记物,优选为用于体内成像的标记物。这样的标记物通常对于治疗应用并不必要。在例如诊断的情况下,标记物可以是有益的。例如,对身体中的靶细胞进行可视化。多种标记物是适用的,并且许多是本领域中公知的。在一个优选的实施方案中,所述标记物是用于检测的放射性标记物。在另一个优选的实施方案中,所述标记物为红外标记物。优选地,所述红外标记物适用于体内成像。多种红外标记物对于本领域技术人员是可用的。优选的红外标记物为例如IRDye800、IRDye680RD、IRDye680LT、IRDye750、IRDye700DX、IRDye800RSIRDye650、IRDye700亚磷酰胺、IRDye800亚磷酰胺(LI-CORUSA;4647SuperiorStreet;Lincoln,Nebraska)。本发明还提供了用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤或有风险患有所述肿瘤的对象的方法,其包括向所述对象施用根据本发明所述的抗体或药物组合物。在开始所述治疗之前,所述方法优选地包括确定所述对象是否患有或有风险患有这样的ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤。在一些实施方案中,所述对象被分类为对于ErbB-2[+]或[++]。在另一个实施方案中,所述对象被分类为对于ErbB-2[+++]。本发明还提供了本发明的抗体,其用于治疗患有或有风险患ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象。或者说,本发明提供了根据本发明的抗体用于制备用于治疗ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的药物或预防剂的用途。本文中使用的术语治疗包括预防。所述肿瘤优选为ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤。优选地,所述阳性肿瘤为乳腺癌,如早期乳腺癌。然而,本发明可应用于范围广泛的ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤,例如胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌、黑色素瘤等。根据本发明的所述抗体通常能够降低配体诱导的受体功能,优选为配体诱导的ErbB-2和ErbB-3阳性细胞生长。根据本发明的所述抗体优选包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位。在一个优选的实施方案中,所述第二抗原结合部位对ErbB-3阳性细胞的亲和力(KD)等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。因此,还提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的抗体,其用于治疗患有或有风险患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象,所述肿瘤优选乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤,其中所述第二抗原结合部位对ErbB-3阳性细胞的亲和力等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。所述第二抗原结合部位对ErbB-3阳性细胞的亲和力优选低于或等于2.0nM,更优选低于或等于1.39nM,更优选低于或等于0.99nM。所述第一抗原结合部位对ErbB-2阳性细胞的亲和力优选低于或等于5.0nM,优选低于或等于4.5nM,优选低于或等于4.0nM。在一个优选的实施方案中,所述抗体为抗体PB4188。在一个优选的实施方案中,根据本发明的所述抗体包含结合ErbB-2结构域I的选自T144、T164、R166、P172、G179、S180和R181的至少一个氨基酸以及位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基的抗原结合部位。在一个优选的实施方案中,根据本发明的所述抗体优选地包含结合ErbB-3结构域III的选自R426的至少一个氨基酸以及在天然ErbB-3蛋白中位于距离R426在以内的暴露于表面的氨基酸残基的抗原结合部位。因此还提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的抗体,其用于治疗患有或有风险患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象,所述肿瘤优选乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤,其中根据本发明的所述抗体包含结合ErbB-2结构域I的选自T144、T164、R166、P172、G179、S180和R181的至少一个氨基酸以及位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基的抗原结合部位,和/或其中根据本发明的所述抗体优选地包含结合ErbB-3结构域III的选自R426的至少一个氨基酸以及在天然ErbB-3蛋白中位于距离R426在以内的暴露于表面的氨基酸残基的抗原结合部位。所述对象优选为人对象。所述对象优选为适合用于使用ErbB-2特异性抗体(如曲妥珠单抗)的单克隆抗体疗法的对象。在一个优选的实施方案中,所述对象包含肿瘤,优选ErbB-2/ErbB-3阳性癌症,优选为具有ErbB-2治疗抗性表型和/或调蛋白抗性表型、优选单克隆抗体抗性表型的肿瘤/癌症。涉及这样的表型的肿瘤可逃避以目前的抗HER2方案进行的治疗,所述方案例如(但不限制于)针对ErbB-2的单克隆抗体治疗。根据本发明的抗体向患者的施用量通常处于治疗窗中,这意为使用用于获得治疗作用的充足量,但该量不超过导致不可接受程度副作用的阈值。需要用于获得期望治疗作用的抗体量越低,所述治疗窗口通常将越大。因此,在低剂量下发挥充分治疗作用的根据本发明的抗体是优选的。所述剂量可在用于曲妥珠单抗的给药方案的范围内或更低。本发明尤其描述了抗体,其靶向ErbB-2和ErbB-3并且导致即便在存在逃避机制(例如上调NRG1-β1)的情况下的对体外癌细胞系的强效增殖抑制和体内肿瘤生长抑制。鉴定到了特异性针对ErbB-2或ErbB-3的多种人和鼠Fab结合臂。这些通过将其克隆到在驱动重链异源二聚化的CH3区含有突变的互补表达载体中作为双特异性抗体产生。以小规模产生超过500种双特异性抗体,并在结合和功能测定中对三种不同的癌细胞系进行测试。选择了多种双特异性抗体并利用BxPC3细胞系在原位异种移植模型(orthotopicxenograft)中进行测试。该细胞系表达ErbB-2和ErbB-3受体二者,并且其生长部分地依赖于ErbB-3配体。BxPC3模型是稳健并且严格的筛选模型。此外,已经利用使用JIMT-1细胞系的异种移植模型确定了体内的强抗肿瘤活性。JIMT-1细胞来自于在临床上对曲妥珠单抗有抗性的患有乳腺癌的62岁患者的胸膜转移。JIMT-1细胞作为贴壁的单层生长,并在裸鼠内形成异种移植移植肿瘤。JIMT-1细胞具有扩增的HER-2癌基因,其在其编码序列中未表现出可鉴定的突变。JIMT-1细胞过量表达HER-2mRNA及蛋白,并且HER-1、HER-3和HER-4mRNA及蛋白质的水平与对曲妥珠单抗敏感的细胞系SKBR-3类似(Tanner等,MolCancerTher2004)。重要的是,与目前使用的单克隆抗体曲妥珠单抗和帕妥珠单抗以及化合物拉帕替尼相比,使用根据本发明的抗体获得了更好的抗肿瘤作用。本发明的抗体可在悬浮293F细胞中,在瞬时转染之后,以>50mg/L的水平产生。该双特异性抗体可以>70%的产率纯化至大于98%的纯度。分析表征研究示出了双特异性IgG1抗体谱,其与二价单特异性IgG1相当。就功能活性而言,本发明的双特异性抗体在体外和体内可表现出与曲妥珠单抗+帕妥珠单抗相比更好的效力。本发明的一些优选实施方案提供了组合治疗。在一个实施方案中,根据本发明的抗体与曲妥珠单抗或帕妥珠单抗组合,因为这些抗体结合不同的ErbB-2表位,所以它们不与根据本发明的抗体竞争相同的表位,如实施例中所示。在另一个实施方案中,根据本发明的抗体与MM-121(#Ab6)或RG7116(Roche)组合,因为这些抗体结合不同的ErbB-3表位结合,所以它们不与根据本发明的抗体竞争相同的表位,如实施例中所示。在另一个优选的实施方案中,特异性针对ErbB-2和ErbB-3的结合化合物与PI3激酶途径组分抑制剂和/或MAPK途径组分抑制剂组合,例如与酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂或Src抑制剂组合。在一个实施方案中,特异性针对ErbB-2和ErbB-3的结合化合物与微管扰乱药物(microtubulidisruptingdrug)或与组蛋白去乙酰化酶(histonedeacetylase,HDAC)抑制剂组合。出人意料地,本发明人发现了当使用这些组合时的协同作用。因此还提供了用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤或有风险患有所述肿瘤的对象的方法,所述方法包括向所述对象施用:-特异性针对ErbB-2和ErbB-3的结合化合物,以及-一种或多种化合物,其选自PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和组蛋白去乙酰化酶(HDAC)抑制剂。所述抑制剂优选地包含酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂或Src抑制剂。所述酪氨酸激酶抑制剂优选为阿法替尼(afatinib)、拉帕替尼和/或来那替尼(neratinib)。所述PI3Ka抑制剂优选为BYL719。在一个实施方案中,所述Akt抑制剂为MK-2206。在一个优选的实施方案中,所述mTOR抑制剂为依维莫司(everolimus)。在一个优选的实施方案中,所述Src抑制剂为塞卡替尼(saracatinib)。在一个优选的实施方案中,所述微管扰乱药物为紫杉醇。在一个优选的实施方案中,所述HDAC抑制剂为伏立诺他(vorinostat)。在一个优选的实施方案中,所述特异性针对ErbB-2和ErbB-3的结合化合物为M-111(MerrimackPharmaceuticals)。在一个优选的实施方案中,所述特异性针对ErbB-2和ErbB-3的结合化合物为双特异性抗体。在一个优选的实施方案中,所述特异性针对ErbB-2和ErbB-3的结合化合物为根据本发明的双特异性抗体。因此还提供了用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤或有风险患有所述肿瘤的对象的方法,所述方法包括向所述对象施用:-包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体,以及-一种或多种化合物,其选自PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和HDAC抑制剂。还提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体,其用于治疗ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤,其中所述治疗包括向患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象施用所述双特异性抗体和至少一种选自以下的化合物:PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和HDAC抑制剂。优选地,具有结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位的根据本发明的双特异性抗体与一种或更多种选自以下的化合物组合:PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和HDAC抑制剂。所述抑制剂优选地包含酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂或Src抑制剂。所述酪氨酸激酶抑制剂优选为阿法替尼、拉帕替尼和/或来那替尼。所述PI3Ka抑制剂优选为BYL719。在一个实施方案中,所述Akt抑制剂为MK-2206。在一个优选的实施方案中,所述mTOR抑制剂为依维莫司。在一个优选的实施方案中,所述Src抑制剂为塞卡替尼。在一个优选的实施方案中,所述微管扰乱药物为紫杉醇。在一个优选的实施方案中,所述HDAC抑制剂为伏立诺他。所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤优选为乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤。最优选地,所述肿瘤为乳腺癌。在一个实施方案中,所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤具有少于1.000.000个ErbB-2细胞表面受体/肿瘤细胞。在一个实施方案中,与选自PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和HDAC抑制剂的一种或更多种化合物,优选地与选自酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂、Src抑制剂、伏立诺他和紫杉醇的至少一种化合物,更优选地与选自阿法替尼、拉帕替尼、来那替尼、BYL719、MK-2206、依维莫司、塞卡替尼、伏立诺他和紫杉醇的至少一种化合物组合的根据本发明的抗体通常能够降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能,优选配体诱导的生长。根据本发明的所述抗体优选包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位。在一个优选的实施方案中,所述第二抗原结合部位对ErbB-3阳性细胞的亲和力(KD)等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。所述第二抗原结合部位对ErbB-3阳性细胞的亲和力优选低于或等于2.0nM,更优选低于或等于1.39nM,更优选低于或等于0.99nM。所述第一抗原结合部位对ErbB-2阳性细胞的亲和力优选低于或等于5.0nM,优选低于或等于4.5nM,优选低于或等于4.0nM。在一个优选的实施方案中,与选自PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和HDAC抑制剂的一种或更多种化合物,优选地与选自酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂、Src抑制剂、伏立诺他和紫杉醇的至少一种化合物,更优选地与选自阿法替尼、拉帕替尼、来那替尼、BYL719、MK-2206、依维莫司、塞卡替尼、伏立诺他和紫杉醇的至少一种化合物组合的根据本发明的抗体包含结合ErbB-2结构域I的选自T144、T164、R166、P172、G179、S180和R181的至少一个氨基酸以及位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基的抗原结合部位。在一个优选的实施方案中,与选自PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和HDAC抑制剂的一种或更多种化合物,优选地与选自酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂、Src抑制剂、伏立诺他和紫杉醇的至少一种化合物,更优选地与选自阿法替尼、拉帕替尼、来那替尼、BYL719、MK-2206、依维莫司、塞卡替尼、伏立诺他和紫杉醇的至少一种化合物组合的根据本发明的抗体包含结合ErbB-3结构域III的选自R426的至少一个氨基酸以及在天然ErbB-3蛋白中位于距离R426在以内的暴露于表面的氨基酸残基的抗原结合部位。优选地,包含选自MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898的ErbB-2特异性重链可变区的至少CDR3序列,优选至少CDR1、CDR2和CDR3序列(如图16A或图16E中所示),和/或包含选自MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074的ErbB-3特异性重链可变区的至少CDR3序列,优选至少CDR1、CDR2和CDR3序列,(如图16B或图16E或图37中所示)的根据本发明的双特异性抗体与选自PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和HDAC抑制剂的一种或更多种化合物,优选地与选自酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂、Src抑制剂、伏立诺他和紫杉醇的至少一种化合物,更优选地与选自阿法替尼、拉帕替尼、来那替尼、BYL719、MK-2206、依维莫司、塞卡替尼、伏立诺他和紫杉醇的至少一种化合物组合。在一个优选的实施方案中,根据本发明的双特异性抗体包含:-ErbB-2特异性重链可变区序列,其选自MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898的重链可变区序列,如图16A或图16E中所示,或包含与MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003或MF1898的重链可变区序列有最多15个氨基酸,优选最多1、2、3、4、5、6、7、8、9或10个氨基酸,更优选最多1、2、3、4或5个氨基酸差异的ErbB-2特异性重链可变区序列,以及-ErbB-3特异性重链可变区序列,其选自MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074的重链可变区序列,如图16B或图16E或图37中所示,或包含与MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MR6070、MF6071、MF6072、MF6073或MF6074的重链可变区序列有最多15个氨基酸,优选最多1、2、3、4、5、6、7、8、9或10个氨基酸,更优选最多1、2、3、4或5个氨基酸差异的ErbB-3特异性重链可变区序列,所述抗体与选自PI3激酶途径成分的抑制剂、MAPK途径成分的抑制剂、微管扰乱药物和HDAC抑制剂的一种或更多种化合物,优选地与选自酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂、Src抑制剂、伏立诺他和紫杉醇的至少一种化合物,更优选地与选自阿法替尼、拉帕替尼、来那替尼、BYL719、MK-2206、依维莫司、塞卡替尼、伏立诺他和紫杉醇的至少一种化合物组合。在一个优选的实施方案中,抗体PB4188与选自PI3激酶途径组分抑制剂、MAPK途径组分抑制剂、微管扰乱药物和HDAC抑制剂的一种或更多种化合物,优选地与选自酪氨酸激酶抑制剂、PI3Ka抑制剂、Akt抑制剂、mTOR抑制剂、Src抑制剂、伏立诺他和紫杉醇的至少一种化合物,更优选地与选自阿法替尼、拉帕替尼、来那替尼、BYL719、MK-2206、依维莫司、塞卡替尼、伏立诺他和紫杉醇的至少一种化合物组合。本发明的一些优选的实施方案提供了根据本发明的抗体在调蛋白应激状况下的用途。调蛋白是参与ErbB-3阳性肿瘤细胞生长的生长因子。通常来说,当肿瘤细胞表达高水平的调蛋白时(称为调蛋白应激),目前已知的治疗(如曲妥珠单抗、帕妥珠单抗和拉帕替尼)不再能够抑制肿瘤生长。该现象被称为调蛋白抵抗(heregulinresistance)。然而,出人意料的是,根据本发明的抗体也能够抵抗表达高水平调蛋白之肿瘤细胞的生长。如本文中使用的,在如下条件下认为调蛋白的表达水平较高:如果细胞所具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。调蛋白表达水平例如使用qPCR以肿瘤RNA进行检测(例如描述于Shames等,PLOSONE,February2013,Vol.8,Issue2,pp1-10和Yonesaka等,Sci.transl.Med.,Vol.3,Issue99(2011);pp1-11),或使用蛋白检测方法,例如ELISA,优选使用血液、血浆或血清样品(例如描述于Yonesaka等,Sci.transl.Med.,Vol.3,Issue99(2011);pp1-11)。因此还提供了根据本发明的抗体,其用于治疗患有或有风险患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象,其中所述肿瘤的所述细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。根据本发明的所述抗体优选包含结合ErbB-2结构域I的第一抗原结合部位。还提供了用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象的方法,其中所述肿瘤的细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%,所述方法包括向所述对象施用根据本发明的抗体或药物组合物。一个优选的实施方案提供了根据本发明的抗体用于制备用于治疗ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的药物的用途,其中所述肿瘤的细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤优选为乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤。最优选地,所述肿瘤为乳腺癌。因此还提供了根据本发明的抗体,其用于治疗患有或有风险患有以下的对象:乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤,优选乳腺癌,其中所述癌症的细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。根据本发明的所述抗体优选包含结合ErbB-2结构域I的第一抗原结合部位。高调蛋白水平通常在转移形成期间(即肿瘤细胞或肿瘤起始细胞的迁移、侵袭、生长和/或分化)存在。通常来说,肿瘤起始细胞基于干细胞标志物来确定,所述标志物例如CD44、CD24、CD133和/或ALDH1。因此,这些过程几乎不可用目前已知的治疗(例如曲妥珠单抗和帕妥珠单抗)所抵抗。因为根据本发明的抗体能够抵抗表达高水平调蛋白的肿瘤细胞或肿瘤起始细胞的生长和/或分化,这样的根据本发明的抗体还特别适用于抵抗转移的形成。因此,还提供了用于在患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象中抵抗转移形成的方法,其中所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%,所述方法包括向所述对象施用包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体。还提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体,其用于治疗或预防转移的形成,其中所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。还提供了根据本发明的双特异性抗体用于制备用于治疗或预防转移形成的药物的使用,其中所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤优选为乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤。最优选地,所述肿瘤为乳腺癌。因此还提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的根据本发明的双特异性抗体,其用于治疗或预防以下细胞的转移形成:乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤细胞,优选乳腺癌细胞,其中所述细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。根据本发明的所述抗体通常能够降低ErbB-2和ErbB-3阳性细胞上ErbB-3的配体诱导之受体功能,优选配体诱导的生长。根据本发明的所述抗体优选地包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位。在一个优选的实施方案中,所述第二抗原结合部位对ErbB-3阳性细胞的亲和力(KD)等于或高于所述第一抗原结合部位对ErbB-2阳性细胞的亲和力。所述第二抗原结合部位对ErbB-3阳性细胞的亲和力优选低于或等于2.0nM,更优选低于或等于1.39nM,更优选低于或等于0.99nM。所述第一抗原结合部位对ErbB-2阳性细胞的亲和力优选低于或等于5.0nM,优选低于或等于4.5nM,更优选低于或等于4.0nM。在一个优选的实施方案中,根据本发明的所述抗体包含结合ErbB-2结构域I的选自T144、T164、R166、P172、G179、S180和R181的至少一个氨基酸以及位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基的抗原结合部位。在一个优选的实施方案中,根据本发明的所述抗体优选地包含结合ErbB-3结构域III的选自R426的至少一个氨基酸以及在天然ErbB-3蛋白中位于距离R426在以内的暴露于表面的氨基酸残基的抗原结合部位。一个优选的实施方案提供了根据本发明的用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象的方法,其中所述肿瘤的细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%,或根据本发明的用于此类治疗的抗体,其中所述抗体包含ErbB-2特异性重链可变区的至少CDR3序列,优选至少CDR1、CDR2和CDR3序列,或至少重链可变区序列,所述ErbB-2特异性重链可变区选自:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示。一个优选的实施方案提供了根据本发明的用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象的方法,其中所述肿瘤的细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%,或根据本发明的用于此类治疗的抗体,其中所述抗体包含ErbB-3特异性重链可变区的至少CDR3序列,优选至少CDR1、CDR2和CDR3序列,或至少重链可变区序列,所述ErbB-3特异性重链可变区选自MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示。一个实施方案提供了用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象的抗体PB4188,其中所述肿瘤的细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。如已描述的,根据本发明的抗体特别适用于治疗ErbB-2阳性肿瘤细胞,所述细胞在其细胞表面上具有少于1.000.000个ErbB-2受体。通常被分类为ErbB-2[++]或ErbB-2[+]的患有此类肿瘤的患者包括带有原发性肿瘤的患者以及带有复发的ErbB-2阳性肿瘤的患者。目前使用的治疗(例如曲妥珠单抗(赫塞汀)和帕妥珠单抗)仅为被分类为ErbB-2[+++]的带有恶性ErbB-2阳性细胞的患者开出,所述细胞在其细胞表面上具有超过1.000.000个ErbB-2受体,。因此,被分类为ErbB-2[++]或ErbB-2[+]的患者优选地用根据本发明的抗体进行治疗。因此还提供了根据本发明使用的方法或抗体,其中所述对象具有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤,所述肿瘤具有少于1.000.000个ErbB-2细胞表面受体/肿瘤细胞。一个优选的实施方案提供了根据本发明的包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体,其用于治疗或预防转移的形成,其中所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%,并且其中所述肿瘤细胞具有少于1.000.000个ErbB-2细胞表面受体。在另一个优选的实施方案中,根据本发明的抗体被用于在患有心脏功能受损或处于其风险中的对象中抵抗ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤。患有心脏功能受损意味着所述对象所具有与健康心脏功能相比低于90%、优选低于85%或低于80%、优选为较低于75%或较低于70%的心脏功能,例如左心室射血分数(leftventricularejectionfraction,LVEF)。所述健康心脏功能为例如健康群体的平均心脏功能(例如平均LVEF)。或者,所述健康心脏功能是患者在开始用根据本发明的抗体进行抗肿瘤治疗之前所测量的功能(例如LVEF)。心脏功能使用例如超声心动图(echocardiogram)或MUGA扫描,例如通过对象的身体检查和通过LVEF检测来监测。作为涉及调蛋白受体复合物HER2:HER4的信号传导网络的一部分,ErbB-2参与成年心肌细胞的生长、修复和存活。如前文中所述,心脏毒性是ErbB-2靶向治疗中的已知风险因素,并且当曲妥珠单抗与蒽环类联用时,并发症的频率提高,从而诱发心脏应激。例如,多西环素与曲妥珠单抗的组合诱发严重的心脏副作用。尽管曲妥珠单抗诱发的心功能障碍的临床病例数在增多,其作用机制却是未知的。鉴于目前已知的针对ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤之治疗的心脏毒性,使用根据本发明的抗体是特别有利的。如实施例中所示,现在提供了不影响或在与曲妥珠单抗和帕妥珠单抗相比显著更小的程度上影响心肌细胞存活的抗体。因为降低了心脏毒性,这提供了重要的优势。这对于未遭受到受损心脏功能的人来说已经是有利的,并且对于遭受到受损心脏功能的人来说(例如患有充血性心脏衰竭(CHF)、左心室功能障碍(LVD)和/或下降的左心室射血分数(LVEF)的对象,和/或已患有心肌梗死的对象)更是如此。因此还提供了根据本发明的双特异性抗体,其用于治疗患有或有风险患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象,其中所述对象所具有的心脏功能与健康心脏功能相比低于90%,优选低于85%或低于80%或低于75%或低于70%。所述心脏功能优选地包括LVEF。所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤优选为乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤。最优选地,所述肿瘤为乳腺癌。根据本发明的所述抗体优选地包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位。一个优选的实施方案提供了根据本发明的方法,其用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象,其中所述对象所具有的心脏功能与健康心脏功能相比低于90%,优选低于85%,优选低于80%,优选低于75%或低于70%,或根据本发明的用于此类治疗的抗体,其中所述抗体包含:-ErbB-2特异性重链可变区的至少CDR3序列,优选至少CDR1、CDR2和CDR3序列,或至少重链可变区序列,所述ErbB-2特异性重链可变区选自:MF2926、MF2930、MF1849、MF2973、MF3004、MF3958、MF2971、MF3025、MF2916、MF3991、MF3031、MF2889、MF2913、MF1847、MF3001、MF3003和MF1898,如图16A或图16E中所示,或与所列举的重链可变区序列有最多15个氨基酸,优选最多1、2、3、4、5、6、7、8、9或10个氨基酸,更优选最多1、2、3、4或5个氨基酸差异的重链可变区序列,和/或-ErbB-3特异性重链可变区的至少CDR3序列,优选至少CDR1、CDR2和CDR3序列,或至少重链可变区序列,所述ErbB-3特异性重链可变区选自:MF3178、MF3176、MF3163、MF3099、MF3307、MF6055、MF6056、MF6057、MF6058、MF6059、MF6060、MF6061、MF6062、MF6063、MF6064、MF6065、MF6066、MF6067、MF6068、MF6069、MF6070、MF6071、MF6072、MF6073和MF6074,如图16B或图16E或图37中所示,或与所列举的重链可变区序列有最多15个氨基酸,优选最多1、2、3、4、5、6、7、8、9或10个氨基酸,更优选最多1、2、3、4或5个氨基酸差异的重链可变区序列。在一个优选的实施方案中,所述抗体为PB4188。在一个优选的实施方案中,所述双特异性抗体用于治疗处于调蛋白应激状况下的对象,如在别处更详细地说明的。因此还提供了根据本发明的双特异性抗体,其用于治疗患有或有风险患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象,其中所述对象所具有的心脏功能与健康心脏功能相比低于90%,优选低于85%,优选低于80%,优选低于75%或低于70%,并且其中所述肿瘤的所述细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。所述心脏功能优选为包括LVEF。还提供了用于治疗患有ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的对象的方法,其中所述对象所具有的心脏功能与健康心脏功能相比低于90%,优选低于85%,优选低于80%,优选低于75%,优选低于70%,并且其中所述肿瘤细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%,所述方法包括向所述对象施用根据本发明的双特异性抗体或药物组合物。一个优选的实施方案提供了根据本发明的双特异性抗体用于制备用于在对象中治疗ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤的药物的用途,所述对象所具有的心脏功能(优选LVEF)与健康心脏功能(优选健康的LVEF)相比低于90%,优选低于85%,优选低于80%,优选低于75%或低于70%,其中所述肿瘤的细胞具有的调蛋白表达水平为BXPC3或MCF7细胞的调蛋白表达水平的至少60%,优选至少70%,更优选至少80%,更优选至少85%,更优选至少90%或95%。还提供了包含结合ErbB-2的第一抗原结合部位和结合ErbB-3的第二抗原结合部位的双特异性抗体,其用于治疗或预防转移形成,其中所述对象所具有的心脏功能与健康心脏功能相比低于90%,优选低于85%,优选低于80%,优选低于75%,优选低于70%。还提供了根据本发明的双特异性抗体用于制备用于治疗或预防转移形成的药物的用途,其中所述对象所具有的心脏功能与健康心脏功能相比低于90%,优选低于85%,优选低于80%,优选低于75%,优选低于70%。所述ErbB-2、ErbB-3或ErbB-2/ErbB-3阳性肿瘤优选为乳腺癌、胃癌、结直肠癌、结肠癌、胃-食管癌、食管癌、子宫内膜癌、卵巢癌、肝癌、包括非小细胞肺癌的肺癌、透明细胞肉瘤、唾液腺癌、头颈部癌、脑癌、膀胱癌、胰腺癌、前列腺癌、肾癌、皮肤癌或黑色素瘤。最优选地,所述肿瘤为乳腺癌。所述心脏功能优选地包括LVEF。在一个优选的实施方案中,所述抗体为抗体PB4188。在另一个实施方案中,使用了根据本发明的抗体用于抵抗促存活途径Akt(也称为PI3激酶途径)和MAP激酶途径的多种因子的磷酸化。这些是HER3的下游促增殖信号传导途径。出人意料的是,本发明人已经成功地用根据本发明的抗体显著地抑制Akt、ERK1/2和S6核糖体蛋白(S6-RP)的磷酸化,然而曲妥珠单抗和帕妥珠单抗不具有这些强抗磷酸化作用。抵抗促增殖的PI3激酶和MAP激酶途径的因子磷酸化是有利的,因为这抵抗了ErbB-3阳性肿瘤细胞的生长。因此还提供了根据本发明的抗体用于抵抗(优选抑制)Akt、ERK1/2和/或S6-RP的磷酸化的用途。重要的是,在体外和体内两种情况下,用本发明的抗体可显著地降低或甚至完全阻断Akt的磷酸化,如实施例中所示。因此,一个优选的实施方案提供了根据本发明的抗体用于抵抗(优选抑制)Akt磷酸化的用途。还提供了根据本发明的抗体用于抵抗HER3-p85复合物形成的用途。因为HER3-p85复合物的形成是Akt活化中的第一阶段,所以抵抗所述HER3-p85复合物的形成是有利的。根据本发明的所述抗体优选为包含结合ErbB-2结构域I的第一抗原结合部位和结合ErbB-3结构域III的第二抗原结合部位的双特异性抗体。所述抗体优选包含结合ErbB-2结构域I的选自T144、T164、R166、P172、G179、S180和R181的至少一个氨基酸以及位于距离T144、T164、R166、P172、G179、S180或R181约5个氨基酸位置以内的暴露于表面的氨基酸残基的抗原结合部位。作为替代或补充,所述抗体优选包含结合ErbB-3结构域III的选自F409和R426的至少一个氨基酸以及在天然ErbB-3蛋白中位于距离R426在以内的暴露于表面的氨基酸残基的抗原结合部位。在一个实施方案中,所述抗体包含至少一个CDR1、CDR2和CDR3序列,或至少一个VH序列,如图16或图37中所示。在一个实施方案中,所述抗体为PB4188。为了达到清楚和简洁描述的目的,本文中作为相同的或分开的一些实施方案的一部分来描述特征,然而,将要理解的是,本发明的范围可包括具有所描述的所有或一些特征的组合的一些实施方案。附图简述图1:一组HER2臂的单体HER2抗原滴定,所述HER2臂也与PG3178的一条臂组合存在于活性HER2xHER3双特异性抗体中。在HER2抗原滴定ELISA中测试了除PG3025以外的HER2xHER3组的所有HER2单克隆。图2:有或无配体刺激下,HER2xHER3双特异性抗体对BxPC3细胞的功能活性。虚线表示在有或无配体刺激下,本测定中参照抗体曲妥珠单抗的活性。图3:在MCF-7测定中,HER2和HER3单克隆抗体(上图)及其HER2xHER3双特异性抗体(下图)的滴定曲线。图4:在原位鼠模型中,在第31天的对BxPC3-luc2肿瘤尺寸的抗体处理效果。BLI,通过生物发光测量的肿瘤生长。图5:在原位鼠模型中,在第31天的对BxPC3-luc2肿瘤尺寸的抗体处理效果。BLI,通过生物发光测量的肿瘤生长。图6:双特异性HER2xHER3抗体及其亲代单克隆抗体对MCF-7和BxPC3-luc2HER2表达细胞的FACS分析。MFI,平均荧光强度。图7:通过HP-SEC和CIEX-HPLC的分析表征。PB4188(上图),抗HER2亲代单克隆抗体(中图),抗RSV单克隆参照IgG(下图)。图8:一系列滴定的抗体对在软琼脂中JIMT-1细胞增殖的抑制。图9:一系列滴定的抗体对在基质胶(matrigel)中BT-474细胞(上图)和SKBR3细胞(下图)增殖的抑制。图10a:HRG诱导的基质胶中SKBR-3细胞的增殖和分支/侵袭。图10b:与亲代单克隆抗体相比的PB4188对HRG诱导的基质胶中SKBR-3细胞的增殖和分支/侵袭的抑制。图10c:与抗HER3单克隆抗体相比的PB4188对HRG诱导的基质胶中SKBR-3细胞的增殖和分支/侵袭的抑制。图10d:与抗HER3单克隆抗体与曲妥珠单抗的组合相比的PB4188对HRG诱导的基质胶中SKBR-3细胞的增殖和分支/侵袭的抑制。图10e:PB4188以及PB4188加曲妥珠单抗的组合对HRG诱导的基质胶中SKBR-3细胞的增殖和分支/侵袭的抑制。图11:PB4188在100ng/ml的HRG存在下在HER2+++N87细胞中的优越抑制活性。图12:在剂量滴度中,PB4188和PB3448的ADCC活性。图13:双特异性抗体与单克隆亲代抗体或其组合相比的升高的ADCC活性。图14:无岩藻糖基化PB4188与曲妥珠单抗相比对低HER2表达细胞(上图)及高HER2表达细胞(下图)的ADCC活性。图15:在表达高或低FcγR变体的报道细胞(reportercell)存在下,无岩藻糖基化PB4188对SKBR-3HER2+++细胞的ADCC活性。图16:本发明抗体的VH链、共同轻链和重链的核酸和氨基酸序列。在该图中标示出了前导序列,其不是VH链或抗体的一部分,而通常在产生该蛋白质的细胞中在蛋白质加工期间被切割掉。图17:在JIMT-1鼠同种异体移植模型中抗体对肿瘤尺寸的处理效果。通过肿瘤体积卡尺测量不同处理组而测量的肿瘤生长。上图,60天期间的肿瘤生长;下图,在处理期结束时(29天)的底部肿瘤生长抑制(tumorgrowthinhibition,TGI)。图18:在JIMT-1鼠同种异体移植模型中不同处理组的Kaplan-Meier生存曲线。图19:N87配体驱动生长的抑制。与亲代抗HER3抗体相比,HRG驱动的N87增殖可在宽范围的HRG中被PB4188克服。数据以40ng/ml的抗体浓度显示。图20:125I标记的IgGHER2xHER3(PB4188)对BT-474细胞(上方;三个独立测定)和SK-BR-3细胞(下方;三个独立测定)的稳态细胞亲和力测量。使用100倍过量的非标记HER2xHER3测定非特异性结合。图21A:对HER2表位通过作图定位。所鉴定的关键残基在HER2晶体结构上表示为黑色球体,所鉴定的次要关键残基表示为灰色球体(PDBID#1S78)。图21Ba)HER2晶体结构(PDB#1S78),其作为浅灰色球体示出经证实的PG3958表位残基,并且作为深灰色球体示出周围的残基(+/-5个氨基酸残基)。b)表位区域的暴露于溶剂的表面,其以灰色示出经证实的表位残基,并且以黑色示出周围的残基(+/-5个残基)。c)表位区域的详细视图,其中经证实的表位残基为浅灰色,且周围的残基(+/-5个残基)为深灰色。d)HER2PG3958表位区域的一级氨基酸序列,其标示了经证实的表位残基(灰色下划线)、周围的残基(黑色)和较远的残基(灰色斜体,在a、b和c中未示出)。以Yasara(www.yasara.org)进行制图和分析。图21C:a)HER3晶体结构(PDB#4P59),其以灰色球体示出表位残基Arg426,并且以黑色球体示出距离Arg426在半径以内的所有暴露于表面的残基。b)表位区域的暴露于溶剂的表面,其中Arg426和较远的残基以灰色示出,且距离Arg426在半径以内的所有暴露于表面的残基以黑色示出。c)表位区域中的残基,Arg426为浅灰色,且周围的残基(所有被标记的)为深灰色。以Yasara(www.yasara.org)进行制图和分析。图22:Fab臂3958对HER2的关键结合残基的确定。包括曲妥珠单抗作为对照抗体。与曲妥珠单抗结合相比,以FACS滴定测定结合,并且以AUC表示结合。不认为D143Y是3958表位的一部分,因为曲妥珠单抗对于该突变体的结合也被阻断。图23:在HER3晶体结构中表示的对于PG3178结合的关键残基。在HER3晶体结构(PDBID#4P59)上,所鉴定的对于PG3178结合的关键残基表示为黑色球体。图24:R426作为对于PG3175与HER3的关键结合残基的确定。包括两种抗HER3抗体作为对照抗体。与对WTHER3的结合相比,以FACS滴定测定结合,并且以AUC表示结合。图25:在体外心脏应激下不存在PB4188毒性。在3μM的蒽环类多柔比星存在下,将心肌细胞与PB4188或单特异性基准抗体孵育。通过ATP定量测定心肌细胞的生存力,并以相对光单位(relativelightunit,RLU)表示。T,曲妥珠单抗;P,帕妥珠单抗。图26:与曲妥珠单抗和HER3抗体相比的PB4188与HER2扩增的细胞的结合。对指定的表达不同HER2水平的细胞系进行FACS滴定。对每个细胞系,对中位PE信号值曲线下面积进行作图。图27:一系列滴定的PB4188FITC与以饱和浓度的PB4188、曲妥珠单抗或阴性对照抗体预孵育的SKBR-3细胞的结合。PB4188FITC与在曲妥珠单抗或阴性对照抗体存在下同样有效地与SKBR-3结合。图28:在HRG应激条件下,由相同HER3Fab臂和导向四个HER2结构域的不同HER2臂组成的HER2xHER3双特异性抗体对细胞增殖的抑制。图29:PB4188与拉帕替尼在SKBR-3细胞生长和形态学上的协同组合。左侧,以不同条件处理的细胞的显微视图;右侧,图形作图的与处理条件相关的形态学变化。图30A+B:在时间过程实验中,PB4188对HRG介导的N87和SKBR-3细胞磷酸化的抑制。包括曲妥珠单抗+帕妥珠单抗和单独的HRG作为对照。图31:在时间过程实验中,PB4188对HRG介导的N87细胞磷酸化的抑制。包括曲妥珠单抗+帕妥珠单抗和拉帕替尼作为对照。图32:在以PB4188的两倍每周剂量或四倍每周剂量处理后4小时评估Akt水平及Akt磷酸化的变化。通过Luminex测定评估肿瘤裂解物中的磷酸化水平。一式两份地进行分析,并且每组分析五种肿瘤。图33:在JIMT-1肿瘤材料中,通过Vera标签分析而分析的PB4188对HER2:HER3介导的信号传导的体内介导的作用。在给药后4小时分析肿瘤,包括来自于经PBS处理动物的肿瘤作为对照。图34:PB4188减缓细胞周期的进程。在标准浓度(1ng/ml)或高浓度(100ng/ml)HRG存在下,将接种在测定介质中的细胞与滴定的抗体孵育。24小时后(或对于MCF-7细胞为48小时后),分析细胞在细胞周期的不同期(G0/G1、S或G2/M期)中的分布。作为处于S和G2/M期细胞百分比和处于G0/G1期细胞百分比之间的比例计算增殖指数。P+T,帕妥珠单抗+曲妥珠单抗。图35:以pH敏感的染料标记的抗体在HER-2过表达癌细胞中的内化。将N87(A、B)和SKBR-3(C、D)接种在补充有1ng/ml的HRG的测定介质中,与100nM的以pH敏感的染料标记的抗体孵育24小时。收获细胞之后,将其以APC标记的抗人IgG二抗染色以检测细胞表面结合的抗体。通过FACS分析细胞在PE(A、C)中的荧光以确定内化,以及分析APC(B、D)通道以确定抗体的表面结合。图36:曲妥珠单抗相对于曲妥珠单抗+帕妥珠单抗对来自于两个不同供体的细胞的ADCC活性。图37:F3178变体的氨基酸和核酸比对。标示出了CDR区。图38:在HRG依赖性N87测定中的HER3单克隆抗体的滴定曲线。PG6058、PG6061和PG6065是PG3178的变体。PG1337为特异性针对破伤风类毒素的阴性对照。将数据根据每板上存在的配体相对于基础增殖进行归一化。图39:HER3单克隆抗体的CIEX-HPLC谱。PG6058、PG6061和PG6065是PG3178的变体。为每种抗体给出所计算的VH区等电点(pI)和主峰的保持时间(tR)。图40:在HRG应激浓度下(A)或生长于基质胶中(B)的PB4188对HER2扩增的细胞系的体外药物组合等效图(isobologram)。实施例方法、材料和抗体的筛选细胞系BxPC-3-luc2(PerkinElmer125058)、N87(CRL-5822TM)、SK-BR-3(HTB-30TM)、BT-474(HTB-20TM)、JIMT-1(DSMZACC589)、L929(SigmaAldrich85011425)、K562(DSMZACC10)、HEK293T(-CRL-11268TM)、CHO-K1(DSMZACC110)、MCF-7(DSMZACC115)、MDA-MB-468(#300279-513,细胞系供应机构)、SK-OV-3(HTB-77TM)、MDA-MB-175(ATCC-HTB-25)、MDA-MB-453(ATCC-HTB-131)、MDA-MB-361(ATCC-HTB-27)、ZR-75-1(ATCC-CRL-1500)和MKN-45(DSMZACC409)细胞系购自ATCC、DSMZ或SigmaAldrich,并且常规地维持于补充了10%热灭活的胎牛血清(fetalbovineserum,FBS)的生长培养基中。HEK293FFreestyle细胞获得自Invitrogen,并且常规地维持于293FreeStyle培养基中。重组的人、鸡、大鼠和交换的结构域载体的产生(HER的克隆)人HER2。全长人HER2通过PCR从来自于分离自乳腺癌细胞系JIMT-1之RNA的cDNA扩增。用于人HER2扩增的引物如下。正向引物:AAGCTGGCTAGCACCATGGAGCTGGCGGCCTTGTGC;反向引物:AATAATTCTAGACTGGCACGTCCAGACCCAGG。将全长的扩增产物用NheI和XbaI消化,并随后克隆到pcDNA3.1(Invitrogen)的相应位点中。通过与NCBI参考序列NM_004448.2的比较证实该序列。为了产生单独表达人HER2胞外结构域(extracellulardomain,ECD)的构建体以达到转染和免疫的目的,将HER2的跨膜结构域和ECD通过PCR扩增并再克隆到pVax1中。为了转染的目的,通过扩增HER2ECD结构域在pDisplay中产生了另一构建体,在该构建体中,HER2ECD结构域与PDGFR跨膜结构域融合。人HER3。HER3的全长人cDNA克隆获自Origene。为了产生单独表达人HER3ECD的构建体以达到转染和免疫的目的,将HER3跨膜结构域和ECD通过PCR扩增并再克隆到pVax1中。此外,在pVax1中产生了另一构建体,借以将HER3ECD结构域与PDGFR跨膜结构域融合。所有序列通过与NCBI参考NM_001982.3比较确证。食蟹猴(Cynomolgus)HER2胞外结构域为通过PCR从食蟹猴cDNA-猴)正常结肠组织(Biochain)扩增。用于食蟹猴HER2扩增的引物如下:正向引物:AAGCTGGCTAGCACCATGGAGCTGGCGGCCTGGTAC;反向引物:AATAATTCTAGACTGGCACGTCCAGACCCAGG。将全长的扩增产物用NheI-XbaI消化,并随后克隆到pcDNA3.1的相应位点中。将所述克隆测序并与可得到的恒河猴(rhesusmonkey)序列(XM_002800451)进行比对以检查该ErbB-2克隆的正确性。食蟹猴HER3胞外结构域通过PCR从食蟹猴cDNA-猴)正常结肠组织(Biochain)扩增。用于食蟹猴HER3扩增的引物如下:正向引物:AAGCTGGCTAGCACCATGAGGGCGAACGGCGCTCTG;反向引物:AATAATTCTAGATTACGTTCTCTGGGCATTAGC。将全长的扩增产物用NheI-XbaI消化,并随后克隆到pcDNA3.1的相应位点中。将所述克隆测序并与可得到的恒河猴序列(ENSMMUP00000027321)进行比对以检查该ErbB-3克隆的正确性。鸡HER2序列基于参考序列NM_001044661.1。嵌合交换结构域(chimericswappeddomain)构建体通过将鸡HER2序列的结构域I至IV交换为人I结构域I至IV而产生。包含myc标签的序列被优化成用于在哺乳动物细胞中表达,并且在Geneart合成。大鼠HER3序列基于参考序列NM_001044661.1。嵌合交换结构域构建体通过将大鼠HER3序列中的结构域I至IV替换为人I结构域I至IV而产生。包含myc标签的序列被优化成用于在哺乳动物细胞中表达,并且在Geneart合成。HER2和HER3过表达细胞系的产生为了产生在细胞表面上表达高水平HER3的细胞系,通过用NotI和KpnI消化切割全长HER3产生了哺乳动物表达载体。随后将该片段克隆到pcDNA3.1(-)/hygro载体的相应位点中。使用编码新霉素抗性基因的全长HER2和HER3表达载体产生在细胞表面上表达高水平HER2的细胞系。在转染之前,通过SSpI和FspI消化将质粒线性化。将两种载体都分别地转染到K562细胞中,并且在抗生素选择后产生稳定的库(pool)。所得的细胞系(K562-HER2和K562-HER3)在其细胞表面上表达高水平的HER2和HER3。免疫接种HER2免疫接种。应用了四种不同的免疫接种策略。对于组别(cohort)#A,以2x106个用HER2瞬时转染的L929细胞以200μl通过腹膜内注射对六只C57Bl/6小鼠进行免疫接种。随后,在第14天,用溶于125μl的TitermaxGold中的20μg的Erbb-2-Fc(RND系统)蛋白通过腹膜内注射对小鼠进行加强(boost),随后在第28天和第42天,以200μl的2x106个用HER2瞬时转染的L929细胞进行加强。对于组别#C,以2x106个用HER2瞬时转染的L929细胞通过腹膜内注射对六只C57Bl/6小鼠进行免疫接种。随后,在第14天,以200μl的2x106个用HER2瞬时转染的L929细胞对小鼠进行加强,随后在第35天,以溶于125μl的TitermaxGold中的20μg的Erbb-2-Fc蛋白通过腹膜内注射进行蛋白质加强,并且在第49天,以溶于200μl的PBS中的20μg的Erbb-2-Fc蛋白通过腹膜内注射进行最后的加强。对于组别#E,以溶于125μl的TitermaxGold中的20μg的Erbb-2-Fc蛋白通过腹膜内注射对六只C57Bl/6小鼠进行免疫接种。随后,在第14天和第28天,以溶于125μl的TitermaxGold中的20μg的Erbb-2-Fc蛋白通过腹膜内注射进行蛋白质加强,并在第42天,以溶于200μl的PBS中的20μg的Erbb-2-Fc蛋白通过腹膜内注射进行最后的加强。对于组别#G,在Genovac(Freiburg,Germany)根据其方案,通过DNA疫苗接种对六只C57Bl/6小鼠进行免疫接种。所提供的用于DNA疫苗接种的无内毒素载体编码克隆到pVax1中的HER2的跨膜和胞外部分。随后,在第14天、第28天和第66天给予DNA加强。HER3免疫接种。应用了四种不同的免疫接种策略。对于组别#B,以2x106个用HER3瞬时转染的L929细胞以200μl通过腹膜内注射对六只C57Bl/6小鼠进行免疫接种。随后,在第14天、第28天、第49天和第63天,以200μl的2x106个用HER3瞬时转染的L929细胞加强。对于组别#D,在第0天、第14天、28天以2x106个用HER3瞬时转染的L929细胞通过腹膜内注射对六只C57Bl/6小鼠进行免疫接种。随后,在第49天,以溶于125μl的TitermaxGold中的20μg的Erbb-3-Fc蛋白通过腹膜内注射对小鼠进行加强,并且在第66天,以溶于200μl的PBS中的20μg的Erbb-3-Fc蛋白通过腹膜内注射进行最后的加强。对于组别#F,以溶于125μl的TitermaxGold中的20μg的Erbb-3-Fc蛋白通过腹膜内注射对六只C57Bl/6小鼠进行免疫接种。随后,在第14天和第28天,以溶于125μl的TitcrmaxGold中的20μg的Erbb-2-Fc蛋白通过腹膜内注射对小鼠进行加强,并且在第42天,以溶于200μl的PBS中的20μg的Erbb-3-Fc蛋白通过腹膜内注射进行最后的加强。对于组别#H,在Genovac(Freiburg,Germany)根据其方案,通过DNA疫苗接种对六只C57Bl/6小鼠进行免疫接种。所提供的用于DNA疫苗接种的无内毒素载体编码克隆到pVax1中的PDGFR的跨膜部分和HER3的胞外部分。随后,在第14天、第28天和第66天给予DNA加强。抗体滴度的测定来自于经免疫接种C57Bl/6小鼠的血清中的抗HER2滴度通过以下方式测定:抗ECD-ErbB-2蛋白的ELISA(Bendermedsystems),以及针对HER2阴性K562、HER2低表达细胞系MCF-7以及HER2扩增的SKBR-3和BT-474细胞的FACS分析。来自于经免疫接种C57Bl/6小鼠的血清中的抗HER3滴度通过以下方式测定:抗Erbb-3-Fc蛋白的ELISA,以及针对HER3阴性K562、HER2低表达细胞系MCF-7以及HER2扩增的SKBR-3和BT-474细胞的FACS分析。处死动物之前的针对HER2和HER3的血清滴度分别描述于表1和表2中。所有组别中的动物都发生了针对HER2或HER3的抗体应答。淋巴组织的恢复从所有用DNA疫苗接种的小鼠(组别#G和#H)中移除脾和引流淋巴结。从所有组织中产生单细胞悬液,并随后在Trizol试剂中裂解组织。从组别#A至组别#F的所有小鼠移除脾(除了在第一次加强之后死亡的组别#C中的一只小鼠之外)。从所有脾中得到单细胞悬液,并且使用通过CD19富集(组别#A、E、F)或耗尽非B细胞(组别相、C、D)的MACS分离方法分离全B细胞级分。来自于经免疫接种小鼠的噬菌体展示文库的产生为每一只小鼠构建一个噬菌体文库。为此,使用以下方法将来自于每组(每组5或6只小鼠)的所有小鼠的材料用于制备噬菌体文库。从每一只独立小鼠分离RNA并合成cDNA,并进行VH家族特异性PCR。随后,将每只小鼠的VH家族PCR产物纯化并测定DNA浓度并且消化和连接到含有共同轻链的噬菌体展示载体中以产生小鼠-人嵌合噬菌体文库。所有噬菌体文库含有>106个克隆,其中插入频率>85%。携带与HER2和HER3特异性结合的Fab片段的噬菌体的选择使用抗体噬菌体展示文库选择抗体片段。将经免疫接种文库和合成的文库(如deKruif等Mol.Biol.(1995),248,97-105中所述)用于选择。HER2噬菌体选择和筛选以VCS-M13辅助噬菌体(Stratagene)拯救噬菌体文库,并在以重组蛋白包被的免疫管(immunotube)(Nunc)中选择两轮。在第一轮中,将ECD-Erbb-2蛋白(Bendermedsystems)包被到免疫管上,而在第二轮中,将Erbb-2-Fc(RND系统)包被到免疫管上。用4%的脱脂奶粉(nonfatdrymilk)(ELK)封闭免疫管。在向免疫管添加噬菌体文库前,也以4%的ELK将噬菌体抗体文库封闭。在室温下在旋转条件下,将噬菌体文库与所包被的蛋白质在免疫管中进行2小时的孵育。之后,以PBS中的0.05%的Tween-20将免疫管洗涤5至10次,随后以PBS洗涤5到10次。利用50mM的甘氨酸(pH2.2)将结合的噬菌体洗脱,并添加至大肠杆菌(E.coli)XL-1Blue中并在37℃孵育用于噬菌体感染。随后将被感染的细菌平板接种(plate)到含有氨苄青霉素、四环素和葡萄糖的琼脂板上,并在37℃孵育过夜。在第一轮后,从板上刮下菌落并合并,并且随后进行拯救和扩增以制备富集的第一轮文库。随后,利用上述方案在Erbb-2-Fc(RND系统)上选择富集的文库。第二轮选择之后,挑出单克隆并拯救之,以制备噬菌体单克隆小量样品(miniprep)。随后将结合Erbb2的阳性噬菌体克隆在FACS中鉴定其与乳腺癌细胞系BT-474的结合。将所有Erbb2特异性克隆的VH基因测序。以VBASE2软件建立VH基因重排,以鉴定独特的克隆。随后在FACS中以噬菌体形式测试所有独特克隆与HEK293T细胞(阴性对照)、用ErbB-2瞬时转染的HEK293T细胞以及BT-474细胞的结合。HER3噬菌体选择和筛选以VCS-M13辅助噬菌体(Stratagene)拯救噬菌体文库,并在以重组蛋白包被的免疫管(Nunc)中选择两轮。在这两轮选择中,都以Erbb-3-Fc(RND系统)包被到免疫管上。为了克服向融合蛋白的Fc部分的选择偏差,所有这两轮对Erbb-3-Fc的选择都在150μg/ml的人IgG存在下进行。以4%的ELK封闭免疫管。在向免疫管添加噬菌体文库前,以4%的ELK将噬菌体抗体文库封闭。在旋转条件下,与噬菌体文库进行2小时的孵育。随后,以PBS中的0.05%的Tween-20将免疫管洗涤5到10次,随后以PBS洗涤5到10次。利用50mM的甘氨酸(pH2.2)将结合的噬菌体洗脱,并添加至大肠杆菌XL-1Blue中并孵育以用于噬菌体感染。随后将被感染的细菌平板接种在含有氨苄青霉素、四环素和葡萄糖的琼脂板上,并在37℃孵育过夜。在第一轮后,从板上刮下菌落并合并,并且随后进行拯救和扩增以制备富集的第一轮文库。随后,利用上述方案在Erbb-3-Fc(RND系统)上选择富集的文库。第二轮选择之后,挑出单克隆并拯救之,以制备噬菌体单克隆小量样品。将阳性噬菌体克隆在FACS中鉴定其与乳腺癌细胞系BT-474的结合。将所有阳性克隆的VH基因测序。以VBASE2软件建立VH基因重排,以鉴定独特的克隆。在FACS中以噬菌体形式测试所有独特克隆与K562细胞(阴性对照)、稳定的K562-HER3细胞和BT-474细胞的结合。以Erbb和Erbb3抗原形式进行总共36次选择。所有的选择筛选流程产生了89个导向HER2的独特Fab克隆和137个导向HER3的独特Fab克隆。基于Fab的独特HCDR3序列(独特VDJ重组事件的指示),认为所述Fab是独特的。在一些情况下获得克隆变体,其带有相同的HCDR3但是在CDR1和/或CDR2中有差异。从经免疫接种小鼠文库中选择含有反映亲和力变体的VH基因中之替换的克隆变体的集群(cluster)。抗体选择/表征单克隆抗体的产生将来自于经免疫接种小鼠噬菌体文库的独特抗体的VH基因(通过VH基因序列及其一些序列变体判断)克隆到骨架IgG1载体中。在该过程期间使用了两种不同的生产细胞系:HEK293T及293FFreestyle细胞。贴附型HEK293T细胞在6孔板中培养至80%汇集。将细胞以单独的DNA-FUGENE混合物进行瞬时转染并进一步培养。转染之后7天,收获上清液并更新培养基。转染之后14天,将上清液合并,并通过0.22μM(Sartorius)过滤。将无菌上清液储存在4℃。将适合于悬浮的293FFreestyle细胞培养于T125培养瓶中,在摇床上培养至3.0x106个细胞/ml的密度。将细胞以0.3-0.5x106个活细胞/ml的密度接种在24-深孔板的每个孔中。将细胞用单独的无菌DNA:PEI混合物进行瞬时转染并进一步培养。转染之后7天,收获上清液并通过0.22μM(Sartorius)过滤。将无菌上清液储存在4℃。双特异性抗体的产生利用专用的CH3技术产生双特异性抗体以确保高效的异源二聚化以及双特异性抗体的形成。该CH3技术使用基于电荷的CH3区域中的点突变以允许两个不同重链分子之间的高效的配对,如先前所述(PCT/NL2013/050294;作为WO2013/157954A1公布)。用于功能筛选的IgG纯化使用亲和色谱以小规模(<500μg)、中等规模(<10mg)和大规模(>10mg)进行IgG的纯化。在无菌条件下,在24孔过滤板中利用真空过滤进行小规模纯化。首先将培养基的pH调整至pH8.0,并随后将小规模产物与蛋白质A琼脂糖凝胶CL-4B珠(50%v/v)(Pierce)在25℃下在600rpm的摇床(Heidolph平板振动器)上孵育2小时。随后通过真空过滤收获珠。以pH7.4的PBS洗涤珠两次。在pH3.0以0.1M的柠檬酸缓冲液洗脱IgG,并立刻以TrispH8.0中和IgG级分。利用多筛选(multiplate)Ultracel10多重板(multiplate)(Millipore)的离心进行缓冲液交换。样品最后溶于PBSpH7.4的最终缓冲液中。HER2/HER3特异性IgG的确认在FACS中测试抗体与BT-474、HEK293T和过表达HER2或HER3的HEK293T的结合。因此,利用胰蛋白酶收获细胞并在FACS缓冲液(PBS/0.5%BSA/0.5mMEDTA)中稀释至106个细胞/ml。在U形底96孔板中向每孔添加1-2x105个细胞。将细胞在4℃以300g离心2分钟。通过倒转板弃去上清液。以10μg/ml的浓度添加50μl各IgG样品,并在冰上孵育1小时。将细胞离心一次,移除上清液并以FACS缓冲液洗涤细胞两次。添加50μl稀释的1∶100小鼠抗人IgGPE(Invitrogen)并在暗处冰上孵育30至60分钟。添加FACS缓冲液之后,将细胞离心一次,去除上清液并以FACS缓冲液洗涤细胞两次。在HTS设置中,以FACSCanto流式细胞仪分析细胞。通过平均荧光强度(meanfluorescenceintensity,MFI)评估抗体与细胞的结合。利用ELISA测定来测试非特异性结合反应性。测试了HER2和HER3抗体针对抗原纤维蛋白原、血红蛋白和破伤风毒素的反应性。为了测试对HER2和HER3的特异性结合,测试了抗体与EGFR、HER2、HER3和HER4的经纯化重组胞外结构域的结合。将抗原过夜包被至MAXISORPTMELISA板。将ELISA板的孔用含有5%BSA的PBS(pH7.2)在37℃封闭1小时。将所选择的抗体以在PBS-2%BSA中稀释的10μg/mL的浓度一式两份地测试,并使其在25℃下结合2小时。作为对照,同时以特异性针对经包被抗原的抗体和阴性对照抗体进行该过程。将ELISA板用PBS-T(PBS-0.05%v/vTween20)洗涤5次。以1∶2000稀释的HRP-缀合物(山羊抗小鼠,BD)检测所结合的IgG并使其在25℃结合2小时。将ELISA板用PBS-T(PBS-0.05%Tween20)洗涤5次并通过OD492nm测量检测所结合的IgG。HER2/HER3特异性IgG的表位分组将抗HER2抗体的组(panel)基于其对来自于其他物种(小鼠、鸡)的HER2ECD的反应性,及其与使用嵌合构建体的HER2分子的特异性结构域(即结构域I、II、III和IV)的结合进行分类(bin)。将抗HER3抗体的组基于其对来自于其他物种(食蟹猴(cyno)、大鼠)的HER3ECD的反应性,及其与使用嵌合构建体的HER3分子的特异性结构域(即结构域I、II、III和IV)的结合进行分组。为了这一目的,使用lipofectamin/DNA混合物将CHO-K1细胞用相关的构建体进行瞬时转染。在嵌合交换结构域构建体中,鸡HER2或大鼠HER3的结构域替换为人的对应部分。通过FACS测量特异性抗体的结合。利用抗myc抗体确认构建体的表达。以曲妥珠单抗的FACS染色被包括为对结构域IV的特异性结合的对照。基于染色的强度(MFI)可对每组中的抗体进行排序。65种抗体的HER2组可被分为7类(表3)。1.结构域I特异性的(25)2.结构域II特异性的(2)3.结构域III特异性的(23)4.结构域IV特异性的(7)5.结构域IV特异性的且与小鼠交叉反应性的(2)6.对所有构建体有反应性的(2)7.仅对人HER2有反应性的(4)与曲妥珠单抗的竞争通过作图定位于HER2结构域IV上的两种抗体抑制SKBR-3细胞的增殖。这两种抗体共享类似的CDR3,只有一个氨基酸差异。在竞争ELISA中,探究了一种抗体PG1849与曲妥珠单抗竞争的能力。在该ELISA中,包被了Fc-HER2并与浓度为15μg/ml的IgG抗体孵育。孵育15分钟后,噬菌体再孵育1小时。此后,检测噬菌体。表4证明了PG1849和曲妥珠单抗可同时与HER2结合,因为在ELISA期间没有出现信号的丢失。在该测定中,真正的竞争仅当相同噬菌体和抗体组合时才被观测到。124种抗体的HER3组可被分为5类(表5):1.高结构域III反应性,对大鼠和小鼠有反应性并且对结构域IV反应性小(8)2.高结构域III反应性,对大鼠、人及食蟹猴有反应性,对结构域IV反应性小(8)3.仅对大鼠、食蟹猴和人HER3有反应性(43)4.仅对人HER3有反应性(32)5.对所有构建体都有反应性(33)细胞系增殖测定在补充了L-谷氨酰胺和10%的热灭活FBS的DMEM-F/12中培养SK-BR-3细胞。在补充了10%的热灭活FBS的RPMI1640中培养BxPC-3-luc2细胞。在补充了100μM的NEAA1、1mM的丙酮酸钠、4μg/ml的胰岛素和10%的热灭活FBS的RPMI1640中培养MCF-7细胞。对于SK-BR-3细胞的增殖测定,将亚汇合的细胞培养物以PBS洗涤、胰蛋白酶消化并通过添加培养基使胰蛋白酶灭活。将细胞在培养基中稀释至6x104个细胞/ml。将抗体稀释至10μg/ml和1μg/ml的浓度,并将其以100μl的体积添加到96孔黑底板(ABgeneAB-0932)中。以6000个细胞/孔的密度添加细胞。将细胞在37℃、5%CO,在95%相对湿度下培养3天。根据制造商说明书添加AlamarBlueTM(Invitrogen),并在暗处以37℃、5%CO,在95%相对湿度下孵育6小时。以550nm激发波长和590nm发射波长测量荧光。将生长抑制的程度与相同浓度的曲妥珠单抗相比较(表6)。对于MCF-7和BxPC-3-luc2细胞的增殖测定,将亚汇合的细胞培养物用PBS洗涤、胰蛋白酶消化并通过添加培养基使胰蛋白酶灭活。将细胞以大体积的测定培养基(含有0.05%的BSA和10μg/ml全转铁蛋白(HoloTransferrin)的RPMI1640培养基)洗涤两次。将MCF-7细胞在培养基中稀释至5x104个细胞/ml。将抗体稀释至10μg/ml及1μg/ml的浓度,并将其以100μl的体积添加到96孔黑底板(ABgeneAB-0932)中。在1ng/ml终浓度的人重组人NRG-β1/HRG-1β1EGF结构域(396-HB-050RND)存在下,以5000个细胞/孔的密度添加细胞。人NRG-β1/HRG-1β1EGF结构域在下文中将被称为HRG。将细胞在37℃、5%CO,在95%相对湿度下培养5天。根据制造商的说明书添加AlamarBlueTM(Invitrogen),并在暗处以37℃、5%CO2,在95%相对湿度下孵育24小时。以550nm激发波长和590nm发射波长测量荧光。将生长抑制的程度与相同浓度的#Ab6相比较(表7)。使用BxPC-3-luc2增殖测定筛选双特异性抗体。将BxPC-3-luc2细胞在培养基中稀释至8x104个细胞/ml。将抗体稀释至10μg/ml和1μg/ml的浓度,并将其以100μl的体积添加到96孔黑底板(ABgeneAB-0932)中。在10ng/ml终浓度的人HRG不存在或存在下,以8000个细胞/孔的密度添加细胞。将细胞在37℃、5%CO,在95%相对湿度下培养4天。根据制造商的说明书添加AlamarBlueTM(Invitrogen),并在暗处以37℃、5%CO,在95%相对湿度下孵育4小时。以550nm激发波长和590nm发射波长测量荧光。为了将边缘效应最小化,96孔板的外侧孔完全用PBS填充。HER2特异性IgG的亲和力分级我们使用了由Devash(PNAS,1990)描述的方法在有限的抗原-ELISA中对抗体进行分级。降低的抗原包被浓度的使用消除了所观测到的交叉反应性反应并且可用于检测高亲和力抗体。因此,将在固体支持物上的抗原浓度逐渐降低,以研究弱的免疫反应性。开始于2.5μg/ml直到0.019μg/ml系列滴定的ECD-Erbb-2蛋白过夜包被至MAXISORPTMELISA板。用含有5%的BSA的PBS(pH7.2)在37℃封闭ELISA板的孔1小时。将所选择的抗体以在PBS-2%BSA中稀释的10μg/mL的浓度一式两份地测试,并使其在25℃下结合2小时。作为对照,同时以特异性针对经包被抗原的抗体和阴性对照抗体进行该过程。将ELISA板用PBS-T(PBS-0.05%v/vTween20)洗涤5次。以1∶2000稀释的HRP-缀合物(山羊抗小鼠IgG,BDViosciences)检测所结合的IgG并使其在25℃结合2小时。将ELISA板用PBS-T(PBS-0.05%Tween20)洗涤5次并通过OD492nm测量检测所结合的IgG。在HER2抗原滴定ELSIA中测试PG1849、PG2916、PG2926、PG2930、PG2971、PG2973、PG3004和PG3031(图1)。HER2VH基因与多种κ轻链的结合为了研究来自于不同噬菌体展示文库的HER2VH的结合,克隆了一组HER2抗体并将其在另一种VKκ链(即MEHD7945A的VL)的情况下表达。将产生的IgG进行在K562细胞和稳定K562-HER2细胞上的FACS分析。来自于组合文库和非组合文库的VH基因列于表8。VH链MF2971、MF3958、MF2916、MF2973、MF3004、MF3025、MF3031都可与MEHD7945A轻链组合而不失去显著的抗原特异性,并且当与共同轻链IGKV1-39组合时所观察到的结合。VH链MF1849不能够与变体κ轻链组合并保持抗原特异性和结合。其他HER2和HER3抗体抑制HER2或HER3功能的抗体是本领域中已知的。根据已发表的信息构建了其他抗体并在293FFreestyle细胞中表达。基于公开于US2006/0212956A1(Genentech)中的信息产生抗HER2抗体帕妥珠单抗和曲妥珠单抗。抗HER3抗体#Ab6基于公开于WO2008/100624(MerrimackPharmaceuticals,Inc.)的信息,并重克隆到IgG1骨架载体中。1-53和U1-59抗HER3抗体的信息获自US7,705,103B2(U3PharmaAG)。抗HER3LJM716抗体的信息获自US2012/0107306。用于构建二合一抗EGFR抗HER3抗体MEHD7945A的信息获自WO2010/108127。HER2xHER3双特异性抗体的筛选将来自HER2和HER3抗体组的VH重克隆到经过电荷工程化载体,以使在转染后,当抗体重链表达时,重链的异源二聚化被强制导致产生双特异性抗体。三种不同的策略被用于在双特异性IgG形式中将HER2与HER3组合:1.HER2(阻断配体非依赖性生长)xHER3(阻断配体非依赖性生长)2.HER2(阻断配体非依赖性生长)xHER3(阻断配体依赖性生长)3.来自不同表位类别的HER2xHER3(阻断配体依赖性生长)在一些双特异性抗体组合中,组2和组3中产生的抗体与组1重叠。以24孔的形式产生了总共495种双特异性抗体,并纯化。对所有抗体对表达HER2和HER3的胰BxPC-3-luc-2细胞系(Caliper)增殖的抑制能力进行测试。抗体的效力在HRG依赖性和HRG非依赖性设置中,在用以10μg/ml和1μg/ml浓度存在的抗体筛选的黑和白筛选(blackandwhitescreening)中确定。包括了相同浓度的曲妥珠单抗作为参照抗体以及阴性对照抗体。1μg/ml的前80位HER2xHER3双特异性抗体(基于组合的抑制)的功能活性在图2中示出。以24孔的形式选择、复制(reproduce)和纯化相对于阳性对照抗体表现出更高抑制活性的抗体(共40个),并以10μg/ml和1μg/ml的浓度在黑和白BxPC-3-luc-2筛选中再次测试。在HRG依赖性MCF-7测定中进一步滴定这些抗体,并与曲妥珠单抗和帕妥珠单抗的组合(1∶1)和阴性对照抗体相比较。图3示出了与亲代HER3抗体和曲妥珠单抗+帕妥珠单抗的组合相比较的三种双特异性抗体的滴定曲线。亲代单克隆抗体在上图中示出,且双特异性抗体在下图中示出。(图3)。以Prism软件,利用非线性回归分析计算双特异性抗体、单克隆抗体和比较抗体的IC50。Graphpad软件列出了MCF-7测定中的双特异性抗体的IC50值及其在用于比较的BxPC3测定中的抑制活性。一组12个HER2xHER3双特异性抗体与曲妥珠单抗+帕妥珠单抗相比具有更强效的抑制活性。此外,双特异性抗体与亲代单克隆PG3178相等或比其更强效(表9)。抑制配体依赖性细胞生长的双特异性抗体由与HER3臂3178、3163、3099和3176组合的HER2臂构成。最强效的双特异性抗体的HER2和HER3臂二者作为二价单克隆抗体也能够抑制配体非依赖性SKBR-3增殖(HER2和HER3臂二者)(表6)或配体依赖性的MCF-7增殖(HER3臂)(表7)。强效抗体的主要部分由与抗HER3抗体3178组合的识别结构域I的HER2臂构成。对BxPC-3-luc2肿瘤生长的抑制在BxPC-3-luc2胰腺同种异体移植模型中对描述于表9中的抗体进行测试。所述BxPC-3-luc2细胞系表达HER2和HER3二者,并被认为是HER2低表达的细胞系。在研究开始时,对8至10周龄的CB17SCID雌性小鼠在胰中原位植入20μl的1×106个肿瘤细胞。为该目标,将小鼠麻醉并使其卧于右侧以暴露左侧,并在其左胁部区域打开0.5cm的切口。将其胰和脾取出,并将20μl的1×106个肿瘤细胞注射至胰尾部的包膜下空间。植入一周后,产生生物发光(bioluminescence,BLI)数据。成像15分钟前,使所有小鼠接受150mg/kg的萤光素(D-萤光素-EF钾盐,Cat.#E6552,Promega)的i.p.注射。使用左侧视野进行每周一次或两次的BLI成像。将异常值的动物(基于BLI/肿瘤体积)移除并将小鼠随机地分配到每组7只的组中。在第8实验日,开始处理。以30mg/kg的抗体对抗体处理组的动物进行连续三周的每周给药(第0天、第7天、第14天和第21天)。在处理的第0天,动物接受两倍的负荷剂量,即60mg/kg的抗体。第31天进行最后的成像。以不同组的双特异性抗体和亲代抗体操作两组BxPC-3-luc2同种异体移植模型。在第一BxPC-3-luc2同种异体移植模型中(图4),一组接受阴性对照抗RSV抗体(CtrlIgG),一组接受对照抗体曲妥珠单抗,并且一组接受阳性对照抗体曲妥珠单抗+帕妥珠单抗(1∶1v/v)。剩下的7组接受如下单克隆(PG)或双特异性(PB)抗体中的一种:PG3004、PG3178、PB3566、PB3710、PB3443、PB3448和PB3441。双特异性抗体的组成的细节在表9中描述。所测试的所有5种双特异性抗体能够抑制肿瘤生长。经双特异性HER2xHER3抗体处理的动物的平均肿瘤质量(meantumormass)(BLI)与以曲妥珠单抗+帕妥珠单抗的组合处理的动物相似(图4)。在第二BxPC-3-luc2同种异体移植模型中(图5),一组接受阴性对照抗RSV抗体(CtrlIgG),并且一组接受阳性对照抗体组合曲妥珠单抗+帕妥珠单抗(1∶1v/v)。剩下的5组接受如下抗体中的一种:PG3163、PB3986、PB3990、PB4011和PB3883。关于双特异性PB抗体的细节:表9。这些双特异性抗体含有与相同的HER2臂MF2971组合的3个不同的HER3结合臂,以及与HER3结合臂MF3163组合的额外HER2臂。在该实验中,对照组中的肿瘤未表现出与第一个实验相同的加速生长的水平,这使得对结果的解读复杂化。然而,与曲妥珠单抗+帕妥珠单抗相比,PB3883和PB3990HER2xHER3双特异性抗体具有类似的抑制活性(图5)。基于体内和体外数据,选择了双特异性的一组抗体,其中HER2臂由MF2971、MF3004、MF1849构成,并且HER3臂由MF3178构成。所述MF2971和MF3004臂为小鼠来源且经过人源化。双特异性HER2xHER3抗体与亲代单克隆抗体相比的结合通过FACS分析确定HER2xHER3双特异性抗体与其亲代对应物相比的结合。以为2.5μgg/ml至0.01μgg/ml系列滴定的抗体在BxPC-3-luc2细胞和MCF-7细胞上进行FACS。被测试的抗体组由双特异性抗体PB3566及其亲代抗体抗HER3抗体PG3178和抗HER2抗体PG3004构成。绘制了MFI数据,并且这两种细胞系的图都示出双特异性PB3566与抗HER3抗体PG3178和抗HER2抗体PG3004相比均更有效地与这两种肿瘤细胞系结合。(图6)。MF2971和MF3004的人源化根据本领域已知的技术将MF2971和MF3004人源化。使MF2971的总共7种人源化的/去免疫化的变体序列在体外作为单克隆以及与HER3特异性抗体MF3178组合的双特异性形式进行表达、确认和表征。以相同方式对MF3004的七种变体序列进行处理,所述变体通过在7种MF2971变体中将MF2971的HCDR3替换为MF3004的HCDR3产生。分析所有人源化变体的表达、完整性、热稳定性和功能活性。基于产量、完整性和功能活性,选择了MF2971的一种变体(2971-var2)作为优化的VH人源化变体,以用于与MF3178的双特异性形式。将该2971-var2重命名为MF3958。双特异性HER2xHER3组合MF3958xMF3178产生了PB4188。PB4188的大规模生产、纯化和分析研究将适于悬浮的293FFreestyle细胞培养于Erlenmeyer瓶中,置于摇床上直至其密度达到3.0x106个细胞/ml。将细胞以0.3-0.5x106个活细胞/ml的密度接种于4L的erlen瓶中。将细胞以单独的无菌DNA:PEI混合物瞬时转染并进一步培养。转染后7天,通过低速离心(5分钟,1000g)、随后的高速离心(5分钟,4000g)收获含有双特异性抗体的条件化培养基。将收集的条件化培养基通过5kDa的Satoriushydrosart盒浓缩至约600ml,并随后以4L的PBS渗滤。将抗体与约35ml的MabSelectSureXL柱结合(11℃)。通过逆流模式依次以150mlPBS、150ml含有1MNaCl的PBS、100mlPBS洗涤柱,将非特异性结合的蛋白质移除。在逆流模式中,利用100mM柠檬酸(pH3.0)洗脱结合的抗体,并将5ml的级分收集在含有4ml的1Tris(pH8.0)的10ml试管中,用于中和。使用superdex20050/1000将洗脱的抗体通过凝胶过滤进一步纯化。将纯化的抗体利用0.22μm注射式滤器过滤除菌。通过OD280测量确定IgG的浓度,并基于氨基酸序列计算蛋白质浓度。测试蛋白质的聚集(HPSEC)、纯度(SDS-PAGE、nMS、IEX和IEF)。将蛋白质样品保存于-80℃。用于分析和同种异体移植研究的IgG纯化在AKTA100Explorer上,使用HiTrapMabSelectSure柱和HiTrap脱盐柱进行中等规模的纯化。以5ml/分钟加载样品。以2倍柱体积的PBS洗涤该柱。在pH3.0以0.1M的柠檬酸缓冲液洗脱IgG。之后将样品脱盐并最后溶于pH7.4的PBS最终缓冲液中。通过0.45μm的滤器(Sartorius)过滤IgG。利用Octet,以蛋白A传感器测量IgG浓度。测试蛋白质的聚集(HPSEC)、纯度(SDS-PAGE、nMS、IEX和IEF)。将蛋白质样品保存于-80℃。PB4188的分析表征将PB4188(MF3958xMF3178)通过HP-SEC和CIEX-HPLC(TSK凝胶-STAT7μm柱,4.6mmIDx10emL)进行分析。PB4188的分析谱大体上与正常单特异性IgG1(例如亲代HER2臂PG3958和抗RSV单克隆对照抗体)的表现一致(图7)。亲和力测定PB4188和PB3448对重组HER2和HER3的单价结合亲和力通过SPR(BiacoreT100)测定。使用BiacoreTMT100(GEHealthcare,Uppsala,Sweden)进行所描述的所有实验。在25℃下进行传感器表面准备和相互作用分析。缓冲液和Biacore试剂购自GEHealthcare。将ErbB2-Fc和ERbB3-Fc(RND)包被于CM5传感器芯片的表面上,所述芯片置于乙酸钾缓冲液(pH5.5)中,并处于500RU的目标固定化水平。运行缓冲液为HBS(hepes缓冲盐水):10mMHEPESpH7.4,150mMNaCI,0.005%Tween-20;0.2μm过滤除菌。将双特异性抗体在HBS中稀释至100nM、50nM、20nM、10nM、1nM和0.1nM,并以高流速(30μl/分钟)在CM5传感器芯片的抗原偶联表面上运行。用BIA评价软件可确定允许确定HER2臂亲和力(单价相互作用)(HER2臂的亲和力)的1∶1单价相互作用的曲线拟合模型。由于HER3臂的低脱离率(low-offrate),不能确定亲和力。为了确定HER3臂的亲和力,将PB4188包被于CM5传感器芯片,其处于500RU的目标固定化水平。将Her-Fc和Her3-Fc抗原在HBS中稀释至100nM、50nM、20nM、10nM、1nM和0.1nM,并以高流速(40μl/分钟)在PB4188表面上运行。为了确定kon及koff值,将BIA评价软件与某一模型联用,该模型考虑到单价分子被包被于传感器芯片表面上以及ErbB3-Fc抗原为二价分子。PB4188和PB3448的亲和力在表10中示出。细胞上PB4188亲和力测定结合亲和力也通过稳态细胞亲和力测量,使用BT-474和SK-BR-3细胞进行测定。分析了4种IgG:1)PB4188(双特异性HER2xHER3),其含有抗HER2抗体3958和抗HER3抗体3178;2)PB9215(双特异性HER3xTT),其含有抗HER3抗体3178和抗TT(破伤风类毒素)抗体1337;3)PB9216(双特异性HER2xTT),其含有抗HER2抗体3958和抗TT抗体1337;4)赫赛汀(单特异性HER2)。利用预包被碘化管(Pierce)以及相关说明用125I放射性标记IgG。将经标记的IgG在25mMTris-HCl、0.4MNaCl、0.25%BSA、5mMEDTA、0.05%NaN3中稀释至活性为约1-2x108cpm/ml。以BCA蛋白质测定试剂盒(Pierce)测定蛋白质浓度。利用BT-474和SK-BR-3细胞所进行的经标记和未标记的IgG的流式细胞术分析表明,在标记之后没有或仅有较少迹象的结合降低。按照如下进行稳态细胞亲和力测量。将细胞种于96孔板中并在4℃与多种浓度的经标记IgG孵育。在4小时后去除未结合的放射性,并利用γ井式计数器测量与细胞结合的放射性。通过添加受体阻断浓度(100倍过量)的未标记抗体测量非特异性结合。每种条件均一式三份地测试,并对每种抗体各进行三次独立实验。使用Prism6.0d(GraphPadSoftware),基于对非特异性结合进行了补偿的非线性回归模型计算KD值。在图20中给出了HER2xHER3IgG(PB4188)对这两种细胞系结合的包括拟合曲线的图表。在表12中给出了所有24个测定的包括平均值的KD数据。总之,使用BT-474和SK-BR-3细胞所测定的平均KD值分别是:对于HER2xHER3为3.2nM和2.0nM,对于赫赛汀为3.7nM和1.3nM,对于HER2xTT为3.9nM和2.3nM,以及对于HER3xTT为0.23nM和0.99nM。因此,与HER2相比,PB4188表现出对HER3更高的亲和力,这与HER2xHER3双特异性分子MM-111相反,所述MM-111以与HER3相比更高的亲和力靶向HER2。对于HER2扩增的乳腺癌细胞的抗增殖活性软琼脂中的JIMT-7测试了PB3448和PB4188抑制软琼脂中曲妥珠单抗抗性JIMT-1细胞生长的效力。为了该目的,准备了96孔悬浮细胞培养板。倒入100μL软琼脂底层(在完全培养基中终浓度为0.6%)并使其凝固。将含有10.000个JIMT-1细胞/孔的50μL软琼脂上层(终浓度0.4%)添加至上方,凝固并将这样的96孔板在37℃,10%C02中孵育过夜。次日,将阴性对照抗体、帕妥珠单抗+曲妥珠单抗(1∶1v/v)、PB3448和PB4188以10μg/ml至0.003μg/ml的半对数滴定添加到DMEM培养基中。随后,将该测定在细胞培养箱中孵育8天。最后,将该细胞与AlamarBlue在37℃下孵育3小时至5小时,测定荧光强度(激发:560nm;发射:590nm)。示出了PB3448和PB4188对JIM-1增殖的剂量依赖性抑制的实例。(图8)。基质胶中的BT-474和SKBR-3测试了PB3448和PB4188抑制BT-474和SKBR-3细胞生长的效力。细胞在位于荷兰雷顿的Ocello公司进行检测,其中使细胞生长于三维基质胶中,并利用主成分分析以从经处理的细胞中区分未处理的细胞。将2000个SK-BR-3或2250个BT474细胞接种在384孔板中(Greiner781091)的每孔中的15μL基质胶中。次日,将抗体以10μg/ml至0.003μg/ml的半对数滴定添加到存在或不存在5ng/mlHRG的培养基中。受试抗体包括阴性对照抗体帕妥珠单抗+曲妥珠单抗(1∶1v/v)、PB3448、PB4188以及双特异性抗EGFRxHER3二合一抗体MEHD7945A。此外,包括剂量依赖的滴定的DRG作为阳性对照。每个剂量一式四份地测试。将细胞在细胞培养箱中以37℃,5%CO2孵育7天。之后,将细胞固定并以鬼笔环肽(phalloidin)对细胞的肌动蛋白骨架进行染色,并以Hoechst对细胞核进行染色。之后,通过凝胶(Z-堆叠(Z-stack))在不同水平记录荧光图像,并将图像叠加。测量了广泛范围的形态学特征(总共800个)。只选择了在培养基和HRG处理之间不同的特征用于分析。在培养基与HRG处理之间,与生长、平均球体面积(meanspheroidarea)和细胞核/球体相关的特征差别最为显著。进行了多参数和单参数分析。对于单参数测量,进行了t检验以对处理(HRG或抗体)与培养基进行比较。确定了每个点的P值。使用了与抗体浓度相关的主成分分析(principalcomponentanalysis,PCA)以对数据作图,所述主成分分析为用于发现捕捉多数变异性的高维度数据中的低维度组合的方法。图9证明了在HRG存在下,帕妥珠单抗+曲妥珠单抗(1∶1v/v)、PB3448和PB4188的效果。在这两种HER2扩增的乳腺癌细胞系中,在HEG的存在下,PB4188示出与帕妥珠单抗+曲妥珠单抗、PB3448和二合一抗体MEHD7945A相比更好的活性。在HEG存在下PB4188对HER2扩增的乳腺癌细胞的更好的抗增殖活性在10ng/mlHRG存在下,将PB4188对SKBR-3和BT-474细胞的活性与HER2、HER3抗体组及其组合相比较。该测定在基质胶中进行,如上文所述,并分析形态学特征。在图10a中对PCA数据的作图示出了基质胶中SKBR-3细胞的HRG诱导的增殖和分支/侵袭。图10b示出了抗体PB4188可完全反转HRG诱导的表型,而亲代单克隆抗体的组合(PG3958+PG3178)则没有作用。此外,PB4188于所测试的所有抗HER3抗体相比远远更有效果(图10c)。另外,单独的抗HER3抗体与曲妥珠单抗(目前治疗转移性乳腺癌(metastaticbreastcancer,mBC)的标准)的组合不能够反转HRG诱导的表型(图10d)。与单独的PB4188相比,在HRG存在下向PB4188添加曲妥珠单抗降低了SK-BR-3细胞的增殖和分支/侵袭(图10e)。PB4188与HER2和HER3单克隆抗体相比对HER2扩增的胃癌细胞的更好的抗增殖活性NRG-1-β1的上调是针对HER2靶向治疗的关键抗性机制(Wilson,2012)。为了评价NRG-1-β1的上调是否会干扰PB4188的抗增殖效力,在N87(HER2扩增)胃癌细胞系上以100ng/mlHRG测试一组抗体。将N87细胞在补充了10%热灭活的FBS的RPMI1640中培养。对于增殖测定,将N87细胞的亚汇合细胞培养物用PBS洗涤、胰蛋白酶消化并通过添加培养基使胰蛋白酶灭活。将细胞以大体积的测定培养基(含有0.05%BSA和10μg/ml全转铁蛋白的RPMI1640培养基)洗涤两次。将抗体以1μg/ml至0.0001μg/ml的半对数滴定稀释。在100ng/ml终浓度的HRG存在下,以10000个细胞/孔的密度添加细胞。将细胞在37℃、5%CO2,在95%相对湿度下培养3天。根据制造商的说明书添加AlamarBlueTM(Invitrogen),并在暗处以37℃、5%CO,在95%相对湿度下孵育6小时。以550nm激发波长和590nm发射波长测量荧光。PB4188表现出相对于抗HER2或抗HER3单克隆抗体的更好的活性(图11)。HER2xHER3双特异性抗体诱导ADCCADCC活性是治疗性抗体在癌症中的重要抗肿瘤作用机制。导向HER受体家族的人单克隆抗体(例如西妥昔单抗和曲妥珠单抗)诱导ADCC。在被证实的体外ADCC测定中,确定了PB4188和PB3448的基线和增强的ADCC活性。在实验中包括曲妥珠单抗和阴性对照抗体作为对照抗体。从健康提供体获得全血和PBMC级分。针对HER2高表达靶细胞(SK-BR-3)和HER2低表达靶细胞(MCF-7)测试每种抗体。向靶细胞加载51Cr(Amersham)并用指定浓度的抗体进行调理(opsonized)。在RPMI1640+10%热灭活的FCS中的200μL反应中,将全血或PBMC级分用作效应细胞。将细胞一起孵育4小时,并通过使用γ闪烁体测量上清液中的放射性评估裂解。如下计算比裂解(specificlysis)的百分比:(实验cpm-基础cpm)/(最大cpm-基础cpm)×100,其中最大裂解在5%的TritonX-100存在下测定,并且基础裂解在不存在抗体和效应器下测定。如图12中所示,双特异性抗体PB3448表现出与组合帕妥珠单抗+曲妥珠单抗相比的相似ADCC活性。双特异性抗体PB4188在高抗体浓度下(10μg/ml)有效。HER2XHER3双特异性抗体表现出与亲代抗体组合相比更高的ADCC在不同的ADCC设置中,使用了ADCC报道生物测定(ADCCReporterBioassay,Promega)。该生物测定使用了稳定地表达FcγRIIIa受体的工程化Jurkat细胞、V158(高亲和力)或F158(低亲和力)变体,以及驱动表达萤火虫萤光素酶的NFAT应答元件。通过比较获自ADCC报道生物测定与经典的51Cr释放测定的数据证实了该测定。使用PromegaADCC生物测定试剂盒,使用384白孔板进行该ADCC测定。在该实验设置中,在生物测定前20至24小时,将SKBR-3细胞以1000个细胞/孔的密度平板接种在30μl测定培养基(具有4%低IgG血清的RPMI)中。次日,移除培养基。之后,一式两份地产生一系列稀释的抗体(PB4188及其亲代抗HER2PG3958和抗HER3PG3178以及其组合)。将10μl抗体稀释液添加至孔中。抗体的起始浓度为10μg/ml,并产生10个点的半对数倍数系列稀释以提供完全的剂量响应曲线。最后,添加5μl的ADCC生物测定效应细胞(15000个细胞/孔,V158)。将细胞在37℃孵育6小时。之后,添加15μl的BIO-Glu萤光素酶底物,并在5分钟后在读板器中检测发光。所获得的数据示于图13中。PB4188双特异性抗HER2xHER3抗体表现出与亲代HER2和HER3单克隆抗体或其组合相比更高的ADCC效力。PB4188的ADCC增强ADCC活性可通过不同技术增强,其中之一是去除岩藻糖。在若干体内模型中,岩藻糖的去除已导致抗肿瘤活性的提高[Junttila,2010]。为了使PB4188活性最大化,应用了无岩藻糖基化技术(ChengLiu及AndreiaLee,ADCCEnhancementTechnologiesforNextGenerationTherapeuticAntibody.Antibodytherapeutics-TrendsinBio/PharmaceuticalIndustry2009[13-17]),从而阻止了Fc区中N-连接碳水化合物结构的岩藻糖基化。在ADCC51Cr释放测定中,使用HER2低表达细胞(MCF-7)和HER2扩增的细胞(SK-BR-3)确定了无岩藻糖基化PB4188与野生型PB4188相比的ADCC效力。这两种抗体都以系列稀释应用,并且该测定中包括了阴性对照抗体和曲妥珠单抗。图14示出了在高和低HER2表达的细胞中,无岩藻糖基化的PB4188与野生型版本和/或曲妥珠单抗相比的ADCC效力提升。在低亲和力FcγRIII受体下无岩藻糖基化PB4188表现出更好ADCC活性在ADCC报道细胞上测试无岩藻糖基化PB4188活性,所述细胞含有V158(高亲和力)FcγRIIIa受体变体或F158(低亲和力)FcγRIIIa受体变体。与带有与贴附型SK-BR-3细胞不同的FcγRIIIa变体的ADCC报道细胞组合添加一系列滴定的抗体(即对照抗体、曲妥珠单抗和无岩藻糖基化PB4188)。通过测量萤光素酶活性测量ADCC的活性。与高亲和力V158FcγRIIIa受体变体组合的情况下,无岩藻糖基化PB4188表现出与曲妥珠单抗相比相等的活性。相比之下,与低亲和力F158FcγRIIIa受体变体组合的情况下,无岩藻糖基化PB4188表现出与曲妥珠单抗相比更好的ADCC活性(图15)。JIMT-1同种异体移植研究JIMT-1人乳腺癌细胞培养于含有10%胎牛血清、100单位/mL青霉素G钠、100μg/mL硫酸链霉素、25μg/mL庆大霉素和2mM谷氨酰胺的DMEM中,直到植入时。在植入当天,在对数期生长期间收获JIMT-1乳腺细胞,并将其重悬于冷PBS中。在研究的第一天,雌性CB.17SCID小鼠(CharlesRiver)为8周龄并且其体重范围为16.5g至20.7g。对每只小鼠在右胁部皮下注射5x106个肿瘤细胞(0.2mL细胞悬液)。每周两次以卡尺从两个维度测量肿瘤,作为平均体积监控其大小。一旦肿瘤已达到大约100mm3至150mm3的大小,则使动物入选效力研究。将异常值的动物(肿瘤体积)移除并将小鼠随机地分配到每组10只小鼠的组中。在4周的时间中,为小鼠每周注射一次(抗体)或每天注射一次(拉帕替尼)。处理组的细节如表11中所示。每周以卡尺测量来测量肿瘤大小。效力研究揭示了,PB4188在这两种给药方案中同等有效,并且比拉帕替尼或帕妥珠单抗与曲妥珠单抗的组合更加强效。数据在图17和图18中示出。PB4188可克服HRG介导的抗性NRG-1-β1的上调是针对以HER2为靶向治疗的关键抗性机制(Wilson,2012)。在升高浓度的HRG(NRG-1-β1EGF)存在下,对PB4188与其亲代抗HER3单克隆抗体PG3178相比以一系列滴定进行测试。为了这一目的,将N87细胞在补充了10%热灭活的FBS的RPMI1640中培养。对于增殖试验,将N87细胞的亚汇合细胞培养物用PBS洗涤、胰蛋白酶消化并通过添加培养基使胰蛋白酶灭活。将细胞以大体积的测定培养基(含有0.05%BSA和10μg/ml全转铁蛋白的RPMI1640培养基)洗涤两次。将抗体以1μg/ml至0.0001μg/ml的半对数滴定稀释。在升高浓度的HRG(0.04nM至39.5nM)存在下,以10000个细胞/孔的密度添加细胞。将细胞在37℃、5%CO2,在95%相对湿度下培养3天。根据制造商的说明书添加AlamarBlueTM(Invitrogen),并在暗处以37℃、5%CO,在95%相对湿度下孵育6小时。以550nm激发波长和590nm发射波长测量荧光。PB4188表现出与亲代抗HER3单克隆抗体相比更好的活性(图19)。因此,在逃离机制的情况下(例如NRG-1-β1的上调),根据本发明的双特异性抗体是优选的。HER2/HER3特异性IgG的表位通过作图定位鸟枪法诱变实验使用丙氨酸扫描诱变来对分别针对HER2和HER3的PG3958和PG3178的表位通过作图定位。在鸟枪法诱变测定中,产生克隆,其中将HER2/HER3胞外结构域(ECD)的每个氨基酸替换为丙氨酸。之后,通过反向转染制备细胞阵列(专利US2011/0077163A1)。因此,将每个克隆的DNA与lipofectamin混合并将混合物置于384孔板的专用孔中。将HEK293T细胞添加至每个孔中,并在24小时后测量蛋白质的表达。随后,通过免疫荧光染色测量抗体的反应性,由此产生结合图谱并且鉴定对于抗体结合的关键残基。通过FACS分析使用市售的单克隆抗体(R&DmAb1129(HER2)和R&DmAb66223(HER3)),证实HER2和HER3ECD构建体的表达水平。HER2在测定中,以0.25μg/ml的浓度对单价PG3958Fab与HER2ECD突变体的结合进行测试,并使用严格的洗涤条件(pH9.0,350mMNaCl)。这导致鉴定了HER2中的3个“关键”残基(T144、R166、R181),其示出与PG3958Fab的残留结合与WTHER2相比低于35%,而保留了对照mAb结合。在HER2结构中,位于关键残基附近的两个残基(P172、G179)表现出显著的但不严重的结合丧失,并被指定为“次要关键”残基(表13和图21A)。所有这些暴露于表面的残基都位于HER2的结构域I中,并且它们一起形成在HER2分子表面上的不连续斑块。HER2表位确认实验将列于表13中的编码野生型(WT)HER2ECD和HER2ECD变体的构建体在CHO-K1细胞中表达。选择了暴露于表面并且在结构上与所确定的关键残基相邻近三个结构域I残基进行进一步的分析。在HER2ECD构建体中产生将T164、S180和D143变为酪氨酸的点突变,并将所得的构建体也在CHO-K1中表达。将L159AHER2ECD变体表达于CHO-K1细胞中,作为对照样品。在FACS滴定实验中,测试双特异性PG3958xTT抗体与ECD变体的结合。将结合HER2结构域IV的抗HER2抗体曲妥珠单抗用于确认HER2ECD在细胞表面的表达。对平均MFI值进行作图,并使用GraphPadPrism5软件对每条曲线计算AUC。使用WTHER2结合对数据进行归一化。FACS数据表明,除了T144A、R166A、R181A、P172A、G179A之外,突变T164Y和S180Y导致PG3958xTT抗体结合的显著降低(图22)。D143Y突变导致表达的严重丧失,如由与对照mAb的结合降低所证明,因此该位点在PG3958表位中的潜在作用不能被确定。HER3在FACS中,PG3178IgG在0.25μg/ml下与HER3ECD突变体的结合分析导致了两个所谓“关键”残基(F409、R426)的鉴定,该残基突变为丙氨酸引起与WTHER3相比结合的显著丧失,而与对照mAb的结合被保留(表14和图23)。这两个残基都位于HER3的结构域III中,并在空间上相距较远。此外,F409被包埋于HER3的疏水核心中,这使得其不太可能是PG3178表位的一部分。HER3表位确认实验用HER3ECD突变构建体(列于表14)、WTHER3ECD和两种对照构建体(H407A和Y424A)转染CHO-K1细胞。在FACS滴定实验中,测试PG3178与HER3ECD变体的结合。包括结合HER3的结构域I(MM-121)和结构域III(MEHD7945A)的两种对照抗体以确认HER3ECD在细胞表面上的表达。对平均MFI值进行作图,并使用GraphPadPrism5软件为每条曲线计算AUC。使用WTHER3结合对数据进行归一化。R426A突变表现为对于PG3178结合是关键的,而因为细胞表面表达的丧失,与F409A的结合不能被确认(图24)。PB4188对心肌细胞的体外活性作为涉及调蛋白受体复合物HER2:HER4的信号传导网络的一部分,HER2参与成体心肌细胞的生长、修复和存活。心脏毒性是在HER2靶向中的已知风险因素,并且当曲妥珠单抗与蒽环类联用时,并发症的频率提高,从而诱发心脏应激。使用基于来自于人干细胞的心肌细胞的模型系统测试PB4188的潜在毒性,并且在蒽环类阿霉素存在下,将其针对曲妥珠单抗和曲妥珠单抗与帕妥珠单抗的组合进行基准测试(benchmark)。将来自于人干细胞的心肌细胞(PluriomicsBV)以20.000每孔的浓度接种在白色平底测定板(corning655098)中。在培养的第5天,将培养基更换为不含有葡萄糖和半乳糖的补充有10ng/mlHRG的培养基。在第7天,将受试抗体与多柔比星(3μM)组合添加。在第9天使用PromegaCelltiterGlo测定对细胞活力进行测定。将单特异性抗体以单一浓度68nM进行测试,而PB4188以3μM多柔比星存在下的三种浓度进行测试。图25表明,心肌细胞的活力不受所测试的所有PB4188浓度的影响。相反,曲妥珠单抗和曲妥珠单抗与帕妥珠单抗的组合二者都降低了心肌细胞活力。PB4188与具有不同HER2水平之细胞的结合通过FACS在表达不同水平HER2的乳腺癌和胃癌细胞系上分析PB4188与曲妥珠单抗和HER3抗体U1-59相比的结合。如果细胞表达数百万的HER2拷贝和/或HER2基因被扩增,则认为该细胞为HER2+++。使用了以下细胞系:MCF-7(HER2+)、MDA-MB-468(HER2+)、MKN-45(HER2+)、MDA-MB-175(HER2+)、MDA-MB-453(HER2++)、MDA-MB-361(HER2++)、ZR-75-1(HER2++)、JIMT-1(HER2+++)、BT-474(HER2+++)、SKBR-3(HER2+++)、SK-OV-3(HER2+++)、N87(HER2+++)。将指数生长的培养物中的细胞通过胰蛋白酶收获,并在FACS缓冲液(PBS/0.5%BSA/0.5mMEDTA)中稀释至106个细胞/ml。在U形底96孔板中,向每孔添加1-2x105个细胞。将细胞在300g、4℃下离心2分钟。通过将上述板倒转并随后挥动一次将上清液弃去。以3.16ng至10μg/ml的系列稀释添加50μl每种IgG样品,并在冰上孵育1小时。将细胞离心一次,弃去上清液,并以FACS缓冲液洗涤细胞两次。添加50μl以1∶100稀释的小鼠抗人IgGγPE(Invitrogen)并在暗处在冰上孵育30至60分钟。将细胞离心一次,移除上清液,并以FACS缓冲液洗涤细胞两次。在HTS设置中,以FACSCanto流式细胞仪分析细胞。通过中位荧光评估抗体结合的量。将数据作图,并为所测试的每种细胞系的每种抗体确定曲线下面积(AUC,中位荧光强度的累积测量)(图26)。从该实验可得出结论,PB4188具有与曲妥珠单抗相比更高的对HER2+++细胞、HER2++细胞和HER2+细胞的结合亲和力。与曲妥珠单抗的同时结合PB4188和曲妥珠单抗不竞争与HER2结合PB4188结合HER2蛋白的结构域I,而曲妥珠单抗的结合表位位于结构域IV中。为了证明这两种抗体不竞争与HER2结合,进行了与HER2扩增的SKBR-3乳腺细胞的结合测定。允许第一未标记的抗体以饱和浓度结合SKBR-3。之后以一定的滴定范围添加FITC-标记的PB4188,并通过FACS测量荧光。图27示出,在曲妥珠单抗或阴性对照存在下,PB4188FITC与细胞的结合同样有效。将SKRB-3细胞与PB4188的预孵育阻碍PB4188FITC结合。因此,曲妥珠单抗与PB4188不竞争与HER2结合。通过HER2xHER3双特异性分子靶向HER2结构域I可克服调蛋白抵抗为了测试PB4188对HER2xHER3二聚体的取向是否对于在HRG应激条件下抑制细胞增殖为优选,产生了由3178HER3臂和靶向结构域I、II、III或IV中任一个的HER2臂构成的双特异性抗体。对于HER2结构域I-IV中的每一个,产生两种HER2xHER3双特异性抗体。该HER2臂包含:靶向结构域I的MF3958和MF3003;靶向结构域II的MF2889和MF2913;靶向结构域III的MF1847和MF3001以及靶向结构域IV的MF1849和MF1898。每个HER2Fab臂与3178HER3Fab臂组合,并测试其在高浓度调蛋白存在下抑制细胞增殖的效力。在HER2低表达的MCF-7细胞和HER2过表达的N87和SK-BR-3细胞上进行抗体滴定。将N87、SK-BR-3和MCF-7细胞的亚汇合细胞培养物用PBS洗涤、胰蛋白酶消化并通过添加培养基使胰蛋白酶灭活。将细胞以大体积的测定培养基(含有0.05%BSA和10μg/ml全转铁蛋白的RPMI1640培养基)洗涤两次。将抗体以半对数滴定稀释。在实验限定的应激浓度的HRG存在下(10nMSK-BR-3,100nMN87和MCF-7),以10000个细胞/孔(N87、SKB-BR-3)和5000个细胞/孔(MCF-7)的密度添加细胞。将细胞在37℃、5%CO2,在95%相对湿度下培养3至4天。添加AlamarBlueTM(Invitrogen)以评估增殖。以550nm激发波长和590nm发射波长测量吸光度。在所测试的所有测定中,只有靶向HER2结构域I的双特异性抗体能够在高浓度调蛋白存在下抑制增殖(图28)。与PB4188的体外药物组合为了探究将PB4188与小分子药物组合的可能性,将PB4188与以不同水平干扰PI3K或MAPK途径的药物组合。此外,还测试了与化疗药物和周期蛋白(cyclin)抑制剂的组合。在HER2过表达细胞上测试这些组合,所述细胞在HRG存在下在基质胶中(SK-BR-3和BT-474)或在HRG应激浓度存在下(N87和SK-BR-3,如增殖测定中所述)培养。药物组合的抑制效果通过成像或通过使用上文描述的AlamarBlue测量增殖进行测试。首先,确定所测试的EC20PB4188和药物。之后,以PB4188和药物进行棋盘式滴定(checherboardtitration)。观察以如下进行测试的所有细胞系中的协同:酪氨酸激酶抑制剂(阿法替尼、拉帕替尼、来那替尼)、PI3Ka抑制剂BYL719、Akt抑制剂MK-2206、mTOR抑制剂依维莫司、Src抑制剂塞卡替尼、微管扰乱药物紫杉醇,以及HDAC抑制剂伏立诺他(vorinostat,其在图40中错拼为“voronistat”)。图29示出了PB4188与拉帕替尼对培养于基质胶中的SKBR-3细胞的协同组合的实例,其导致细胞形态学改变以及细胞生长的降低。计算了用每种组合获得的生长抑制的程度。利用等效图(Greco等,1995)可展示效力的平移,其示出了当与达到该效果所需要的单一药剂相比时,在组合中需要少多少药物以达到期望的水平。通过CHALICETMAnalyzer软件,使用组合实验的抑制值以产生所述等效图。不同药物组合对HER2扩增的细胞的等效图在图40中示出。等效图分析表明,PB4188展示了与阿法替尼、拉帕替尼、来那替尼、BYL719、MK-2206、依维莫司、塞卡替尼、伏立诺他和紫杉醇的协同药物组合。这些数据表明,与PB4188的组合的作用于PI3K途径的药物特别有效。此外,与酪氨酸激酶抑制剂的组合是有效的。另外,与生长和迁移/侵袭药物塞卡替尼的组合在转移的情况下是有利的。PB4188对磷酸化的体外抑制收获指数生长的培养物的细胞,并接种在6孔板中(对于N87为3.75x106个细胞,并且对于SKBR-3为1.5x106个细胞)的饥饿培养基中(N87细胞:RPMI-1640,0.05%BSA,10μg/ml全转铁蛋白;SKBR-3细胞:DMEM/F-12,2mML-谷氨酰胺,0.05%BSA,10μg/ml全转铁蛋白),并在37℃、5%CO2、95%相对湿度下孵育过夜。次日,添加抗体至5nM的终浓度,并将细胞在37℃、5%CO2、95%相对湿度下孵育1小时。之后,添加HRG至100ng/ml的终浓度。在37℃、5%CO2、95%相对湿度下经过1小时、3小时、6小时或24小时后,将板置于冰上,用冷PBS洗涤细胞两次。随后添加0.3ml冰冷的裂解缓冲液(CellsignalingRTK#9803或IC#7018)并使细胞在冰上裂解最少30分钟。之后,使用BCA(Pierce#23235)测量蛋白质浓度。以裂解缓冲液将蛋白质浓度调整至2mg/ml。之后,将裂解物应用于PathScanRTK信号传导抗体阵列(Cellsignaling#7949)或PathScan细胞内信号传导抗体阵列。所有的孵育均在室温下,在定轨摇床(orbitalshaker)上封闭的孔中进行。以75μl补充有蛋白酶抑制剂混合物(cocktail)的阵列稀释缓冲液稀释裂解物2次,至0.8mg/ml浓度,并保持于冰上。以100μl阵列封闭缓冲液将阵列的孔封闭15分钟。移除封闭缓冲液并将裂解物施加至孔中,并使其孵育2小时。吸去裂解物并以100μl洗涤缓冲液将孔洗涤4次。之后,向每孔添加100μl检测抗体混合物并孵育1小时。吸去抗体混合物并用100μl洗涤缓冲液将孔洗涤4次。向每孔中添加75μl的Dylight80TM链霉亲和素。吸去Dylight80TM链霉亲和素并用100μl洗涤缓冲液将孔洗涤4次。移除多重衬垫(multi-gasket)并以10ml的去离子水洗涤载片10秒。使载片干燥并在Clx上进行成像。使用ImageStudio软件计算点荧光强度。在N87和SKBR-3中,PB4188与曲妥珠单抗+帕妥珠单抗的组合相比,在开始的6小时孵育期间完全阻断AKT磷酸化。此外,与曲妥珠单抗和帕妥珠单抗的组合相比,还观测到了在ERK和S6磷酸化中的强抑制。PB4188不抑制HER2的磷酸化(图30)。Western印迹分析为了确认在RTK和胞内Pathscan阵列中所观测到的磷酸化抑制,对在HRG应激浓度存在下用PB4188、帕妥珠单抗与曲妥珠单抗的组合和对照抗体处理的细胞进行Western印迹。收获指数生长的培养物的细胞,并将其接种在10cm培养皿中(对于N87为20x106个细胞,并且对于SKBR-3为7x106个细胞)的饥饿培养基(N87细胞:RPMI-1640,0.05%BSA,10μg/ml全转铁蛋白;SKBR-3细胞:DMEM/F-12,2mML-谷氨酰胺,0.05%BSA,10μg/ml全转铁蛋白)中。次日,添加抗体至5nM的终浓度,并将细胞孵育1小时。之后,添加HRG至100ng/ml的终浓度。在经过1小时、3小时、6小时或24小时后,将培养皿置于冰上,用冷PBS洗涤细胞两次,转移到Eppendorf管中并用250μl的RIPA裂解缓冲液(20mMTris-HClpH7.5、150mMNaCl、1mMNa2EDTA、1mMEGTA、1%NP-40、1%脱氧胆酸钠、0.1%SDS、2.5mM焦磷酸钠、1mMβ-甘油磷酸、1mMNa3VO4、1μg/ml亮肽酶素)进行裂解。使裂解在冰上进行30分钟。将细胞裂解物离心并将上清液收集到新的Eppendorf管中。使用BCA法(Pierce)测定蛋白质浓度。将30μg的裂解物在4%-12%的Bis-TrisNuPage凝胶(Invitrogen)上分离,并将凝胶上的蛋白质转移至硝酸纤维素膜。以含有5%BSA的TBS-T封闭该膜1小时,并根据制造商的说明说(CellSignalingTechnology)用指定的抗体染色。之后将膜与HRP-缀合的二抗孵育,与ECL底物孵育,并使用X光胶片(Amersham)将其进行放射自显影。所有的检测抗体均来自CellSignalingTechnology:磷酸化-Akt(Ser473)#4060、总Akt#4691、磷酸化-HER2(Tyr1221/1222)#2243、总HER2#2242、磷酸化-HER3(Tyr1289)#4791、总HER3#4754、磷酸化-ERK1/2(Thr202/Tyr204)#4377、总ERK1/2#4695、磷酸化-S6RP(Ser235/236)#2211、总S6RP#2217、山羊抗兔HRP连接的#7074。结果表明,PB4188表现出对HER3磷酸化的长时间抑制,其导致MAPK和PI3激酶这两条途径的抑制以及对AKT磷酸化抑制的严重影响(图31)。PB4188的体内药效学通过Luminex的磷蛋白分析将用2剂量的PB4188和4剂量的PB4188处理的JIMT-1移植小鼠的肿瘤(100mm3)在给药24小时后移除。将肿瘤快速冻结并处理成粉末。对冷冻粉末样品使用冷的BioRad裂解缓冲液(补充0.4%的BioRad因子1、0.2%的BioRad因子2和2mM的PMSF)将肿瘤裂解物制备为50mg肿瘤/mL的浓度,在4℃的摇床上孵育60分钟以确保完全裂解。在4℃以16000xg将样品离心10分钟,并分装。使用BioradDC蛋白测定试剂根据制造商的说明书测定总蛋白。Luminex测定:使用市售的来自Millipore的Luminex试剂盒(Cat#48-618MAG(LotNo.2532050)、46-645MAG(LotNo.46645M-1K))对JIMT-1肿瘤裂解物样品进行处理并分析:总AKT、AKT(Ser473)和AKT(Thr308)。对每个样品一式两份地测试。在样品稀释剂中制备稀释物以加载每孔约25μg蛋白质的靶标,用于所有总分析物和磷酸化分析物的测定。根据制造商的说明书使用Millipore试剂盒。用PB4188处理的肿瘤表现出于未处理肿瘤相比Akt表达的升高。在2倍每周剂量后和4倍每周剂量处理后,AKT的磷酸化均被PB4188完全抑制(图32)。通过VeraTag测定的磷蛋白分析将用1或2剂量PB4188处理的JIMT-1移植小鼠的肿瘤(100mm3或400mm3)移除并在10%中性缓冲福尔马林中固定。将荷有100mm3肿瘤的小鼠在单PB4188剂量(25mg/kg)24小时后处死,而荷有400mm3肿瘤的小鼠接受25mg/kg的2倍每周剂量,并在给药4小时后处死。之后,将样品以石蜡包埋。以切片机(LEICA)将其切为7μm厚度的切片,并置于以序号标记的带正电荷的玻璃载片(VWR)上。将载片在空气中干燥30分钟并且之后在设置为60℃的加热烘箱中烘烤。之后将样品进行不同的VeraTag分析。根据美国专利申请No.12/340,436的总HER2分析(HT2),根据美国专利No.8,349,574、美国专利申请No.2013/0071859的总HER3分析(HT3),以及最后根据国际专利申请No.PCT/US2014/033208的HER2-HER3异源二聚体(H23D)、HER3pY1289(H3pY1289)和HER3-PI3激酶(H3PI3K)。在这两种给药方案中,相对于未处理的对照,显著的PB4188介导的HER2:HER3二聚体降低变得明显。在PB4188处理的肿瘤与对照之间,没有观测到总HER2、HER3或磷酸化HER3的差异。PB4188给药之后4小时进行分析的肿瘤相对于未处理的对照表现出HER3-p85(PI3K)的显著降低。PB4188在HRG刺激的癌细胞中降低细胞周期进展在表达多种HER2蛋白水平的癌细胞系中,研究了PB4188影响细胞周期进展的能力。将HER2+(MCF-7)、HER2+++(JIMT-1、SK-BR-3和N87细胞)细胞接种在测定培养基中(MCF-7细胞:RPMI-1640,0.05%BSA,10μg/ml全转铁蛋白,1mM丙酮酸钠,MEMNEAA;JIMT-1:DMEM,0.05%BSA,10μg/ml全转铁蛋白;SKBR-3细胞:DMEM/F-12,2mML-谷氨酰胺,0.05%BSA,10μg/ml全转铁蛋白;N87细胞:RPMI-1640,0.05%BSA,10μg/ml全转铁蛋白)。在24孔板的每孔中,将300.000个MCF-7,或400.000个N87或150.000个SK-BR-3或150.000个JIMT-1细胞接种在1ml的测定培养基中,并在37℃、5%CO2、95%相对湿度下孵育过夜。次日,在1ng/ml或100ng/ml终浓度的HRG存在下,向细胞中添加PB4188或帕妥珠单抗+曲妥珠单抗或PB3178或PB1337。在37℃、5%CO2、95%相对湿度下孵育24小时(对于JIMT-1、N87或SK-BR-3细胞)或48小时(对于MCF-7细胞)后,向细胞补充EdU(10μM终浓度)经过2小时,之后收获细胞,并利用Click-iTEdUAlexaFluor488试剂盒根据制造商说明书(LifeTechnologies,cat.no.C10425)进行EdU并入染色。在通过流式细胞术在FACSCanto上分析细胞的至少30分钟前,将细胞与200nMFxCycle远红外染料(LifeTechnologies,cat.no.F10348)和100μg/mlRNA酶A(LifeTechnologies,cat.no.12091-039)孵育。在AlexaFluor488通道(用于EdU检测)和APC通道(用于用FxCycle染料的全DNA染色)中获取事件。通过以下分析数据:在FSC-宽度对FCS-高度的散点图上对单细胞进行圈门(gating),并在APC对AlexaFluor488的散点图上对细胞周期中的G0/G1、S和G2M期进行亚圈门(subgating),分别作为EdUnegAPClow、EdUpos和EdUnegAPChigh群。将数据表示为增殖指数,该指数为通过将处于S和G2/M期细胞百分比除以处于G0/G1期细胞百分比计算。图34示出,在抑制由标准(1ng/ml)或高(100ng/ml)浓度的HRG诱导的增殖中,PB4188一直比PB3178或帕妥珠单抗+曲妥珠单抗更强效。在高浓度的HRG下,PB4188仍抑制细胞周期的进展。PB4188诱导受体内化利用pH敏感染料测量抗体的内化模式。在现有技术中,该方法已描述于WO2013134686A1,其中当与抗体偶联时,一旦暴露于较低的pH,此类染料就展示出增强的荧光信号。这发生于当与染料偶联的抗体从靶细胞表面内化到弱酸性内体中(pH6-6.5)再到酸性溶酶体中(pH低于5.5)时。为了探究在癌细胞中PB4188是否内化,根据制造商的说明书将该抗体与带有琥珀酰亚胺酯反应性基团的pH感受染料(pHsensordye)(Promega,cat.no.CS1783A01)偶联。包括了以抗HER2(曲妥珠单抗、帕妥珠单抗、PG3958)、抗HER3(PG3178、#Ab6)和阴性对照(抗破伤风毒素、PG1337)染料标记的抗体作为对比剂。收获指数生长的培养物中的HER2过表达的SKBR-3和N87癌细胞,并将其接种在96孔板中(15x103个细胞/孔)的含有1ng/mlHRG的100μl测定培养基(N87细胞:RPMI-1640,0.05%BSA,10μg/ml全转铁蛋白;SKBR-3细胞:DMEM/F-12,2mML-谷氨酰胺,0.05%BSA,10μg/ml全转铁蛋白)中,并在37℃、5%CO2、95%相对湿度下孵育过夜。次日,添加20μl的以pH敏感染料标记的抗体以达到100nM的终浓度,并将细胞在37℃、5%CO2、95%相对湿度下孵育过夜。次日,通过收集非贴壁细胞并以胰蛋白酶消化贴壁细胞来收获细胞。以FACS缓冲液(PBS,0.5%BSA,0.1%叠氮钠)洗涤细胞后,用以APC标记的抗人IgG(JacksonImmunoresearch,cat.no.109-136-098,1∶100稀释)对细胞进行染色。在FACSCanto(BDBiosciences)上通过流式细胞术对细胞进行分析,其测量PE和APC通道的中位荧光强度(MFI)以分别确定抗体的内化和残余表面结合。如图35中所示数据表明,PB4188内化至与曲妥珠单抗相同的程度,而曲妥珠单抗+帕妥珠单抗的组合导致增强的内化。曲妥珠单抗+帕妥珠单抗的组合与单独的曲妥珠单抗相比降低ADCC(图36)。因此,可以预期的是,PB4188内化水平不影响ADCC效力。抗HER3抗体3178变体的产生和表征抗HER3抗体3178的变体被设计成旨在改善抗体特性。在VH基因框架区1(FR1)、互补决定区1(CDR1)、FR2、CDR2和/或FR3中引入突变,而CDR3和FR4未被修饰。所述设计包括但不限于突变,引入该突变以去除转录后修饰(post-translationalmodification,PTM)基序(例如通过将脱酰胺基序NS改变为NQ)、降低表面疏水性(例如通过将I改变为T)或提高等电点(pI;例如通过将Q改变为K)。将所有20种变体(见图37)作为与破伤风类毒素(TetanusToxoid,TT)臂组合的双特异性抗体表达,并在MCF-7功能测定中测试,并且所有20种变体在该形式中均具有与MF3178抗体类似的效力。所有20种变体也以该形式在FACS中在与MCF-7结合的滴度中进行测试,并且所有变体具有非常相似的结合谱,表明所有变体的亲和力均是相似的。选择了三种领先的变体MF6058、MF6061和MF6056以用于进一步的实验,这三种变体分别含有10个、3个和7个氨基酸突变(见图16E和图37中的序列)。以大规模生产和纯化对应的单特异性IgG1:PG6058、PG6061和PG6065。如图38中所示,在HRG依赖性N87细胞系增殖测定中,这三种变体的抑制活性与PG3178类似。这三种变体的CIEX-HPLC谱在电荷异质性以及峰宽和对称性上与PG3178类似,如图39中所示。主峰的保留时间(retentiontime,tR)大致与抗体的pI相关联,即更高的pI导致更长的保留时间。在双特异性抗体或抗体混合物的设计中,选择具有优化的tR的抗体变体是有价值的,因为这可以促进利用CIEX进行期望抗体组分的纯化。由FACS确定的经免疫接种小鼠的不同组别的血清滴度。D=确定抗体滴度时的天数。表1:针对HER2的应答。表2:针对HER3的应答。指定了所使用的细胞系(MCF7、SKBR3、BT474)。不同的小鼠如列中所示。表1,抗HER2应答表2,抗HER3应答表3根据HER2抗体与鸡-人-HER2嵌合体的反应性和对小鼠HER2的反应性的HER2抗体的分类。“数目”指每组中独特抗体的数目。表4使用IgG和噬菌体抗体的竞争ELISA。四种IgG抗体被用于竞争试验:两种识别结构域IV的HER2抗体(曲妥珠单抗和PG1849);一种识别结构域II的抗体(PG2971)和一种阴性对照抗RSV抗体。当噬菌体与相同可变区基因所编码的抗体竞争时,观察到信号的丢失;即,MF1849与PG1849以及MF2971与PG2971。-MF1849MF2971MF2708曲妥珠单抗0.0461.021.1150.044PG18490.0430.3841.1390.041PG29710.0421.2020.0910.042抗RSVmAb0.0440.941.0030.047-0.0451.4321.4810.038表5根据HER3抗体与大鼠-人-HER2嵌合体的反应性以及对HER3和其他物种HER3的反应性的HER3抗体的分类。“数目”指每组中独特抗体的数目。表6最强效的HER2单克隆抗体在1μg/mlIgG下的功能活性。与参照参照抗体(即SKBR-3中的曲妥珠单抗和MCF-7中的#Ab6)相比的百分比活性。对于HER2抗体,除了PG2926外的所有抗体的结构域均通过作图定位于结构域I、结构域III或结构域IV。表7在HRG依赖性MCF-7测定中,最强效的HER3单克隆抗体在1μg/mlIgG下的功能活性。与参照抗体#Ab6相比的百分比活性。表8HER2抗体的FACS染色,其中HER2VH与不同轻链(而不是图16所标示的共同轻链)组合。MFI指FACS中的平均荧光强度。HER2的MF编号在括号中标示,不同轻链的情况下的HER2结合克隆以灰色标示。MFIMFIPG编号K562细胞(阴性对照)K562HER2PG4462(MF2971)26714900PG4463(MF3958)24815600PG4474(MF2916)25414700PG4478(MF2973)25418000PG4481(MF3004)26716200PG4482(MF3025)29912000PG4483(MF3031)26014900PG4465(MF1849)270249抗HER2mAb3097618抗RSVmAb263276表9在HRG依赖性MCF-7和BxPC3测定中,领先的HER2xHER3双特异性抗体(使用PB前缀标出;如表中所示,每个PB包含HER2臂和HER3臂)与比较抗体相比的功能活性。基于使用嵌合构建体的结合谱,可将HER2和HER3抗体分为不同类别。对于HER2抗体,除了PG2926以外所有抗体的结构域均可通过作图定位于结构域I、结构域IIJ或结构域IV。表10在biacore中所测量的PB4188和PB3448对HER2和HER3的单价结合亲和力。这两种双特异性抗体均共享相同的HER3臂。ND,未进行。表11JIMT-1同种异体移植研究处理组表12使用稳态细胞亲和力测量以BT-474细胞和SK-BR-3细胞确定的以125I标记的IgG(HER2xHER3IgG(PB4188)、HER3xTT(PB9215)、HER2xTT(PB9216)和赫赛汀(单特异性针对HER2))的亲和力。数据获自三次独立的实验。BT-474SK-BR-3赫赛汀3.7±0.5nM1.3±0.1nMPB41883.2±0.5nM2.0±0.4nMHER2xTT3.9±0.6nM2.3±0.7nMHER3xTT0.23±0.08nM0.99±0.4nM表13.针对所有已鉴定的关键残基所列出的平均结合蛋白质反应性(和范围)。参与PG3958Fab结合的关键残基通过克隆中对于PG3958Fab结合为阴性(<35%WT)但对于对照mAb1129结合为阳性(>80%WT)的那些突变进行鉴定。鉴定了两个额外的关键残基,其未达到阈值指导标准(thresholdguideline),但其突变体以较小的程度降低抗体结合。残基编号来自于PDBID#1S78。表14.对这两个关键残基列出了平均结合蛋白质反应性(和范围)。参与PG3178结合的关键残基通过克隆中对于PG3178mAb结合为阴性(<20%WT)但对于对照mAb66223结合为阳性(>70%WT)的那些突变进行鉴定。残基编号来自于PDBID#4P59。表15.在HER3中距离Arg426在半径内的暴露残基列表:Leu423L423Tyr424Y424Asn425N425Gly427G427Gly452G452Arg453R453Tyr455Y455Glu480E480Arg481R481Leu482L482Asp483D483Lys485K485参考文献ArteagaCL,SliwkowskiMX,OsborneCK,PerezEA,PuglisiF,GianniL.2011.TreatmentofHER2-positivebreastcancer:currentstatusandfutureperspectives.NatRevClinOncol.2011Nov29;9(1):16-32.BalkoJM,MillerTW,MorrisonMM,HutchinsonK,YoungC,RinehartC,SánchezV,JeeD,PolyakK,PratA,PerouCM,ArteagaCL,CookRS.2012.ThereceptortyrosinekinaseErbB3maintainsthebalancebetweenluminalandbasalbreastepithelium.ProcNatlAcadSciUSA.Jan3;109(1):221-6.BaselgaJ,CortésJ,KimSB,ImSA,HeggR,ImYH,RomanL,PedriniJL,PienkowskiT,KnottA,ClarkE,BenyunesMC,RossG,SwainSM.2012.Pertuzumabplustrastuzumabplusdocetaxelformetastaticbreastcancer.NEnglJMed.Jan12;366(2):109-19.deKruifetal.Mol.Biol.(1995),248,97-105EwerMS,EwerSM.Cardiotoxicityofanticancertreatments:Whatthecardiologistneedstoknow.NatRevCardiol2010;7∶564-75GuarneriJainKK,CasperES,GellerNL,etal.Aprospectiverandomizedcomparisonofepirubicinanddoxorubicininpatientswithadvancedbreastcancer;JClinOncol1985;3∶818-26JunttilaTT,AkitaRW,ParsonsK,FieldsC,LewisPhillipsGD,FriedmanLS,SampathD,SliwkowskiMX.2009.Ligand-independentHER2/HER3/PI3KcomplexisdisruptedbytrastuzumabandiseffectivelyinhibitedbythePI3KinhibitorGDC-0941.CancerCell.May5;15(5):429-40.Junttila,T.T.,K.Parsons,etal.(2010).″SuperiorInvivoEfficacyofAfucosylatedTrastuzumabintheTreatmentofHER2-AmplifiedBreastCancer.″CancerResearch70(11):4481-4489Merchantetal.NatureBioteehnology,Vol.16July1998pp677-681NissimA,HoogenboomHR,TomlinsonIM,FlynnG,MidgleyC,LaneD,WinterG.1994.Antibodyfragmentsfroma′singlepot′phagedisplaylibraryasimmunochemicalreagents.EMBOJ.1994Feb1;13(3):692-8.OcanaA,Vera-BadilloF,SerugaB,TempletonA,PandiellaA,AmirE.2013.HER3overexpressionandsurvivalinsolidtumors:ameta-analysis.JNatlCancerInst.Feb20;105(4):266-73.SerginaNV,RauschM,WangD,BlairJ,HannB,ShokatKM,MoasserMM.2007.EscapefromHER-familytyrosinekinaseinhibitortherapybythekinase-inactiveHER3.Nature.Jan25;445(7126):437-41.Schaeferetal.CancerCell20,472-486,October2011SchoeberlB,FaberAC,LiD,LiangMC,CrosbyK,OnsumM,BurenkovaO,PaceE,WaltonZ,NieL,FulghamA,SongY,NielsenUB,EngelmanJA,WongKK.2010.AnErbB3antibody,MM-121,isactiveincancerswithligand-dependentactivation.CancerRes.Mar15;70(6):2485-94.Shamesetal.PLOSONE,February2013,Vol.8,Issue2,pp1-10TannerM,KapanenAI,JunttilaT,RaheemO,GrenmanS,EloJ,EleniusK,IsolaJ.2004.CharacterizationofanovelcelllineestablishedfromapatientwithHerceptin-resistantbreastcancer.MolCancerTher.2004Dec;3(12):1585-92.YardenY,PinesG.2012.TheERBBnetwork:atlast,cancertherapymeetssystemsbiology.NatRevCancerJul12;12(8):553-63.TheryJ.-C.etal.,Resistancetohumanepidermalgrowthfactorreceptortype2-targetedtherapies,EurJCancer(2014),Vol.50,Issue5,pages892-901WadhwaD,Fallah-RadN,GrenierD,etal.Trastuzumabmediatedcardiotoxicityinthesettingoftheadjuvantchemotherapyforbreastcancer:Aretrospectivestudy.BreastCancerResTreat2009;117∶357-64.WehrmanTS,RaabWJ,CasipitCL,DoyonnasR,PomerantzJH,BlauHM.2006.AsystemforquantifyingdynamicproteininteractionsdefinesaroleforHerceptininmodulatingErbB2interactions.ProcNatlAcadSciUSA.Dec12;103(50):19063-8.WilsonTR,FridlyandJ,YanY,PenuelE,BurtonL,ChanE,PengJ,LinE,WangY,SosmanJ,RibasA,LiJ,MoffatJ,SutherlinDP,KoeppenH,MerchantM,NeveR,SettlemanJ.2012.Widespreadpotentialforgrowth-factor-drivenresistancetoanticancerkinaseinhibitors.Nature.Jul26;487(7408):505-9.Yonesakaetal.,Sci.transl.Med.,Vol.3,Issue99(2011);pp1-11ZhangH,BerezovA,WangQ,ZhangG,DrebinJ,MuraliR,GreeneMI.2007.ErbBreceptors:fromoncogenestotargetedcancertherapies.JClinInvest.Aug;117(8):2051-8.Greco,Bravo,Parsons(1995)Thesearchforsynergy:acriticalreviewfromaresponsesurfaceperspective.Pharmacol.Rev47(2):331-85当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1