用于治疗多发性骨髓瘤的喹啉甲酰胺的制作方法
发明领域
本发明涉及用于治疗多发性骨髓瘤的某些喹啉甲酰胺。更具体而言,本发明涉及用于治疗多发性骨髓瘤的化合物4-羟基-5-甲氧基-n,1-二甲基-2-氧代-n-[4-(三氟甲基)苯基]-1,2-二氢喹啉-3-甲酰胺(他喹莫德tasquinimod),或其药学上可接受的盐。
发明背景
多种在治疗上有活性的喹啉甲酰胺及用于其制备的方法描述于公布为wo99/55678的国际申请号pct/se99/00676和公布为wo00/03991的国际申请号pct/se99/01270,所述申请公开了这些化合物用于治疗因自身免疫所致的疾病(例如多发性硬化、胰岛素依赖型糖尿病、系统性红斑狼疮、类风湿性关节炎、炎性肠病和银屑病)以及此外其中病理性炎症起主要作用的疾病(例如哮喘、动脉粥样硬化、中风和阿尔茨海默氏病)的效用。
用于制备在治疗上有活性的喹啉甲酰胺的过程亦描述于公布为wo03/106424的国际申请号pct/se2003/000780和公布为wo2012/004338的国际申请号pct/ep2011/061490。一种氘化形式的喹啉甲酰胺描述于公布为wo2012/175541的国际申请号pct/ep2012/061798。
含有在室温下长期储存期间稳定性增加的喹啉甲酰胺的盐的药物组合物、用于制备所述组合物的方法、喹啉甲酰胺的结晶盐和用于制备喹啉甲酰胺的结晶盐的方法,描述于公布为wo2005/074899的国际申请号pct/ep2005/050485。
多种喹啉甲酰胺用于治疗癌症、更具体而言实体癌症(例如前列腺癌和乳腺癌)的用途,描述于公布为wo01/30758的国际申请号pct/se00/02055。发现的是,这些化合物与免疫调节蛋白(s100a9)结合并抑制其相互作用,所述蛋白质促进肿瘤形成,影响肿瘤微环境中的抑制性细胞和促血管生成细胞,并参与预转移生态环境(pre-metastaticniches)的建立。
他喹莫德经历了用于口服治疗去势抵抗性前列腺癌(cprc)骨转移的试验,但近来发现其对该类型癌症的总生存缺乏足够的效果。
通用术语“癌症”涵盖了大量恶性疾病,其可以两种方式进行分类:通过其中所述癌症起源的组织类型(组织学类型),和通过原发位点,或者其中首先形成所述癌症的身体部位。用于组织学分类和命名的国际标准为用于肿瘤学的国际疾病分类(internationalclassificationofdiseasesforoncology),第三版(icd-o-3)。从组织学观点看来,癌症可分为六个主要类别,即癌、肉瘤、骨髓瘤、白血病、淋巴瘤和所谓的混合型。
多发性骨髓瘤(mm)为骨髓中浆细胞癌。通常,浆细胞产生抗体并在免疫功能中起重要作用。在mm中,异常浆细胞的群体积累在骨髓中并干扰正常血细胞的产生。mm的症状为骨骼(骨)痛和骨折、贫血、感染及其他并发症,例如多神经病和肾机能不全。mm为第二大常见的血液恶性肿瘤,且其确切病因仍为未知的。
mm通常使用化学疗法来治疗,其可任选接着进行自体干细胞移植术(sct)。
在sct中,将干细胞从患者取出,并冷冻和储存。通常首先使所述患者经历高剂量化学疗法,其破坏骨髓中的健康细胞和导致所述疾病的浆细胞二者,之后使所述取出的干细胞返回所述患者中,以在骨髓中产生新的健康血细胞。经历sct的患者通常必须采取长达2年的维持治疗,例如使用沙利度胺(thalidomide)或雷利度胺(lenalidomide)。sct并未治愈mm,其仅能够得到更长的生存期。此外,sct可导致严重的并发症,特别是易患感染。
特别是在处于对来自sct的并发症的较高风险的患者中,mm亦可仅通过化学疗法来治疗。在所述情况下,所述化疗药物常常与其他药物组合使用以减小化学疗法副作用,所述其他药物例如皮质激素(corticosteroid)。最后,mm亦可通过放射疗法来治疗。
目前,mm被认为是不可治愈的。根据来自美国国立卫生研究院(nationalinstituteofhealth)的国家癌症研究所(nationalcancerinstitute)的数据,在2010年,小于45%的确诊mm的美国患者在诊断后生存长于5年。显然,仍存在对用于mm的新治疗选项的迫切需求。
发明概述
一方面为用于治疗多发性骨髓瘤的式(i)化合物或其药学上可接受的盐
其中
r1选自氢、甲基、乙基、正丙基、异丙基、甲氧基、乙氧基、氟、氯、溴、三氟甲基和三氟甲氧基;
r2为c1-c4烷基;
r3选自甲基、甲氧基、氟、氯、溴、三氟甲基和三氟甲氧基;和
r4选自氢、氟和氯,前提是仅当r3选自氟和氯时,r4方选自氟和氯。
在一些实施方案中,通过给予诸如人等哺乳动物受试者量为每天0.001mg-0.2mg/kg体重的式(i)化合物,或者对应量的其药学上可接受的盐,来进行所述治疗。
优选所述给予为口服的,但其亦可以是例如直肠的或者胃肠外的,例如通过注射,如皮下注射、肌内注射或静脉内注射。
在一些实施方案中,所述治疗进一步包括放射治疗。在一些实施方案中,所述治疗进一步包括自体干细胞移植术。
在第二方面,提供了式(i)化合物或其药学上可接受的盐用于制备治疗多发性骨髓瘤的药剂的用途。
另一方面为治疗多发性骨髓瘤的方法,其包括给予需要所述治疗的哺乳动物受试者(具体而言人受试者)治疗上有效量的式(i)化合物或其药学上可接受的盐。
在一些实施方案中,式(i)化合物为4-羟基-5-甲氧基-n,1-二甲基-2-氧代-n-[4-(三氟甲基)苯基]-1,2-二氢喹啉-3-甲酰胺(他喹莫德),或其药学上可接受的盐。
附图简述
图1为显示在多发性骨髓瘤小鼠模型中,作为时间的函数的生存率百分数的图表。将来自fvb/nxc57bl/6小鼠的6-8周龄f1子代静脉内注射dp42多发性骨髓瘤肿瘤细胞。从第二天开始,其接受含30mg/kg/天他喹莫德的饮用水,在第30天停药。
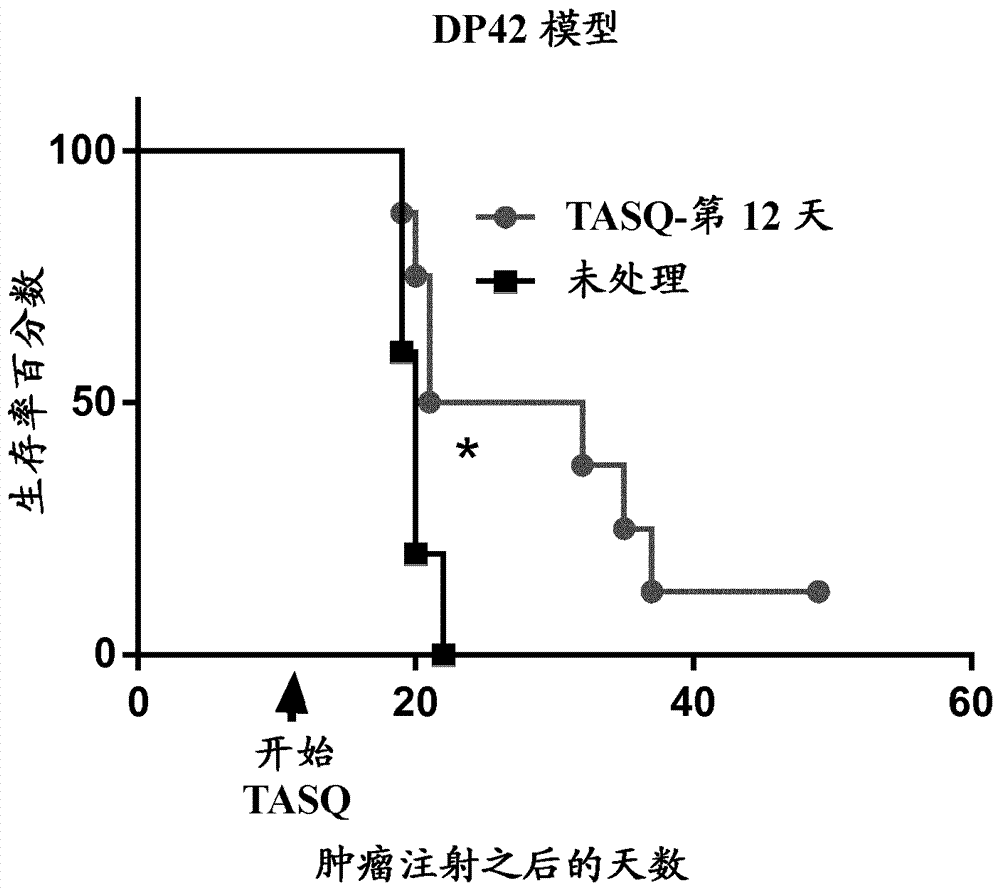
图2为显示在多发性骨髓瘤小鼠模型中,作为时间的函数的生存率百分数的图表。将来自fvb/nxc57bl/6小鼠的6-8周龄f1子代静脉内注射dp42多发性骨髓瘤肿瘤细胞。在dp42注射之后第12天,当骨髓中的肿瘤(cd138+)为约5-7%时,小鼠开始接受含他喹莫德的饮用水。
图3显示注射了dp42萤光素酶细胞并(a)从注射之后当天开始用含30mg/kg/天他喹莫德的饮用水处理或者(b)未接受他喹莫德的来自fvb/nxc57bl/6小鼠的6-8周龄f1子代的ivis图像。在肿瘤注射之后第13天获取所述ivis图像。
图4为显示在皮下注射人mm细胞系h929并从第10天起接受他喹莫德(30mg/kg/天)或仅接受溶媒的scid-beige小鼠中,作为时间的函数的肿瘤大小(mm2)的图表。
图5为显示在皮下注射人mm细胞系h929并从第10天起接受他喹莫德(30mg/kg/天)或仅接受溶媒的scid-beige小鼠中,作为时间的函数的生存率百分数的图表。
图6为显示在皮下注射人mm细胞系8226并从第15天起接受他喹莫德(30mg/kg/天)或仅接受溶媒的scid-beige小鼠中,作为时间的函数的肿瘤大小(mm2)的图表。
图7为显示作为时间的函数的在皮下注射人mm细胞系8226并从第15天起接受他喹莫德(30mg/kg/天)或仅接受溶媒的scid-beige小鼠的生存率百分数的图表。
发明详述
定义
应注意的是,存在标明疾病“多发性骨髓瘤”的数个同义术语,即卡勒病、骨髓瘤、骨髓瘤病、浆细胞恶性增生和浆细胞骨髓瘤。对于本发明的目的,认为这些术语均与术语多发性骨髓瘤为可交换的。
“任选的”或“任选地”意指其后描述的事件或状况可能但无需发生,且该描述包括其中所述事件或状况发生的情况及其不发生的情况。
“药学上可接受的”意指其在制备药物组合物上为有用的,所述药物组合物通常为安全无毒的,且在生物学上或其他方面并非不合乎需要的,以及包括对于兽医用途及人类药物用途而言为可接受的。
药学上可接受的盐的实例包括具有(作为反荷离子)碱金属离子(例如li+、na+或k+)、或者碱土金属离子(例如mg2+或ca2+)、或者任何其他药学上可接受的金属离子(例如zn2+或al3+)的盐;或者与有机碱形成的药学上可接受的盐,所述有机碱例如二乙醇胺、乙醇胺、n-甲基葡糖胺、三乙醇胺或氨丁三醇。
“治疗上有效的量”意指式(i)化合物或其药学上可接受的盐,当给予受试者用于治疗疾病状态(此处为mm)时,足以实现对于所述疾病状态的所述治疗的量。所述“治疗上有效的量”将根据例如治疗受试者的年龄和相对健康、mm的进展状态、给予的途径和形式、可能额外使用其他药物(例如在联合治疗中)等而不同。
本文所用的术语“治疗”或“处理”为用于获得有益或所需结果(包括临床结果)的途径。有益或所需的临床结果可包括但不限于减轻或改善mm(“所述疾病”)的一种或多种症状,减小所述疾病的程度、使所述疾病的状态稳定(即不恶化)、阻止所述疾病扩散、延迟或减缓所述疾病进展、改善或减轻疾病状态和缓解(不论局部或总体),而不论是否可检测。所述术语亦可意指与未进行所述治疗的预期生存期相比,延长生存期。
mm的常见症状为因溶解性骨病(lyticbonedisease)所致的骨痛、因贫血所致的虚弱和疲劳、体重减轻、意识错乱、过度口渴、因高钙血症所致的便秘、肾脏问题、因非功能性免疫球蛋白所致的感染。更多的不常见症状包括浆细胞蓄积在皮肤下可见的紫色肿块中,所谓的髓外浆细胞瘤。
术语“哺乳动物”是指人或任何哺乳动物,例如灵长类、家畜、宠物或实验室动物。优选所述哺乳动物为人。
可根据本发明适当治疗的哺乳动物(例如人)受试者,可以是受mm所累的受试者,或者处于形成mm的(增加的)风险中的受试者。存在具有形成mm的增加风险的受某些其他病况所累的患者。所述病况为意义不明的单克隆丙种球蛋白病(mgus)和孤立性浆细胞瘤。实际上,这些病况甚至可以是mm的早期形式。因此,在一些实施方案中,术语mm亦包括选自意义不明的单克隆丙种球蛋白病(mgus)和孤立性浆细胞瘤的病况。
术语“c1-c4烷基”是指具有1、2、3或4个碳原子的支链或无支链烷基基团,即甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基。
术语甲氧基是指meo-或ch3o-部分。
术语乙氧基是指eto-或ch3ch2o-部分。
术语氟、氯和溴亦可通过f、cl和br表示。
术语三氟甲基是指cf3-部分。
术语三氟甲氧基是指cf3o-部分。
如在上文中所述,用于根据本发明使用的化合物为式(i)化合物或其药学上可接受的盐,
如在上文中所定义。
在式(i)化合物中,r1选自h、甲基、乙基、正丙基、异丙基、甲氧基、乙氧基、氟、氯、溴、三氟甲基和三氟甲氧基。在一些实施方案中,r1选自甲基、乙基、正丙基、异丙基、甲氧基、乙氧基、氟、氯、溴、三氟甲基和三氟甲氧基。在一些其它实施方案中,r1选自乙基、正丙基、异丙基、甲氧基、乙氧基、氯、溴、三氟甲基和三氟甲氧基。在再其它实施方案中,r1选自乙基、甲氧基、氯和三氟甲基。在一些具体的实施方案中,r1为甲氧基。
r2部分为c1-c4烷基,所述基团可以是支链的或线性的。在一些实施方案中,r2为c1-c3烷基。在一些实施方案中,r2为甲基或乙基。在一些具体的实施方案中,r2为甲基。
r3部分选自甲基、甲氧基、氟、氯、溴、三氟甲基和三氟甲氧基。在一些实施方案中,r3选自甲基、甲氧基、氟、氯、三氟甲基和三氟甲氧基。在一些具体的实施方案中,r3为三氟甲基。
r4选自氢、氟和氯,前提是仅当r3选自氟和氯时,r4方选自氟和氯。在一些实施方案中,r4为氢或氟。在一些具体的实施方案中,r4为氢。
在一些具体的实施方案中,在式(i)化合物中,
r1和r4如在上文中所定义;
r2为甲基或乙基,具体而言为甲基;和
r3选自甲基、甲氧基、氟、氯、三氟甲基和三氟甲氧基。
在一些其它具体的实施方案中,在式(i)化合物中,
r1如在上文中所定义;
r2为甲基或乙基,具体而言为甲基;
r3选自甲基、甲氧基、氟、氯、三氟甲基和三氟甲氧基;和
r4为h。
在一些实施方案中,r3为在对位的,即用于如本文所定义用途的化合物可通过式(ia)表示,
其中r1、r2、r3和r4如在上文中所定义。
例如,在式(ia)化合物的一些实施方案中,
r1和r4如在上文中所定义;
r2为甲基或乙基,具体而言为甲基;和
r3选自甲基、甲氧基、氟、氯、三氟甲基和三氟甲氧基。
在一些其它具体的实施方案中,在式(ia)化合物中,
r1如在上文中所定义;
r2为甲基或乙基,具体而言为甲基;
r3选自甲基、甲氧基、氟、氯、三氟甲基和三氟甲氧基;和
r4为h。
如在上文中所述,在一些实施方案中,r4为氢。在所述实施方案中,式(i)化合物可通过式(ib)表示,
其中r1、r2和r3如在上文中所定义。
例如,在式(ib)化合物的一些实施方案中,
r1如在上文中所定义;
r2为甲基或乙基,具体而言为甲基;和
r3选自甲基、甲氧基、氟、氯、三氟甲基和三氟甲氧基。
在式(i)化合物的一些具体的实施方案中,r3为对位的和r4为h,且用于如本文所定义用途的化合物可随后通过式(ic)表示,
其中r1、r2和r3如在上文中所定义。
在式(ic)化合物的一些具体的实施方案中,
r1如在上文中所定义;
r2为甲基或乙基,具体而言为甲基;和
r3选自甲基、甲氧基、氟、氯、三氟甲基和三氟甲氧基。
对于本发明的目的,除非另有规定或从文段中显而易见,否则对式(i)化合物的任何引用,亦应理解为对式(ia)、(ib)和(ic)中任一种化合物的引用。
在一个实施方案中,式(i)化合物为4-羟基-5-甲氧基-n,1-二甲基-2-氧代-n-[4-(三氟甲基)苯基]-1,2-二氢喹啉-3-甲酰胺(他喹莫德),结构式为:
如在上文中所提及,式(i)化合物、其药学上可接受的盐、其氘化形式、其结晶盐和含有所述化合物及其盐的药物组合物、以及用于制备所述化合物、其盐、氘化形式和含有所述化合物及其盐的药物组合物的方法,描述于wo99/55678、wo00/03991、wo03/106424、wo2005/074899、wo2012/004338和wo2012/175541(同上),所述文件在本文中通过引用以其整体结合到本申请中。
在一些实施方案中,对式(i)化合物的任何引用亦包括其氘化形式。如在上文中所提及,他喹莫德的氘化形式描述于wo2012/175541。通过遵循在所述wo手册中提供的描述,本领域普通技术人员将能够类似地制备氘化的式(i)化合物。因此,在一些实施方案中,式(i)化合物在式(i)的r2部分具有至少70%、更优选至少90%的氘富集。例如,在一些实施方案中,r2为具有至少70%、更优选至少90%的氘富集的甲基。
在一些具体的实施方案中,式(i)化合物为在酰胺-n甲基基团具有至少70%、更优选至少90%的氘富集的他喹莫德。
在一些其它实施方案中,式(i)化合物为非氘化的,具有与氘的天然丰度一致的氘含量。
本发明包括任选连同药学上可接受的赋形剂(例如载体)一起配制在药物组合物中以用于治疗多发性骨髓瘤的式(i)化合物或其药学上可接受的盐。
所述药物组合物可适于肠内给予(例如直肠给予或口服给予)或者适于胃肠外给予哺乳动物(特别是人),且包含治疗上有效量的式(i)化合物或其药学上可接受的盐作为活性成分,任选联合药学上可接受的赋形剂,例如药学上可接受的载体。所述活性成分的治疗上有效的量如在上文中所定义且取决于例如哺乳动物的物种、体重、年龄、个体状况、个体药代动力学数据和给予模式。
对于肠内给予,例如口服给予,可以多种不同的剂型配制式(i)化合物。所述药学上可接受的载体可以是固体或液体。固体形式制剂包括粉剂、片剂、丸剂、锭剂、胶囊剂、扁囊剂、栓剂和可分散颗粒剂。固体载体可以是这样的一种或多种物质,其亦可充当稀释剂、调味剂、增溶剂、润滑剂、助悬剂、粘合剂、防腐剂、片剂崩解剂或封胶囊材料。在粉剂中,所述载体通常为细碎固体,其为与细碎活性组分的混合物。在片剂中,所述活性组分通常与具有必要粘合能力的载体以合适比例混合并以所需的形状和大小进行压制。合适的载体包括但不限于碳酸镁、硬脂酸镁、滑石粉、糖、乳糖、果胶、糊精、淀粉、明胶、西黄蓍胶、甲基纤维素、羧甲基纤维素钠、低熔点蜡、可可脂等。
适于口服给予的其他形式包括液体形式制剂,其包括乳剂、糖浆剂、酏剂、水溶液、水混悬剂,或者意图在临用前将其转变成液体形式制剂的固体形式制剂。乳剂可在溶液中配制,例如在丙二醇水溶液中配制,或者可含有乳化剂,例如卵磷脂、去水山梨糖醇单油酸酯或阿拉伯胶。水溶液可通过将所述活性成分溶于水并添加合适的着色剂、调味剂、稳定剂和增稠剂来制备。水混悬剂可通过将所述细碎活性组分与粘性物质一起分散到水中来制备,所述粘性物质例如天然或合成树胶、树脂、甲基纤维素、羧甲基纤维素钠及其他众所周知的助悬剂。固体形式制剂包括溶液剂、混悬剂和乳剂,并且除所述活性组分之外,还可包含着色剂、调味剂、稳定剂、缓冲剂、人造和天然甜味剂、分散剂、增稠剂、助溶剂,等等。
用于直肠给予的示例性组合物包括这样的栓剂,其可包含例如合适的非刺激性赋形剂,例如可可脂、合成甘油酯或聚乙二醇,其在常温下为固体,但在直肠腔中液化和/或溶解以释放所述药物。
式(i)化合物亦可经胃肠外给予,例如通过注射或输注,如通过静脉内、动脉内、骨内、肌内、大脑内、脑室内、滑膜内、胸骨内、鞘内、病灶内(intralesional)、颅内、瘤内、皮内和皮下注射或输注。因此,对于胃肠外给予,所述药物组合物可以呈无菌可注射或可输注制剂的形式,例如作为无菌水性或油性混悬剂。可使用合适的分散剂或湿润剂(例如吐温80)和助悬剂,根据本领域已知的技术配制该混悬剂。所述无菌可注射或可输注制剂亦可以是呈无毒性的胃肠外可接受的稀释剂或溶剂的无菌可注射或可输注溶液剂或混悬剂。例如,所述药物组合物可以是1,3-丁二醇的溶液。可用于本发明的组合物的可接受溶媒和溶剂的其他实例包括但不限于甘露醇、水、林格溶液和等渗氯化钠溶液。此外,无菌的不挥发性油通常用作溶剂或混悬介质。对于此目的,可使用任何温和的不挥发性油,包括合成的甘油一酯和甘油二酯。诸如油酸等脂肪酸及其甘油酯衍生物在注射剂的制备中为有用的,如为天然的药学上可接受的油,例如橄榄油或蓖麻油(特别是以其聚氧乙醇化形式)。这些油性溶液剂或混悬剂亦可含有长链醇稀释剂或分散剂。
用于胃肠外使用的溶液剂亦可含有合适的稳定剂,以及需要时,包含缓冲物质。合适的稳定剂包括抗氧化剂,例如单独的或组合的硫酸氢钠、亚硫酸钠或抗坏血酸,柠檬酸及其盐和edta钠。胃肠外溶液剂亦可包含防腐剂,例如苯扎氯铵、对羟基苯甲酸甲酯或丙酯和氯代丁醇。
用于选择和制备合适药物制剂的常规程序,描述于例如“pharmaceutics-thescienceofdosageformdesign(药剂学——剂型设计科学)”,m.b.aulton,churchilllivingstone,2002年第2版(isbn0443055173,9780443055171)。合适的药物赋形剂(例如载体)及制备药物剂型的方法,亦描述于remington'spharmaceuticalsciences(雷明顿药物科学),mackpublishingcompany,其为药物制剂领域中的标准参考文本。
所述药物组合物可包含从约1%至约95%、优选从约20%至约90%的式(i)化合物,连同至少一种药学上可接受的赋形剂。一般而言,将通过用作类似效用的剂的任何可接受的给予模式,以治疗上有效量给予式(i)化合物。
虽然需要时可能考虑例如注射给予或直肠给予式(i)化合物,通常认为口服给予为最便利的。
剂量水平和频率通常应通过治疗医师适当考虑以下因素来确定,例如治疗受试者的性别、年龄、体重和相对健康、mm的进展状态、所选的给予途径和形式、其他药物的额外使用(例如在联合治疗中)。
一般而言,考虑范围从最小0.001mg/kg体重、或0.002mg/kg体重或0.005mg/kg体重或0.01mg/kg体重至最大0.2mg/kg体重、或0.1mg/kg体重、或0.05mg/kg体重、或0.02mg/kg体重的每日剂量。
在一个实施方案中,以0.05-0.15mg/天、或0.08-0.1mg/天(例如0.1mg/天)的量给予式(i)化合物。
在一个实施方案中,以0.1-0.3mg/天、或0.15-0.25mg/天(例如0.2mg/天)的量给予式(i)化合物。
在一个实施方案中,以0.1-1mg/天、或0.2-0.8mg/天(例如0.5mg/天)的量给予式(i)化合物。
在一个实施方案中,以0.2-1.5mg/天、或0.4-1.2mg/天(例如0.8mg/天)的量给予式(i)化合物。
在一个实施方案中,以0.5-2mg/天、或0.8-1.2mg/天(例如1mg/天)的量给予式(i)化合物。
在一个实施方案中,以0.8-3mg/天、或1-2.5mg/天(例如2mg/天)的量给予式(i)化合物。
在一个实施方案中,以1-6mg/天、或2-4mg/天(例如3mg/天)的量给予式(i)化合物。
在一些实施方案中,可对所述剂量逐步调整以达到最佳结果,所谓的剂量滴定。例如,剂量滴定可包括以例如0.25mg的低每日剂量开始并将该剂量水平维持1或2周的时间。如果未遇到可能禁止增加所述剂量的显著副作用,则可将所述水平增加至例如0.5mg/天达1或2周,在所述时期之后可考虑再一次增加,以达到1mg的每日剂量,以此类推。在所述方法中,如果在增量增加所述剂量之后出现任何显著的副作用,可将所述剂量再次降至先前水平。
可能出现的副作用包括通常可在该类型治疗(例如胃肠问题、疲劳和类流感综合征)中遇到的副作用,其被认为与剂量相关。
优选按日给予式(i)化合物,例如每日1-3次,或者每日1-2次,如每日一次。在一些实施方案中,按更低的频率给予所述药物,例如每两日一次、每周一次等。
还应注意的是,如果给予式(i)化合物的药学上可接受的盐,则等效剂量应是得到非盐形式的指示剂量的所述化合物的剂量。
除非另有明确指示或从文段中显而易见,否则上述信息和实施方案通常亦用于式(i)化合物的药学上可接受的盐。
实施例
在下文中,本发明将通过多个非限制性实施例来进一步阐述。
在实施例1-3中,使用graphpadprism®软件完成统计学分析。在小鼠生存率上的差异通过对数秩(mantel-cox)检验来评价。在肿瘤生长上的差异通过2因素(2-way)anova来分析。
统计学显著性:*-p<0.05;**-p<0.005;和***-p<0.001。
实施例1
在同系6-8周龄小鼠(来自fvb/nxc57bl/6的f1子代;cf.jimmunol.2013年4月1日;190(7):3815-23)中建立dp42多发性骨髓瘤肿瘤。在肿瘤细胞注射一天之后,将小鼠分成2组,并使用含30mg/kg/天的剂量的饮用水给予的他喹莫德处理(n=5)或者接受不含他喹莫德的饮用水(n=6)。在第30天停用他喹莫德(图1)。监测小鼠的生存率。在另一个试验中,在dp42肿瘤细胞注射之后第12天开始用他喹莫德处理(n=8)。对照组(n=5)接受不含他喹莫德的饮用水。监测小鼠的生存率(图2)。
静脉内注射表达萤光素酶的dp42多发性骨髓瘤肿瘤细胞。在次日开始他喹莫德处理,并在肿瘤注射之后第13天通过ivis对肿瘤生长成像(图3a和b)。
实施例2
将6-8周龄scid-beige小鼠在右胁皮下接种含5x106个nci-h929细胞的100μl磷酸缓冲盐水(pbs)(参见blood.2008年2月15日;111(4):2220-9)。在肿瘤细胞注射之后十天,将小鼠分配到处理(n=7)或对照(n=9)组中。处理组以30mg/kg/天的剂量接受他喹莫德。每周两次监测肿瘤大小(图4)。当肿瘤达到400mm2时将小鼠安乐死,监测终点时间并作图(图5)。在肿瘤生长上的差异通过2因素anova评价。在生存率上的差异通过对数秩检验分析。
实施例3
将6-8周龄scid-beige小鼠在右胁皮下接种含10x106个rpmi-8226细胞的100μl磷酸缓冲盐水(pbs)(参见blood.2008年2月15日;111(4):2220-9)。在肿瘤细胞注射之后十五天,将小鼠分配到处理(n=4)或对照(n=6)组中。处理组以30mg/kg/天的剂量接受他喹莫德。每周两次监测肿瘤大小(图6)。当肿瘤达到400mm2时将小鼠安乐死,监测终点时间并作图(图7)。在生存率上的差异通过对数秩检验分析。
- 还没有人留言评论。精彩留言会获得点赞!