制备胶原酶的方法以及利用其制备胶原三肽的方法与流程
本发明涉及一种制备胶原三肽的方法,更具体地,涉及一种利用能够特别地产生胶原三肽的胶原酶来制备具有高胶原三肽含量的胶原三肽的方法。
背景技术:
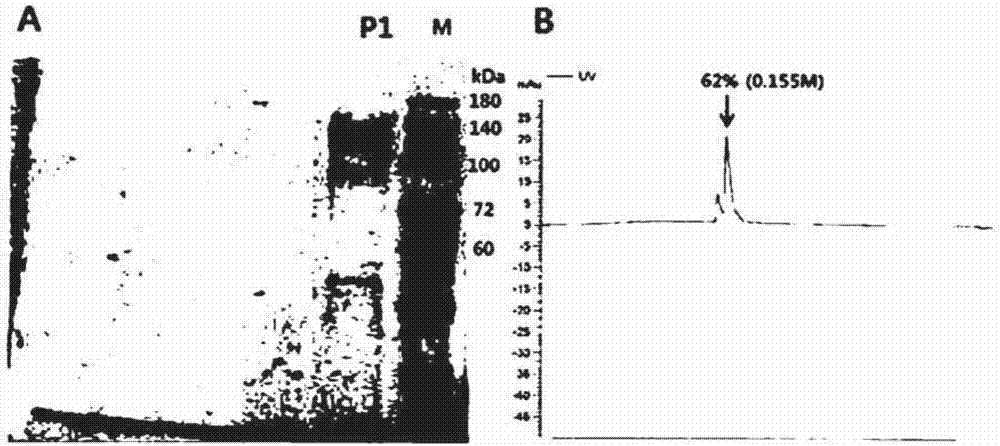
:胶原蛋白是一种由脯氨酸、羟脯氨酸、甘氨酸、谷氨酸等约18种氨基酸构成的动物纤维性蛋白质,它是一种在构成人体的5000多种蛋白质中占30%(最多)的特殊结构的蛋白质。特别是,胶原蛋白多存在于皮肤、骨骼、肌腱中,尤其是皮肤中的真皮层,其70%由胶原蛋白构成,因此胶原蛋白作为构成皮肤的成分,起到非常重要的作用。胶原蛋白显现各种氨基酸以多肽形式结合并卷绕成三条链的形式,并且分子量非常高,为约300000左右。低分子量胶原蛋白是一种通过胶原酶等降解的且具有5000以下(一般3000-5000)的低分子量的胶原蛋白,也称为胶原蛋白肽,这些低分子量胶原蛋白进入人体以后被人体内的蛋白酶进一步降解,最终以氨基酸的形式被人体吸收。相对于大部分的蛋白质(分子量为12000-70000),胶原蛋白的分子量为300000,非常大,因此很难被吸收,所以为了方便人体消化、吸收,在提取、分离、纯化步骤之后通过降解步骤制备成分子量5000以下的肽形式。胶原三肽是指3个氨基酸连接(甘氨酸-x-y)形成的小胶原蛋白(分子量一般为200-500),并已知由于分子量小,因此很容易透过皮肤。另外,如果4个或更多个氨基酸连接,由于分子结构变大而无法通过皮肤。由于在透过皮肤后能够立即相互再连接,胶原三肽有助于缩短修复受损胶原蛋白组织的时间。例如,爱茉莉太平洋公司曾提交过一份为了促进激光治疗后的皮肤再生的包含胶原三肽的组合物的专利申请(韩国专利公开号:10-2013-0122569)。并且,在摄取时,相对于低分子量胶原蛋白,由于胶原三肽的体内吸收率高,因此具有将胶原蛋白的生物活性最大化的优点。通常,胶原蛋白主要利用牛、猪、鱼、鱿鱼等作为原料,并通过酶水解而获得胶原三肽组合物。但是取决于通常使用的蛋白酶,三肽的含量非常低,因此很难获得高含量的三肽。因此,持续存在对制备高含量三肽胶原蛋白水解物的有效制备方法的需求。技术实现要素:发明要解决的课题为了解决所述问题,本发明的目的是提供一种制备胶原酶的方法,该胶原酶具有高的胶原三肽收率。并且,本发明的另一个目的是提供一种利用高收率的胶原酶来制备胶原三肽的方法。解决课题的方法为了达成所述目的,本发明的制备胶原酶的方法的特征在于包括:第1步骤:离心分离枯草芽孢杆菌(bacillussubtilis)菌株;第2步骤:浓缩经离心分离的上清液;第3步骤:利用离子交换色谱法进行纯化。所述离子交换色谱法的特征在于:其利用阳离子交换色谱法,并使用0.1至0.3m浓度的氯化钠(nacl)。所述离子交换色谱法的特征在于:其利用阴离子交换色谱法,并使用0.09至0.155m浓度的氯化钠(nacl)。并且,本发明的不同实施例的制备胶原三肽的方法的特征在于:其利用根据上述方法制备的胶原酶来制备胶原三肽。并且,本发明的另一个不同实施例的制备胶原三肽的方法的特征在于包括:第1步骤:将预处理过的鱼鳞和水以2∶8的重量比混合;第2步骤:将所述混合物在90℃下热处理持续5小时;第3步骤:加入根据上述方法制备的胶原酶并在35℃下降解12小时;第4步骤:通过离心分离法从第3步骤的成分中去除杂物;第5步骤:通过离子交换色谱法纯化所述成分;第6步骤:浓缩所述经纯化的成分;第7步骤:利用活性炭纯化所述经浓缩的成分;以及第8步骤:利用过滤器对所述成分进行除菌。发明的效果本发明的制备胶原酶的方法以及利用其制备胶原三肽的方法具有如下效果。在不改变现有制备工序的情况下,在使用酶的胶原蛋白水解工序中,通过使用具有高的三肽收率的新型酶,能够简单地制备出具有高三肽含量的胶原蛋白水解物。附图说明图1为表示利用本发明的优选实施例所制备的胶原酶的阳离子树脂的分离和纯化图。a为经纯化的胶原酶的sds-page分析结果(m:蛋白质大小标记,cone:经浓缩的样品,wash:清洗,e1至e5:洗脱样品1至5)。b显示在aktaprime中随缓冲液浓度而变化的胶原酶纯化峰(箭头表示各个洗脱样品)。图2为表示利用本发明的优选实施例所制备的胶原酶的阴离子树脂的分离和纯化图。a为经纯化的胶原酶的sds-page分析结果(m:蛋白质大小标记,p1:峰1)。b显示在aktaprime中随缓冲液浓度而变化的胶原酶纯化峰(箭头表示各个洗脱样品)。图3为表示本发明的优选实施例所制备的胶原酶的随温度而变化的酶活性结果的趋势图。图4为表示本发明的优选实施例所制备的胶原酶的依赖时间的温度稳定性结果的趋势图。图5为表示本发明的优选实施例所制备的胶原酶随ph而变化的酶活性结果的趋势图。图6为比较本发明的优选实施例所制备的胶原酶和一般蛋白酶的胶原三肽生产率的hplc数据。图7为表示利用本发明的优选实施例所制备的胶原酶来生产具有高含量胶原三肽的胶原蛋白水解物的制备工序的图。图8为分析利用本发明的优选实施例所制备的胶原酶而生产的产品中胶原三肽(ctp)含量的hplc数据。图9为分析利用本发明的优选实施例所制备的胶原酶而生产的产品中甘氨酸-脯氨酸-羟脯氨酸含量的hplc数据。具体实施方式下文中,将参考附图来详细说明本发明的制备胶原酶的方法以及利用其制备胶原三肽的方法的优选实施例。本发明的制备胶原酶的方法包括:第1步骤:离心分离枯草芽孢杆菌菌株;第2步骤:浓缩经离心分离的上清液;第3步骤:利用离子交换色谱法进行纯化。并且,本发明的不同实施例的利用胶原酶制备胶原三肽的方法包括:第1步骤(s10):将预处理过的鱼鳞和水以2∶8的重量比混合;第2步骤(s20):将所述混合物在90℃下热处理5小时;第3步骤(s30):加入根据权利要求1制备的胶原酶并在35℃下降解12小时;第4步骤(s40):通过离心分离法从第3步骤的成分中去除杂物;第5步骤(s50):根据离子交换色谱法纯化所述成分;第6步骤(s60):浓缩所述经纯化的成分;第7步骤(s70):利用活性炭纯化所述经浓缩的成分;以及第8步骤(s80):利用过滤器对所述成分进行除菌。首先,对本发明的制备胶原酶的过程的具体实施例进行说明。<实施例1>对具有胶原蛋白降解活性的新菌株的筛选作为一般被认为是安全的(gras)菌株,已知枯草芽孢杆菌对人体无害,并由于它可生产出多种蛋白质水解酶、脂质分解酶以及糖转化酶,因此被广泛用于食品制造以及饲料添加中。并且,还有报道称一部分枯草芽孢杆菌具有胶原蛋白水解活性(naganohetal.,bioscibiotehnolbiochem,2000年,64(1):181-3;tranlhetal.,jfoodsci,2002年,67(3):1184-7)。在本发明中,分离了一种来自新的枯草芽孢杆菌的胶原蛋白降解酶,并试图将其用于胶原蛋白降解工序中。收集庆尚南道晋州地区土壤样品后,使30g土壤悬浮在270ml无菌pbs缓冲液中,在室温下放置30分钟左右以通过沉降作用而除去粗土粒和杂质等。将10ml上清液与90ml无菌pbs缓冲液充分混合来制备100ml稀释液,并重复相同的操作来制备100ml的第3、第4、第5稀释液。将所制备的200ml第3、第4、第5稀释液加入含有1%脱脂乳和1.5%琼脂的lb(1%细菌胰蛋白胨,0.5%酵母提取物,0.5%氯化钠(nacl))固体培养基中,在30℃下培养24小时之后,筛选生成亮区的菌落。将筛选出的菌株在lb液体培养基中在25℃至30℃和180rpm下培养24小时,然后回收上清液并测量滴度。滴度的测量方法如下:将净制的猪皮加入到缓冲液(50mmtris-hcl(ph7.4)、5mmcacl2)中,在56℃下溶解并制备终浓度为2%的底物溶液。将150μl底物溶液在30℃下预加热15分钟之后,添加100μl酶,在30℃下反应30分钟。添加500μl0.01nhcl来中止酶反应,并添加50μl2%茚三酮溶液并煮沸4分钟,然后测量570nm处的吸光度值。酶单位值的定义如下:与底物在ph7.4的含钙离子的溶液中在在30℃下反应30分钟而释放出1μmoll-亮氨酸的值被定义为1酶单位。结果,5个菌株(#8、#9、#15、#60、#86)表现出强的胶原蛋白水解活性(表1)。通过使用api50chb试剂盒(biomerieux公司)分析菌株的生理特性而从5个菌株中筛选出来1个枯草芽孢杆菌属种(#86)。此外,通过分析16srrna基因的碱基序列来鉴定菌株。作为16srrna测序的结果,所筛选出的菌株和枯草芽孢杆菌显示出99%以上的同源性。将该菌株命名为枯草芽孢杆菌bp(bacillussubtilisbp),并于2015年7月13日保藏在生物科学和生物技术研究院的基因库中(保藏为kctc12866bp)。[表1]菌株酶活性(u/ml)的筛选样品u/ml样品u/ml样品u/ml样品u/ml样品u/ml#10.51#640.16#1561.24#2320.57#4650.76#30.12#710.68#1580.98#2400.67#4741.08#84.65#863.41#1610.21#2610.43#5680.60#92.90#1030.57#1660.43#2630.38#5770.71#100.56#1100.69#1691.42#2650.28#5920.54#152.60#1150.45#1730.67#2741.21#6030.31#360.55#1170.32#1760.53#3940.89#6150.37#380.1#1330.31#2010.45#4390.74#7020.29#510.21#1400.86#2040.31#4500.12#7160.51#602.92#1420.12#2090.13#4630.36#7730.43<实施例2>新胶原酶(bp)的分离分离并纯化了源于芽孢杆菌的胶原酶(bp)。将菌株在1000mlmtb培养液(2.4%酵母提取物、1.2%胰蛋白胨、1%甘油、2.31%kh2po4、12.54%k2hpo4)中在30℃和180rpm下培养24小时,然后在6500rpm下离心分离15分钟。小心地将所得上清液移到新的试管中,并利用30kda过滤器进行5倍浓缩。利用aktaprime装置将经浓缩的上清液通过离子交换色谱法法纯化。所使用的纯化条件为:将a缓冲液(50mmtris-hcl(ph7.5))作为结合缓冲液,并使用b缓冲液(50mmtris-hcl(ph7.5)、0.5mnacl)进行梯度洗脱。流速为5ml/min。使用阳离子交换色谱法和阴离子交换色谱法进行纯化,作为离子树脂分别使用了阳离子树脂——sp琼脂糖树脂(gehealthcare,usa,新泽西州)和阴离子树脂——q琼脂糖树脂(gehealthcare,usa,新泽西州)。在最初的阳离子交换色谱法中采用0.5mnacl梯度洗脱,并收集各流分中的经纯化的蛋白质。如图1b中所示,通过sds-page确认了在纯化曲线中显示出蛋白质峰的流分e1至e5中的蛋白质纯度,结果证实e1、e2中含有预计为靶酶的蛋白质,特别地,e1中含有最多的胶原酶(图1a的箭头标记)。e1至e5中的nacl浓度为e1:0.1-0.2m,e2:0.2-0.3m,e3:0.3-0.4m,e4:0.4-0.5m,e5:0.5m,因此可知在阳离子交换色谱法中可分离靶酶的nacl浓度为0.1-0.3m,并且靶酶的最佳回收率出现在0.1-0.2m的nacl浓度下,而这正是e1部分。然后,将e1通过阴离子交换色谱法法纯化。此时所使用的缓冲液为0.25m的nacl,并采用与阳离子交换色谱法相同的梯度洗脱。如图2b中所示,在纯化曲线中阴离子交换树脂在0.09-0.155mnacl处显示出蛋白质峰(图2b的箭头标记)。通过sds-page确认了该流分的纯度,结果证实大部分靶酶被完全纯化了(图2a的p1)。因此,在阴离子交换色谱法中,靶酶的最佳回收率出现在0.09-0.155m的nacl浓度下。然后,将经纯化的新胶原酶命名为bp。<实施例3>bp酶反应条件的实验在20-70℃下测量酶活性以确定最佳温度。如图3中所示,在30-55℃下显示出酶活性,特别是在50℃下显示出最高的比活性(specificactivity)和相对活性(relativeactivity),在60℃下活性急剧下降。将温度稳定化实验应用于实际的大量生产中。将温度调节为30℃、35℃、40℃和50℃,对各温度样品从0至12小时进行取样以确认残余的活性。如图4中所示,随着温度的降低,酶依然保持稳定,在35℃和40℃下12小时后酶活性剩余59.3%左右。根据这些结果,优选将本发明的胶原三肽的生产方法设定在35℃。接下来,研究最佳ph。将猪皮胶原蛋白底物溶解在不同ph的缓冲液(50mm柠檬酸盐-na2hpo4(ph5.0-6.0),50mmtris-hcl(ph6.0-9.0)以及50mmna2co3-na2hco3(ph9.0-10.0))中,并测量酶活性以确认最佳ph。bp在ph7.4下显示出最高活性,并在ph6-10的中性范围内显示出高活性。但是,如图5中所示,证实了酸性或碱性越强时,酶活性均类似地降低。下文中,对利用上述胶原酶(bp)来制备胶原三肽的方法进行说明。<实施例4>bp胶原三肽生产率的确认在配有搅拌器的反应器中,将预处理过的鱼鳞以鱼鳞和水20:80的重量比混合均匀,并在90℃下热处理5小时,以制备4份样品。对4份样品,使用bp(制造商:amicogen)、alcalase2.4lfg(制造商:novozymes,购自biosis)、flavourzyme1,000l(制造商:novozymes,购自biosis)、collupulinmg(制造商:novozymes,购自大宗商社)酶以比较胶原三肽生产率。各酶的反应条件(温度、ph、酶使用量、反应时间)如下:-bp:35℃,ph7.4,30单位/g(鱼鳞),12小时;-alcalase2.4lfg:60℃,ph7.0,30单位/g(鱼鳞),12小时;-flavourzyme1,000l:55℃,ph6.0,30单位/g(鱼鳞),12小时;-collupulinmg:60℃,ph7.0,,30单位/g(鱼鳞),12小时。酶处理后,以80℃下通过热处理30分钟而使酶失活。之后对4种酶进行比较分析以确认bp的胶原三肽生产率。使用hplc(gilson公司)分析所制备的胶原三肽,在下述条件下分析胶原三肽(ctp):superdextmpeptide10/300gl柱、流动相(10mmtris-cl(ph7.4)、0.15mnacl、5mmcacl2)、流速:0.5ml/min。使用由三个氨基酸构成的甘氨酸-脯氨酸-羟脯氨酸(gph)作为ctp标准物质。如图6中所示,结果表明在ctp标准物质的情况中,在约55分钟时形成峰。在比较4种酶的降解活性的结果中,发现在bp的情况中,峰大部分出现在较晚的时间段,因此可确认胶原蛋白变成了低分子量的,并且和标准物质在相同时间段中显示出大的峰,表明ctp的含量高。与其他flavourzyme1,000l、collupulinmg相比,alcalase2.4lfg显示更高含量的低分子量物质,但几乎不包含ctp。从该结果可知bp对于胶原三肽的生产而言是非常有效的。<实施例5>利用bp制备高含量胶原三肽的方法的建立为了生产包含高含量胶原三肽的产品而建立利用bp的制备方法。在配有搅拌器的反应器中,将处理过的鱼鳞以鱼鳞和水20:80的重量比混合均匀,并在90℃下热处理5小时。在35℃下,通过向经热处理的溶液中添加10%的naoh而将溶液调节为ph7.4。向校准后的溶液中添加约30单位/g(鱼鳞)的bp,然后在35℃下反应12小时。酶促反应后,在80℃下热处理30分钟以使酶失活。利用超高速连续离心分离机从酶处理过的胶原三肽溶液中除去杂物,然后通过离子柱纯化除去金属离子等杂质。利用真空浓缩仪将所述液浓缩到35%的白利糖度(brix),然后通过活性炭纯化进行脱色和脱臭。通过压滤机过滤和膜过滤对经活性炭纯化的溶液进行除菌,然后通过喷雾干燥机进行粉末化,并进行质量检查,并经过包装步骤而制备高含量三肽(图7)。<比较例>:利用一般蛋白质水解酶的高含量胶原三肽的制备为了和利用新bp的制备方法进行比较,利用通常用于低分子胶原蛋白水解方法中的alcalase2.4lfg(制造商:novozymes,购自biosis)比较了胶原三肽的生产率。在配有搅拌器的反应器中,将预处理过的鱼鳞以鱼鳞和水20∶80的重量比混合均匀,并在90℃下热处理5小时。在55℃下,通过向经热处理的溶液中添加10%的naoh而将溶液调节为ph7.5。向校准后的溶液中添加约30单位/g(鱼鳞)的alcalase酶,然后在35℃下处理12小时。酶促反应后,在80℃下热处理30分钟以使酶失活。利用超高速连续离心分离机从酶处理过的胶原三肽溶液中除去杂物,然后通过离子柱纯化除去金属离子等杂质。利用真空浓缩仪将所述液浓缩到35%的白利糖度,然后通过活性炭纯化进行脱色和脱臭。通过压滤机过滤和膜过滤对经活性炭纯化的液进行除菌,然后通过喷雾干燥机进行粉末化,并进行质量检查,并比较ctp含量和gph含量。以与上述实施例2相同的方法测定ctp含量,gph含量分析以如下所述的方法进行:使用hplc(gilson公司),jupiter4uproteo90a柱,流动相为10mmtris-cl(ph7.4)、5mmcacl2,流速:0.5ml/min。分析了使用bp以及alcalase和从日本jellice公司购买的其他产品而制备的胶原蛋白水解物样品。如图8中所示,在ctp含量的情况中,证实了使用bp制备的胶原蛋白水解物和ctp标准物质在相同位置上出现了峰,其他公司的产品有的在相同位置上出现了峰,但相对于bp样品其峰较小,因此可确认其含量较少。如图9中所示,在gph含量的情况中,与ctp的结果类似,在alcalase中没有出现gph的峰,相对于其他公司的产品,bp样品的峰较大,因此可确认其含量非常高。定量比较了利用bp和alcalase而生产的产品中的胶原三肽(ctp)含量,结果如表1中所示,bp为56%、alcalase为0%、其他公司产品为18.1%的含量;在作为ctp标准物质的甘氨酸-脯氨酸-羟脯氨酸(gph)情况中,bp为13.1%、alcalase为0%、其他公司产品为2.6%的含量。该结果表明相对于现有市售中的产品,使用bp可制备出胶原三肽含量更高的胶原蛋白水解物。[表2]胶原三肽(ctp)和标准物质(gfp)的含量比较应理解本发明不限于上述实施例,而是由记载于权利要求书中的内容所定义,在本发明的领域中,具有普通知识的技术人员可在所附权利要求书记载的范围内进行多种变形和改变是显而易见的。工业实用性胶原三肽作为3个氨基酸相连接的小胶原蛋白,由于分子量小,因此很容易透过皮肤,透过皮肤后立即相互再连接,因此缩短修复受损胶原蛋白组织的时间。其可用于多种化妆品或皮肤治疗剂中。国际承认用于专利程序的微生物保藏布达佩斯条约国际通用表格首次保藏收据按第7.1条的规定出具致:阿美克生物科技株式公司阿美克生物科技株式公司64,dongbu-ro1259beon-gil,jinseong-myeon,jinju-si,gyeongsangnam-do660-852韩国表格bp/4(kctc表格17)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1