生物样品中的核酸的扩增和检测的制作方法
相关申请的交叉引用
本申请要求2014年11月25日提交的美国临时申请no.62/084,257的优先权,将该申请的内容通过参考以其整体并入本文中。
本发明涉及核酸的诊断和检测方法,其用于使用直接扩增来检测生物样品中的有机体和基因检测。
背景技术:
提供以下对本发明的背景的探讨仅为帮助阅读者理解本发明,不能视为描述或构成本发明的现有技术。
在生物样品如全血中的核酸检测,通常需要在实施pcr之前从所述样品提取和纯化所述核酸。这是因为成分(例如血液样品中的血红蛋白)和保存剂(例如抗凝剂)能够干扰pcr扩增(wang,j-t.,etal.,1992,j.clin.microbiol.30:750)。靶核酸特别难以检测,因为所述核酸通常以比内源性核酸如基因组dna或其转录的rna低得多的水平存在。从生物样品提取有机体的核酸耗费时间,并涉及污染的高风险。
考虑到分离和检测生物样品中的核酸分子涉及的高度的复杂性,日益期望不用任何上游核酸提取或大量的预处理步骤,直接检测生物样品中的核酸。已经报道了用于对来自血液样本的致病核酸直接pcr的几种方法,如微波照射(ihhara,m.,etal.,1994,biotechniques17(4):726),过氧化氢处理(rudbeck,l.anddissing,j.,1998,biotechniques25(4):588),和氢氧化钠处理(queipo-ortuna,m.,etal.,1999,biotechniques27(2):248)。然而,在寻求快速诊断的情况下,需要只涉及少数步骤和最小的技术要求,并仍然达到对生物样品中的核酸的稳定而成功的扩增的快速方法。
技术实现要素:
本发明是基于允许直接扩增全血样品中的核酸,而不用首先从样品中提取所述核酸的方法的发现。本发明的方法包括以下步骤:将全血样品以高速旋转,以除去在pcr扩增期间干扰或猝灭荧光发射的细胞碎片和物质,直接扩增和检测所述核酸分子的步骤。
因此,本发明提供用于鉴定所述靶核酸的存在或不存在的方法,其用于基因检测或检测生物样品中的有机体。其中所述方法包括:(a)以足以使存在于所述样品中的细胞碎片和荧光抑制剂沉淀的旋转速度旋转包含全血的生物样品,降低所述样品中的荧光干扰或猝灭;和(b)直接扩增和检测所述样品中的靶核酸。优选所述旋转速度在大于140×g至1500×g的范围内,并且所述生物样品放置在离心式微流控盘(centrifugalmicrofluidicdisc)中。
在本发明的一个方面中,所述检测步骤包括检测在所述沉淀样品中通过光路发射的可见信号。优选所述可检测信号为荧光发射。在本发明的另一个方面中,所述扩增步骤包括实时聚合酶链式反应分析。在优选的实施方式中,所述靶核酸为dna。在另一个优选的实施方式中,所述靶核酸为rna。
在本发明优选的一个方面中,所述生物样品为全血,而所述靶核酸来自血液中发现的一种或多种有机体。在一个方面,所述靶核酸为人类核酸。在另一个方面,所述靶核酸来自微生物。所述微生物可以为病毒,例如埃博拉病毒(ebolavirus)、马尔堡病毒(marburgvirus)、流感病毒(influenzavirus)、呼吸道合胞病毒(respiratorysyncytialvirus)、水痘带状疱疹病毒(varicellazostervirus)、单纯疱疹病毒(herpessimplexvirus)、肠道病毒(enterovirus)、登革病毒(denguevirus)或它们的任何组合。在另一方面,所述微生物为革兰氏阴性细菌或革兰氏阳性细菌。在优选的实施方案中,所述细菌为选自芽孢杆菌(bacillus)、博德特氏菌(bordetella)、疏螺旋体(borrelia)、李斯特菌(listeria)、埃希氏杆菌(escherichia)、沙门氏菌(salmonella)、弯曲杆菌(campylobacter)、梭状芽胞杆菌(clostridium)、幽门螺杆菌(helicobacter)、分枝杆菌(mycobacterium)、葡萄球菌(staphylococcus)、弯曲菌(camplobacter)、肠球菌(enterococcus)、奈瑟氏菌(neisseria)、志贺氏菌(shigella)、链球菌(streptococcus)、弧菌(vibrio)、耶尔森菌(yersinia)和假单胞菌(pseudomonas)或它们的任何组合中的一种或多种。优选所述细菌为炭疽杆菌。在再一个实施方案中,所述微生物为真菌。所述细胞碎片可以包括裂解的和完整的红细胞。上述一般描述和详细描述为示例性和说明性的,旨在提供对要求保护的本发明的进一步说明。为了详细理解本发明,结合附图参考对优选实施方式的以下详细描述。其他对象、优点和新颖特征基于本发明的以下详细描述对于本领域技术人员将是显而易见的。
附图说明
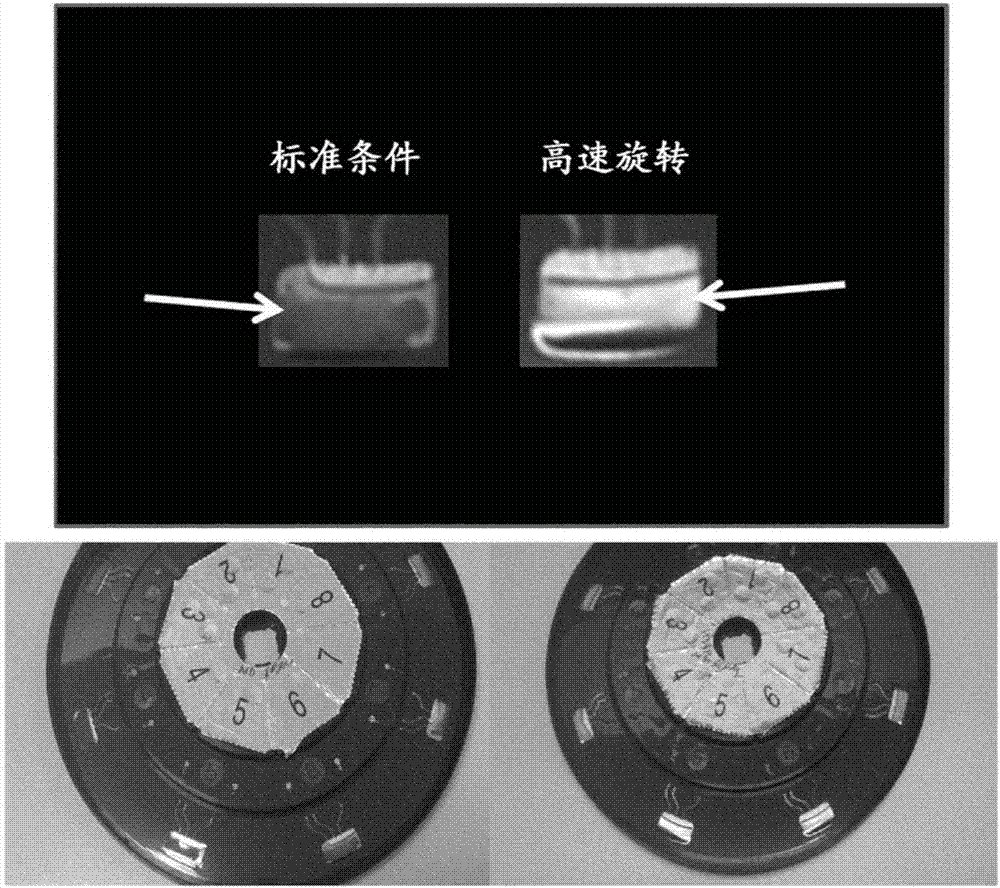
图1示出了高速旋转对检测人工产物的影响。从收集在edta管中的全血样品(反应体积的10%)扩增炭疽杆菌(bacillusanthracis)染色体靶标,每个反应50个拷贝(copy)。上图中的样品表示未处理的样品,而下图表示如实施例1所述的在23℃以约900×g旋转off-board10分钟的样品。图1示出在旋转的样品中,在5-30之间的循环所述人工产物消失。
图2为实施例2中所述的离心式微流控盘的照片。显示了示例的单独孔(顶部)和所述盘(底部)的俯视图。左侧的盘使用测定定义运行,所述测定定义为在整个测定期间以约1500rpm(约140×g)旋转所述样品的标准化的方法,而右侧的盘使用高速定义运行,所述高速定义为除了在以约1500rpm(约140×g)的标准速度旋转样品的光学读取步骤以外,在整个测定中以约5000rpm(1500×g)旋转样品。在所述标准速度盘中,在整个孔可以观察到血液颗粒,而在所述高速盘中,所述血液颗粒被沉淀于孔的周边,留下清晰的在孔的中央的光路。
图3示出了在优化高速旋转测定参数期间,从全血中检测来自炭疽杆菌的细菌染色体靶标的结果。样品使用两种不同的高速和持续时间运行。在运行的开始,样品以2500rpm(780×g)旋转6分钟(a)或以3500rpm(1500×g)旋转2分钟(b),接着在运行的剩余时间以约1500rpm(约140×g)的标准速度旋转。示出了通过改变初始旋转速度和持续时间的扩增曲线和平均ct值。
图4示出了使用vhf高速旋转测定参数进行的、来自全血的rna病毒埃博拉莱斯顿(rnavirusebolareston)的扩增。
图5示出了在对来自全血的mthfr1298杂合子样品进行的遗传测定中,高速旋转对熔点曲线下的面积值的影响。
使用包括引物和用于亚甲基四氢叶酸还原酶(mthfr)基因中的单核苷酸多态性(singlenucleotidepolymorphisms)的hybeacontm探针的反应混合物,制备了两个相同的通常盘(universaldisc)。所述反应包括8μl的反应混合物加上2μl的全血或者缓冲液作为样品,或者9μl的反应混合物加上1μl的全血或缓冲液。两个盘使用独立参数运行:一个进行所述标准pcr然后是熔融分析程序(灰条)[meltanalysisprotocol(greybars)],而另一个进行所述标准程序,但在所述pcr循环和所述熔融分析步骤之间添加了高速旋转步骤(黑条)。在大多数血液样品中所述高速旋转提高了所述熔点曲线下的面积值,导致阳性样品和阴性样品之间的荧光强度差异增大。
图6示出了全血中的mthfr1298杂合子样品检测的熔点曲线。使用了标准速度旋转(上图)和高速旋转(下图)参数。与标准速度相比,高速旋转导致杂合子测定的尖峰分离(sharppeakdifferentiation)。
发明详述
本文公开涉及用于鉴定生物样品中靶核酸的存在或不存在的方法,其不用先从所述生物样品中分离、提取和纯化所述核酸。本文公开的方法基于以下意想不到的发现:对全血样品施用高离心力,导致所述样品中存在的可能干扰所述pcr反应化学或荧光的发射的细胞碎片和物质发生沉淀,使得可以成功实现对所述全血样品的实时pcr扩增。本发明人发现,通过调节旋转样品进行旋转的旋转速度,可以使那些可能(i)抑制来自所述样品的可检测信号的发射和/或检测,(ii)干扰或猝灭聚合酶链式反应化学本身,和/或(iii)阻塞可检测信号在实时pcr测定期间传播通过的光路,的细胞碎片在样品内沉淀,从而允许对靶核酸有效扩增并清晰样品通过的光路,使得可以检测到可见扩增信号。结果,本文公开的方法允许在全血样品中检测核酸,而不用从所述样品提取所述核酸。
在优选的实施方案中,本发明利用配备有消耗性的直接扩增盘(directamplificationdisc)的3mintegratedcycler。通过将所述消耗性盘整合到3mintegratedcycler中实现的高旋转速度,导致全血样品中的细胞碎片进行移动并沉淀在所述消耗性盘的周边,从而使得分离细胞碎片并对所述全血样品成功实时pcr扩增,所述细胞碎片包括通常会导致所述pcr反应猝灭或干扰荧光发射的裂解的和完整的红细胞和荧光抑制剂。优选所述相对离心力为约0×g~约1500×g。
在其他实施方案中,将高离心力施用到在其上放置所述全血样品用于测试的复合紧密盘平台(multiplexedcompactdiscplatform),并通过以高角速度例如1500×g进行旋转而分离所述细胞碎片。
定义
本文所用的术语“dna”意指包含与在rna中发现的核糖相反(opposeto)的脱氧核糖的核酸分子。
本文所用的术语“rna”意指包含与在dna中发现的脱氧核糖相反的核糖的核酸分子。本文所用的rna意指所有种类,或包括信使rna(mrna)、核糖体rna(rrna)、转移rna(trna)以及具有调节功能的smallrna类的rna。所述“smallrna类”具有特定含义,指在细菌中具有管家或调节作用的非翻译rna。“smallrna类”不是rrna或trna。
本文所用的术语“靶核酸”意指作为样品中检测的靶的任何核酸分子或片段。在一些实施方案中,靶核酸为病毒、细菌或真菌来源。在其他实施方案中,所述靶核酸分子为人源。靶核酸可以是dna或rna分子。
本文所用的术语“循环”或“热循环”意指,使用实验室设备,利用使用预编程的升高和降低的温度循环的引物延伸反应来扩增核酸序列的片段的任何技术。热循环的实例包括但不限于:pcr、实时pcr和逆转录聚合酶链式反应(rt-pcr)。
本文所用的术语“逆转录酶-聚合酶链式反应”或“rt-pcr”意指,用于利用作为rna序列的拷贝的序列合成和扩增dna分子的任何技术。rt-pcr在检测rna种类如在基因表达的定量分析中有用,也在生产用于在克隆、拷贝dna文库构建、探针合成、原位杂交中的信号扩增中使用的rna的dna拷贝中有用。
本文所用的术语“试剂混合物”或“反应混合剂”或“反应混合物”意指,具有进行逆转录和/或逆转录聚合酶链式反应、或实时聚合酶链式反应需要的所有要素的组合物,包括但不限于聚合酶和分别具有针对诊断靶rna或dna的序列的特异性的引物。
本文所用的术语“扩增混合物”是用于核酸扩增反应的试剂的混合物,但不含引物或样品。扩增混合物包括缓冲液、dntp、和dna聚合酶。扩增混合物还可以进一步包含mgcl2、kcl、非离子型和离子型去污剂中的至少一种。
本文所用的术语“扩增主混合物”包括扩增混合物和用于扩增靶核酸的引物,但不包含要扩增的样品。
本文所用的术语“试剂-样品混合物”意指含有试剂混合物加样品的混合物。
本文所用的“引物”意指合成或天然存在的寡核苷酸,当置于互补链的合成由聚合酶进行催化的条件下时,所述寡核苷酸能够作为沿着模板链的核酸合成或复制的起始点发挥作用。在逆转录的情况下,引物由核酸组成并基于rna模板引导。在pcr的情况下,引物由核酸组成并基于dna模板引导。
本文所用的术语“dna聚合酶”意指在脱氧核糖核苷酸聚合成dna链中帮助催化的任何酶。dna聚合酶作用为向新形成的链的3'末端添加游离核苷酸,导致所述新链在5'-3'方向延长。
本文使用的“
本文所用的“裂解”意指促进获取或释放所述细胞rna或dna的、对细胞壁或病毒颗粒的扰动或改变。完全破坏或细胞壁的破裂都不是裂解的本质要求。
本文所用的术语“循环阈值”或“ct”意指,在热循环期间,由产物形成导致的荧光的增加达到了高于背景信号的显著和可检测的水平的循环。
本文所用的术语“直接扩增”意指,不用事先纯化、提取或浓缩,从所述样品中扩增靶核酸的核酸扩增反应。“循环阈值”或“ct”是在pcr反应中靶的浓度的相对量度。除所述靶的浓度外,有多种因素影响ct的绝对值。然而,来自反应混合物或仪器的、会改变与ct计算相关联的荧光测量的人工产物,将导致所述ct值发生与模板无关的变化。
本文所用的术语“提取”意指从在样品中存在的其他(非核酸)材料中除去核酸的任何操作。这样的操作包括但不限于:机械或化学裂解、添加去污剂或蛋白酶、或沉淀和除去非核酸如蛋白质。
本文所用的术语“干扰物质”意指样品中不是靶核酸的任何物质。这样的干扰物质包括合成物质和生物物质。这样的合成物质包括化学品和药品。这样的生物物质包括血液、尿液、蛋白质和其他生物分子。
本文所用的术语“荧光抑制剂”意指可以实质上干扰或猝灭荧光发射的细胞成分、细胞碎片和物质。
本文所用的术语“旋转速度”或“旋转速”或“旋转速”或“旋转速”意指,在每个时间单位中完整旋转、转动、循环或绕中心点转动的次数。优选所述相对离心力为约140×g~约1500×。
本文所用的术语"扩增"或"进行扩增"包括用于复制靶核酸、由此增加所选核酸序列的拷贝数的方法。扩增可以是指数性的或线性的。靶核酸可以是dna或rna。以此方式扩增的序列形成“扩增子”。虽然下文描述了示例性的涉及用聚合酶链式反应(pcr)来扩增的方法,本领域还已知大量其他方法用于扩增核酸(例如等温方法、滚环方法等)。技术人员会理解,这些其他方法可以用于代替pcr方法或与其一起使用。参见例如saiki,"amplificationofgenomicdna"inpcrprotocols,innis等,eds.,academicpress,sandiego,ca1990,pp13-20;wharam等,nucleicacidsres.2001jun1;29(11):e54-e54;hafner等,biotechniques2001apr;30(4):852-860;zhong,etal.,biotechniques2001,30(4):852-6,858,860.zhong,等,biotechniques2001,30(4):852-6,858,860。
如本文所用的,在检测来自可检测标记的信号以确定样品中靶核酸存在的内容中,所有术语“检测”不需要该方法提供100%灵敏度和/或100%特异性。众所周知的是,“灵敏度”是当人具有靶核酸时测试为阳性的概率,而“特异性”是当人不具有靶核酸时测试为阴性的概率。优选为至少50%的灵敏度,而至少60%、至少70%、至少80%、至少90%和至少99%明显是更优选的。优选为至少50%的特异性,而至少60%、至少70%、至少80%、至少90%和至少99%明显是更优选的。检测还涵盖了具有假阳性和假阴性的测定。假阴性率(falsenegativerates)可以是1%、5%、10%、15%、20%或甚至更高。假阳性率(falsepositiverates)可以是1%、5%、10%、15%、20%或甚至更高。
本文所用的术语“样品”或“测试样品”可以包含临床样品、分离的核酸、或分离的微生物。在优选的实施方案中,从生物来源获取样品(即“生物样品”),所述生物来源如收集自受试者的组织、体液、或微生物。样品来源包括但不限于痰(经处理的或未经处理的)、支气管肺泡灌洗液(bal)、支气管洗涤液(bw)、血液、全血、体液、脑脊液(csf)、尿液、血浆、血清、或组织(例如活检材料)。优选的样品来源包括鼻咽拭子(nasopharyngealswabs)、伤口拭子(woundswabs)、和鼻洗涤液(nasalwash)。本文所用的术语“患者样品”意指获取自寻求疾病的诊断和/或治疗的人的样品。
本文所用的术语“引物-探针检测系统”意指用于实时pcr的方法。该方法利用双功能性分子(此处称为引物-探针),其含有通过聚合酶阻断基团共价连接至探针元件的pcr引物元件。此外,每个引物-探针分子含有荧光团,其与猝灭剂相互作用以降低背景荧光。本文所用的引物-探针可以包含带有5’延长探针尾(其包含发夹结构)的3'引物,其具有荧光团/猝灭剂对。在pcr过程中,通过包含六甘醇(hexethlyeneglycol)(heg),阻断了聚合酶延伸至探针尾中。在第一轮扩增过程中,3’靶标特异性引物与靶核酸退火,并延伸,从而使引物-探针整合至新合成的链中,其具有新合成的针对5'探针的靶区域。在下一轮变性和退火过程中,引物-探针发夹环的探针区会与靶标杂交,从而将荧光团和猝灭剂分离并产生可测量的信号。此类引物-探针描述于whitcombe等,naturebiotech17:804-807(1999)中。
生物样品
可以使用本文公开的方法检测其中的靶核酸的生物样品可以来自无菌和/或非无菌部位,并包括体液如全血、血浆、血清、无细胞血浆、尿液、脑脊液(csf)、滑液、胸膜液、心包液、眼内填充液和可能含有核酸的粪便样品。在一个实施方案中,所述生物样品为全血。本文所用的“无细胞血浆”意指含有按体积低于1%细胞的血浆。
生物样品可能被怀疑含有靶核酸。靶核酸可以是rna和/或dna。在一些实施方案中,靶核酸来自微生物如细菌、真菌或病毒。在其它实施方案中,所述靶核酸来自人。此外,可以从疑似被微生物如细菌、真菌或病毒感染的个体获得生物样品。在一些实施方案中,靶核酸可以是内源核酸,例如基因或转录物(rna)。在一些实施方案中,靶核酸是基因或转录物或特定单核苷酸多态性(snp)的突变形式。
本文公开的方法优选使用未处理的生物样品(即,含有内源性核酸的生物样品;和/或未提取过核酸的生物样品),由此导致直接的、简化的从样品到答案的工艺。不过,如果将本文公开的检测方法用于按照本领域技术人员熟知的任何方法从生物样品纯化的已分离的核酸(dna和/或rna),也是有效的。
靶核酸
靶核酸可以是dna(包括基因组dna)或rna。此外,靶核酸可以是在微生物或人宿主中发现的任何核酸。dna包括例如来源于人、细菌种类、真菌和dna病毒的dna。适用于评价的病毒dna包括直接从所述病毒衣壳获得的dna以及整合到宿主基因组中的dna。
可以作为靶核酸测定的rna类型包括rrna、mrna、转移rna(trna)或其他的rna多核苷酸。rrna的种类包括5s、16s和23s多核苷酸,其可以含有一种或多种一组相关细菌特有的子序列。对特征序列的检测能力是可变的,取决于要利用所述测定检测的所述病毒或细菌的相关性水平。其他rna多核苷酸可用作靶rna。引物可以由本领域技术人员设计,以在逆转录反应中使用所述靶rna作为模板来引导拷贝dna的合成。
本领域技术人员也会知道,如何设计用于在pcr中使用所述拷贝dna作为模板扩增所述靶dna或靶rna的一对引物。在本领域中众所周知的是,在pcr中同时使用的引物应具有相似的杂交熔解温度。
逆转录和实时pcr
核酸的扩增
生物样品中的靶核酸可以通过本领域技术人员已知的各种方法扩增。优选使用pcr对感兴趣的靶核酸进行扩增。在该方法中,将两个以上相接或包括于感兴趣的核酸的相反链、并与其退火的寡核苷酸引物,与其互补序列重复退火,由dna聚合酶(例如amplitaqgold聚合酶)进行延伸,并热变性,使得所述靶核酸序列指数扩增。循环参数可以根据待延伸的所述核酸的长度而改变。根据本发明内容,技术人员能够设计和制备适于扩增靶序列的引物。在本发明中使用的所述扩增引物的长度取决于几个因素,所述因素包括:所述核苷酸序列一致性和所述核酸在体外核酸扩增期间杂交或使用的温度。为了确定特定序列同一性的扩增引物的优选长度所需的考虑因素,为普通技术人员所熟知。例如,短核酸或寡核苷酸的长度可以与其杂交特异性或选择性相关。
在检测扩增的核酸产物之前不需要分离步骤的方法,通常称为实时pcr或均相检测。大多数实时方法是通过监测热循环期间的荧光变化来检测扩增产物的形成。这些方法包括但不限于:
在本文方法中,靶核酸的存在可以通过逆转录(rt)和聚合酶链式反应(pcr)来检测。当逆转录和聚合酶链式反应一起使用时,可以在两个步骤中连续进行,或者利用加至所述样品的所有反应组合物试剂一个步骤中一起进行。
在两步法中,温育逆转录反应组合物中的样品,以允许合成来自所述靶rna的dna拷贝。所述试剂混合物包含:与所述靶rna杂交来引发拷贝dna的合成的引物。此外,所述试剂混合物包含dntp、mgcl2、kcl、逆转录酶和逆转录酶缓冲液。如果需要从多于一种靶rna制备dna拷贝,所述试剂混合物可以包含一个以上的引物。然后将所述逆转录反应的产物转移到另一测定管,在其中根据本领域熟知的方案进行pcr。pcr组合物通常包括一对引物,其从所述反转录模板起始合成dna的所需片段。此外,所述pcr混合物通常包含dntps、mgcl2、kcl、热稳定性dna聚合酶如taq聚合酶、聚合酶缓冲液。如果期望合成dna的多重片段,则可以包括多于一对的引物。也可以添加一条新引物,新引物会作为所述对的第二引物与原始rt引物进行扩增dna片段。可用于病毒样品的另外的逆转录酶包括但不限于:hiv逆转录酶(ambion)、transcriptor逆转录酶(roche)、thermoscript逆转录酶(invitrogen)。可以使用的另外的dna聚合酶包括但不限于:pfu、vent和sequithermdna聚合酶(epicentre)。
在本发明的一个实施方案中,将生物样品与rt-扩增混合物组合,使得rt和pcr可以在单次测定中进行。
无论所述rt-pcr是以两个步骤还是一个步骤进行,rt步骤首先运行,并通常包括在约37℃~约70℃之间的温度下的单温度温育。如本领域技术人员已知,不同的温度适合不同的rt酶和不同的引物。随后的pcr反应通常包括在约94℃~约97℃的初始温育,约2~约15分钟。此步骤用于使拷贝dna变性并激活热活化的taq聚合酶。然后接着进行所述拷贝dna靶的多次循环扩增。在每个循环期间进行三个操作:靶标变性、引物退火和引物延伸。靶标变性通常发生于大于约90℃。引物退火温度由反应中使用的所述特异性引物的熔解温度决定,引物延伸在取决于使用的所述热稳定聚合酶的约50℃~约72℃的温度范围下进行。当引物的退火和延伸在相同温度下进行时为双温度pcr,与此相比,在三个温度pcr中,三个步骤的每一个在不同的温度下发生。在扩增阶段完成后,通常加上最终延伸时间以确保所有扩增产物的合成。
不经单独的前端试样制备,将所述生物样品直接装入离心式微流控盘孔或室、或基因转子盘室中,随后在同一盘中进行逆转录和实时pcr扩增以及靶核酸的检测(如果样品中存在)。在样品中,可以包含利用寡核苷酸引物和探针的内部阳性扩增对照(ipc)。
在一些实施方案中,所述pcr为多重pcr反应。所述集成热循环仪可以以每秒>5℃的速度加热,以每秒>4℃的速度冷却,并且允许根据要延伸的扩增产物的长度改变循环参数。
旋转平台(rotaryplatform)技术
本文公开的方法可以使用任何具有旋转平台的热循环仪进行,所述旋转平台能够以高旋转速度沿着绕中心点的弯曲路径离心或旋转样品。所述旋转速度必须足以将所述生物样品或所述试剂-样品混合物中的细胞碎片移动到样品室内的部分(优选形成沉淀),从而隔绝会抑制来自所述样品的可检测信号的发射和/或检测、会干扰或猝灭聚合酶链式反应化学本身、和/或会阻碍可检测信号在实时pcr测定期间传播通过的光路的碎片。所述“高旋转速度”意指大于140g的转速。优选所述相对离心力为约140×g~约1500×g。
在一些实施方案中,在扩增循环期间样品被包含在离心式微流控盘的室中。本文所用的“离心式微流控盘”为圆盘,所述圆盘在热循环仪内在其轴上旋转,并包括可以沉积生物样品的室。示例性的离心式微流控盘为来自focusdiagnostics的直接扩增盘(8孔)和所述通常盘(96孔),其与3m(st.paul,mn,usa)出售的3mtmintegratedcycler热循环仪一起使用。所述3mtmintegratedcycler可以接收直接扩增盘,并对每个盘进行多测定。在一些实施方案中,生物样品沉积在基因转子盘中。优选所述生物样品为全血样品。本文所用的“基因转子盘”为离心机转子插入件,其将管或其它能够容纳样品和/或样品扩增混合物的室保持于均匀温度。基因转子盘的例子为与qiagenrotor-geneq热循环仪一起使用的qiagenrotordiscs和/或genediscs。
在一些实施方案中,将全血样品沉积在与沉积有试剂混合物的盘室分离的盘室(或孔)中。在该实施方案中,所述样品和试剂混合物可以随后在所述盘中组合,以允许扩增靶核酸(如果存在)。在一些实施方案中,将试剂混合物和样品在沉积在离心式微流控盘或基因转子盘中之前进行组合。在一些实施方案中,实时pcr扩增和检测使用simplexadirect测定在直接扩增盘中进行,并在热循环仪如3mtmintegratedcycler中进行。另外,pcr扩增和检测可以使用pall
使用离心式微流控盘和相关联的热循环仪、基因转子盘和相关联的热循环仪,或具有能够产生这样的旋转速度的旋转平台的任何其它热循环仪实现的旋转速度,可用于从生物样品沉淀细胞碎片。细胞碎片被隔离(优选被沉淀)到样品室的周边。来自生物样品的所述细胞碎片包括但不限于:裂解和完整的红细胞、荧光抑制剂、和试剂,它们可以干扰或猝灭所述pcr反应化学本身,或干扰在实时pcr测定期间读取荧光发射所需的光学路径。
为了直接检测和扩增全血样品中的靶核酸,需要增加离心式微流控盘或基因转子盘的旋转速度或转速。本发明人发现,在正常操作条件下以由制造商设定的旋转速使用3mtmintegratedcycler时,不允许对来自全血患者样品的成功的实时pcr扩增。
本发明涉及对系统参数的修改,其允许将所述碎片的沉淀用于成功扩增核酸,而不用从所述全血样品中提取所述核酸。本发明还涉及在所述实时pcr测定的某些步骤期间的旋转速,其经过优化和修饰以允许在每个循环确定实时pcr荧光发射之前清理所述光路。下表示出了实时pcr步骤中用于每个步骤的旋转速。可以在pcr循环参数的任何阶段引入旋转速(表1)。对快速旋转而言,除了在读取荧光之前,可以在每个循环中的整个运行期间进行(表1),或者在所述退火/延伸步骤期间读取荧光之前的pcr循环的任何阶段进行(表2-4)。
表1:阀(valving)和旋转(spinning)参数
*在混合前首先选择阀门(valve)反应混合物或样品。优先阀门可以改善稳定的结果,特别是在检测限度附近。
**旋转速设置可以在pcr循环参数的各个阶段引入。
表2:最终的用于炭疽杆菌(bacillusanthracis)的测定定义
表3:最终的病毒性出血热(viralhemorrhagicfever)的测定定义
表4:最终用于凝血熔融测定的测定定义
本发明是用于直接pcr反应的、能够使用高旋转速度去除细胞碎片和抑制剂的实时pcr系统的第一个报告。本文公开的方法证明,如实施例3所示,使用从全血直接扩增的人dna进行的熔融曲线分析,改善了检测和一致性。
所述高速旋转测定通过将离心式微流控盘,例如直接扩增盘的相对离心力从大约140×g增加到大约1500×g来执行。对于具有不同半径的离心式微流控盘或基因转子盘,足以将细胞碎片充分沉淀/隔离所需的旋转速度可能不同。一旦发现所述工艺有利,则可以在每个测定的基础上进一步优化所述旋转速参数。本发明公开的方法可以直接从任何生物样品扩增核酸,而不用另外的提取和纯化所述核酸的步骤。所述软件控制了旋转的速度,使得来自不同有机体的核酸可以在全血样品中分离和检测。旋转的持续时间随着所述旋转的速度而变化。更高的转速需要更短的旋转周期。因此,以1500×g旋转导致碎片在两分钟内从所述样品中完全分离。可以在每个测定基础上进一步优化所述旋转速参数。本发明人已成功应用该方法来直接从全血中扩增核酸,从而用于炭疽杆菌的检测、病毒性出血热panel、登革热血清分型测定,以及用来检测单核苷酸多态性(singlenucleotidepolymorphism,snp)。
在一些实施方案中,将所述3mtmintegratedcycler或相当的仪器,与直接扩增盘消耗品或相当的消耗品及直接化学(directchemistry)一起使用,来产生允许直接从生物样品(例如全血试样)中检测dna和rna的提高的旋转速度。成功检测的实例包括但不限于:细菌病原体炭疽杆菌中的dna靶标,以及rna病毒埃博拉和马尔堡(marburg)。
可检测信号
在本文公开的方法中,通过检测通过扩增所述靶核酸(如果存在于样品中)的信号产生来确定在全血样品中靶核酸的存在或不存在。在核酸扩增过程中的可检测信号发射是实时聚合酶链式反应的标志。因此,在一个实施方案中,对样品进行实时pcr反应,如果靶核酸存在于样品中,则靶核酸的存在通过检测可检测标签来检测。
实时pcr的一种通用方法是使用荧光探针,如
与检测最终扩增产物的量的其他形式的定量逆转录酶pcr相比,实时pcr定量至所述模板的初始量,具有更多的特异性、灵敏度和可重现性。实时rt-pcr检测不到所述扩增子的大小。
在一些实施方案中,所述可检测标签为荧光团。本文所用的术语“荧光团”意指吸收特定波长(激发频率)的光并随后发射更长的波长(发射频率)的光的分子。本文所用的术语“供体荧光团”意指当与猝灭剂部分非常接近时,向猝灭剂贡献或转移发射能量的荧光团。作为向所述猝灭剂部分贡献能量的结果,所述供体荧光团本身将以特定发射频率发射光,所述光少于在定位于附近的猝灭剂部分不存在时其所具有的光。
引物-探针如scorpions、或taqman和hybeacon探针可以用于根据本发明进行所述方法。也可以由本领域技术人员施用其他实时pcr荧光扩增技术。
可以使用本领域已知的方法可探测地标记探针。其他有用的标记包括,例如:在所述可见光谱的红光区发出荧光的,并可以被猝灭剂如blackholequenchertm(bhqtm)、bhq-1、bhq-2和bhq-3有效地猝灭的荧光染料例如cy5α、cy3α、fitc、罗丹明、镧(lanthamide)磷光体、德克萨斯红、羧基荧光素荧光团如羟基荧光素(fam)、joe、呫吨染料如calfluorred
在一些实施方案中,当所述样品在热循环仪中旋转时,读取来自所述样品的可检测信号。所述可检测信号在所述细胞碎片已经沉淀或隔离之后通过清除的光路进行读取,从而降低可能导致误读和/或屏蔽扩增曲线的背景荧光和不期望的扩增曲线变化。参见美国专利申请公开号2011/0117656和2012/0171677,其内容全部并入本文。在一些实施方案中,来自沉淀样品的所述可检测信号在样品旋转降低之后不久进行读取。优选为,高速旋转仅在热循环之前进行,并且所述样品在最佳读取期间以低速(约140×g)旋转,以允许在高速旋转重新开始之前进行光学读取。在供选择的实施方案中,在整个测定期间,所述样品以高速(1500×g)旋转。
测定灵敏度
通过向所述测定中使用的所述缓冲液中加入一种或多种增加灵敏度的成分,可以增加若干使用未处理样品的扩增测定的灵敏度。这些成分包括但不限于kcl、表面活性剂和白蛋白。在一些实施方案中,所述白蛋白为牛血清白蛋白。在一些实施方案中,所述表面活性剂为阳离子表面活性剂。通过提供额外的加热,例如在添加所述试剂之前预热样品,也可以增加所述直接扩增测定的灵敏度。在一些实施方案中,可以通过将增加灵敏度的成分和额外的加热组合来增加所述灵敏度。
实施例
大略描述的本文的方法通过参考以下实施例将更容易地理解,这些实施例仅为了说明而提供,本发明的方法和试剂盒不受其限制。
实施例1:全血的off-board旋转试验
进行了包括全血样品的off-board离心的试验。所述样品在23℃,以900×g离心10分钟。结果显示,利用预旋转的血液样品的离心降低了背景荧光和不期望的扩增曲线的变化,而没有预旋转的血液样品中,所述荧光背景没有降低的变化(图1)。
实施例2:离心式微流控盘高速旋转对全血中病毒rna或细菌dna的检测的影响
提高3mintegratedcycler系统上的离心式微流控盘的旋转速度或旋转速产生了意想不到的结果。使用专门设计的软件,将所述旋转速度或旋转速控制于约140×g至约1500×g的范围内。如下所示,以每个测定为基础进一步优化了所述旋转速参数。如下所示,本方法已成功应用于在测定中直接从全血中扩增核酸来检测炭疽杆菌、病毒性出血热病毒panel,以及登革热血清分型测定。
a.掺有登革病毒的血
将灭活的登革热病毒稀释在全血或pbs缓冲液中。相同的样品,一种测定运行为在整个测定期间以约1500rpm(约140×g)旋转所述样品的标准化的方法,另一种测定运行为除了在以约1500rpm(约140×g)的标准速度旋转样品的光学读取步骤以外,在整个测定中以约5000rpm(1500×g)旋转样品。
表5:旋转速对所述登革热病毒靶标的ct值的影响
b.炭疽杆菌
将炭疽杆菌稀释在全血中。相同的样品,一种测定运行为在所述运行开始时将所述样品以780×g旋转6分钟(较慢旋转),另一种测定运行为在所述运行开始时将所述样品以约5000rpm(1500×g)旋转2分钟(高速旋转)。在两种情况下,在所述运行的剩余时间,样品均以约1500rpm(约140×g)的标准速度旋转。图3示出了初始旋转速对用于炭疽杆菌检测的荧光强度和ct值的优化的影响。
c.病毒性出血热panel
将灭活的埃博拉莱斯顿病毒(ebolarestonvirus)稀释在全血或pbs缓冲液中。相同的样品使用能够检测埃博拉病毒和马尔堡病毒并且区分埃博拉莱斯顿(ebolareston)病毒和埃博拉扎伊尔病毒(ebolazaireviruses)的试剂运行。将结果对于下述测定定义的运行进行比较,一种测定定义为在整个测定期间以约1500rpm(约140×g)旋转所述样品的标准化的方法,另一种的测定定义为除了在以约1500rpm(约140×g)的标准速度旋转样品的光学读取步骤以外,在整个测定中以约5000rpm(1500×g)旋转样品。图4示出了使用5000rpm的高旋转速,来从所述埃博拉莱斯顿病毒中检测病毒性出血热的扩增曲线。
上述结果证明,直接从炭疽杆菌、病毒性出血热panel和登革热血清型的全血成功地扩增和检测核酸。
实施例3:通常盘高速旋转对全血中的人dna的扩增和熔融分析的影响
进行对与血栓形成相关的负责凝血的基因(如因子v、因子ii和mthfr基因)的突变的分子检测,以确定高速旋转对全血中的人类dna的检测和扩增的影响。
使用包括引物和用于所述亚甲基四氢叶酸还原酶(mthfr)基因的单核苷酸多态性的hybeacontm探针的反应混合物,制备了两个相同的通常盘。所述反应包括8μl的反应混合物加上2μl的全血或者缓冲液作为样品,或者9μl的反应混合物加上1μl的全血或缓冲液。两个盘使用独立参数运行:一个进行所述标准pcr然后是熔融分析程序,而另一个进行所述标准程序,但在所述pcr循环和所述熔融分析步骤之间添加了高速旋转步骤。如图5所示,结果表明,所述高速旋转在大多数血液样品中增加了熔点曲线值下的面积,从而增加了阳性和无模板样品之间的差异。在观察从全血患者样本中检测mthfr1298杂合子的相似的实验中,与标准速度相比,高旋转的引入导致杂合子测定的尖峰分离(图6)。
这些结果证明,改善了在全血中的任何微生物的核酸(包括但不限于:细菌、病毒和真菌)以及人类核酸的检测和扩增。这些结果还显示,高速离心全血样品可降低背景荧光,消除细胞碎片例如裂解和完整的红细胞,和降低荧光干扰和猝灭,并防止导致误读和/或屏蔽扩增曲线的不期望的扩增曲线变化。
本文提及或引用的所有文章、专利、专利申请的内容、以及所有其他文献和电子版的信息,在此通过引用以其整体并入,其程度如同各单独出版物通过引用而特异及单独的并入一样。申请人保留将来自任何此类文章、专利、专利申请或其他物理和电子文件中的任何和所有材料和信息,物理地并入本申请的权利。
本文说明性地描述的发明,可以适当地在缺少任一要素或任意多个要素、任一限定或任意多个限定的条件的情况下实施,这些要素或限定条件的省略没有在本文中具体公开。此外,本文采用的术语和表达方式用作描述性术语而非限定性术语,并且在对这些术语和表达方式的使用中并不意在将显示和描述的特征及其部分的任何等效物排除在外,而是公认在本发明要求保护的范围内多种修改都是可能的。因此,应当理解,虽然本发明通过优选的实施方案和最优的特征来进行了具体公开,但在其中体现的对于本文公开的发明修改、改进和变化是本领域技术人员可以采取的,并且这些修改、改进和变化视为在本发明的范围内。
本文广泛地且一般性地描述了本发明。落在一般性地公开内的每个较窄的种类和亚类分组也形成本发明的一部分。这包括对本发明的一般性描述,以及附带条件或从该类属去除任何主题的否定性限制,无论切离的(excised)材料是否在本文具体记载。其他实施方案示于所附的权利要求书中。此外,当本发明的特征或方面以马库什组群来描述时,本领域技术人员会认识到本发明还由此以马库什组群的任何单个成员或成员亚组得以描述。
- 还没有人留言评论。精彩留言会获得点赞!