一株光叶红豆伯克氏菌XS1685及其应用的制作方法
本发明属于微生物技术领域。更具体地,涉及一株光叶红豆伯克氏菌XS1685及其应用。
背景技术:
土传病害是指病原体随病残体生活在土壤中,条件适宜时从作物根部或茎部侵害作物而引起的病害。土传病害的侵染病原包括真菌、细菌、放线菌、线虫和病毒等,其中真菌为主,如尖孢镰刀菌等,是导致作物减产的主要原因之一。
化学农药因其速度快、成本低等特点,是目前主要的土传病害防治手段。然而,化学农药的长期使用会导致一系列问题,包括化学试剂对环境的污染、农药残留对人类健康的威胁及病原菌抗药性进化导致的药力失效等。
相比之下,具有抗菌活性的有益微生物作为生物防治的手段,具有无毒、无污染,不产生抗药性等优点,成为目前开发应用的热点。因此,可用于生物防治的有益微生物的筛选和获得是土传病害生物防治中至关重要的因素。
技术实现要素:
本发明要解决的技术问题是克服现有土传病害尤其是真菌病害防治技术的缺陷和不足,提供一种能够抑制真菌的生长活性的有益微生物,即光叶红豆伯克氏菌(Burkholderia)XS1685,可作为生物抗性菌,可用于土传病害的生物防治。
本发明的目的是提供一株光叶红豆伯克氏菌Burkholderia sp.XS1685。
本发明另一目的是提供所述光叶红豆伯克氏菌XS1685的培养方法。
本发明的再一目的是提供所述光叶红豆伯克氏菌XS1685的应用。
本发明上述目的通过以下技术方案实现:
一株光叶红豆伯克氏菌(Burkholderia)XS1685,该菌株于2015年4月3日保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO:M 2015193,保藏地址为武汉,武汉大学。
所述光叶红豆伯克氏菌(Burkholderia)XS1685属于伯克氏菌属(Burkholderia)。
该菌株是从种植于黑石顶自然保护区采回的野外土中的木本豆科植物光叶红豆(Ormosia glaberrima)根际上分离,采用从根际中分离伯克氏菌的常规方法分离筛选获得。经过鉴定分析,该菌株属于伯克氏菌属(Burkholderia),命名为光叶红豆伯克氏菌(Burkholderia)XS1685。
光叶红豆伯克氏菌(Burkholderia)XS1685属革兰氏阴性菌,好氧,其形态特征为:光叶红豆伯克氏菌XS1685在YMB平板上生长3天左右,菌落呈圆形,边缘整齐,半透明,具有粘质感。其最适生长温度为27℃,最适pH为6.8~7.0。
另外,上述光叶红豆伯克氏菌(Burkholderia)XS1685的培养方法包括如下步骤:
S1.菌种的活化:接种光叶红豆伯克氏菌XS1685至灭菌YMB培养基,在25~30℃下培养2.5~3.5天;
S2.菌种的培养:将YMB培养基上活化的单克隆菌接至灭菌YMA培养基中,在25~30℃、190~210rpm条件下培养2.5~3.5天。
其中,步骤S1所述YMB培养基的成分包括K2HPO4 0.4~0.6g/L,MgSO4 0.1~0.3g/L,NaCl 0.05~0.2g/L,甘露醇9~11g/L,琼脂14~16g/L,酵母浸膏0.3~0.5g/L,pH=7.0。
步骤S2所述YMA液体培养基成分包括K2HPO4 0.4~0.6g/L,MgSO4 0.1~0.3g/L,NaCl 0.05~0.2g/L,甘露醇9~11g/L,酵母浸膏0.3~0.5g/L,pH=7.0。
优选地,步骤S1所述YMB培养基的成分包括K2HPO4 0.5g/L,MgSO4 0.2g/L,NaCl 0.1g/L,甘露醇10g/L,琼脂15g/L,酵母浸膏0.4g/L(pH=7.0)。
优选地,步骤S2所述YMA液体培养基成分包括K2HPO4 0.5g/L,MgSO4 0.2g/L,NaCl 0.1g/L,甘露醇10g/L,酵母浸膏0.4g/L(pH=7.0)。
根据上述培养方法获得的光叶红豆伯克氏菌XS1685的活菌数可达到100亿/ml以上另外,优选地,步骤S1所述培养的条件为27℃下培养3天。
优选地,步骤S2所述培养的条件为27℃、200rpm条件下摇床培养3天。
经过试验证实,上述光叶红豆伯克氏菌XS1685具有抑制真菌生长活性,可以用于土传病害的生物防治;尤其是针对真菌病害。
因此,上述光叶红豆伯克氏菌XS1685在制备土传病害生物防治剂方面的应用、在制备抗真菌剂方面的应用,以及在制备具有抗真菌功能的肥料方面的应用,都应在本发明的保护范围之内。
进一步地,一种包含上述光叶红豆伯克氏菌XS1685的抗真菌剂,以及包含上述光叶红豆伯克氏菌XS1685的具有抗真菌功能的肥料,都应在本发明的保护范围之内。
优选地,上述真菌,即本发明的光叶红豆伯克氏菌XS1685对如实施例中所述的以下真菌具有非常显著的抑制作用:拟盘多毛孢霉Pestalotiopsis sp.(FJ947050.1)、拟盘多毛孢霉Pestalotiopsis sp.(GU723442.1)、棒孢拟盘多毛孢Pestalotiopsis clavispora(HM999902.1)、聚多拟盘多毛孢Pestalotiopsis sydowiana(HQ248207.1)、葡萄座腔菌Botryosphaeria parva(DQ499154.1)、尖孢镰刀菌Fusarium oxysporum(AY684919.1)、密实链格孢Alternaria compacta(EU128529.1)、拟隐盘孢属Paraconiothyrium hawaiiense(HM7510092.1)、淡色生赤壳菌Bionectria ochroleuca(GU929189.1)、平头碳团菌属Annululohypoxylon atroroseum(EF488415.1)、煨木霉Trichoderma erinaceum(EU280106.1)、嗜松青霉Penicillium pinophilum(HQ589151.1)、微紫青霉菌Penicillium janthinellum(AY373921.1)、嗜松青霉Penicillium pinophilum(AB293968.1)、青霉属Penicillium sp.(FJ379828.1)、肉座菌属Hypocrea koningii(GU176484.1)、肉桂霉Peziza ostracoderma(FJ537076.1)和/或肉座菌目Hypocreales sp.(GQ923983.1)。
本发明具有以下有益效果:
本发明提供了一株新的光叶红豆伯克氏菌(Burkholderia)XS1685,该菌株属于伯克氏菌属(Burkholderia),分离自光叶红豆根际。
经过试验证实,上述光叶红豆伯克氏菌XS1685能够抑制多种真菌的菌丝生长,具有抑制真菌生长的活性,可用做生物抗性菌,可用于各类植物土传病害的生物防治,尤其是针对真菌病害,在制备抗真菌剂和相关肥料方面具有显著的应用前景和优势。
附图说明
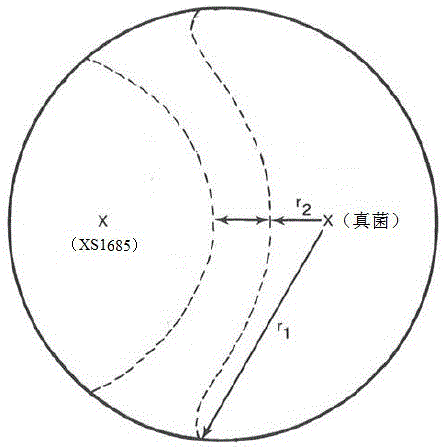
图1为真菌和光叶红豆伯克氏菌XS1685双接种于琼脂平板的模式图。
图2为光叶红豆伯克氏菌XS1685对真菌生长的抑制活性检测。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、材料、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所述的各种固体平板培养基、菌种活化培养基所使用的原料都来自目前市场上销售的在细菌培养中通常使用的原料。所述固体平板培养基、菌种活化培养基所使用的设备与器具都是目前市场上销售的在细菌培养中通常使用的设备与器具,设备器具均经过消毒处理。另外,液体光叶红豆伯克氏菌活菌数目的测定是运用本领域技术人员熟知的各技术方法,通过稀释平板计数法进行测定。
实施例1光叶红豆伯克氏菌XS1685的分离鉴定
1、光叶红豆伯克氏菌XS1685的分离
该菌株是从种植于黑石顶自然保护区采回的野外土中的木本豆科植物光叶红豆(Ormosia glaberrima)根际上分离,采用从根际中分离伯克氏菌的常规方法分离筛选获得。
具体分离方法如下:
(1)根瘤的采集
1)自来水冲洗掉光叶红豆根上泥土,并用无菌水冲洗干净,控干水分后吸水纸吸干根瘤表面的残留水分。
2)表面消毒:首先将根瘤置于70%的乙醇中浸泡5min,无菌水清洗并吸干根瘤表面水分。然后浸入3%的次氯酸钠4min,灭菌水清洗吸干。最后用无菌水再清洗5次。
(2)细菌的分离
表面消毒后的根瘤用于分离根瘤菌:
1)超净台内,根瘤埋于1.5%琼脂培养皿中,用刀片和镊子将根瘤从中间切开;枪头挑取根瘤中间红色部分到离心管中;加入500μl蒸馏水稀释后取悬液涂YMA(yeast-mannitol agar)培养基平板。
2)平板于27℃培养3~7天后,用画线法分离得到纯培养的单菌落。纯培养单菌落与40%甘油等体积混合后-70℃长期保存。
2、光叶红豆伯克氏菌XS1685的鉴定
(1)供试菌株经活化后,挑取单克隆于液体TY培养基中27℃、220rpm/min震荡培养3~5天至对数期,取1.5ml菌液8000rpm/min离心5min,弃上清,收集菌体提取基因组DNA。DNA提取方法参考Chen et al.(1993)。
(2)以上述DNA为模板,利用通用简并引物(Weisburg et al.1991)16S rDNA-f(引物序列AGAGTTTGATCMTGGCTCA)和16S rDNA-r(引物序列AAGGAGGTGWTCCARCC)扩增16S rRNA基因,目的片段约1.5kb。
PCR反应体系50μl,包括:20ng模板DNA、125ng引物、200μM dNTP、6.25单位的Taq(rTaq)聚合酶和ddH2O(ddH2O补齐50μl)。
(3)扩增产物回收并送样测序,NCBI比对确定菌种类型,鉴定结果显示:该菌株属于伯克氏菌属(Burkholderia)。
3、光叶红豆伯克氏菌XS1685的培养方法如下:
S1.菌种的活化:接种光叶红豆伯克氏菌XS1685至灭菌YMB培养基,在27℃下培养3天;
S2.菌种的培养:将YMB培养基上活化的单克隆菌接至灭菌YMA培养基中,在27℃、190~210rpm条件下培养3天。
其中,步骤S1所述YMB培养基的成分包括K2HPO4 0.5g/L,MgSO4 0.2g/L,NaCl0.1g/L,甘露醇10g/L,酵母浸膏0.4g/L(pH=7.0),琼脂15g/L。
步骤S2所述YMA液体培养基成分包括K2HPO4 0.5g/L,MgSO4 0.2g/L,NaCl 0.1g/L,甘露醇10g/L,酵母浸膏0.4g/L(pH=7.0)。
根据上述培养方法获得的光叶红豆伯克氏菌XS1685的活菌数可达到100亿/ml以上。
综上所述,本发明分离到的菌株是属于伯克氏菌属(Burkholderia)的一个新菌株,命名为光叶红豆伯克氏菌(Burkholderia)XS1685,并于2015年4月3日保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO:M 2015193,保藏地址为武汉,武汉大学。
上述光叶红豆伯克氏菌(Burkholderia)XS1685属革兰氏阴性菌,好氧,其形态特征为:光叶红豆伯克氏菌XS1685在YMB平板上生长3天左右,菌落呈圆形,边缘整齐,半透明,具有粘质感。其最适生长温度为27℃,最适pH为6.8~7.0。
实施例2光叶红豆伯克氏菌XS1685抑制真菌生长活性的检测
1、将光叶红豆伯克氏菌XS1685与分离于光叶红豆死亡幼苗的多种真菌双培养于马铃薯葡萄糖琼脂培养基。
测试所用真菌包括:
(1):拟盘多毛孢霉属Pestalotiopsis sp.(FJ947050.1);
(2):拟盘多毛孢霉属Pestalotiopsis sp.(GU723442.1);
(3):棒孢拟盘多毛孢Pestalotiopsis clavispora(HM999902.1);
(4):聚多拟盘多毛孢Pestalotiopsis sydowiana(HQ248207.1);
(5):葡萄座腔菌Botryosphaeria parva(DQ499154.1);
(6):尖孢镰刀菌Fusarium oxysporum(AY684919.1);
(7):密实链格孢Alternaria compacta(EU128529.1);
(8):拟隐盘孢属Paraconiothyrium hawaiiense(HM7510092.1);
(9):淡色生赤壳菌Bionectria ochroleuca(GU929189.1);
(10):平头碳团菌属Annulohypoxylon atroroseum(EF488415.1);
(11):煨木霉Trichoderma erinaceum(EU280106.1);
(12):嗜松青霉Penicillium pinophilum(HQ589151.1);
(13):微紫青霉菌Penicillium janthinellum(AY373921.1);
(14):嗜松青霉Penicillium pinophilum(AB293968.1);
(15):青霉属Penicillium sp.(FJ379828.1);
(16):肉座菌属Hypocrea koningii(GU176484.1);
(17):肉桂霉Peziza ostracoderma(FJ537076.1);
(18):肉座菌目Hypocreales sp.(GQ923983.1)。
2、测定分析真菌菌丝的生长情况,菌丝生长被抑制的抑制百分数算法为:
其中,R1为真菌接种点到真菌生长边缘的最大距离,R2为真菌接种点到真菌生长边缘的最小距离(如图1所示)。
3、结果如附图2所示,除1、4、7号菌株外,大部分真菌的菌丝生长被抑制。图中“N”表示没有抑制效果。
以上结果表明,本发明的光叶红豆伯克氏菌XS1685对上述大多数的真菌都具有显著的抑制作用,显示出优异的抑制真菌生长的活性,可用做生物抗性菌。
因此该菌株在各类植物土传病害的生物防治,尤其是针对真菌病害,在制备抗真菌剂和相关肥料方面具有显著的应用前景和优势。
- 还没有人留言评论。精彩留言会获得点赞!