核酸的等位基因特异性捕获的制作方法
本申请要求2017年1月20日提交的美国临时申请号62/448,730的权益,所述临时申请特此以引用的方式整体并入。
背景技术:
核酸序列的小差异可导致生物学功能的显著差异。在诊断背景下,人基因组中的单核苷酸多态性(snp)是疾病易感性的差异的基础。广泛范围的人疾病,如镰状细胞性贫血、β-地中海贫血、阿尔茨海默氏病和囊性纤维化由snp引起。
在其他情况下,单核苷酸突变对于基因疗法或合成生物学可以是有效的。在基因治疗方法中,单核苷酸变化可提供基因的健康型式,所述基因当引入患者的细胞时将治疗由所述基因的突变型式引起的疾病。合成生物学可基于突变产生工业上有用的生物分子,甚至在编码它们的核酸中的单个核苷酸位点处。
捕获或选择具有所需snp或突变体的核酸的能力可用于许多情况下核酸的表征、合成和质量评估,如上文例示的诊断、治疗和合成方法。在许多情况下,所需序列的丰度低和/或存在于污染物的背景中,如具有不同序列的其他核酸。目前的方法利用互补核酸链之间结合的特异性来进行这种捕获和选择。在典型的技术中,使用与靶核酸的序列互补的载体结合的核酸来捕获靶核酸。虽然,互补性在理论上能够区分序列,但实际上,关于存在的非靶序列的多样性和关于与靶分子相比的非靶分子的绝对数量,许多样品是高度复杂的。这种复杂性使得选择性地捕获与污染核酸相差仅一个或一些核苷酸的序列是不切实际的并且在一些情况下是不可能的。
因此,对于分离彼此相差仅一些或甚至仅一个核苷酸的核酸的方法存在需要。本公开满足了这种需要并且也提供了相关的优点。
技术实现要素:
本公开提供了一种用于从核酸混合物中分离靶等位基因的方法。所述方法可包括以下步骤:(a)提供与附接至固体载体的稳定化的三元复合物流体接触的核酸混合物,其中所述稳定化的三元复合物包含聚合酶、引发的核酸模板和下一个正确的核苷酸,其中所述模板具有靶等位基因,其中所述下一个正确的核苷酸是所述靶等位基因的同源核苷酸,并且其中所述稳定化的三元复合物经由所述聚合酶与所述固体载体之间的键联或经由所述核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所述核酸混合物分离,从而从所述核酸混合物中分离所述靶等位基因。
还提供了一种用于使基因座的第一等位基因与所述基因座处的第二等位基因分离的方法。所述方法可包括以下步骤:(a)提供与附接至固体载体的稳定化的三元复合物流体接触的包含所述第二等位基因的混合物,其中所述稳定化的三元复合物包含聚合酶、与核酸模板杂交的引物和下一个正确的核苷酸,其中所述模板具有所述第一等位基因,其中所述下一个正确的核苷酸是所述第一等位基因的同源核苷酸,或者所述引物的3'端具有所述第一等位基因的同源核苷酸,并且其中所述稳定化的三元复合物经由所述聚合酶与所述固体载体之间的键联或经由所述下一个正确的核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所述核酸混合物分离,从而使所述第一等位基因与所述第二等位基因分离。
本公开进一步提供了一种用于从核酸混合物中分离多个靶等位基因的方法。所述方法可包括以下步骤:(a)提供与多种稳定化的三元复合物流体接触的核酸混合物,所述稳定化的三元复合物是固体载体附接的,其中所述稳定化的三元复合物各自包含聚合酶、引发的核酸模板和下一个正确的核苷酸,其中所述模板具有靶等位基因,其中所述下一个正确的核苷酸是所述靶等位基因的同源核苷酸,并且其中所述稳定化的三元复合物各自经由所述聚合酶与所述固体载体之间的键联或经由所述下一个正确的核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所述核酸混合物分离,从而从所述核酸混合物中分离所述靶等位基因。
本公开进一步提供了一种用于分别使多个基因座处的第一等位基因与所述多个基因座处的第二等位基因分离的方法。所述方法可包括以下步骤:(a)提供分别与多种稳定化的三元复合物流体接触的所述多个基因座处的第二等位基因的混合物,所述稳定化的三元复合物是固体载体附接的,其中所述稳定化的三元复合物各自包含聚合酶、引发的核酸模板和下一个正确的核苷酸,其中所述模板包含第一等位基因,其中所述下一个正确的核苷酸是所述第一等位基因的同源核苷酸,或者所述引物的3'端包含所述第一等位基因的同源核苷酸,并且其中所述稳定化的三元复合物各自经由所述聚合酶与所述固体载体之间的键联或经由所述下一个正确的核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所述核酸混合物分离,从而使所述多个基因座处的所述第一等位基因与所述第二等位基因分离。
附图说明
图1a是示出使用聚合酶(表示为饼形)、与模板结合的等位基因特异性引物和结合在所述模板上与所述等位基因位置相邻的位置处的同源核苷酸的等位基因特异性三元复合物形成的图解表示的示意图。
图1b是示出使用聚合酶(表示为饼形)、等位基因特异性同源核苷酸和结合在与所述等位基因位置相邻的区域处的基因座引物的等位基因特异性三元复合物形成的图解表示的示意图。
图是示出用于使稀有变体等位基因与野生型等位基因分离的方法的图解表示的示意图,所述方法包括通过与同源核苷酸和生物素化的聚合酶形成稳定化的三元复合物来捕获所述稀有等位基因的步骤(1),随后使所述生物素化的聚合酶结合至链霉抗生物素蛋白包被的珠粒以使所述携带等位基因的三元复合物与所述野生型等位基因分离的步骤(2)。
图3是示出用于使稀有变体等位基因与野生型等位基因分离的示例性工作流程的示意图,所述工作流程包括以下步骤:(1)使特异性捕获引物(虚线)与含有由所需的靶标以及脱靶物种(实线)组成的核酸混合物的样品退火;(2)在非催化金属和同源dntp存在下,添加含有共价附接的生物素的聚合酶(饼形);(3)添加固体捕获载体(用链霉抗生物素蛋白包被的实心圆圈的部分圆弧;(4)在非催化金属和dntp存在下在辨别条件下洗涤捕获的三元复合物;以及(5)例如通过添加摩尔过量的mg2+离子或使所述复合物解离来洗脱靶向核酸。
图4是示出使用非标记光学检测方法的结合测定的结果的图,其中引发的模板、聚合酶和核苷酸在镁存在或不存在下一起孵育。
图5是示出盐浓度对在
具体实施方式
本公开提供了用于选择或捕获具有目标靶等位基因的基于聚合酶的方法。所述方法的实施方案利用聚合酶可与引发的模板和下一个正确的核苷酸形成稳定化的三元复合物的特异性。例如,可在聚合酶、靶等位基因和所述等位基因的同源核苷酸之间形成稳定化的三元复合物。所述方法的一个优点是聚合酶特异性允许靶等位基因与其他核酸分离,包括例如与靶等位基因由于单个核苷酸而不同的其他等位基因。例如,可在聚合酶、编码靶单核苷酸多态性(snp)等位基因的引发的模板和snp等位基因的同源核苷酸之间形成三元复合物。与同一基因座处的非靶snp等位基因相比,三元复合物的捕获将导致snp等位基因的选择性捕获,因为当与聚合酶形成三元复合物时,同源核苷酸对靶snp具有选择性。
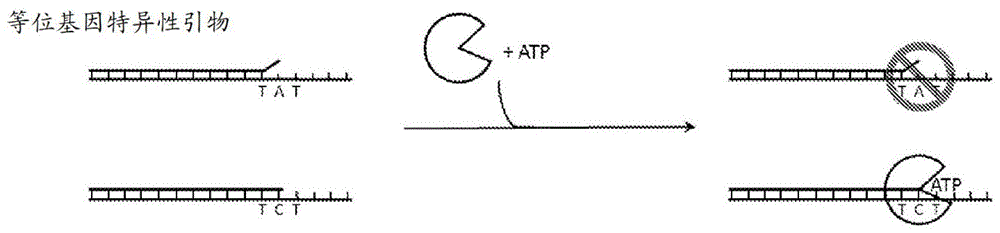
本文阐述的方法和组合物可用于捕获且任选地富集在其序列内含有各种突变的稀有等位基因(例如基于dna或rna的)。所述方法非常适合于从含有相同基因座的野生型dna序列以及其他不相关序列的纯化或半纯化的寡核苷酸池捕获甚至稀有变体等位基因。图1示出可用于形成等位基因特异性三元复合物的两种不同引物-核苷酸组合的图解表示。如图1a所示,可使用等位基因特异性引物,以使得引物的3'端选择性地与特定基因座处的靶等位基因匹配,但与所述基因座处的其他等位基因错配。例如,在单核苷酸多态性(snp)基因座的情况下,所述引物的3'端与位置n处的靶向snp等位基因c碱基配对,但不与位置n处的等位基因a碱基配对。在对于位置n+1添加聚合酶和下一个正确的核苷酸(即图中的atp)后,可在不与错配的非靶等位基因形成稳定化的三元复合物的条件下,针对靶等位基因选择性地形成稳定化的三元复合物。
或者,如图1b所示,可使用基因座引物,所述基因座引物结合至特定基因座的多个等位基因,以使得所述基因座引物的3'端与n-1位置碱基配对。这种构型使目标靶碱基(在位置n处)可用于结合至等位基因特异性同源核苷酸。再次,以snp基因座为例,所述引物与两个等位基因杂交。在添加聚合酶和靶snp的同源核苷酸(即靶snp为c且同源核苷酸为图中的gtp)后,可在不与非靶a等位基因形成稳定化的三元复合物的条件下针对靶等位基因选择性地形成稳定化的三元复合物。
图2示出使用基因座引物和等位基因特异性同源核苷酸、随后捕获三元复合物的等位基因特异性三元复合物形成的图解表示。在三元复合物稳定化条件下,在正确dntp(图中的dctp)存在下生物素化的聚合酶的结合将产生可捕获的三元复合物,对稀有等位基因具有显著偏好。生物素化的三元复合物可捕获在对生物素化的聚合酶具有亲和力的磁性链霉抗生物素蛋白珠粒上。可分离珠粒和流体组分以从包含具有野生型等位基因的核酸的污染物中除去三元复合物。任选地,可在用于捕获稀有变体等位基因的相同dntp存在下洗涤珠粒,以进一步除去污染物。可通过在无聚合酶且无dntp的情况下使三元复合物与mg2+或其他三元复合物去稳定化条件接触来实现具有稀有变体等位基因的核酸的温和洗脱。富集的等位基因然后可用于各种所需的应用,包括例如扩增、合成程序或分析程序,如测序。尽管使用等位基因特异性核苷酸形式(例如,如图1b所示)例示图2,但应理解也可使用等位基因特异性引物形式(例如,如图1a所示)。使用等位基因特异性引物的方法的示例性工作流程在图3中示出。
通常,本文阐述的方法允许分离等位基因。如图2的实施例所证明的,可进行分离以产生靶等位基因的富集。然而,应理解可进行分离以产生靶等位基因的消减。更具体地,可修饰图2中所示的方法以通过在dttp而不是dctp存在下形成生物素化的三元复合物来捕获野生型等位基因。以这种方式消减野生型等位基因可留下更丰富的稀有变体等位基因群体。因此,应当理解,术语“靶等位基因”在本文中可用于指在本文所阐述的方法中靶向三元复合物形成的等位基因,而不依赖于之后使用捕获的等位基因的需要。因此,可捕获靶等位基因以便富集捕获的靶等位基因以供后续使用,或者可替代地,可捕获靶等位基因以便随后丢弃。
应当理解,可使用消减和富集方法的组合来获得特定等位基因。例如,通过对携带稀有变体等位基因的基因组样品进行以下迭代,可使所述等位基因与更突出的野生型等位基因分离。首先,本文阐述的方法可用于从所述基因组样品中消减野生型等位基因(即通过形成靶向所述野生型等位基因的三元复合物且然后从所述样品中除去这种三元复合物),且然后使所述样品经受本文阐述的方法以富集所述稀有变体等位基因(即通过形成靶向所述稀有变体等位基因的三元复合物且然后从所述样品中除去这种三元复合物)。在此实例中,在富集之前进行消减,但是如果需要顺序可颠倒。此外,所述方法可多重复用以并行加工多个等位基因。
除非另有说明,否则本文所用的术语将被理解为具有它们在相关技术中的普通含义。本文所用的若干术语及其含义在以下列出。
如本文所用,术语“等位基因”当关于遗传基因座使用时,是指在遗传基因座处出现的替代核苷酸、序列或其他遗传特征中的任一者。示例性等位基因包括但不限于在基因座处出现的单核苷酸多态性(snp)、插入和/或缺失(插入缺失)、替代mrna剪接位点或重复。
如本文所用,术语“等位基因特异性引物”是指与基因座的一个等位基因互补而不与所述基因座的另一个等位基因互补的寡核苷酸。等位基因特异性引物的一部分可与两个等位基因互补,只要引物中的至少一个核苷酸是所述等位基因中的仅一个的同源物。例如,等位基因特异性引物可具有3'核苷酸,所述3'核苷酸是基因座处的第一等位基因的同源物,但不是所述基因座处的第二等位基因的同源物。应当理解,等位基因特异性引物可具有缺乏与任一等位基因的互补性的部分,例如标签或接头。
如本文所用,术语“阵列”是指与一个或多个固相基底附接、以使得一个特征处的分子可与其他特征处的分子区分开的分子群体。阵列可包括不同的分子,所述分子各自位于固相基底上的不同可寻址特征处。或者,阵列可包括单独的固相基底,所述固相基底各自用作携带不同分子的特征,其中可根据固相基底在所述固相基底所附接至的表面上的位置或根据所述固相基底在诸如流体流的液体中的位置来鉴定不同的探针分子。所述阵列的分子可以是核苷酸、核酸引物、核酸探针、核酸模板或核酸酶,如聚合酶、连接酶或核酸外切酶。
如本文所用,术语“催化金属离子”是指通过聚合酶促进核酸(例如引物)的3'-oh与引入的核苷酸的磷酸酯之间的磷酸二酯键形成的金属离子。“二价催化金属阳离子”是化合价为2的催化金属离子。催化金属离子可以使聚合酶、核苷酸和引发的模板核酸之间的复合物形成稳定的浓度(被称为金属离子的非催化浓度)存在,只要不发生磷酸二酯键形成即可。金属离子的催化浓度是指足以使聚合酶催化核酸(例如引物)的3'-oh基团与引入的核苷酸的磷酸酯基团之间的反应的金属离子的量。
如本文所用,术语“包括”在本文中意图是开放式的,不仅包括所列举的要素,而且还涵盖任何另外的要素。
如本文所用,在关于项目的集合使用时,术语“每个”意图鉴定集合中的个别项目,但不一定是指集合中的每个项目。如果明确的公开或上下文清楚地另外指示,则可出现例外情况。
如本文所用,术语“外源的”当关于分子的部分使用时,是指不存在于分子的天然类似物中的化学部分。例如,核苷酸的外源标记是不存在于天然存在的核苷酸上的标记。类似地,聚合酶上存在的外源标记未在其天然环境中的聚合酶上发现。
如本文所用,术语“延伸”当关于核酸使用时,是指将至少一个核苷酸添加至所述核酸的3'端的过程。通过延伸添加至核酸中的核苷酸被称为并入所述核酸中。因此,术语“并入”可用于指通过磷酸二酯键的形成将核苷酸连接至核酸的3'端的过程。
如本文所用,术语“特征”是指阵列中存在特定分子的位置。特征可仅含有单个分子,或者它可含有相同物种的若干分子的群体。或者,特征可包括为不同物种的分子群体(例如具有不同模板序列的三元复合物的群体)。阵列的特征通常是离散的。离散特征可以是连续的,或者它们可在彼此之间具有空间。可用于本文的阵列可具有例如相隔小于100微米、50微米、10微米、5微米、1微米或0.5微米的特征。可替代地或另外地,阵列可具有相隔大于0.5微米、1微米、5微米、10微米、50微米或100微米的特征。所述特征可各自具有小于1平方毫米、500平方微米、100平方微米、25平方微米、1平方微米或更小的面积。
如本文所用,术语“凝胶材料”意图表示对液体和气体是可渗透的半刚性材料。通常,凝胶材料可在吸收液体时溶胀,并且可在通过干燥除去液体时收缩。示例性凝胶包括但不限于具有胶体结构的那些,如琼脂糖;具有聚合物网状结构的那些,如明胶;或具有交联聚合物结构的那些,如聚丙烯酰胺。有用的凝胶描述于例如美国专利申请公布号2011/0059865a1和美国专利号9,012,022中,所述专利各自以引用的方式并入本文。
术语“基因座”当关于核酸使用时,是指核酸中出现核苷酸、核酸序列或其他遗传特征的位置。
如本文所用,术语“基因座特异性引物”是指与核酸中的第一基因座互补而不与所述核酸中的第二基因座互补的寡核苷酸,其中所述第一基因座的至少两个等位基因与所述寡核苷酸互补。例如,基因座特异性引物可与核酸中两个等位基因的位置附近或邻近的基因座的一部分互补。在后一种构型中,基因座特异性引物可与为等位基因的下一个模板核苷酸相邻的核酸杂交。应当理解,基因座特异性引物可具有缺乏与任一基因座的互补性的部分,例如标签部分或接头。
如本文所用,术语“下一个正确的核苷酸”是指将在引物的3'端结合和/或并入以补充所述引物与其杂交的模板链中的碱基的核苷酸类型。所述模板链中的碱基被称为“下一个模板核苷酸”,并且紧邻与所述引物的3'端杂交的模板中的碱基的5'。下一个正确的核苷酸可被称为下一个模板核苷酸的“同源无”,反之亦然。在三元复合物或双链核酸中彼此相互作用的同源核苷酸据称彼此“配对”。具有与下一个模板碱基不互补的碱基的核苷酸被称为“不正确”、“错配”或“非同源”核苷酸。
如本文所用,术语“非催化金属离子”是指当在聚合酶存在下不促进将核苷酸化学并入引物所需的磷酸二酯键形成的金属离子。非催化金属离子可例如与催化金属离子相比经由竞争性结合与聚合酶相互作用。“二价非催化金属离子”是化合价为2的非催化金属离子。二价非催化金属离子的实例包括但不限于ca2+、zn2+、co2+、ni2+和sr2+。三价eu3+和tb3+离子是化合价为3的非催化金属离子。
如本文所用,术语“聚合酶”可用于指核酸合成酶,包括但不限于dna聚合酶、rna聚合酶、逆转录酶、引发酶和转移酶。通常,聚合酶包含一个或多个活性位点,在所述一个或多个活性位点处可发生核苷酸结合和/或核苷酸聚合的催化。聚合酶可催化核苷酸聚合至双链核酸分子的第一链的3'端。例如,聚合酶经由磷酸二酯键催化下一个正确的核苷酸添加至双链核酸分子的第一链的3'oh基团,从而将所述核苷酸共价并入至所述双链核酸的第一链。任选地,聚合酶不需要能够在本文阐述的方法中使用的一种或多种条件下进行核苷酸并入。例如,突变型聚合酶可能能够形成三元复合物,但不能催化核苷酸并入。
如本文所用,术语“固体载体”是指不溶于水性液体中的刚性基底。所述基底可以是无孔的或多孔的。所述基底可任选地能够吸收液体(例如由于孔隙率),但通常将具有足够的刚性,以使得所述基底在吸收所述液体时基本上不会溶胀,并且在通过干燥除去所述液体时基本上不会收缩。无孔固体载体通常对液体或气体是不可渗透的。示例性固体载体包括但不限于玻璃和改性的或功能化的玻璃、塑料(包括丙烯酸类、聚苯乙烯以及苯乙烯与其他材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、teflontm、环烯烃、聚酰亚胺等)、尼龙、陶瓷、树脂、zeonor、二氧化硅或基于二氧化硅的材料(包括硅和改性硅)、碳、金属、无机玻璃、光纤束以及聚合物。
如本文所用,术语“三元复合物”是指聚合酶、双链核酸和核苷酸之间的分子间缔合。通常,聚合酶促进下一个正确的核苷酸与引发的核酸的模板链之间的相互作用。下一个正确的核苷酸可经由沃森-克里克(watson-crick)氢键合与模板链相互作用。术语“稳定化的三元复合物”是指具有促进的或延长的存在的三元复合物或已抑制其破坏的三元复合物。通常,三元复合物的稳定化防止三元复合物的核苷酸组分并入所述三元复合物的引发的核酸组分中。
根据以上定义可理解以下列出并且在权利要求书中阐述的实施方案。
本公开提供了一种用于从核酸混合物中分离靶等位基因的方法。所述方法可包括以下步骤:(a)提供与附接至固体载体的稳定化的三元复合物流体接触的核酸混合物,其中所述稳定化的三元复合物包含聚合酶、引发的核酸模板和下一个正确的核苷酸,其中所述模板具有靶等位基因,其中所述下一个正确的核苷酸是所述靶等位基因的同源核苷酸,并且其中所述稳定化的三元复合物经由所述聚合酶与所述固体载体之间的键联或经由所述核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所述核酸混合物分离,从而从所述核酸混合物中分离所述靶等位基因。
还提供了一种用于使基因座的第一等位基因与所述基因座处的第二等位基因分离的方法。所述方法可包括以下步骤:(a)提供与附接至固体载体的稳定化的三元复合物流体接触的包含所述第二等位基因的混合物,其中所述稳定化的三元复合物包含聚合酶、与核酸模板杂交的引物和下一个正确的核苷酸,其中所述模板具有所述第一等位基因,其中所述下一个正确的核苷酸是所述第一等位基因的同源核苷酸,或者所述引物的3'端具有所述第一等位基因的同源核苷酸,并且其中所述稳定化的三元复合物经由所述聚合酶与所述固体载体之间的键联或经由所述下一个正确的核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所述核酸混合物分离,从而使所述第一等位基因与所述第二等位基因分离。
本文描述了用于捕获具有目标靶序列(如靶等位基因)的核酸的基于聚合酶的方法。所述方法的实施方案利用聚合酶可与靶等位基因和所述等位基因的同源核苷酸形成稳定化的三元复合物的特异性。所述稳定化的三元复合物可包括所述聚合酶、具有所述靶等位基因的引发的核酸模板和所述靶等位基因的同源核苷酸。所述同源核苷酸不与所述稳定化的三元复合物中的引物共价附接,而是通过非共价相互作用与所述复合物结合。在特定实施方案中,所述同源核苷酸与所述稳定化的三元复合物非共价结合,仅经由非共价相互作用与所述复合物的其他成员相互作用。用于形成三元复合物的有用方法和组合物在下文以及在共同拥有的美国序列号14/805,381(现在公布为美国公布号2017/0022553a1)和62/375,379(其在美国序列号15/677,870中以引用的方式并入)中进一步详细阐述,所述专利各自以引用的方式并入本文。
虽然在不存在某些催化金属离子(例如,mg2+)的情况下,可在聚合酶、引发的模板核酸和下一个正确的核苷酸之间形成三元复合物,但在不存在催化金属离子的情况下,核苷酸的化学添加受到抑制。低或不足的催化金属离子水平导致稳定化的三元复合物中下一个正确的核苷酸的非共价(物理)敖合。本文公开的其他方法也可用于产生稳定化的三元复合物。
任选地,当引发的模板核酸的引物包括阻止将引入的核苷酸酶并入所述引物中的封闭基团时,可形成稳定化的三元复合物。相互作用可在稳定剂存在下进行,由此聚合酶-核酸相互作用在下一个正确的核苷酸存在下稳定(即使三元复合物稳定的稳定剂)。引发的模板核酸的引物任选地可以是可延伸的引物,或在其3'端被阻断延伸的引物(例如,通过可逆终止子部分的存在)。当同源核苷酸的碱基与引发的模板核酸的下一碱基互补时,所述引发的模板核酸、聚合酶和所述同源核苷酸能够形成三元复合物。
如上所述,有利于三元复合物或使三元复合物稳定的条件可通过封闭基团(所述封闭基团阻止将引入的核苷酸酶促并入引物中(例如所述引物的3'核苷酸上的可逆终止子部分))的存在或催化金属离子的不存在来提供。其他有用的条件包括存在三元复合物稳定剂,如抑制核苷酸并入或聚合的非催化离子(例如二价或三价非催化金属离子)。可用作特定聚合酶的非催化金属离子的金属离子包括但不限于钙、锶、钪、钛、钒、铬、铁、钴、镍、铜、锌、镓、锗、砷、硒、铑、铕和铽离子。任选地,通过一种或多种单价阳离子和/或谷氨酸阴离子的存在来提供不利于二元复合物或使二元复合物(即聚合酶与引发的核酸之间的复合物,但缺乏同源核苷酸)不稳定的条件。作为进一步的选择,可使用工程化为具有降低的催化活性或降低的二元复合物形成的倾向的聚合酶。另一种选择是使用不可并入或不可水解的核苷酸,所述核苷酸可形成辨别性三元复合物但不能并入引物链中。
如上所述,三元复合物稳定化条件可强调在不同核苷酸存在下聚合酶对引发的模板核酸的亲和力差异,例如通过使二元复合物不稳定。任选地,所述条件在不同核苷酸存在下引起聚合酶对引发的模板核酸的差异亲和力。举例来说,所述条件包括但不限于高盐和谷氨酸离子。例如,盐可溶解在水溶液中以产生一价阳离子,如一价金属阳离子(例如,钠离子或钾离子)。任选地,提供一价阳离子(例如,一价金属阳离子)的盐进一步提供谷氨酸阴离子。任选地,谷氨酸离子的来源可以是谷氨酸钾。在一些情况下,可用于改变引发的模板核酸的聚合酶亲和力的谷氨酸钾的浓度从10mm至1.6m的谷氨酸钾或10mm与1.6m之间的任何量延伸。如上所述,高盐是指50至1,500mm盐的盐浓度。
应当理解,本文阐述的用于使三元复合物稳定的选择不需要相互排斥,而是可以各种组合使用。例如,三元复合物可通过一种方式或多种方式的组合来稳定,所述方式包括但不限于聚合酶结构域的交联、聚合酶与核酸的交联、使三元复合物稳定的聚合酶突变、通过小分子的变构抑制、非竞争性抑制剂、竞争性抑制剂、非竞争性抑制剂和本文阐述的其他方式。
根据本公开制备或使用的三元复合物可任选地包含一种或多种外源标记。所述标记可存在于聚合酶、模板核酸、引物和/或同源核苷酸上。在本文阐述的一种或多种操作过程中,外源标记可用于检测三元复合物或其单独组分。示例性标记、用于附接标记的方法和使用标记的组分的方法在共同拥有的美国序列号14/805,381(现在公布为美国公布号2017/0022553)和62/375,379(其在美国序列号15/677,870中以引用的方式并入)中阐述,所述专利各自以引用的方式并入本文。
在替代实施方案中,三元复合物可缺乏外源标记。例如,三元复合物和用于形成三元复合物的组分(例如聚合酶、模板核酸、引物和/或同源核苷酸)可缺乏以上并入的参考文献中描述的一种、几种或所有外源标记。
可用本文阐述的方法中的各种核酸模板序列中的任一种形成三元复合物。所述方法特别适用于选择性地捕获遗传基因座处的一个等位基因以使其与所述基因座处的一个或多个其他等位基因分离。因此,在本文阐述的方法中使用的核酸模板的混合物可包含特定基因座处的第一和第二等位基因,所述等位基因中的一者被选择性地捕获。所述混合物可包含多种其他核酸,例如来自一种或多种生物体的基因组或外显子组的一些或全部序列内容物。
本文阐述的方法对于选择性地捕获次要等位基因可以是特别有用的。次要等位基因可以是在双等位基因基因座处出现的一对中的一个、在三等位基因基因座处的三个等位基因中的一个或在四等位基因基因座处的四个等位基因中的一个。本文捕获的等位基因的次要等位基因频率可以是至多40%、25%、10%、5%、0.5%或更低。所述方法还可用于捕获具有更高频率的等位基因,包括例如主要等位基因。可捕获的示例性等位基因包括但不限于单核苷酸多态性(snp)、插入-缺失(indel)多态性和选择性剪接多态性。
尽管本公开的方法特别适合于选择性地捕获多等位基因基因座处的等位基因,但是也可捕获其他序列。因此,针对等位基因所例示的方法和组合物可扩展至其他序列和其他模板。例如,所述方法可用于捕获非多态性序列。在此类情况下,下一个正确的核苷酸和引物不需要与模板中的特定等位基因相关。在其他实施方案中,所述方法可用于选择性地捕获与其野生型序列相比的突变序列,反之亦然。例如,当操作或评价用于蛋白质工程化或合成生物学的试剂或蛋白质工程化或合成生物学的产物时,这可能是有用的。
在本文的方法或组合物中使用的核酸模板可以是dna,如基因组dna、合成dna、扩增的dna、互补dna(cdna)等。也可使用rna,如mrna、核糖体rna、trna等。核酸类似物也可用作本文的模板。因此,本文使用的核酸混合物可源自生物来源、合成来源或扩增产物。本文使用的引物可以是dna、rna或其类似物。
核酸可来源于的示例性生物体包括例如来自以下的那些:哺乳动物,如啮齿类动物、小鼠、大鼠、兔、豚鼠、有蹄类动物、马、绵羊、猪、山羊、牛、猫、狗、灵长类动物、人或非人灵长类动物;植物,如拟南芥、玉米、高粱、燕麦、小麦、大米、油菜或大豆;藻类,如莱茵衣藻;线虫,如秀丽隐杆线虫;昆虫,如黑尾果蝇、蚊、果蝇、蜜蜂或蜘蛛;鱼,如斑马鱼;爬行动物;两栖动物,如蛙或非洲蟾蜍;盘基网柄菌;真菌,如卡氏肺孢子虫、红鳍东方鲀、酵母、酿酒酵母或粟酒裂殖酵母;或恶性疟原虫。核酸也可来源于原核生物,如细菌、大肠杆菌、葡萄球菌或肺炎支原体;古细菌;病毒,如丙型肝炎病毒或人类免疫缺陷病毒;或类病毒。核酸可来源于上述生物体的同质培养物或群体,或者可替代地来自若干不同生物体的集合,例如,在群落或生态系统中。可使用本领域中已知的方法分离核酸,包括例如sambrook等人,molecularcloning:alaboratorymanual,第3版,coldspringharborlaboratory,newyork(2001)或ausubel等人,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md.(1998)中描述的那些方法,所述文献各自以引用的方式并入本文。
本文阐述的方法的具体实施方案可使用天然核苷酸、核苷酸类似物或修饰的核苷酸。此类核苷酸可用于例如形成稳定化的三元复合物。任选地,核苷酸类似物包含含氮碱基、五碳糖和磷酸基团;其中可修饰、除去和/或替代核苷酸的任何部分。核苷酸类似物可以是不可并入的核苷酸。此类不能并入的核苷酸包括例如单磷酸和二磷酸核苷酸。在另一个实例中,核苷酸可含有对三磷酸基团的修饰,所述修饰使得核苷酸不可并入。不可并入的核苷酸的实例可在美国专利号7,482,120中找到,所述专利以引用的方式并入本文。随后可修饰不可并入的核苷酸以变得可并入。核苷酸类似物包括但不限于α-磷酸修饰的核苷酸、α-β核苷酸类似物、β-磷酸修饰的核苷酸、β-γ核苷酸类似物、γ-磷酸修饰的核苷酸、笼状(caged)核苷酸或ddntp。核苷酸类似物的实例描述于美国专利号8,071,755中,所述专利以引用的方式并入本文。
核苷酸类似物可包括终止子,所述终止子在已经并入类似物后可逆地防止在引物的3'端处的核苷酸并入。例如,u.s.7,544,794和u.s.8,034,923(这些专利的公开内容以引用的方式并入本文)描述了可逆终止子,其中3'-oh基团被3'-onh2部分替代。另一种类型的可逆终止子与核苷酸的含氮碱基连接,如例如u.s.8,808,989(其公开内容以引用的方式并入本文)中所阐述。类似地可与本文所述的方法结合使用的其他可逆终止子包括在u.s.7,956,171、u.s.8,071,755和u.s.9,399,798中描述的那些(这些美国专利的公开内容以引用的方式并入本文)。在某些实施方案中,可从引物除去可逆的封闭部分,从而允许核苷酸并入。用于解封闭的组合物和方法在以上参考文献中阐述。
或者,核苷酸类似物不可逆地防止在它们已经并入的引物的3'端处的核苷酸并入。不可逆的核苷酸类似物包括2',3'-双脱氧核苷酸、ddntp(ddgtp、ddatp、ddttp、ddctp)。双脱氧核苷酸缺乏dntp的3'-oh基团,所述3'-oh基团对于聚合酶介导的引物延伸是必需的。
任选地,在形成稳定化的三元复合物期间,核苷酸(例如天然核苷酸或核苷酸类似物)存在于混合物中。例如,可存在至少1、2、3、4或更多种核苷酸类型。或者或另外,可存在至多4、3、2或1种核苷酸类型。类似地,所存在的一种或多种核苷酸类型可与模板核酸中的至少1、2、3或4种核苷酸类型互补。或者或另外,所存在的一种或多种核苷酸类型可与模板核酸中的至多4、3、2或1种核苷酸类型互补。
任选地,核苷酸类似物与聚合酶融合。任选地,多种核苷酸类似物包含与多种聚合酶的融合物,其中每种核苷酸类似物包含不同的聚合酶。
在三元复合物中使聚合酶稳定的任何核苷酸修饰可用于本文公开的方法中。核苷酸可永久地或瞬时地结合。任选地,存在于稳定化的三元复合物中的核苷酸不是使三元复合物稳定的手段。因此,任何各种其他三元复合物稳定化方法可在利用核苷酸类似物的反应中组合。
在特定实施方案中,经历本文阐述的方法的一个或多个步骤的引发的模板核酸分子的引物链在化学上不被聚合酶改变。也就是说,引物既不通过形成新的磷酸二酯键而延伸,也不会在检查步骤中通过溶核降解而缩短以鉴定下一个正确的核苷酸。
可用于实施本公开的方法的聚合酶包括天然存在的聚合酶及其修饰的变型,包括但不限于突变体、重组体、融合体、遗传修饰、化学修饰、合成物和类似物。天然存在的聚合酶及其修饰的变型不限于保留催化聚合反应的能力的聚合酶。任选地,天然存在的和/或其修饰的变型保留催化聚合反应的能力。任选地,天然存在的和/或修饰的变型具有特殊性质,例如,与核酸的结合亲和力增强、与核酸的结合亲和力降低、与核苷酸的结合亲和力增强、与核苷酸的结合亲和力降低、对下一个正确的核苷酸的特异性增强、对下一个正确的核苷酸的特异性降低、催化速率增强、催化速率降低、催化无活性等。突变型聚合酶包括其中一个或多个氨基酸被其他氨基酸以及一个或多个氨基酸的插入或缺失替代的聚合酶。
修饰的聚合酶包括含有外源亲和力部分(例如,外源配体或受体)的聚合酶,所述外源亲和力部分可用于捕获或操作聚合酶。任选地,在使用蛋白质分离技术至少部分地纯化聚合酶后,可附接亲和力部分。例如,可使用聚合酶的游离巯基或游离胺部分将外源亲和力部分化学连接至聚合酶。这可涉及通过半胱氨酸残基的侧链或通过n-末端的游离氨基与聚合酶的化学键联。外源亲和力部分也可经由蛋白质融合与聚合酶附接。可经由蛋白质融合附接的示例性亲和力部分包括例如,聚组氨酸、抗体片段、特定抗体的表位、链霉抗生物素蛋白和用于纯化重组蛋白的亲和标签(例如来自thermofisher,waltham,ma或promega,madisonwi的可商购的亲和标签)。
有用的dna聚合酶包括但不限于细菌dna聚合酶、真核dna聚合酶、古细菌dna聚合酶、病毒dna聚合酶和噬菌体dna聚合酶。细菌dna聚合酶包括大肠杆菌dna聚合酶i、ii和iii、iv以及v、大肠杆菌dna聚合酶的klenow片段、粪堆梭菌(clostridiumstercorarium)(cst)dna聚合酶、热纤维梭菌(clostridiumthermocellum)(cth)dna聚合酶和硫磺矿硫化叶菌(sulfolobussolfataricus)(sso)dna聚合酶。真核dna聚合酶包括dna聚合酶α、β、γ、δ、€、η、ζ、λ、σ、μ和κ,以及rev1聚合酶(末端脱氧胞苷基转移酶)和末端脱氧核苷酸基转移酶(tdt)。病毒dna聚合酶包括t4dna聚合酶、phi-29dna聚合酶、ga-1、phi-29样dna聚合酶、pzadna聚合酶、phi-15dna聚合酶、cp1dna聚合酶、cp7dna聚合酶、t7dna聚合酶和t4聚合酶。其他有用的dna聚合酶包括热稳定和/或嗜热dna聚合酶,如栖热水生菌(thermusaquaticus)(taq)dna聚合酶、丝状栖热菌(thermusfiliformis)(tfi)dna聚合酶、速生热球菌(thermococcuszilligi)(tzi)dna聚合酶、嗜热栖热菌(thermusthermophilus)(tth)dna聚合酶、黄色栖热菌(thermusflavusu)(tfl)dna聚合酶、沃氏火球菌(pyrococcuswoesei)(pwo)dna聚合酶、强烈火球菌(pyrococcusfuriosus)(pfu)dna聚合酶和turbopfudna聚合酶、海滨嗜热球菌(thermococcuslitoralis)(tli)dna聚合酶、火球菌属gb-d聚合酶、海栖热袍菌(thermotogamaritima)(tma)dna聚合酶、嗜热脂肪芽孢杆菌(bacillusstearothermophilus)(bst)dna聚合酶、柯达克氏火球菌(pyrococcuskodakaraensis)(kod)dna聚合酶、pfxdna聚合酶、热球菌属jdf-3(jdf-3)dna聚合酶、高氏热球菌(thermococcusgorgonarius)(tgo)dna聚合酶、嗜酸热球菌(thermococcusacidophilium)dna聚合酶;嗜酸热硫化叶菌(sulfolobusacidocaldarius)dna聚合酶;热球菌属gon-7dna聚合酶;隐蔽热网菌(pyrodictiumoccultum)dna聚合酶;沃氏甲烷球菌(methanococcusvoltae)dna聚合酶;嗜热自养甲烷球菌(methanococcusthermoautotrophicum)dna聚合酶;詹氏甲烷球菌(methanococcusjannaschii)dna聚合酶;除硫球菌属(desulfurococcus)菌株tokdna聚合酶(d.tokpol);深海火球菌(pyrococcusabyssi)dna聚合酶;掘越氏火球菌(pyrococcushorikoshii)dna聚合酶;海岛火球菌(pyrococcusislandicum)dna聚合酶;烟生热球菌(thermococcusfumicolans)dna聚合酶;敏捷气热菌(aeropyrumpernix)dna聚合酶;以及异二聚体dna聚合酶dp1/dp2。工程化的和修饰的聚合酶也可与所公开的技术结合使用。例如,可使用极端嗜热海洋古细菌热球菌属9°n的修饰的型式(例如,来自newenglandbiolabsinc.;ipswich,ma的therminatordna聚合酶)。其他有用的dna聚合酶(包括3pdx聚合酶)公开于u.s.8,703,461中,其公开内容以引用的方式并入本文。
有用的rna聚合酶包括但不限于病毒rna聚合酶,如t7rna聚合酶、t3聚合酶、sp6聚合酶和kll聚合酶;真核rna聚合酶,如rna聚合酶i、rna聚合酶ii、rna聚合酶iii、rna聚合酶iv和rna聚合酶v;以及古细菌rna聚合酶。
有用的逆转录酶包括但不限于来自人类免疫缺陷病毒1型(pdb1hmv)的hiv-1逆转录酶、来自人类免疫缺陷病毒2型的hiv-2逆转录酶、来自莫洛尼鼠白血病病毒的m-mlv逆转录酶、来自禽成髓细胞瘤病毒的amv逆转录酶以及维持真核染色体的端粒的端粒酶逆转录酶。
具有内在3'-5'校正核酸外切酶活性的聚合酶可用于一些实施方案。基本上缺乏3'-5'校正核酸外切酶活性的聚合酶在一些实施方案中也是有用的,例如,在大多数测序实施方案中。核酸外切酶活性的不存在可以是野生型特征或由变体或工程化的聚合酶结构赋予的特征。例如,exominusklenow片段是缺乏3'-5'校正核酸外切酶活性的klenow片段的突变型式。klenow片段及其exominus变体可用于本文阐述的方法或组合物中。
稳定化的三元复合物可附接至固体载体。固体载体可由本文阐述的各种材料中的任一种制成,例如以上在定义中或下文中。合适的材料可包括玻璃、聚合物材料、硅、石英(熔融石英)、硼浮法玻璃、二氧化硅、基于二氧化硅的材料、碳、金属、光纤或光纤束、蓝宝石或塑料材料。可基于特定用途所需的性质来选择特定材料。例如,对所需波长的辐射透明的材料可用于将利用所述波长的辐射的分析技术。相反,可能希望选择不通过特定波长的辐射(例如,不透明、吸收或反射)的材料。可利用的材料的其他性质是对下游工艺中使用的某些试剂(如本文阐述的那些)的惰性或反应性;或易于操作或低制造成本。
特别有用的固体载体是颗粒,如珠粒或微球体,如下文所例示。珠粒群体可用于附接稳定化的三元复合物群体。在一些实施方案中,可能有用的是使用其中每个珠粒具有单一类型的稳定化的三元复合物(例如每个珠粒一个等位基因类型)的构型。或者,不需要在逐个珠粒的基础上分离不同的稳定化的三元复合物。因此,珠粒可携带多种不同类型的稳定化的三元复合物(例如每个珠粒多种类型的等位基因)。珠粒的组成可根据例如待使用的形式、化学和/或附接方法而变化。示例性珠粒组合物包括用于蛋白质和核酸捕获方法中的固体载体和赋予其的化学官能团。此类组合物包括,例如,塑料、陶瓷、玻璃、聚苯乙烯、三聚氰胺、甲基苯乙烯、丙烯酸聚合物、顺磁性材料、氧化钍溶胶、石墨碳、二氧化钛、胶乳或交联葡聚糖如sepharosetm、纤维素、尼龙、交联胶束和teflontm、以及来自bangslaboratories,fishersind.的“microspheredetectionguide”中所阐述的其他材料,所述文献以引用的方式并入本文。
颗粒、珠粒或微球体的几何形状也可对应于各种不同的形式和形状。例如,它们可以是对称形状的(例如球形或圆柱形)或不规则形状的(例如可控孔度玻璃)。另外,珠粒可以是例如多孔的,因此增加可用于捕获三元复合物或其组分的表面积。本文使用的珠粒的示例性尺寸可在纳米至毫米或约10nm-1mm的范围内。
在特定实施方案中,珠粒可排列或以其他方式在空间上区分。可使用的示例性的基于珠粒的阵列包括但不限于其中珠粒与固体载体缔合的那些,如在美国专利号6,355,431b1、美国公布号2002/0102578或pct公布号wo00/63437中描述的那些,所述专利各自以引用的方式并入本文。珠粒可位于固相载体上的离散位置,如孔,其中每个位置容纳单个珠粒。或者,珠粒所在的离散位置可各自包括多个珠粒,如例如在美国公布号2004/0263923、2004/0233485、2004/0132205或2004/0125424中所描述,所述公布各自以引用的方式并入本文。
另一种有用的固体载体是特征的阵列。阵列特别适用于多重应用,其中制备并使用多种不同的三元配合物。用于制备和使用阵列的组合物和技术在下文进一步详细地阐述。阵列上的特征可用于附接稳定化的三元复合物群体。在一些实施方案中,可能有用的是使用其中每个特征具有单一类型的稳定化的三元复合物(例如每个特征一个等位基因类型)的构型。或者,不需要在逐个特征的基础上分离不同的稳定化的三元复合物。因此,特征可携带多种不同类型的稳定化的三元复合物(例如每个特征多种类型的等位基因)。
可使用本领域熟知的各种方法中的任一种将稳定化的三元复合物或用于制备这种复合物的组分附接至固体载体。此类方法包括例如通过直接化学合成附接至固体载体、化学附接、光化学附接、热附接、酶促附接和/或吸收。这些和其他方法是本领域熟知的,并且适用于以各种形式和构型中的任一种附接蛋白质、核苷酸或核酸。与固体载体的附接可经由共价键联或经由非共价相互作用发生。示例性的非共价相互作用是配体-受体对如链霉抗生物素蛋白(或其类似物)与生物素(或其类似物)之间或抗体(或其功能片段,如fab或scfv)与表位之间的相互作用。其他有用的受体-配体对包括凝集素和碳水化合物,以及核酸的互补的第一链和第二链。
参与形成三元复合物的聚合酶、核苷酸、引物或模板可在形成稳定化的三元复合物之前或之后附接至固体载体。其中三元复合物在溶液中形成并随后附接至固体载体的示例性实施方案示于图2中。如图中所例示,聚合酶可包含配体部分(例如生物素),所述配体部分在形成稳定化的三元复合物后与固相受体(例如链霉抗生物素蛋白)结合。或者,有可能在形成稳定化的三元复合物之前使聚合酶的配体部分与固相受体结合(例如通过使生物素化的聚合酶与链霉抗生物素蛋白珠粒结合)。因此,可在固体载体上形成稳定化的三元复合物。
尽管以上针对经由聚合酶附接例示了固相附接和三元复合物形成顺序的可变性,但是应当理解,当三元复合物的其他组分具有附接部分时,可发生步骤顺序的类似可变性。使用除受体-配体相互作用以外的键联,可发生步骤顺序的类似可变性。例如,可使用温和的化学条件,所述条件允许化学附接部分在形成三元复合物之前或之后与固体载体共价键合。示例性化学条件和键联包括常规用于修饰活性蛋白质和酶的那些,如可从thermofisher(waltham,ma)、sigmaaldrich(st.louis,mo.)或promega(madisonwi)商购的那些。
其他有用的化学条件和键联是称为“点击化学”的那些(例如美国专利号6,737,236和美国专利号7,427,678,所述专利各自以引用的方式整体并入本文)。还有用的是叠氮化物炔烃胡伊斯根(huisgen)环加成反应,其使用铜催化剂(例如美国专利号7,375,234和美国专利号7,763,736,所述专利各自以引用的方式整体并入本文)。可采用使用应变炔烃的无铜胡伊斯根反应(“无金属点击”)。其他有用的键联化学包括但不限于可与醛部分连接的三嗪-肼部分,例如,如美国专利号7,259,258中所描述,所述专利以引用的方式并入本文;可与胺部分连接的三嗪氯化物部分;可使用偶联剂如edc与胺部分连接的羧酸部分;可与硫醇部分连接的硫醇部分;可与通过狄尔斯-阿尔德(diels-alder)反应偶联的二烯烃部分连接的烯烃部分;以及可连接硫代磷酸酯部分的乙酰溴部分,如pct公布号wo2005/065814中描述的那些,所述专利以引用的方式并入本文。玻璃状表面也可用各种玻璃反应性分子(如官能化硅烷)改性,其中一些可通过gelest,inc商购获得。
因此,用于从核酸混合物中分离靶等位基因的方法可包括以下步骤:(a)(i)提供包含引发的模板核酸的核酸混合物并使所述混合物与聚合酶和下一个正确的核苷酸接触,其中所述模板具有靶等位基因,其中所述下一个正确的核苷酸是所述靶等位基因的同源核苷酸,以及(ii)形成稳定化的三元复合物,其中所述稳定化的三元复合物包含所述聚合酶、引发的核酸模板和下一个正确的核苷酸,并且其中所述稳定化的三元复合物经由所述聚合酶与固体载体之间的键联而附接至所述固体载体,或者其中所述稳定化的三元复合物经由所述下一个正确的核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所以核酸混合物分离,从而从所述核酸混合物中分离所述靶等位基因。
任选地,将所述聚合酶或下一个正确的核苷酸附接至固体载体,之后在步骤(a)(ii)中在固体载体上形成稳定化的三元复合物。因此,在所述固体载体上形成稳定化的三元复合物。在替代选择中,在步骤(a)(ii)期间或之后形成稳定化的三元复合物后,将所述聚合酶或下一个正确的核苷酸附接至固体载体。因此,在溶液中形成三元复合物,之后将所述三元复合物附接至固体载体。后一种选择在图2中举例说明。
本公开的方法可包括使固体载体与核酸混合物分离的步骤,稳定化的三元复合物附接至所述固体载体。因此,可从混合物中分离等位基因,所述等位基因在所述混合物中、且随后附接至三元复合物。可使用适合于固体载体的方法进行分离。例如,当使用磁性载体时,例如如图2所示,可使用磁体来吸引载体以便分离(例如,磁体可用于从含有混合物的容器中除去载体,或者磁体可用于将固体载体保留在容器中,从所述中除去所述混合物)。类似地,珠粒或其他颗粒可基于比混合物更致密的材料上的其他吸引力如重力(例如沉降或离心)、带电材料的电吸引力、介电颗粒的光学吸引力或所述颗粒与其他表面的亲和吸引力(例如经由受体-配体相互作用而与所述混合物分离)。
固体载体结合的三元复合物与流体混合物的分离也可通过流体远离固体载体表面的流体流来实现。例如,稳定化的三元复合物可附接至容器的表面,如流动池或阵列表面,并且所述流体混合物可经由重力(例如倾倒)、泵送作用(例如正压或负压)、毛细管作用、电泳、数字流体(其中通过电润湿或其他力移动微滴)(参见,例如,美国公布号2007/0242105;us2011/0303542或2008/0283414)等通过与所述表面接触而去除。
在特定实施方案中,稳定化的三元复合物附接至流动池表面或流动池中的固体载体。流动池通过使溶液进出与载体结合的三元复合物接触的流体室而允许方便的流体操作。可使用的示例性流动池描述于,例如美国公布号2010/0111768a1、wo05/065814和美国公布号2012/0270305中,所述专利各自以引用的方式并入本文。
任选地,所提供的方法还包括洗涤步骤。所述洗涤步骤可在所述方法中的任何其他步骤之前或之后进行。例如,本文阐述的方法可任选地包括洗涤与稳定化的三元复合物附接的固体载体的步骤。洗涤可提供除去污染物(如稳定化的三元复合物的一种或多种组分所来源于的混合物的组分)的优点。在特定实施方案中,洗涤步骤在使三元复合物稳定的条件下进行。例如,可在洗涤步骤过程中采用本文其他地方所阐述的一种或多种稳定条件或稳定剂。任选地,洗涤溶液包含与在形成稳定化的三元复合物过程中使用的下一个正确的核苷酸相同类型的核苷酸。包含足够浓度的下一个正确的核苷酸可提供使先前形成的三元复合物稳定免于不希望的解离的优点。这进而防止由于洗去先前形成的三元复合物所致的靶等位基因的不想要的损失。任选地,三元复合物具有半衰期,并且进行洗涤步骤持续短于三元复合物的半衰期的持续时间。
本公开的方法还可包括将靶等位基因从固体载体解离的步骤。例如,在从形成所述复合物的混合物除去固体载体结合的稳定化的三元复合物后,可发生解离。任选地,可在不将下一个正确的核苷酸共价添加至引物的3'端的情况下进行解离。这可通过保持三元复合物稳定化直至引物不再存在于所述三元复合物中来实现。释放未修饰的引物的优点是引物可重复用于捕获相同类型的等位基因。例如,引物可以迭代方法使用以重新捕获如下文进一步详细阐述的相同等位基因。引物也可与新的核酸混合物一起使用,以捕获具有相同类型等位基因的新模板核酸。
示例性的解离技术包括但不限于聚合酶的变性,不同核酸与聚合酶的竞争性结合以引起靶等位基因的释放,三元复合物在没有下一个正确的核苷酸的溶液中、在没有引发的模板的溶液中或在下一个正确的核苷酸或引发的模板的浓度基本上分别低于用于下一个正确的核苷酸或引发的模板的聚合酶的解离常数(kd)的溶液中的孵育。在一些实施方案中,三元复合物可与不同于下一个正确的核苷酸的核苷酸(例如,与靶等位基因不同的等位基因的同源核苷酸)一起孵育。这种解离方法提供了相对温和和特异以使得选择所需等位基因的解离而不是可能作为污染物存在的其他等位基因的优点。
或者,可通过使引物延伸以并入下一个正确的核苷酸来进行将靶等位基因从固体载体解离的步骤。所并入的核苷酸可以是在稳定化的三元复合物中当其在混合物中形成和/或当所述复合物从所述混合物中分离时存在的核苷酸分子。或者,不同的核苷酸分子可进入三元复合物且然后并入引物中。因此,并入步骤可涉及替换来自先前步骤核苷酸并将另一核苷酸并入引物的3'端。并入步骤可涉及从三元复合物内释放核苷酸,并将不同种类的核苷酸并入引物的3'端。
任选地,所并入的核苷酸可具有外源标记。使用标记的优点是通过检测引物上的标记来确认下一个正确的核苷酸的身份的能力。或者,所并入的核苷酸将缺乏检测到的外源标记。
因此,本文所述的方法任选地包括并入步骤。并入步骤涉及在与模板核酸杂交的引物的3'端共价并入一个或多个核苷酸。在一些实施方案中,在引物的3'端仅并入单个核苷酸。例如,可修饰核苷酸的3'位置以包括3'终止子部分。3'终止子部分可以是可逆终止子或者可以是不可逆终止子。任选地,可逆终止子核苷酸包括附接在糖部分的3'位置处的3'-onh2部分。有用的可逆终止子部分的其他实例描述于例如bentley等人,nature456:53-59(2008);wo04/018497;美国专利号7,057,026;wo91/06678;wo07/123744;美国专利号7,329,492;美国专利号7,211,414;美国专利号7,315,019;美国专利号7,405,281和us2008/0108082中,其各自以引用的方式并入本文。任选地,在引物的3'端并入多个核苷酸。例如,所并入的核苷酸可包含在并入后能够进一步延伸的3'-羟基。在一些实施方案中,并入步骤是测序技术、扩增技术或使用三元复合物进行的其他技术的一部分,已经使用本文阐述的方法捕获了所述三元复合物。
并入的核苷酸或者可以是未标记的核苷酸或可检测标记的核苷酸类似物。无论是否标记,所述核苷酸可以是一旦并入引物中就被永久地或可逆地阻止延伸的终止子核苷酸。在核苷酸并入后,聚合酶可从引发的模板中解离。用于将核苷酸并入三元复合物的引发的模板中的示例性试剂和条件在共同拥有的美国专利申请序列号14/805,381(现在公布为美国公布号2017/0022553)和62/375,379(其在美国序列号15/677,870中以引用的方式并入)中阐述,所述专利各自以引用的方式并入本文。
可使用其中重复本文阐述的方法的步骤的迭代方法来捕获靶等位基因或其他靶序列。本文阐述的方法非常适合于迭代,因为在用于捕获靶序列后不需要消耗或修饰核酸引物。这与其中使引物延伸以并入亲和力标记的核苷酸的其他核酸捕获方法形成对比。一旦以这种方式修饰了引物,它就已经耗费并且必须更换或化学回复以用于引物延伸步骤的重复中。
本公开提供的迭代方法的优点在于每次迭代可进一步纯化所述靶序列,从而允许核酸与其他生物材料,包括具有相似序列的其他核酸(例如在与靶等位基因同一基因座处的其他等位基因)分离。可重复使用试剂,从而为消耗引物和其他试剂的其他方法提供成本和时间有效的替代方案。
因此,本公开提供了一种用于从核酸混合物中分离靶等位基因的方法。所述方法可包括以下步骤:(a)提供与附接至固体载体的稳定化的三元复合物流体接触的核酸混合物,其中所述稳定化的三元复合物包含聚合酶、引发的核酸模板和下一个正确的核苷酸,其中所述模板具有靶等位基因,其中所述下一个正确的核苷酸是所述靶等位基因的同源核苷酸,并且其中所述稳定化的三元复合物经由所述聚合酶与所述固体载体之间的键联或经由所述核苷酸与所述固体载体之间的键联而附接至所述固体载体;(b)使所述固体载体与所述核酸混合物分离,从而从所述核酸混合物中分离所述靶等位基因;(c)使具有所述靶等位基因的模板从所述分离的固体载体解离;(d)形成包含第二稳定化的三元复合物的溶液,所述第二稳定化的三元复合物包含先前解离的模板、聚合酶和下一个正确的核苷酸,所述下一个正确的核苷酸是所述靶等位基因的同源核苷酸,其中所述聚合酶或所述下一个正确的核苷酸附接至固体载体;以及(e)从所述溶液中分离步骤(d)的固体载体,从而从所述溶液中分离具有所述靶等位基因的先前解离的模板。所述方法还可包括任选的步骤:(f)使所述先前解离的模板从步骤(e)中分离的固体载体解离。
还提供了一种用于使基因座的第一等位基因与所述基因座处的第二等位基因分离的方法。所述方法可包括以下步骤:(a)提供与附接至固体载体的稳定化的三元复合物流体接触的包含所述第二等位基因的混合物,其中所述稳定化的三元复合物包含聚合酶、与核酸模板杂交的引物和下一个正确的核苷酸,其中所述模板具有所述第一等位基因,其中所述下一个正确的核苷酸是所述第一等位基因的同源核苷酸,或者所述引物的3'端具有所述第一等位基因的同源核苷酸,并且其中所述稳定化的三元复合物经由所述聚合酶与所述固体载体之间的键联或经由所述下一个正确的核苷酸与所述固体载体之间的键联而附接至所述固体载体;(b)使所述固体载体与所述核酸混合物分离,从而使所述第一等位基因与所述第二等位基因分离;(c)使具有所述第一等位基因的模板从所述分离的固体载体解离;(d)形成包含第二稳定化的三元复合物的溶液,所述第二稳定化的三元复合物包含先前解离的模板、聚合酶和下一个正确的核苷酸,其中所述聚合酶或所述下一个正确的核苷酸附接至固体载体;以及(e)从所述溶液中分离步骤(d)的固体载体,从而从所述溶液中分离具有所述第一等位基因的先前解离的模板。所述方法还可包括任选的步骤:(f)使所述先前解离的模板从步骤(e)中分离的固体载体解离。
在上述迭代方法的特定实施方案中,如步骤(a)中所用,同一固体载体用于步骤(d)。与在步骤(d)中使用新的固体载体相比,这可提供成本节省。然而,在一些实施方案中,在步骤(d)和步骤(a)中使用不同的固体载体。每个步骤中使用的固体载体可具有相同类型或不同类型。可使用本文阐述或本领域中另外已知的各种固体载体中的任一种。
类似地,如步骤(a)中所用,同一聚合酶可任选地用于步骤(d)。再次,与在步骤(d)中使用新的聚合酶相比,这可提供成本节省。然而,在一些实施方案中,在步骤(d)和步骤(a)中使用不同的聚合酶。每个步骤中使用的聚合酶可具有相同类型或不同类型。可使用本文阐述或本领域中另外已知的各种聚合酶中的任一种。
通常,同一引物用于步骤(a)和步骤(d)。然而,在一些实施方案中,可在步骤(d)中使用新的引物。新的引物通常将与先前使用的引物具有相同的类型(即两个引物可具有相同的序列并且具有相同的长度)。但是,如果需要,可使用具有不同长度或序列的引物。
本公开的方法可以多重形式进行,由此在本文阐述的一个或多个步骤期间并行加工多种不同类型的核酸。尽管还有可能使用本文阐述的方法的一个或多个步骤连续加工不同类型的核酸,但并行加工可提供成本节省、时间节省和条件均一性。
因此,本公开提供了一种用于从核酸混合物中分离多个靶等位基因的方法。所述方法可包括以下步骤:(a)提供与多种稳定化的三元复合物流体接触的核酸混合物,所述稳定化的三元复合物是固体载体附接的,其中所述稳定化的三元复合物各自包含聚合酶、引发的核酸模板和下一个正确的核苷酸,其中所述模板具有靶等位基因,其中所述下一个正确的核苷酸是所述靶等位基因的同源核苷酸,并且其中所述稳定化的三元复合物各自经由所述聚合酶与所述固体载体之间的键联或经由所述下一个正确的核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所述核酸混合物分离,从而从所述核酸混合物中分离所述靶等位基因。
本公开进一步提供了一种用于分别使多个基因座处的第一等位基因与所述多个基因座处的第二等位基因分离的方法。所述方法可包括以下步骤:(a)提供分别与多种稳定化的三元复合物流体接触的所述多个基因座处的第二等位基因的混合物,所述稳定化的三元复合物是固体载体附接的,其中所述稳定化的三元复合物各自包含聚合酶、引发的核酸模板和下一个正确的核苷酸,其中所述模板包含第一等位基因,其中所述下一个正确的核苷酸是所述第一等位基因的同源核苷酸,或者所述引物的3'端包含所述第一等位基因的同源核苷酸,并且其中所述稳定化的三元复合物各自经由所述聚合酶与所述固体载体之间的键联或经由所述下一个正确的核苷酸与所述固体载体之间的键联而附接至所述固体载体;以及(b)使所述固体载体与所述核酸混合物分离,从而使所述多个基因座处的所述第一等位基因与所述第二等位基因分离。
用于多重复用实施方案的特别有用的固体载体是具有特征的阵列的固体载体。例如,每种稳定化的三元复合物可经由与阵列的特定特征的键联而附接至所述阵列,从而使包含不同等位基因的模板彼此分开。可修饰本领域中已知的多种阵列中的任一种以用于本文阐述的方法或组合物中。例如,由商业阵列(或其他核酸阵列)制成的与核酸探针的键联可用本文阐述的用于将聚合酶或核苷酸附接至表面的键联替代。在其他实施方案中,聚合酶或核苷酸可附接至与位于核酸阵列上的探针互补的寡核苷酸部分。在此类实施方案中,核苷酸或聚合酶可经由互补链的杂交或交联附接至表面。如果需要,可将模板和/或引物附接至阵列的特征。
可适用的示例性阵列基底包括但不限于可从illumina,inc.(sandiego,ca)获得的beadchiptm阵列或诸如美国专利号6,266,459、6,355,431、6,770,441、6,859,570或7,622,294或pct公布号wo00/63437中描述的那些的阵列,所述专利各自以引用的方式并入本文。可使用的可商购阵列基底的其他实例包括例如affymetrixgenechiptm阵列。根据一些实施方案还可使用成点阵列基底。示例性成点阵列是可从amershambiosciences获得的codelinktm阵列。另一种有用的阵列是使用喷墨印刷方法,如可从agilenttechnologies获得的sureprinttm技术制造的阵列。
其他有用的阵列基底包括用于核酸测序应用的那些阵列基底。例如,用于附接基因组片段(通常称为簇)的扩增子的阵列可能是特别有用的。可修饰以在本文中使用的基底的实例包括bentley等人,nature456:53-59(2008);pct公布号wo91/06678;wo04/018497或wo07/123744;美国专利号7,057,026;7,211,414;7,315,019;7,329,492或7,405,281;或美国专利申请公布号2008/0108082中描述的那些,所述文献以引用的方式并入本文。
可使用图1a中例示的类型的等位基因特异性核苷酸和基因座引物进行多重实施方案。更具体地,存在于稳定化的三元复合物中的下一个正确的核苷酸可以是基因座处的第一等位基因的同源核苷酸,以使得所述下一个正确的核苷酸不是所述基因座处的第二等位基因的同源核苷酸。具有跨越多种不同核苷酸类型的等位基因的基因座可顺序地进行处理。例如,以多重形式存在的多个基因座可跨越四种不同类型的核苷酸。在此实例中,可进行多重方法的第一次迭代以形成多种稳定化的三元复合物,所述多种稳定化的三元复合物具有四种不同类型的核苷酸中的仅第一类型的同源核苷酸。然后可进行多重方法的第二次迭代以形成多种稳定化的三元复合物,所述多种稳定化的三元复合物具有四种不同类型的核苷酸中的仅第二类型的同源核苷酸,所述第二类型不同于第一类型。在第三次迭代中,可形成多种稳定化的三元复合物,所述多种稳定化的三元复合物具有四种不同类型的核苷酸中的仅第三类型的同源核苷酸,所述第三类型不同于第一类型和第二类型。在第四次迭代中,可形成多种稳定化的三元复合物,所述多种稳定化的三元复合物具有四种不同类型的核苷酸中的仅第四类型的同源核苷酸,所述第四类型不同于第一类型、第二类型和第三类型。
在一些多重实施方案中,可使用图1a中例示的类型的等位基因特异性引物。更具体地,每个引物的3'端可具有基因座处的第一等位基因的同源核苷酸,以使得所述引物的3'端不具有所述基因座处的第二等位基因的同源核苷酸。以多重形式使用等位基因特异性引物的优点是可并行处理具有跨越多种不同核苷酸类型的等位基因的基因座。因为等位基因通过在引物的3'端处的同源核苷酸的存在或不存在而不是通过下一个正确的核苷酸进行区分,所以具有不同基因座和等位基因的三元复合物的混合物可与多于一种类型的下一个正确的核苷酸同时接触。当然,如果需要,混合物可包含多种三元复合物,所述三元复合物已经用等位基因特异性引物以及可在所述混合物中形成稳定化的三元复合物的仅下一个正确的核苷酸类型的子集形成。所述子集可包括在存在的多个基因座中不超过1、2、3或4种不同类型的核苷酸的同源核苷酸。
使用本公开的方法捕获的一种或多种模板核酸可用于各种后续应用。例如,所述模板核酸可用于制备方法,如基因或基因片段的克隆。可使用诸如聚合酶链反应(pcr)、滚环扩增(rca)、多重置换扩增(mda)等的方法扩增模板。在一些情况下,用于在捕获方法中形成三元复合物的引物也可用于扩增。通常,使用本文阐述的方法捕获的模板可使用本领域已知的方法进行操作,包括但不限于,在sambrook等人,molecularcloning:alaboratorymanual,第3版,coldspringharborlaboratory,newyork(2001)或ausubel等人,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md.(1998)中描述的那些方法,所述文献各自以引用的方式并入本文。
在特定实施方案中,使用本文阐述的方法捕获的一种或多种模板核酸可用于分析方法中,例如,实时聚合酶链反应(rtpcr)、定量pcr(qpcr)、核酸测序、基因分型分析、表达分析等。这些方法中的一些采用使引物沿着待分析的模板延伸的步骤。在一些情况下,用于在捕获方法中形成三元复合物的引物也可用于分析技术中的引物延伸。
任选地,如共同拥有的u.s.s.n.14/805,381(现在公布为美国公布号2017/0022553a1)中所描述进行测序,所述专利以引用的方式并入本文。简言之,用于确定模板核酸分子的序列的方法可基于在指定条件下形成三元复合物(聚合酶、引发的核酸和同源核苷酸之间)。所述方法通常可包括在并入核苷酸之前的检查步骤。检查步骤可涉及提供用引物引发的模板核酸分子;使所述引发的模板核酸分子与包含聚合酶和至少一个核苷酸分子的第一反应混合物接触;监测所述聚合酶与所述引发的模板核酸分子在所述核苷酸分子存在下的相互作用,而不将所述核苷酸分子化学并入到所述引发的模板核酸中;以及使用在所述核苷酸分子存在下所述聚合酶与所述引发的模板核酸分子的监测的相互作用来鉴定所述模板核酸中的下一个碱基。在这种程序中,三元复合物稳定化和二元复合物去稳定化有利地增强了正确核苷酸与不正确核苷酸之间的辨别。
也可使用合成测序(sbs)技术。sbs通常涉及通过针对与引物杂交的模板链反复添加核苷酸而使新生引物酶促延伸。sbs可利用具有终止子部分的核苷酸单体或缺乏任何终止子部分的核苷酸单体。使用具有终止子的单体的方法包括例如,在wo04/018497、美国专利号7,057,026、wo91/106678、wo07/123744、u.s.us2007/0166705、us2006/0188901、us2006/0240439、us2006/0281109、wo05/065814、us2005/0100900、wo06/064199或wo07010251中描述的那些方法,所述专利的公开内容以引用的方式并入本文。同样有用的是可从illumina,inc.,sandiegocalif商购的sbs方法。
一些sbs实施方案包括检测在将核苷酸并入延伸产物中时释放的质子。例如,基于释放的质子的检测的测序可使用可从thermofisher(waltham,ma)商购获得的电检测器和相关技术或者在美国专利申请公布号2009/0026082a1、2009/0127589a1、2010/0137143a1或2010/0282617a1中描述的测序方法和系统,所述专利各自以引用的方式并入本文。
可使用其他测序程序,如焦磷酸测序。当特定核苷酸并入到与模板核酸链杂交的新生引物中时,焦磷酸测序检测无机焦磷酸盐(ppi)的释放(ronaghi等人,analyticalbiochemistry242(1),84-9(1996);ronaghi,genomeres.11(1),3-11(2001);ronaghi等人science281(5375),363(1998);美国专利号6,210,891;6,258,568和6,274,320,所述文献各自以引用的方式并入本文)。在焦磷酸测序中,释放的ppi可通过经由atp硫酸化酶转化为三磷酸腺苷(atp)来检测,并且可经由荧光素酶产生的光子检测所得的atp。因此,可经由发光检测系统来监测测序反应。
边连接边测序反应也是可用的,包括例如描述于以下中的那些:shendure等人science309:1728-1732(2005);美国专利号5,599,675;以及美国专利号5,750,341,所述文献各自以引用的方式并入本文。一些实施方案可包括边测序边杂交程序,如例如描述于bains等人,journaloftheoreticalbiology135(3),303-7(1988);drmanac等人,naturebiotechnology16,54-58(1998);fodor等人,science251(4995),767-773(1995);以及wo1989/10977中,所述文献各自以引用的方式并入本文。在边连接边测序和边测序边杂交程序两者中,通过寡核苷酸连接对与核酸模板杂交的引物进行重复的延伸循环。通常,寡核苷酸进行荧光标记并且可进行检测以确定模板的序列。
一些实施方案可利用涉及dna聚合酶活性的实时监测的方法。例如,可通过携带荧光团的聚合酶与γ-磷酸标记的核苷酸之间的荧光共振能量转移(fret)相互作用或使用零模波导(zmw)来检测核苷酸并入。经由fret和/或zmw检测进行测序的技术和试剂描述于例如levene等人science299,682-686(2003);lundquist等人opt.lett.33,1026-1028(2008);korlach等人proc.natl.acad.sci.usa105,1176-1181(2008)中,所述文献的公开内容以引用的方式并入本文。
在一些实施方案中,测序方法利用附接至zmw或其他固体载体特征的聚合酶。在本文阐述的方法中捕获的三元复合物或其组分可附接至zmw或用于上述测序技术或本领域已知的其他固体载体。
通过本公开的方法捕获的模板核酸的另一种有用的应用是基因表达分析。可使用rna测序技术(如被称为数字rna测序的那些)检测或定量基因表达。rna测序技术可使用本领域中已知的测序方法(如上文阐述的那些)进行。还可使用通过直接杂交至阵列进行的杂交技术或使用多重测定来检测或定量基因表达,其产物在阵列上检测。本公开的阵列还可用于确定来自一个或多个个体的基因组dna样品的基因型。可使用通过本公开的方法捕获的模板核酸进行的用于基于阵列的表达和基因分型分析的示例性方法描述于美国专利号7,582,420、6,890,741、6,913,884或6,355,431或美国公布号2005/0053980、2009/0186349或2005/0181440中,所述专利各自以引用的方式并入本文。
此外,使用本文阐述的方法分离的核酸可在2017年1月20日提交的美国临时申请号62/448,630、与本申请同时提交并且以引用的方式整体并入本文的标题为“genotypingbypolymerasebinding”的美国专利申请案号omni-014(097128-1036629(022pv1)中阐述的方法中检测。更具体地,使用本文阐述的方法分离的一种或多种等位基因可在基于聚合酶的方法中进行检测以检测或鉴定目标靶标等位基因。所述方法的实施方案利用聚合酶可与引发的模板和下一个正确的核苷酸形成稳定化的三元复合物的特异性。例如,可在聚合酶、具有靶等位基因的引发的模板和等位基因的同源核苷酸之间形成稳定化的三元复合物。所述方法的一个优点是聚合酶特异性允许靶等位基因与其他核酸区分开,包括例如与靶等位基因(在一些情况下仅因单个核苷酸)不同的其他等位基因。例如,可在聚合酶、编码靶单核苷酸多态性(snp)等位基因的引发的模板和snp等位基因的同源核苷酸之间形成三元复合物。与同一基因座处的非靶snp等位基因相比,三元复合物的检测将导致snp等位基因的选择性检测,因为当与聚合酶形成三元复合物时,同源核苷酸对靶snp具有选择性。
本文阐述的方法和组合物可用于检测在其序列内含有各种突变的稀有等位基因(例如基于dna或rna的)。所述方法非常适合于从含有相同基因座的野生型dna序列以及其他不相关序列的纯化或半纯化的寡核苷酸池检测甚至稀有变体等位基因。可用于在检测方法中形成等位基因特异性三元复合物的有用的引物-核苷酸组合包括图1a和图1b中所示的那些。
在一个示例性实施方案中,第一等位基因特异性引物可存在于阵列的第一特征处,并且第二等位基因特异性引物可存在于所述阵列的第二特征处。可使所述阵列与模板核酸、聚合酶和四种不同核苷酸类型的混合物接触,所述四种不同核苷酸类型都具有相同的标记。引物与核酸模板之间的错配将抑制聚合酶结合,而匹配的引物模板可结合聚合酶和下一个正确的核苷酸以形成稳定化的三元复合物。任选地,可洗涤所述阵列。然后可使用在空间上解析特征并感测所述标记的存在或不存在的装置来检测所述阵列。
用于检测等位基因的替代阵列形式可利用基因座特异性引物和可区分标记的等位基因特异性同源核苷酸。在第一步骤中,可使具有不同等位基因的核酸模板与具有基因座特异性引物的多个拷贝的阵列上的特征杂交。因此,两个不同的等位基因可结合在所述特征处。聚合酶然后可在具有不同标记的两种不同核苷酸类型存在下与引物-模板杂合体结合,以形成稳定化的三元复合物。任选地,可洗涤所述阵列。然后可使用区分所述两种标记的装置来检测所述阵列。
因此,可在下面的方法中检测在本文阐述方法中分离的一个或多个等位基因。
一种用于鉴定靶等位基因的方法可包括以下步骤:(a)在阵列上的多个特征处形成多种稳定化的三元复合物,其中所述稳定化的三元复合物各自具有聚合酶、具有基因座的靶等位基因的模板核酸、与所述基因座杂交的引物,以及在所述基因座中具有同源物的下一个正确的核苷酸,其中(i)所述引物是具有3'核苷酸的等位基因特异性引物,所述3'核苷酸是所述靶等位基因的同源核苷酸,或者(ii)所述引物是基因座特异性引物,并且所述下一个正确的核苷酸与所述靶等位基因杂交;以及(b)检测所述特征处的稳定化的三元复合物,从而鉴定所述靶等位基因。
在一些实施方案中,所述用于鉴定靶等位基因的方法可包括以下步骤:(a)提供特征的阵列,其中不同的基因座特异性引物附接在所述阵列的不同特征处;(b)使所述阵列与多种核酸模板、聚合酶和核苷酸接触以在多个所述特征处形成多种稳定化的三元复合物,其中所述稳定化的三元复合物各自具有聚合酶、具有基因座的靶等位基因的模板核酸、与所述基因座杂交的基因座特异性引物,以及下一个正确的核苷酸,所述下一个正确的核苷酸是所述靶等位基因的同源物;以及(c)检测所述特征处的稳定化的三元复合物,从而鉴定所述靶等位基因。
所述用于鉴定靶等位基因的方法的替代实施方案可包括以下步骤:(a)提供特征的阵列,其中不同的等位基因特异性引物附接在所述阵列的不同特征处;(b)使所述阵列与多种核酸模板、聚合酶和核苷酸接触以在多个所述特征处形成多种稳定化的三元复合物,其中所述稳定化的三元复合物各自具有聚合酶、具有基因座的靶等位基因的模板核酸、与所述基因座杂交的等位基因特异性引物,以及在所述基因座中具有同源物的下一个正确的核苷酸,其中所述等位基因特异性引物的3'端具有所述靶等位基因的同源核苷酸;以及(c)检测所述特征处的稳定化的三元复合物,从而鉴定所述靶等位基因。
一种用于鉴定核酸混合物中的靶等位基因的方法可包括以下步骤:(a)提供特征的阵列,其中不同的基因座特异性引物附接在所述阵列的所述特征的第一子集处,并且其中不同的等位基因特异性引物附接在所述阵列的所述特征的第二子集处;(b)使所述阵列与多种核酸模板、聚合酶和核苷酸接触以在多个所述特征处形成多种稳定化的三元复合物,其中所述第一特征子集处的所述稳定化的三元复合物各自具有聚合酶、具有基因座的靶等位基因的模板核酸、与所述基因座杂交的基因座特异性引物,以及下一个正确的核苷酸,所述下一个正确的核苷酸是所述靶等位基因的同源物,其中所述第二特征子集处的所述稳定化的三元复合物各自具有聚合酶、具有基因座的靶等位基因的模板核酸、与所述基因座杂交的等位基因特异性引物,以及在所述基因座中具有同源物的下一个正确的核苷酸,并且其中所述等位基因特异性引物的3'端具有所述靶等位基因的同源核苷酸;以及(c)检测所述特征处的稳定化的三元复合物,从而鉴定所述靶等位基因。
还提供了一种用于鉴定核酸混合物中的靶等位基因的方法,所述方法包括以下步骤:(a)提供特征的阵列,其中不同的模板核酸附接在所述阵列的不同特征处;(b)使所述阵列与多种引物、聚合酶和核苷酸接触以在多个所述特征处形成多种稳定化的三元复合物,其中所述特征处的所述稳定化的三元复合物各自具有聚合酶、与所述阵列的特征附接且具有基因座的靶等位基因的模板核酸、与所述基因座杂交的引物,以及在所述基因座中具有同源物的下一个正确的核苷酸,其中(i)所述引物是具有3'核苷酸的等位基因特异性引物,所述3'核苷酸是所述靶等位基因的同源核苷酸,或者(ii)所述引物是基因座特异性引物,并且所述下一个正确的核苷酸与所述靶等位基因杂交;以及(c)检测所述特征处的稳定化的三元复合物,从而鉴定所述靶等位基因。
进一步提供了一种用于鉴定核酸混合物中的靶等位基因的方法,所述方法包括以下步骤:(a)提供特征的阵列,其中聚合酶附接在所述阵列的特征处;(b)使所述阵列与多种引物、模板核酸和核苷酸接触以在多个所述特征处形成多种稳定化的三元复合物,其中所述特征处的所述稳定化的三元复合物各自具有附接在所述阵列的特征处的聚合酶、具有基因座的靶等位基因的模板核酸、与所述基因座杂交的引物,以及在所述基因座中具有同源物的下一个正确的核苷酸,其中(i)所述引物是具有3'核苷酸的等位基因特异性引物,所述3'核苷酸是所述靶等位基因的同源核苷酸,或者(ii)所述引物是基因座特异性引物,并且所述下一个正确的核苷酸与所述靶等位基因杂交;以及(c)检测所述特征处的稳定化的三元复合物,从而鉴定所述靶等位基因。
实施例1
区分下一个正确的核苷酸与错配的核苷酸。
方法和材料。聚合酶缓冲液:20mmtris(ph8)、300mmnacl、5mmdtt、100μmdntp、150nmkienow、0.01%bsa、0.02%tween-20、10mmmgcl2。检查缓冲液:20mmtris(ph8)、300mmnacl、5mmdtt、100μmdntp、150nmklenow、0.01%bsa、0.02%tween-20。并入缓冲液:20mmtris(ph8)、300mmnacl、5mmdtt、0.01%bsa、0.02%tween-20、10mmmgcl2。洗涤缓冲液:20mmtris(ph8)、300mmnacl、5mmdtt、0.01%bsa、0.02%tween-20。
图4示出使用聚合酶、引发的模板和核苷酸(与模板中的下一个碱基匹配或错配)的结合测定的结果,其中在所述结合测定期间存在或不存在镁。第一递送的核苷酸是dctp(c:t错配),并且第二递送是datp(a:t匹配)。图3中的实线示出使用聚合酶缓冲液的结果。对于匹配a和不匹配c步骤,前稳态速率常数分别为0.0106和0.0084。差异太小而不能准确地辨别同源碱基。图4中的虚线表示检查缓冲液中的无镁结合步骤,然后浸泡在并入缓冲液中。1.1nm的信号阈值可允许准确鉴定正确的碱基。这些结果表明,当在检查期间镁被包含在缓冲液中时,传感平台不能区分匹配与错配碱基(聚合酶缓冲液,实线,图4)。相反,在不存在镁的情况下结合提供正确碱基与不正确碱基之间的非常大的区分(检查缓冲液,虚线,图4)。通过信号阈值而不是结合速率来确定正确碱基序列。
实施例2
盐浓度对匹配/错配碱基辨别的影响
实验条件:将phix_匹配c和phix_匹配a负载到各个尖端上。将引物-模板以在含有0.01-0.02%bsa和0.01-0.02%tween20的1-2xpbs(负载缓冲液)中100与500nm之间负载到所述尖端上。fp2引物相对于模板处于1.25-2倍过量。通过信号的变化监测负载,并且通常在30℃下在5分钟内达到平稳水平。将尖端在负载缓冲液中浸泡1-5分钟以除去未结合的dna材料。对于碱基识别,将所述尖端浸泡在含有补充有0.01-0.02%bsa和0.01-0.02%tween20(ls缓冲液)、100nm聚合酶、100μmntp以及50至300mm的不同浓度的额外nacl的ixtaq缓冲液(10mmtris-hcl,50mmkcl,ph8.3,25℃,不含镁)的溶液中。phix_匹配c双链体将形成三元复合物并显示结合信号的增加,因为呈现了下一个正确的核苷酸(同源物)。phix_匹配a应该不会如此,因为它是不正确的核苷酸(非同源物)。
结果:在标准反应条件下,两种模板都结合聚合酶。然而,随着盐浓度的增加,非同源复合物的结合亲和力降低,而同源复合物的结合亲和力仍然较高。因此,碱基辨别的信噪比(snr)增加,以使得在此检查步骤期间容易地鉴定下一个正确的碱基(图5)。在此实施例中使用氯化钠(nacl),但也可使用诸如kcl、nh2(s04)、谷氨酸钾和本领域已知的其他盐的盐。显示正确核苷酸与不正确核苷酸之间的结合亲和力差异的聚合酶包括klenow、bst2.0、bsu和taq。
贯穿本申请已参考各种公布、专利和/或专利申请。这些文件的公开内容特此以引用的方式整体并入本申请中。
已经描述了多个实施方案。然而,应理解,可做出各种修改。因此,其他实施方案也处于以下权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 油菜BnaSPT1基因在促进双子叶植物角果生长中的应用的制造方法与工艺
- 油菜BnaSPT3基因在促进双子叶植物角果生长中的应用的制造方法与工艺
- 一种木质素合成途径中上位性效应检测方法与制造工艺
- 用于检测人类HLA‑B*5701等位基因的核酸、试剂盒及方法与制造工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- 与癌症相关的基因融合体和基因变异体的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 一种高通量测序检测无创亲子鉴定的方法与制造工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 通过分析预示性基因集诊断亚临床和临床的急性排异的方法与制造工艺