树枝状高分子化合物及其制备方法和应用与流程
本发明涉及树枝状高分子化合物及其制备方法和应用。
背景技术:
树枝状高分子(dendrimer)是一种人工合成的新型纳米高分子化合物,自1985年tomalia首次成功合成树枝状高分子以来,由于其重要的理论意义和潜在的应用价值,引起了众多领域科学家的广泛关注。树枝状高分子在合成过程中,反应每循环一次,在原聚合物基础上增加一代,因此,可以在纳米水平上严格控制分子的大小、结构、表面基团的数量和相对分子量。在树枝状高分子内存在空腔,每生成一代便具有一层结构,每层结构中具有一定的分子空腔,这些空腔存在有利于药物与基因运输与分子催化的研究。树枝状高分子本身有纳米尺寸,由于高度支化的拓扑形态,使得树枝形分子在三维空间中具有近似的球形结构,其尺寸一般在几纳米至几十纳米之间,并且在树枝状高分子的外层富集了大量的官能团,由于端基性质的不同,使树枝状高分子具有多功能性,因此,树枝状高分子在很多方面将产生更广泛的应用。
技术实现要素:
本发明目的是提供一种树枝状高分子化合物及其制备方法和应用。具体地说是一种双羧酸氨基酸型树枝状高分子化合物(amino-dendrimer),其是以多羧酸分子(如丙三羧酸或1,3,5-环己三羧酸等)为中心再由双羧酸氨基酸分子(如天冬氨酸,asp;谷氨酸,glu)以树状排列进行支化反应,按几何学规则向外扩大,形成的双羧酸氨基酸型树状化合物。支化反应的树状延伸,形成不同分子大小的树状化合物。
特别地,本发明所述树枝状高分子化合物,或称双羧酸氨基酸型树状化合物(amino-dendrimer)是以丙三羧酸作为同心分子,再由双羧酸氨基酸(如天冬氨酸,asp;谷氨酸,glu)以酰胺键按树状排列连接形成的,其结构示意如图1所示。
以下对本发明所述树枝状高分子化合物进行详细描述。
一种树枝状高分子化合物,为在核心pa上连接3个树枝结构r,每个树枝结构r均有2n个端基,n为自然数;所述树枝状高分子化合物的结构如下式i所示,
其中,pa表示下式iii所示的结构,r表示下式ii所示的结构;a独立地表示下式iv或下式v所示的结构;
其中,pa与r通过酰胺键(-conh-)键合;即l-天冬氨酸分子或l-谷氨酸分子上的α-nh2与丙三羧酸分子上的-cooh脱水(-h2o)形成酰胺键(-conh-)。
a分别与下一层两个a通过酰胺键(-conh-)键合;即l-天冬氨酸分子两个羧基(α-cooh和β-cooh)再分别与另外两个l-天冬氨酸分子上的α-nh2进行-h2o反应,形成酰胺键(-conh-);或l-谷氨酸分子上的两个羧基(α-cooh和γ-cooh)再分别与另外两个l-谷氨酸分子上的α-nh2进行-h2o反应,形成酰胺键(-conh-)。
本发明有关术语定义如下:
本发明所述树枝状高分子化合物是具有上述核心(或核)pa和含有上述树枝结构r构成的树枝状化合物。
本发明所述树枝状高分子化合物,当a独立地表示上式iv所示的结构时,该所述树枝状高分子化合物称为l-天冬氨酸型树枝状高分子化合物;当a独立地表示上式v所示的结构时,该所述树枝状高分子化合物称为l-谷氨酸型树枝状高分子化合物。
本发明可采用世代(generation)的概念表示上述树枝状高分子化合物分子的大小。本发明中把由上述核心到最初的树枝结构定义为第1代(或称为第1层)。当第1代树枝结构的外侧具有下一个树枝结构时,把该下一个树枝结构定义为第2代(或称为第2层)。第3代以后也同样地把由下一个树枝结构定义为下一代(或称下一层)。以此类推,直至第n代(或称为第n层)。
本发明所述端基是指所述树枝状高分子化合物表面(最外层)的羧基(-cooh)。为便于描述,在上述式ii中示出了端基中的羟基(-oh)。
当本发明所述树枝状高分子化合物的世代数为1(即第1层)时,每个所述树枝结构r的端基的数量为2个;当本发明所述树枝状高分子化合物的世代数为2(即第2层)时,每个所述树枝结构r的端基的数量为4个;当本发明所述树枝状高分子化合物的世代数为3(即第3层)时,每个所述树枝结构r的端基的数量为8个;……当本发明所述树枝状高分子化合物的世代数为n(即第n层)时,每个所述树枝结构r的端基的数量为2n个,n为自然数。
优选地,本发明所述树枝状高分子化合物,其中n为1-5,优选为1-3。
优选地,本发明所述树枝状高分子化合物的世代数为1-5,更优选为1-3。
以下列出本发明所述树枝状高分子化合物的优选的例子:
l-天冬氨酸型树枝状高分子化合物优选为下式vi-ix所示的化合物:
所述l-谷氨酸型树枝状高分子化合物优选为下式xi-xiv所示的化合物:
本发明所述树枝状高分子化合物(双羧酸氨基酸型树状化合物)的特点是:1)这种特别造型的树状化合物可以作为新型药物载体;2)由中心向外支化反应是可控的,所以载体分子量也是可控的(如上式vi-ix所示化合物,表示l-天冬氨酸组成的不同分子量的双羧酸氨基酸型树状化合物);3)由于双羧氨基酸树状化合物是由氨基酸组成,具有良好的水溶性、生物相容性及生物降解性;4)载体表面分子上存在许多羧基,易连接许多药物分子,也可部分成盐,解决药物的水溶性;5)载体-药物接合物改变了药物原有的性质,使药物具有靶向性和缓释性。
本发明所述树枝状高分子化合物还具有以下特点:
1.同心分子同心分子是组成双羧酸氨基酸型树状化合物的起源,本发明所述树枝状高分子化合物以丙三羧酸(propane-1,2,3-tricarboxylicacid)作为同心分子,其结构式如下式xvi所示。丙三羧酸或丙三羧酸的羧基脱去羟基后形成的结构(如下式iii所示,)在本发明所述树枝状高分子化合物中也称作核心或核。
2.双羧酸氨基酸的按列双羧酸氨基酸分子上的α-nh2与丙三羧酸分子上的-cooh脱水(-h2o)形成酰胺键(-conh-)。双羧酸氨基酸分子上的两个羧基(α-cooh和,β-cooh或γ-cooh)再分别与另外两个双羧酸氨基酸分子上的α-nh2进行-h2o反应。每次-h2o反应树状化合物按几何学规则扩大分子量。
3.树状化合物的表面双羧酸氨基酸型树枝状高分子化合物的表面分子(外层)为多个羧酸(第一层6个-cooh,第二层12个-cooh,第三层24个-cooh…,第n层3×2n个-cooh,n为自然数),分子表面的羧酸为游离羧酸。
4.树状化合物的载体作用树枝状高分子化合物的表面游离羧酸能与药物分子上的-oh或-nh2脱水(-h2o)形成酯键(-coo-)或酰胺键(-conh-),将药物分子与树状化合物键合组合成载体-药物的新型药物。
5.树状化合物的靶向作用树状化合物随着加层反应的次数增加,其树状化合物的分子量也按几何学规则扩大分子量,呈大分子载体。一定分子量及特定氨基酸(天冬氨酸)组成的大分子具有肿瘤靶向作用(如图2所示)。
6.树状化合物的螯合金属作用树状化合物的表面游离羧酸因为是多个羧酸,能螯合正二价以上的金属离子(如下式xvii所示)(如:钙离子(ca2+)、铬离子(cr3+)、铁离子(fe3+)、铜离子(cu2+)、锗(ge)、砷(as)、铂(pt)、金(au)…等),也是很好的金属螯合剂。树状化合物的螯合金属的作用可将具有生物活性的金属安全载入体内,并通过体内靶向分布、代谢,可作为有治疗作用的载体-金属药物(比如:载体-铂等),同样载体也能螯合体内过量有害金属,对金属中毒可用来解毒等。
7.树状化合物的螯合放射性同位素作用树状化合物的表面游离羧酸同样也能螯合临床上常用的放射性同位素(如:碘(131i)、金(198au)、汞(203hg)、锝(99mtc)、铟(113min)、铬(51cr)、钴(57、58co)、锶(85sr)、镓(67se)…等),也是很好的放射性同位素的金属螯合剂。树状化合物的螯合放射性同位素作用可将放射性同位素安全载入体内,并通过体内靶向分布、代谢,可作为有特殊意义的诊断剂或放疗剂。
上式xvii表示l-天冬氨酸型树状化合物螯合金属(m+2)。
7.载体-药物的意义1.改变药物的水溶性;2.提高药物的靶向性;3.缓慢释放药物,维持较长的有效血药浓度和降低药物的毒、副作用;4.改变药物的药代动力学;5.载体可生物降解,主要降解物为机体所需的双羧酸氨基酸。
本发明还提供上述树枝状高分子化合物的制备方法。
所述树枝状高分子化合物的制备方法,包括以丙三羧酸和,l-天门冬氨酸双苄酯(l-asparticaciddibenzylester,如下式xix所示)或l-谷氨酸双苄酯(l-glutamicaciddibenzylester,如下式xxi所示)为原料制得;即以丙三羧酸和l-天门冬氨酸双苄酯为原料制得l-天门冬氨酸型树枝状高分子化合物;以丙三羧酸和l-谷氨酸双苄酯为原料制得l-谷氨酸型树枝状高分子化合物。
优选地,本发明采用发散合成法,即是从所述树枝状高分子化合物的核心(中心点)开始向外扩展来进行合成反应。从核心(中心点)开始,该核心拥有3个反应点,然后用带有分支结构的单元与核心反应,即得到了第一代分子。将第一代分子分支末端的官能团转化为可继续进行反应的官能团,然后重复与分支单元反应物进行反应则得到第二代分子。不断重复以上的两个步骤,就可以得到期望的树枝状高分子化合物。
上述树枝状高分子化合物的合成方法中,包括以n,n’-二环已基碳二亚胺(dcc,n,n’-dicyclohexylcarbodiimide)为催化剂,以dmf(即n,n-二甲基甲酰胺)为反应溶剂。
上述l-天门冬氨酸双苄酯可由l-天冬氨酸双苄酯对甲苯磺酸盐经脱盐(如下式xviii所示)而制得;其反应历程如下式所示:
制备l-天门冬氨酸双苄酯的具体方法如下:取天门冬氨酸双苄酯对甲苯磺酸盐、乙酸乙酯和2.5%的碳酸氢钠溶液一起投入到反应瓶中,25℃下搅拌15min,静置分层,分去下层水相;收集上层有机相,加无水硫酸钠干燥后过滤,滤液50℃真空浓缩去乙酸乙酯,得到天门冬氨酸双苄酯黄色油状液体。其中优选地,l-天门冬氨酸双苄酯对甲苯磺酸盐、碳酸氢钠的摩尔比为1∶1-1.2。
上述l-谷氨酸双苄酯可由l-谷氨酸双苄酯对甲苯磺酸盐(l-glutamicaciddibenzylester4-toluenesulfonate,如下式xx所示)经脱盐而制得;其反应历程如下式所示:
制备l-谷氨酸双苄酯的具体方法如下:取l-谷氨酸双苄酯对甲苯磺酸盐、乙酸乙酯和2.5%的碳酸氢钠溶液一起投入到反应瓶中,25℃下搅拌15min,静置分层,分去下层水相。收集上层有机相,加无水硫酸钠干燥后过滤,滤液50℃真空浓缩去乙酸乙酯,得到l-谷氨酸双苄酯黄色油状液体。其中优选地,l-谷氨酸双苄酯对甲苯磺酸盐、碳酸氢钠的摩尔比为1∶1-1.2。
具体地,上述l-天冬氨酸型树枝状高分子化合物的制备方法,其合成路线如下:
上式vi、式vii所示化合物即分别为第1世代(第一层)、第2世代(第二层)l-天冬氨酸型树枝状高分子化合物。
第3世代(第三层)、第4世代(第四层)……第n世代(第n层)l-天冬氨酸型树枝状高分子化合物的制备方法以此类推,直至获得所需代数的树枝状高分子化合物。
上述l-天冬氨酸型树枝状高分子化合物的制备方法描述如下:
原料:丙三羧酸(propane-1,2,3-tricarboxylicacid);l-天门冬氨酸双苄酯(l-asparticaciddibenzylester)。
催化剂:n,n’-二环已基碳二亚胺(dcc,n,n’-dicyclohexylcarbodiimide)。
反应溶剂:n,n-二甲基甲酰胺(即dmf)。
产物及中间体的简化命名:1、第一层由丙三羧酸和l-天冬氨酸双苄酯合成的树状单环含酯基的多肽,以下简称单环肽酯(l-天冬氨酸型)。2、由所述单环肽酯脱保护得到的一层树状多肽,以下简称单环肽(l-天冬氨酸型)。3、由所述单环肽和l-天冬氨酸双苄酯合成的树状双环含酯基的多肽(l-天冬氨酸型),以下简称双环肽酯。4、由所述双环肽酯脱保护得到的二层树状多肽,以下简称双环肽(l-天冬氨酸型)。
具体地,上述l-天冬氨酸型树枝状高分子化合物的制备方法,包括以下步骤:
以l-天冬氨酸双苄酯和丙三羧酸原料为反应原料,以dmf为反应溶剂,以dcc为催化剂发生成肽反应,分离得到式xxii所示的化合物(单环肽酯);将所述式xxii所示的化合物(单环肽酯)脱保护得到vi所示的化合物(单环肽);然后以式vi所示的化合物(单环肽)和l-天冬氨酸双苄酯为原料,重复交替进行成肽反应和脱保护反应,直到得到含有3×2n个端基的树枝状高分子化合物。其中n为自然数,优选地,n为1-5,进一步优选为1-3。
例如,以l-天冬氨酸双苄酯和所述vi所示的化合物(单环肽)为原料,在dmf和n,n’-二环已基碳二亚胺存在条件下发生成肽反应,分离得到式xxiii所示的化合物(双环肽酯);将所述式xxiii所示的化合物(双环肽酯)脱保护得到vii所示的化合物(双环肽)。
所述成肽反应的条件为:反应物料摩尔比,丙三羧酸∶l-天冬氨酸双苄酯∶dcc为1∶3.5-4.5∶3-3.3;反应温度40±5℃;反应时间8h以上。
优选地,所述脱保护反应为水解反应,具体反应条件为:ph为2-3;反应时间4-6h;反应温度30±5℃。
更具体地,上述l-天冬氨酸型树枝状高分子化合物第1世代(即第一层,上式vi所示化合物)的制备方法,包括以下步骤:
1-1)单环肽酯的制备:
该步骤反应路线如下:
优选地,所述单环肽酯的制备方法包括:将原料l-天冬氨酸双苄酯和丙三羧酸在dmf和n,n’-二环已基碳二亚胺存在条件下反应完全,用盐酸、乙酸乙酯萃取,上层酯层依次用碳酸氢钠水溶液及饱和氯化钠水溶液洗涤,取上层有机相加热、搅拌溶解,降温、析出白色固体,抽滤,烘干,得单环肽酯粗品;
其中,优选地,所述原料丙三羧酸和l-天冬氨酸双苄酯的摩尔比为1∶3.5-4.5,进一步优选为1-4;
优选地,将所得单环肽酯粗品制得单环肽酯精制品,其方法包括:向所得单环肽酯粗品加入乙酸乙酯,加热回流,保温搅拌,然后降温,静置析晶,过滤,将晶体烘干,得单环肽酯精制品。
1-2)单环肽的制备:
该步骤反应路线如下:
优选地,所述单环肽的制备方法包括:将步骤1-1)所得单环肽酯(单环肽酯精粗品或单环肽酯精制品)溶解在甲醇和四氢呋喃的混合溶液中,搅拌下滴加盐酸,调节ph至2-3;反应结束,蒸去溶剂,降温得到白色固体;加入乙酸乙酯搅拌使其全部溶解,再加入稀盐酸萃取,静置分层,分去下层水相,上层有机相再加水萃取,静置分层,分去下层水相,上层有机相加无水硫酸钠干燥过夜;过滤,除去硫酸钠,得到澄清液;浓缩去溶剂,浓缩液析晶,过滤,得到单环肽白色固体潮品;
优选地,将所得单环肽白色固体潮品制得单环肽精制品,其方法包括:将所得单环肽白色固体潮品加氢氧化钠水溶液调节ph至8-9,使溶清(即溶解澄清,dissolvedclarification);通过透析袋进行透析(截留分子量1000);透析外液用盐酸调节ph至2-3,得到白色固体,过滤,纯水洗涤烘干,得到单环肽精制品,即为上述l-天冬氨酸型树枝状高分子化合物第1世代(即第一层,上式vi所示化合物)。
上述l-天冬氨酸型树枝状高分子化合物第2世代(即第二层,上式vii所示化合物)的制备方法,包括以下步骤:
2-1)双环肽酯的制备:
该步骤反应路线如下:
优选地,所述双环肽酯的制备方法包括:将原料l-天冬氨酸双苄酯和单环肽(即上式vi所示化合物)在dmf和n,n’-二环已基碳二亚胺存在条件下反应完全,用盐酸、乙酸乙酯萃取,上层酯层依次用碳酸氢钠水溶液及饱和氯化钠水溶液洗涤,将上层有机相干燥,过滤,滤液浓缩后,析晶,过滤,得到白色固体双环肽酯潮品;
其中,优选地,所述原料单环肽和l-天冬氨酸双苄酯的摩尔比为1∶6.5-7.5;
优选地,将所得双环肽酯潮品制得双环肽酯精制品,其方法包括:向所得双环肽酯潮品加入乙酸乙酯,加热至回流,保温搅拌,然后降温,静置析晶,过滤得到白色固体,再用纯水洗涤,过滤,烘干,得双环肽酯精制品;
2-2)双环肽的制备:
该步骤反应路线如下:
优选地,所述双环肽的制备方法包括:将步骤2-1)所得双环肽酯(双环肽酯潮品或双环肽酯精制品)溶解在甲醇和四氢呋喃的混合溶液中,搅拌下滴加盐酸,调节ph至2-3;反应结束,蒸去溶剂,降温得到白色固体;加入乙酸乙酯搅拌使其全部溶解,再加入稀盐酸萃取,静置分层,分去下层水相,上层有机相再加水萃取,静置分层,分去下层水相,上层有机相加无水硫酸钠干燥过夜;过滤,除去硫酸钠,得到澄清液;浓缩去溶剂,浓缩液析晶,过滤,得到双环肽白色固体潮品;
优选地,将所得双环肽白色固体潮品制得双环肽精制品,其方法包括:将所得双环肽白色固体潮品加氢氧化钠水溶液调节ph至8-9,使溶清(即溶解澄清,dissolvedclarification);通过透析袋进行透析(截留分子量2000);透析外液用盐酸调节ph至2-3,得到白色固体,过滤,纯水洗涤,烘干,得到双环肽精制品,即为上述l-天冬氨酸型树枝状高分子化合物第2世代(即第二层,上式vii所示化合物)。
第3世代(第三层)、第4世代(第四层)……第n世代(第n层)l-天冬氨酸型树枝状高分子化合物的制备方法以此类推。
上述l-谷氨酸型树枝状高分子化合物的制备方法,其合成路线如下:
l-谷氨酸型树枝状高分子化合物第3世代(第三层)、第4世代(第四层)……第n世代(第n层)的制备方法以此类推,直至获得所需代数的树枝状高分子化合物。
上述l-谷氨酸型树状化合物的制备方法描述如下:
原料:丙三羧酸(propane-1,2,3-tricarboxylicacid);l-谷氨酸双苄酯对甲苯磺酸盐(l-glutamicaciddibenzylester4-toluenesulfonate)。
催化剂:n,n’-二环已基碳二亚胺(dcc,n,n’-dicyclohexylcarbodiimide)。
反应溶剂:n,n-二甲基甲酰胺(即dmf)。
产物及中间体的简化命名:1、第一层由丙三羧酸和l-谷氨酸双苄酯合成的树状单环含酯基的多肽,以下简称单环肽酯(l-谷氨酸型)。2、由单环肽酯脱保护得到的一层树状多肽,以下简称单环肽(l-谷氨酸型)。3、由单环肽和l-谷氨酸双苄酯合成的树状双环含酯基的多肽,以下简称双环肽酯(l-谷氨酸型)。4、由双环肽酯脱保护得到的二层树状多肽,以下简称双环肽(l-谷氨酸型)。
具体地,上述l-谷氨酸型树枝状高分子化合物的制备方法,包括以下步骤:
以l-谷氨酸双苄酯和丙三羧酸原料为反应原料,以dmf为反应溶剂,以dcc为催化剂发生成肽反应,分离得到式xxiv所示的化合物(单环肽酯);将所述式xxiv所示的化合物(单环肽酯)脱保护得到xi所示的化合物(单环肽);然后以式xi所示的化合物(单环肽)和l-谷氨酸双苄酯为原料,重复交替进行成肽反应和脱保护反应,直到得到含有3×2n个端基的树枝状高分子化合物;其中n为自然数,优选地,n为1-5,进一步优选为1-3。
例如,以l-谷氨酸双苄酯和所述xi所示的化合物(单环肽)为原料,在dmf和dcc存在条件下发生成肽反应,分离得到式xxv所示的化合物(双环肽酯);将所述式xxv所示的化合物(双环肽酯)脱保护得到xii所示的化合物(双环肽)。
优选地,所述成肽反应的条件为:反应物料摩尔比,丙三羧酸∶l-谷氨酸双苄酯∶dcc为1∶3.5-4.5∶3-3.3;反应温度40±5℃;反应时间8h以上。
优选地,所述脱保护反应为水解反应,具体反应条件为:ph为2-3;反应时间4-6h;反应温度30±5℃。
更具体地,上述l-谷氨酸型树枝状高分子化合物第1世代(即第一层,上式xi所示化合物)的制备方法,包括以下步骤:
1-1)单环肽酯的制备:
该步骤反应路线如下:
优选地,所述单环肽酯的制备方法包括:将原料l-谷氨酸双苄酯和丙三羧酸在dmf和n,n’-二环已基碳二亚胺存在条件下反应完全,加入盐酸、乙酸乙酯萃取,上层酯层依次用碳酸氢钠水溶液及饱和氯化钠水溶液洗涤,取上层有机相加热、搅拌溶解,降温、析出白色固体,抽滤,烘干,得单环肽酯粗品;
其中,优选地,所述原料丙三羧酸和l-谷氨酸双苄酯的摩尔比为1∶3.5-4.5;进一步优选为1∶4。
优选地,将所得单环肽酯粗品制得单环肽酯精制品,其方法包括:向所得单环肽酯粗品加入乙酸乙酯,加热回流,保温搅拌,然后降温,静置析晶,过滤,将晶体烘干,得单环肽酯精制品。外观:白色粉末状固体。
1-2)单环肽的制备:
该步骤反应路线如下:
优选地,所述单环肽的制备方法包括:将步骤1-1)所得单环肽酯(单环肽酯精粗品或单环肽酯精制品)溶解在甲醇和四氢呋喃的混合溶液中,搅拌下滴加盐酸,调节ph至2-3;反应结束,蒸去溶剂,降温得到白色固体;加入乙酸乙酯搅拌使其全部溶解,再加入稀盐酸萃取,静置分层,分去下层水相,上层有机相再加水萃取,静置分层,分去下层水相,上层有机相加无水硫酸钠干燥过夜;过滤,除去硫酸钠,得到澄清液;浓缩去溶剂,浓缩液析晶,过滤,得到单环肽白色固体潮品;
优选地,将所得单环肽白色固体潮品制得单环肽精制品,其方法包括:将所得单环肽白色固体潮品加氢氧化钠水溶液调节ph至8-9,使溶清(即溶解澄清,dissolvedclarification);通过透析袋进行透析(截留分子量1000);透析外液用盐酸调节ph至2-3,得到白色固体,过滤,纯水洗涤烘干,得到单环肽精制品,即为上述l-谷氨酸型树枝状高分子化合物第1世代(即第一层,上式xi所示化合物)。
上述l-谷氨酸型树枝状高分子化合物第2世代(即第二层,上式xii所示化合物)的制备方法,包括以下步骤:
2-1)双环肽酯的制备:
该步骤反应路线如下:
优选地,所述双环肽酯的制备方法包括:将原料l-谷氨酸双苄酯和上述单环肽(即上式xi所示化合物)在dmf和n,n’-二环已基碳二亚胺存在条件下反应完全,用盐酸、乙酸乙酯萃取,上层酯层依次用碳酸氢钠水溶液及饱和氯化钠水溶液洗涤,将上层有机相干燥,过滤,滤液浓缩后,析晶,过滤,得到白色固体双环肽酯潮品;
其中,优选地,所述原料单环肽和l-谷氨酸双苄酯的摩尔比为1∶6.5-7.5;
优选地,将所得双环肽酯潮品制得双环肽酯精制品,其方法包括:向所得双环肽酯潮品加入乙酸乙酯,加热至回流,保温搅拌,然后降温,静置析晶,过滤得到白色固体,再用纯水洗涤,过滤,烘干,得双环肽酯精制品;外观:白色粉末状固体;
2-2)双环肽的制备:
该步骤反应路线如下:
优选地,所述双环肽的制备方法包括:将步骤2-1)所得双环肽酯(双环肽酯潮品或双环肽酯精制品)溶解在甲醇和四氢呋喃的混合溶液中,搅拌下滴加盐酸,调节ph至2-3;反应结束,蒸去溶剂,降温得到白色固体;加入乙酸乙酯搅拌使其全部溶解,再加入稀盐酸萃取,静置分层,分去下层水相,上层有机相再加水萃取,静置分层,分去下层水相,上层有机相加无水硫酸钠干燥过夜;过滤,除去硫酸钠,得到澄清液;浓缩去溶剂,浓缩液析晶,过滤,得到双环肽白色固体潮品;
优选地,将所得双环肽白色固体潮品制得双环肽精制品,其方法包括:将所得双环肽白色固体潮品加氢氧化钠水溶液调节ph至8-9,使溶清(即溶解澄清,dissolvedclarification);通过透析袋进行透析(截留分子量2000);透析外液用盐酸调节ph至2-3,得到白色固体,过滤,纯水洗涤,烘干,得到双环肽精制品,即为上述l-谷氨酸型树枝状高分子化合物第2世代(即第二层,上式xii所示化合物)。
l-谷氨酸型树枝状高分子化合物第3世代(第三层)、第4世代(第四层)……第n世代(第n层)的制备方法以此类推。
本发明还包括上述树枝状高分子化合物的用途,所述用途包括作为药物的载体、作为肿瘤靶向载体、螯合正二价及正二价以上的金属离子、螯合放射性同位素等。
当上述树枝状高分子化合物作为药物的载体时,其表面游离羧酸(-cooh)与药物分子上的羟基(-oh)或氨基(-nh2)脱水(-h2o)形成酯键(-coo-)或酰胺键(-conh-),键合组合成载体-药物的新化学结构。这种载体-药物的新化学结构的优点或有益效果是:具有良好的水溶性、生物相容性及生物降解性;载体表面分子上存在许多羧基,易连接许多药物分子,也可部分成盐,解决药物的水溶性;载体-药物接合物改变了药物原有的性质,使药物具有靶向性和缓释性等。
本发明上述树枝状高分子化合物的表面多个游离羧酸能螯合正二价以上的金属离子,可作为金属螯合剂;可螯合的金属包括:钙离子(ca2+)、铬离子(cr3+)、铁离子(fe3+)、铜离子(cu2+)、锗(ge)、砷(as)、铂(pt)、金(au)等。
本发明上述树枝状高分子化合物表面游离羧酸同样也能螯合临床上常用的放射性同位素(如:碘(131i)、金(198au)、汞(203hg)、锝(99mtc)、铟(113min)、铬(51cr)、钴(57、58co)、锶(85sr)、镓(67se)等。
本发明上述树枝状高分子化合物的表面游离羧酸(-cooh)与药物分子结合或螯合金属,剩余的表面游离羧酸(-cooh)可与钠(na+)或钾(k+)成羧酸盐(-coo-na+或-coo-k+),从而解决了水溶性的技术问题。
本发明上述树枝状高分子化合物还可用作为肿瘤靶向载体,其优点或有益效果是通过与抗肿瘤药物分子结构中的金属离子螯合形成大分子抗肿瘤药物。通过不同分子量的载体与药物螯合后,可以延长螯合后的药物在肿瘤区域的滞留时间,起到靶向作用,从而达到减少抗肿瘤药物的毒性和增强抗肿瘤药效的作用。
本发明还提供一种含有上述树枝状高分子化合物的组合物。所述组合物的用途包括作为药物的载体、作为肿瘤靶向载体、螯合正二价及正二价以上的金属离子、螯合放射性同位素或作为诊断剂或放疗剂。
附图说明
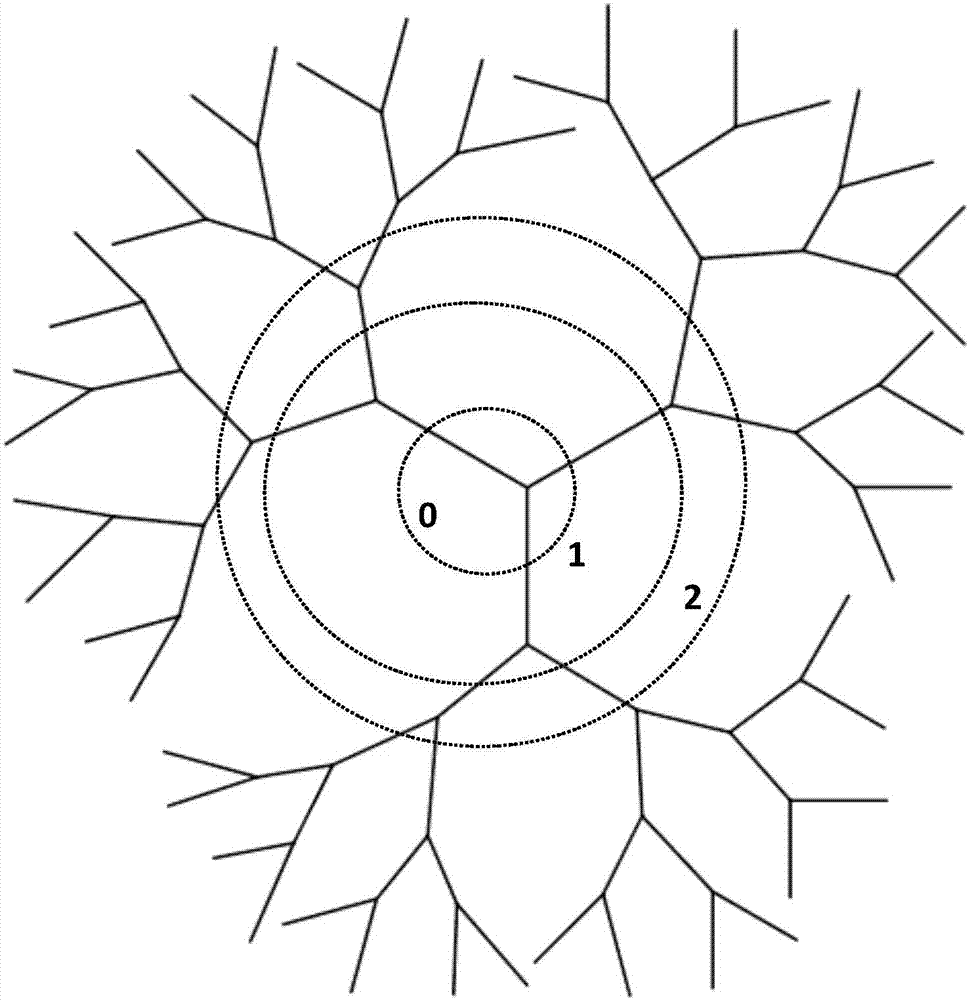
图1为本发明树枝状高分子化合物的结构示意图,其中0表示核心、1表示第1世代(即第一层)、2表示表示第2世代(即第二层)。
图2为l-天冬氨酸型单环肽酯(式xxii所示化合物)的质谱图。
图3为l-天冬氨酸型单环肽(式vi所示化合物)的质谱图。
图4为l-天冬氨酸型双环肽酯(式xxiii所示化合物)的质谱图。
图5为l-天冬氨酸型双环肽(式vii所示化合物)的质谱图。
图6为实验例1结果图。
图7为实验例2结果图。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
实施例1l-天冬氨酸型树枝状高分子化合物的制备
制备l-天门冬氨酸双苄酯:取天门冬氨酸双苄酯对甲苯磺酸盐58.26g(0.12mol)、乙酸乙酯500ml和2.5%的碳酸氢钠溶液500ml一起投入到反应瓶中,25℃下搅拌15min,静置分层,分去下层水相。收集上层有机相,加无水硫酸钠干燥后过滤,滤液50℃真空浓缩去乙酸乙酯,得到天门冬氨酸双苄酯黄色油状液体。
1、第一层合成(l-天冬氨酸型树枝状高分子化合物第1世代即第一层,式vi所示化合物)
单环肽酯(l-天冬氨酸型)的合成:向上述l-天冬氨酸双苄酯黄色油状液体中加入丙三羧酸5.28g(0.03mol)、dmf200ml、n,n’-二环已基碳二亚胺18.57-20.63g(0.09mol-0.1mol),40℃下搅拌反应8h停止反应。将反应液中倒入2000ml烧杯中,加入0.1n盐酸600ml,乙酸乙酯600ml,室温搅拌萃取30min,用分液漏斗静置后分液,分去下层水相。上层酯层再加入2.5%的碳酸氢钠水溶液600ml,室温搅拌洗涤30min,倒入分液漏斗中静置后分去下层水相。上层酯层再用600ml饱和氯化钠水溶液洗涤,分去下层水相。上层有机相为白色乳化物。将白色乳状物加热至70℃,搅拌溶解,自然降温至室温,析出白色固体。抽滤,得潮品。50℃鼓风烘干,得单环肽酯粗品约30.9g。
单环肽酯(l-天冬氨酸型)精制:将单环肽酯粗品30.9g,加乙酸乙酯400ml,加热至回流保温搅拌1h,降温至室温静置析晶12h。过滤,晶体50℃烘干,得单环肽酯精制品。外观:白色粉末状固体。收重:28.4g。收率:88.5%(以丙三羧酸计)。单环肽酯m/z(esi):1169.41/1157.92(见图2)。
2.第一层脱保护
单环肽(l-天冬氨酸型)合成:将单环肽酯10.6g(0.01mol)溶解在甲醇30ml和四氢呋喃30ml的混合溶液中,30℃温度搅拌下滴加2.0mol/l的盐酸,调节ph=2-3,继续保温搅拌4-6h,期间监控反应液酸度,补加盐酸使反应液酸度维持在ph=2-3。反应结束,60℃下真空浓缩蒸去溶剂,降温至室温得到白色固体。加入乙酸乙酯80ml搅拌使其全部溶解,再加入0.2mol/l的稀盐酸30ml,萃取,静置分层,分去下层水相。上层有机相再加水30ml,萃取,静置分层,分去下层水相,上层有机相加无水硫酸钠干燥过夜。过滤,除去硫酸钠,得到澄清液90ml。浓缩去溶剂50-60ml,浓缩液2-5℃下析晶12-16h,过滤,得到单环肽白色固体潮品。
单环肽(l-天冬氨酸型)精制:将上述单环肽白色固体潮品加5%的氢氧化钠水溶液调节ph=8-9,使溶清。通过截留分子量1000的透析袋进行透析。透析外液用1mol/l的盐酸调节ph=2-3,得到白色固体,过滤,纯水洗涤2遍,30℃鼓风烘干,得到单环肽精制品。收重:4.5g,收率82%(以单环肽酯计)。单环肽m/z(esi):500.11、518.12(见图3)。
3.第二层合成(l-天冬氨酸型树枝状高分子化合物第2世代,即第二层,式vii所示化合物)
l-天冬氨酸双苄酯对甲苯磺酸盐脱盐:取l-天冬双苄酯对甲苯磺酸盐26.7g(0.055mol)、乙酸乙酯200ml和2.5%的碳酸氢钠溶液200ml一起投入到反应瓶中,25℃下搅拌15min,静置分层,分去下层水相。收集上层有机相,加无水硫酸钠干燥后过滤,滤液50℃真空浓缩去乙酸乙酯,得到天冬氨酸双苄酯黄色油状液体。
双环肽酯(l-天冬氨酸型)的合成:向上述l-天冬氨酸双苄酯黄色油状液体中加入单环肽4.2g(0.0076mol)、dmf150ml、n,n’-二环已基碳二亚胺9.3-11.2g(0.0456-0.0547mol),40℃下搅拌反应8h,停止反应。反应液加入0.1n盐酸400ml和乙酸乙酯400ml,萃取,分液漏斗静置后分液,分去下层水相。上层酯层再加入2.5%的碳酸氢钠水溶液400ml洗涤酯层,分液漏斗中静置后分去下层水相。上层酯层再用400ml饱和氯化钠水溶液洗涤,分去下层水相。上层有机相干燥后,过滤,滤液真空浓缩后2-5℃下析晶12h,过滤,得到白色固体潮品15g。
双环肽酯(l-天冬氨酸型)精制:将上述白色固体潮品加乙酸乙酯400ml,加热至回流保温搅拌1h,降温至室温静置析晶14-18h。过滤得到白色固体,再用纯水100ml×2室温下搅拌洗涤30min,过滤,得到白色固体,30℃鼓风烘干,得双环肽酯精制品。外观:白色粉末状固体。收重:13.5g。收率:77.1%(以单环肽计)。双环肽酯m/z(esi):2314.13(见图4)。
4.第二层脱保护
双环肽(l-天冬氨酸型)合成:将双环肽酯11.5g(0.005mol)溶解在甲醇30ml和四氢呋喃30ml的混合溶液中,30℃温度搅拌下滴加2.0mol/l的盐酸,调节ph=2-3,继续保温搅拌6h,期间监控反应液酸度,补加盐酸使反应液酸度维持在ph=2-3。反应结束,60℃下真空浓缩蒸去溶剂,降温至室温得到白色固体。加入乙酸乙酯70ml搅拌使其全部溶解,再加入0.2mol/l的稀盐酸30ml,萃取,静置分层,分去下层水相。上层有机相再加入30ml水,萃取,静置分层,分去下层水相,上层有机相加无水硫酸钠干燥过夜。过滤,除去硫酸钠,得到澄清液80ml。浓缩去溶剂50ml,浓缩液2-5℃下析晶12-16h,过滤,得到双环肽白色固体潮品。
双环肽(l-天冬氨酸型)精制:将上述双环肽白色固体潮品加5%的氢氧化钠水溶液调节ph=8-9,使溶清。通过截留分子量2000的透析袋进行透析。透析外液用1mol/l的盐酸调节ph=2-3,得到白色固体,过滤,纯水洗涤2遍,30℃鼓风烘干,得到双环肽精制品。收重:4.8g,收率约80%(以双环肽酯计)。双环肽m/z(esi):1233.4、1248.2(见图5)。
第3世代(第三层)、第4世代(第四层)……第n世代(第n层)l-天冬氨酸型树枝状高分子化合物的制备方法以此类推。
实施例2l-谷氨酸型树枝状高分子化合物的制备
制备l-谷氨酸双苄酯:取l-谷氨酸双苄酯对甲苯磺酸盐59.95g(0.12mol)、乙酸乙酯500ml和2.5%的碳酸氢钠溶液500ml一起投入到反应瓶中,25℃下搅拌15min,静置分层,分去下层水相。收集上层有机相,加无水硫酸钠干燥后过滤,滤液50℃真空浓缩去乙酸乙酯,得到l-谷氨酸双苄酯黄色油状液体。
1.第一层合成(l-谷氨酸型树枝状高分子化合物第1世代,即第一层,式xi所示化合物)
单环肽酯(l-谷氨酸型)的合成:向上述l-谷氨酸双苄酯黄色油状液体中加入丙三羧酸5.28g(0.03mol)、dmf200ml、n,n’-二环已基碳二亚胺18.57-20.63g(0.09-0.1mol),40℃下搅拌反应8h停止反应。将反应液中倒入2000ml烧杯中,加入0.1n盐酸600ml,乙酸乙酯600ml,室温搅拌萃取30min,用分液漏斗静置后分液,分去下层水相。上层酯层再加入2.5%的碳酸氢钠水溶液600ml,室温搅拌洗涤30min,倒入分液漏斗中静置后分去下层水相。上层酯层再用600ml饱和氯化钠水溶液洗涤,分去下层水相。上层有机相为白色乳化物。将白色乳状物加热至70℃,搅拌溶解,自然降温至室温,析出白色固体。抽滤,得潮品。50℃鼓风烘干,得粗品约31.5g。
单环肽酯(l-谷氨酸型)精制:将单环肽酯粗品31.5g,加乙酸乙酯400-500ml,加热至回流保温搅拌1h,降温至室温静置析晶12-16h。过滤,晶体50℃烘干,得单环肽酯精制品。外观:白色粉末状固体。收重:26.5g。收率:84.0%(以丙三羧酸计)。
2.第一层脱保护
单环肽(l-谷氨酸型)合成:将单环肽酯10.5g(0.01mol)溶解在甲醇30ml和四氢呋喃30ml的混合溶液中,30℃温度搅拌下滴加2.0mol/l的盐酸,调节ph=2-3,继续保温搅拌4h,期间监控反应液酸度,补加盐酸使反应液酸度维持在ph=2-3。反应结束,60℃下真空浓缩蒸去溶剂,降温至室温得到白色固体。加入乙酸乙酯80ml搅拌使其全部溶解,再加入0.2mol/l的稀盐酸30ml,萃取,静置分层,分去下层水相。上层有机相再加入30ml水,萃取,静置分层,分去下层水相,上层有机相加无水硫酸钠干燥过夜。过滤,除去硫酸钠,得到澄清液85ml。浓缩去溶剂55-60ml,浓缩液2-5℃下析晶12-16h,过滤,得到单环肽白色固体潮品。
单环肽(l-谷氨酸型)精制:将上述单环肽白色固体潮品加5%的氢氧化钠水溶液调节ph=8-9,使溶清。通过截留分子量1000的透析袋进行透析。透析外液用1mol/l的盐酸调节ph=2-3,得到白色固体,过滤,纯水洗涤2遍,30℃鼓风烘干,得到单环肽精制品。收重:4.1g,收率80%(以单环肽酯计)。
3.第二层合成(l-谷氨酸型树枝状高分子化合物第2世代,即第二层,式xii所示化合物)
l-谷氨酸双苄酯对甲苯磺酸盐脱盐:取l-谷氨酸双苄酯对甲苯磺酸盐25.2g(0.0504mol)、乙酸乙酯200ml和2.5%的碳酸氢钠溶液200ml一起投入到反应瓶中,25℃下搅拌15min,静置分层,分去下层水相。收集上层有机相,加无水硫酸钠干燥后过滤,滤液50℃真空浓缩去乙酸乙酯,得到谷氨酸双苄酯黄色油状液体。
双环肽酯(l-谷氨酸型)的合成:向上述l-谷氨酸双苄酯黄色油状液体中加入单环肽3.57g(0.007mol)、dmf150ml、n,n’-二环已基碳二亚胺8.60-10.32g(0.042-0.0504mol),40℃下搅拌反应8h,停止反应。反应液加入0.1n盐酸400ml和乙酸乙酯400ml,萃取,分液漏斗静置后分液,分去下层水相。上层酯层再加入2.5%的碳酸氢钠水溶液400ml洗涤酯层,分液漏斗中静置后分去下层水相。上层酯层再用400ml饱和氯化钠水溶液洗涤,分去下层水相。上层有机相干燥后,过滤,滤液真空浓缩后2-5℃下析晶12h,过滤,得到白色固体潮品13g。
双环肽酯(l-谷氨酸型)精制:将上述白色固体潮品加乙酸乙酯400ml,加热至回流保温搅拌1h,降温至室温静置析晶14h。过滤得到白色固体,再用纯水100ml×2室温下搅拌洗涤30min,过滤,得到白色固体,30℃鼓风烘干,得双环肽酯精制品。外观:白色粉末状固体。收重:12.5g。收率:79.1%(以单环肽计)。
4.第二层脱保护
双环肽(l-谷氨酸型)合成:将双环肽酯11.3g(0.005mol)溶解在甲醇30ml和四氢呋喃30ml的混合溶液中,30℃温度搅拌下滴加2.0mol/l的盐酸,调节ph=2-3,继续保温搅拌6-8h,期间监控反应液酸度,补加盐酸使反应液酸度维持在ph=2-3。反应结束,60℃下真空浓缩蒸去溶剂,降温至室温得到白色固体。加入乙酸乙酯70ml搅拌使其全部溶解,再加入0.2mol/l的稀盐酸30ml,萃取,静置分层,分去下层水相。上层有机相再加入30ml水,萃取,静置分层,分去下层水相,上层有机相加无水硫酸钠干燥过夜。过滤,除去硫酸钠,得到澄清液80ml。浓缩去溶剂50-60ml,浓缩液2-5℃下析晶12-16h,过滤,得到双环肽白色固体潮品。
双环肽(l-谷氨酸型)精制:将上述双环肽白色固体潮品加5%的氢氧化钠水溶液调节ph=8-9,使溶清。通过截留分子量2000的透析袋进行透析。透析外液用1mol/l的盐酸调节ph=2-3,得到白色固体,过滤,纯水洗涤2遍,30℃鼓风烘干,得到双环肽精制品。收重:4.2g,收率约71.2%(以双环肽酯计)。
第3世代(第三层)、第4世代(第四层)……第n世代(第n层)l-谷氨酸型树枝状高分子化合物的制备方法以此类推。
实施例3
分别含有式v~式ix任一化合物的组合物。该组合物的用途包括作为药物的载体、作为肿瘤靶向载体、螯合正二价及正二价以上的金属离子、螯合放射性同位素或作为诊断剂或放疗剂。
实施例4
分别含有式xi~式xiv任一化合物的组合物。该组合物的用途是包括作为药物的载体、作为肿瘤靶向载体、螯合正二价及正二价以上的金属离子、螯合放射性同位素或作为诊断剂或放疗剂。
实验例1
分别将式vi和vii化合物在锝标后大鼠给药,考察是否可作为肿瘤靶向载体。本实验例中,通过实验考察了式vi和vii化合物在锝标后大鼠体内与肿瘤分子是否结合并具有影像跟踪功能。实验结果显示,式vi和vii化合物锝标后大鼠给药可以与肿瘤分子结合并具有影像跟踪功能。实验结果见图6。图6中a、b分别表示l-天冬氨酸型树枝状高分子化合物第1世代(即式vi所示化合物)及l-天冬氨酸型树枝状高分子化合物第2世代(即式vii所示化合物)锝标大鼠给药后2小时肿瘤(左小腿)影像。
实验例2
分别将式xi和xii化合物在锝标后大鼠给药,考察是否可作为肿瘤靶向载体。本实验例中,通过实验考察了式xi和xii化合物在小鼠体内与肿瘤分子是否结合并具有影像跟踪功能。实验结果显示,式xi和xii化合物锝标后大鼠给药可以与肿瘤分子结合并具有影像跟踪功能。实验结果见图7。图7中a、b分别表示l-谷氨酸型树枝状高分子化合物第1世代(即式xi所示化合物)及l-天冬氨酸型树枝状高分子化合物第2世代(即式vii所示化合物)锝标大鼠给药后2小时肿瘤(左小腿)影像。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!