耐氧驯化动物双歧杆菌乳亚种BZ11的高密度发酵方法与流程
本发明涉及微生物,特别涉及耐氧双歧杆菌,也涉及其发酵方法。
背景技术:
双歧杆菌可定殖在机体肠粘膜表面,是无任何毒副作用的生物反应调节剂,已被证实它是人体肠道内唯一的一种有益而无害的细菌,在调节人体的生理机能方面发挥着重要的作用。双歧杆菌具有抗菌、抗氧化、抗肿瘤、降血脂、增强免疫等多方面功能。
随人体年龄的增长,肠道内的双歧杆菌会显著减少,而人体内的益生菌要粘附在肠道表面且需达到一定数量之后才能发挥其益生作用,目前普遍认为肠内含物中的双歧杆活菌量要达到107CFU/mL以上。为了增加肠道内定殖的双歧杆菌的数量,人们通常选择服用一些富含高活性双歧杆菌菌体的食品或药品。但双歧杆菌对营养及生长环境要求较苛刻,这就需要实现双歧杆菌的高密度培养才能满足人们的生活需求。
细胞的高密度培养(high cell density culture)是指在体外人工模拟菌株在宿主体内生长的环境,使得经培养后的细胞密度超过常规培养的10倍左右,最终达到提高菌体的生物量或者特定代谢产物的目的。
多数双歧杆菌属专性厌氧菌,培养环境中氧成分会对其正常生长造成不同程度的影响,且代谢产物会不同程度地抑制菌体的生长,要实现其大规模细胞培养,需要严格控制培养条件,这给许多双歧杆菌制品的厂家带来了较大的困难。一直以来,在发酵罐上实现双歧杆菌的高密度培养是很多研究者们研究的焦点。目前,国内外通常围绕选育优良菌株,优化培养条件两方面来实现双歧杆菌的高密度培养。
目前中国专利数据库中,涉及耐氧双歧杆菌的专利申请件仅有浙江大学申请的ZL2009100965117号《一种耐氧性双歧杆菌》天津科技大学申请的ZL2011100894937号《一种耐氧耐酸性长双歧杆菌》和本申请人申请的201510018144.4号《一株香猪源性降胆固醇、耐氧双歧杆菌BZ11》,该申请件已于2015年5月公布。
技术实现要素:
本发明旨在提供耐氧驯化动物双歧杆菌乳亚种BZ11的高密度发酵方法,以1株经耐氧驯化后的性能优良的双歧杆菌乳BZ11为研究对象,采用优化培养基进行分批培养、分批补料培养,探究出影响双歧杆菌生长的因素,通过改进培养方式实现双歧乳杆菌BZ11的高密度培养。
动物双歧杆菌乳亚种BZ11(Bifidobacterium animalis subsp.Lactis)于2014年12月18日保藏于中国微生物菌种保藏委员会普通微生物中心(CGMCC),该中心地址:中国北京市朝阳区北辰西路1号院3号,中国科学院微生物也研究所,邮政编码100101;保藏编号为CGMCC NO.10224。该菌株从贵州特色资源小香猪的肠道内溶物中筛选与分离纯化得到。
发明人提供的耐氧驯化动物双歧杆菌乳亚种BZ11的高密度发酵方法包括以下两个步骤:
1动物双歧杆菌乳亚种BZ11的驯化
驯化目的是进一步提高该菌株的耐氧能力,为高密度发酵奠定基础,分离纯化的动物双歧杆菌乳亚种BZ11用PTYG培养基保存,通过逐渐增加培养基中氧分压对该菌株进行耐氧驯化,具体步骤如下:首先,在无菌条件下挑取纯化培养后的初始菌株单菌落接种到PTYG培养基在20%CO2培养箱进行培养;然后,采用2%的接种量在20%CO2培养箱进行传代培养,连续传代5次后转到生化培养箱培养;最后,在转速为150r/min的摇床上 振荡培养;驯化完毕后,测定菌株在生化培养箱中培养32h过程中的生长状况;
驯化结果的检测:比较驯化前后菌株在0~32h之內的OD600,活菌数以及pH,并进一步比较它们的形态特征和生理生化特征,以及降胆固醇能力,确保驯化后的菌株未发生任何变异。
2高密度发酵
首先制备胡萝卜汁、卷心菜汁:使用榨汁机分别按1∶2的料液比对胡萝卜和卷心菜进行榨汁,煮沸之后用8层纱布进行过滤,再重复煮沸过滤一次,取滤液即胡萝卜汁、卷心菜汁,用于制备优化培养基;接着制备盐溶液:取无水CaCl2 0.2g,K2HPO4 1.0g,KH2PO4 1.0g MgSO4·7H2O 0.48g,Na2CO3 10g,NaCl 2g;将CaCl2和MgSO4·7H2O混合放入300mL蒸馏水中直至溶解;加入500mL水,搅拌同时缓慢加入其他盐类,直至溶解,加入200mL蒸馏水,混合后贮存于4℃,得到盐溶液备用;之后制备PTYG培养基:取胰蛋白胨5g,大豆蛋白胨5g,酵母粉10g,葡萄糖10g,吐温801mL,L-半胱氨酸盐酸盐0.05g,盐溶液40mL,胡萝卜汁143.3mL,卷心菜汁177.8mL,蒸馏水1000mL,调pH值至6.5,121℃灭菌15min后,得到PTYG培养基,备用;
接着进行一系列试验:
⑴接种量试验:将驯化得到的动物双歧杆菌乳亚种BZ11菌种,分别以2%,4%,6%,8%,10%的接种量接种到250mL三角瓶装液量为50mL的优化培养基中进行培养,测定菌株在培养20h后吸光值,活菌数;通过试验,确定最佳接种量为10%;
⑵菌株的活化:将在-80℃低温冰箱里甘油保藏的耐氧驯化后菌种管取出,在37℃恒温水箱快速解冻,然后采用PTYG培养基进行活化,置于 20%C02培养箱,37℃下培养48h,挑取单菌落进行划线纯化,然后挑取单菌落接种到30mL液体培养基在20%CO2培养箱培养,备用;
⑶pH值的确定:实验证明,在不控制pH的分批培养过程中,菌株没有明显的延滞期,在培养16h后进入稳定期,在培养24h后活菌数达到最大为1.34×109cfu/mL;控制pH恒定时,菌株在培养8h后进入稳定期,菌株在培养28h时活菌数可达最大为2.33×109cfu/mL;采用恒pH进行指数分批补料培养时,相对不控制pH进行指数分批补料培养时活菌数提高了1.38倍,加入的碱液能够中和双歧杆菌在发酵培养过程中产生的酸性物质,和不控制pH分批培养和控制恒pH分批培养得出的结果一致;因此,为实现菌株的高密度培养,须使用1mol/L的NaOH溶液控制发酵液pH恒为6.0;
⑷重复分批补料培养试验:重复分批培养连续六次循环后,在培养39.5h时活菌数最大为2.57×109cfu/mL,显著高于分批培养和分批补料培养;
⑸膜过滤耦合分批补料培养试验:结果表明,菌株在分批补料期间随着新鲜的培养基的补入会对培养液进行稀释造成活菌数下降,之后在膜过滤培养过程中活菌数又出现上升;菌株在培养72h后,活菌数可达2.29×1010cfu/mL,提高了近一个数量级,相应的OD600可达到2.245;
最后进行高密度发酵:采用含有胡萝卜汁和卷心菜汁的优化的培养基对耐氧驯化后的菌株BZ11在5L发酵罐进行培养,控制的工艺条件为:接种量为10%,发酵液pH恒为6.0,发酵方式为膜过滤—耦合分批补料、膜过滤耦合分批补料培养。
上述PTYG培养基是按照以下方法制备的:①先制备盐溶液:取无水CaCl2 0.2g,K2HPO4 1.0g,KH2PO4 1.0g MgSO4·7H2O 0.48g,Na2CO3 10 g,NaCl 2g;将CaCl2和MgSO4·7H2O混合放入300mL蒸馏水中直至溶解;加入500mL水,搅拌同时缓慢加入其他盐类,直至溶解,加入200mL蒸馏水,混合后贮存于4℃,得到盐溶液备用;②取胰蛋白胨5g,大豆蛋白胨5g,酵母粉10g,葡萄糖10g,吐温801mL,L-半胱氨酸盐酸盐0.05g,盐溶液40mL,蒸馏水1000mL,调pH值至6.5,121℃灭菌15min后,得到PTYG培养基,备用。
上述初始菌株单菌落的培养中,每次培养时间均为32h,培养温度均为37℃,所采用的培养装置为250mL带棉筛三角瓶,装液量为50mL。
本发明的耐氧驯化动物双歧杆菌乳亚种BZ11的高密度发酵方法,在培养72h后活菌数可达到2.29×1010cfu/mL,是恒pH分批培养的9.8倍,是恒速分批补料培养的12.8倍,是重复分批补料培养的8.9倍,达到人们将其进行食品或医药添加所需的活菌数要求。适用于培养动物双歧杆菌乳亚种BZ11,使之服务于富含高活性双歧杆菌菌体的食品或药品生产,满足人们的生活需求。
附图说明
图1为耐氧驯化前后动物双歧杆菌的生长过程OD600变化的比较;
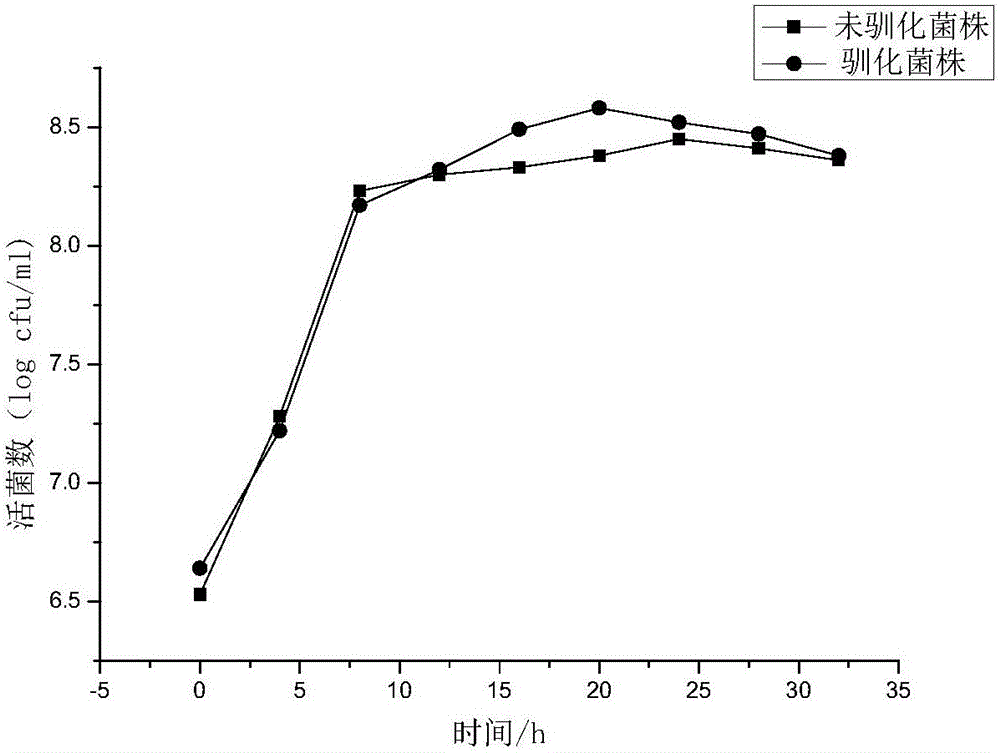
图2为耐氧驯化前后动物双歧杆菌的生长过程活菌数变化比较;
图3为耐氧驯化前后动物双歧杆菌的生长过程pH变化的比较;
图4为耐氧驯化前动物双歧杆菌乳亚种BZ11菌体形态;
图5为耐氧驯化后动物双歧杆菌乳亚种BZ11菌体形态;
图6耐氧动物双歧杆菌乳亚种BZ11的膜过滤培养模型图
图7为不同接种量对耐氧驯化后动物双歧杆菌乳亚种BZ11生长的影响;
图8为耐氧驯化后动物双歧杆菌乳亚种BZ11的分批培养发酵曲线图;
图9为耐氧驯化后动物双歧杆菌乳亚种BZ11的恒pH分批培养发酵曲线图;
图10为耐氧驯化后动物双歧杆菌乳亚种BZ11的恒速流加方式下的发酵曲线图;
图11为耐氧驯化后动物双歧杆菌乳亚种BZ11的指数流加培养发酵曲线图;
图12为耐氧驯化后动物双歧杆菌乳亚种BZ11的恒pH指数流加培养发酵曲线图;
图13为耐氧驯化后动物双歧杆菌乳亚种BZ11的重复分批培养发酵曲线图;
图14为耐氧驯化后动物双歧杆菌乳亚种BZ11的膜过滤耦合分批补料培养发酵曲线图。
具体实施方式
实施例1:从贵州省特色资源小香猪的肠道内溶物中筛选与分离筛选得到动物双歧杆菌BZ11:
1双歧杆菌BZ11的驯化
1.1双歧杆菌的耐氧驯化:
通过逐渐增加液体培养基中氧分压的方案进行驯化。具体步骤如下:首先,在无菌条件下挑取纯化培养后的初始菌株单菌落接种到PTYG培养基在20%CO2培养箱进行培养;然后,采用2%的接种量在20%CO2培养箱进行传代培养,连续传代5次后转到生化培养箱培养;最后,在转速为150r/min的摇床上振荡培养。每次培养时间均为32h,培养温度均为37℃,所采用的培养装置为250mL带棉筛三角瓶,装液量为50mL。驯化完毕后,测定菌株在生化培养箱中培养32h过程中的生长状况。
1.2驯化前后菌株性能比较:
比较驯化前后菌株在0~32h之內的OD600、活菌数以及pH,并进一步比较它们的形态特征和生理生化特征,以及降胆固醇能力,以确保驯化后的菌株并未发生任何变异。结果表明:菌株在耐氧驯化前后均可以在有氧条件下显著生长(p<0.05),菌株在培养4h后便可以进入对数生长期。按第一种方案驯化后的菌株在培养16~28h处于稳定期,在20h处活菌数达到最大为6.30×108cfu/mL,培养液OD600为0.938,pH值下降到3.38。随后将经过驯化后菌株测定48h后的降胆固醇能力,并与未驯化菌株进行比较,进一步对驯化菌株进行生理生化鉴定。结果表明:驯化后的菌株在有氧条件下培养20h后,活菌数可达到6.30×108cfu/mL,是初始菌株的2.24倍。驯化后菌株的降胆固醇率为(27.31±0.80)%,与初始菌株相比没有显著性差异(p>0.05)。通过鉴定得出,动物双歧杆菌乳亚种BZ11在耐氧驯化前后保持了相似的形态及生理生化特征,较驯化前菌株而言并未发生变异,可将其用于后续高密度发酵。形态特征见图4,图5,生理生化鉴定结果结果见表1。
表1耐氧驯化前后动物双歧杆菌乳亚种BZ11的生理生化鉴定结果
注:表中“+”表示阳性反应;“-”表示阴性反应。
2优化培养条件:
2.1菌株:
经过逐渐增加培养基中氧分压驯化得到的动物双歧杆菌乳亚种BZ11;
2.2培养基:
该环节使用的是优化后的培养基,使用榨汁机分别按1∶2的料液比对胡萝卜和卷心菜进行榨汁,煮沸之后用8层纱布进行过滤,再重复煮沸过滤一次,滤液即为胡萝卜汁、卷心菜汁,用于制备优化培养基;再制备盐溶液:取无水CaCl2 0.2g,K2HPO4 1.0g,KH2PO4 1.0g MgSO4·7H2O 0.48g,Na2CO3 10g,NaCl 2g;将CaCl2和MgSO4·7H2O混合放入300mL蒸馏水中直至溶解;加入500mL水,搅拌同时缓慢加入其他盐类,直至溶解,加入200mL蒸馏水,混合后贮存于4℃,得到盐溶液备用;之后取胰蛋白胨5g,大豆蛋白胨5g,酵母粉10g,葡萄糖10g,吐温801mL,L-半胱氨酸盐酸盐0.05g,盐溶液40mL,胡萝卜汁143.3mL,卷心菜汁177.8mL,蒸馏水1000mL,调pH值至6.5,121℃灭菌15min后,得到PTYG培养基,备用;
2.3接种量的优化:
分别采用2%,4%,6%,8%,10%的接种量接种到250mL三角瓶装液量 为50mL的优化液体培养基中进行培养,测定菌株在培养20h后吸光值(OD600),活菌数。
2.4.不同发酵方式比较:
菌株的活化:将在-80℃低温冰箱里甘油保藏的耐氧驯化后菌种管取出,在37℃恒温水箱快速解冻,然后采用PTYG培养基进行活化,置于C0220%(V/V)培养箱,37℃下培养48h,挑取单菌落进行划线纯化,然后挑取单菌落接种到30mL液体培养基在20%CO2培养箱培养,备用。
2.4.1不控制pH的分批培养
将活化后的菌株按10%接种量接种到装有270mL的优化培养基里,总体积300mL,置于20%CO2培养箱中培养24h后,再将培养好的300mL菌液接入事先灭菌好的5L发酵罐中,发酵罐中装液量为2700mL,接种后总体积为3L。通过调节控制面板,控制培养温度为37℃,转速150r/min。每隔4h用10mL无菌的注射器取样1次,共12次,来监测菌株在培养48h全过程中发酵液的吸光值OD600、活菌数并通过发酵罐控制面板读取实时发酵液的pH,绘制生长曲线。
2.4.2恒pH分批培养
将活化后的菌株按10%接种量接种到装有270mL的优化培养基里,总体积300mL,置于20%CO2培养箱中培养24h后,再将培养好的300mL菌液接入事先灭菌好的5L发酵罐中,发酵罐中装液量为2700mL,接种后总体积为3L。通过调节控制面板,控制培养温度为37℃,转速150r/min。在发酵前首先设定发酵罐控制面板上的pH恒为6.0,发酵过程中通过添加1mol/L的NaOH溶液反馈调节发酵液的pH,使之维持在pH 6.0。每隔4h用10mL无菌的注射器取样1次,共12次,来测定菌株在发酵48h全过程中发酵液的吸光值OD600、活菌数,绘制生长曲线。
2.4.3.分批补料培养
分批补料培养分为:恒速流加,指数流加,恒pH指数流加。5L发酵罐內初始装液量为2000mL,接种菌液225mL,接种后总体积2250mL。要保证发酵罐内发酵液体积为3000mL,故在不同时间段对发酵罐內进行补料。具体的补料过程如下表所示:
表2三种不同的补料流加方法
恒速流加是在控制发酵罐培养温度为37℃,转速150r/min,不控pH的情况下,在发酵8~16h补入750mL新鲜培养基,补料速度控制为1.56mL/min。每隔4h用无菌10mL注射器取样,共12次,测定发酵液的吸光值OD600,活菌数及pH变化。
指数流加是控制发酵罐培养温度为37℃,转速150r/min,不控pH的情况下,在发酵8h时补入新鲜培养基50mL,在发酵12h时补入新鲜培养基100mL,发酵16h时补入新鲜培养基200mL,发酵20h时补入新鲜培养基400mL。每隔4h用无菌10mL注射器取样,共12次,测定发酵液的吸光值OD600,活菌数,及pH变化。
恒pH指数流加是控制发酵罐培养温度为37℃,转速150r/min,在发酵过程中使用1mol/L的NaOH溶液控制发酵液的pH恒为6.0的情况下,在发酵8h时补入新鲜培养基50mL,在发酵12h时补入新鲜培养基100mL,发酵16h时补入新鲜培养基200mL,发酵20h时补入新鲜培养 基400mL。每隔4h用无菌10mL注射器取样,共12次,测定发酵液的吸光值OD600,活菌数。
2.4.4.重复分批补料培养
将活化后的菌株按10%接种量接种到装有270mL的优化培养基里,总体积300mL,置于20%CO2培养箱中培养24h后,再将培养好的300mL菌液接入事先灭菌好的5L发酵罐中,发酵罐中装液量为2700mL,接种后总体积为3L。通过调节控制面板,控制培养温度为37℃,转速150r/min。当pH值下降至恒定时,流出2250mL发酵液,然后泵入2250mL的新鲜培养基,每4.5h一个循环,连续循环6次。每隔4h用无菌10mL注射器取样,共12次,测定发酵液的吸光值OD600,活菌数及pH变化。
2.4.5.膜过滤耦合分批补料培养
①膜过滤培养装置
膜过滤耦合培养采用两个蠕动泵和一套错流过滤膜具组装而成的系统,其中采用的过滤膜是聚砜材质,膜孔径为50000Da,发酵前用0.5%的亚硫酸氢钠灭菌2h并用无菌蒸馏水反复清洗3~5次,有一只蠕动泵用来在发酵罐和外膜之间重复循环。
②试验流程
首先,将发酵罐装液2.7L进行高温高压灭菌,待冷却后按10%的接种量接入300mL培养48h后的种子液,接种到5L发酵罐中进行液体培养,控制发酵罐的装液量为3L,培养温度为37℃,转速150r/min,在发酵全过程中使用1mol/L的NaOH溶液控制发酵液的pH恒为6.0。然后进行膜过滤耦合培养,具体流程为发酵培养16h后开始采用膜过滤装置从发酵罐中过滤发酵液,控制在16~24h之间过滤出发酵液2L,过滤时可通过调节阀门大小控制滤液的流速。在24~32h过程中开始进行补 料,补入新鲜培养基体积为2L,下面按同样的方法进行,32~40h滤出发酵液2L,40~48h补入新鲜培养基2L,48~56h滤出发酵液2L,56~64h补入新鲜培养基2L,64~72h滤出发酵液2L后终止发酵。每隔4h用10mL无菌的注射器取样1次,共18次,测定发酵液的OD600,活菌数。
3高密度发酵:
采用含有胡萝卜汁和卷心菜汁的优化的培养基对耐氧驯化后的菌株BZ11在5L发酵罐进行培养,控制的工艺条件为:接种量为10%,发酵液pH恒为6.0,发酵方式为膜过滤—耦合分批补料、膜过滤耦合分批补料培养。
- 还没有人留言评论。精彩留言会获得点赞!