水稻抗细菌性条斑病主效基因BLS1的分子标记及其应用的制作方法
本发明涉及分子生物学领域,特别涉及水稻抗细菌性条斑病主效基因BLS1的分子标记。
背景技术:
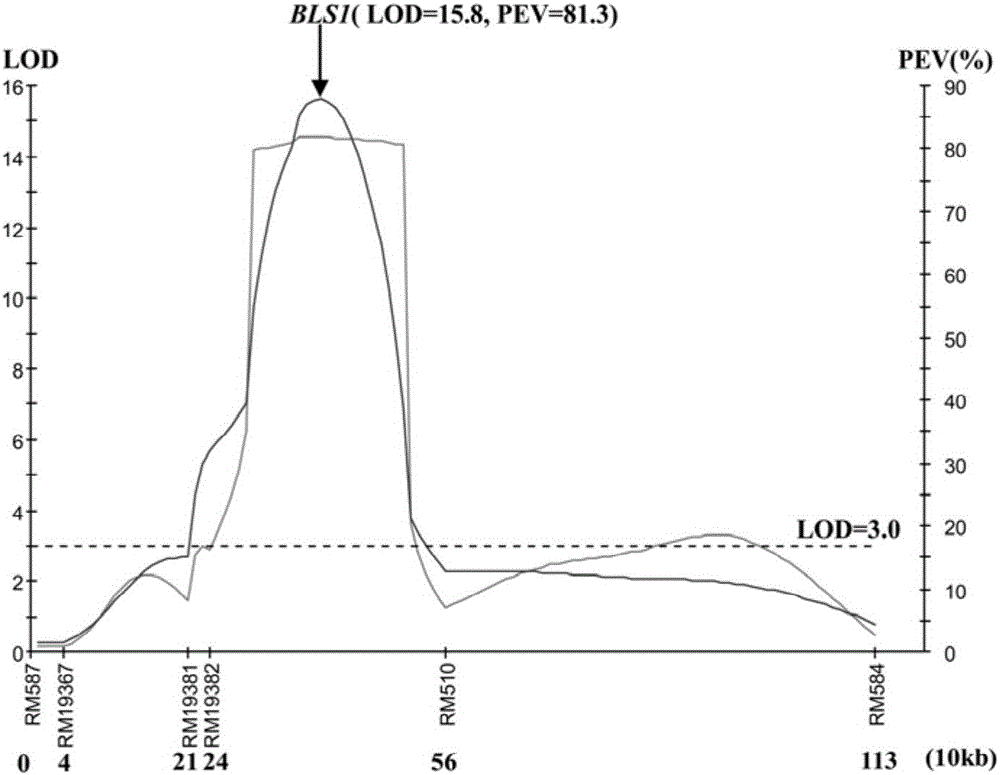
:细菌性条斑病(简称细条病)由病原菌Xanthomonasoryzepv.Oryzicola(Xoc)引起,是一种重要的水稻病害。该病害在爆发流行年份可导致水稻产量损失32%。栽培措施和农药使用是防治细条病的有效办法。但是,利用抗性资源培育抗性品种是防治该病害最为经济有效的办法。遗传分析表明存在主效基因和数量性状位点(Quantitativetraitlocus,QTL)等两种不同类型的抗性资源。目前关于抗细菌性条斑病主效基因分子标记应用研究尚很少见。稻种中抗细条病资源较丰富,但多数抗源主要来自热带地区,且大都是一些古老的地方品种,农艺性状比较差,因此,单靠常规育种方法改良,周期长,资源利用效率低。此外,对抗源开发力度不足,也是造成抗细条病育种进展缓慢的原因之一。细条病抗源中,主效基因控制的抗性是一种重要的抗源类型。关于抗细条病主效基因的研究,大多集中在抗源筛选和抗性遗传分析等方面,而对抗病基因的分子遗传机理研究较少,特别是有关基因的定位等分子基础研究尚不深入。因此,加强抗细条病主效基因的发掘利用,开发出可用于辅助育种的分子标记,可以大大提高这一种重要资源的利用效率。技术实现要素:鉴于上述内容,有必要加强抗细条病主效基因的发掘利用,开发出可用于辅助育种的分子标记,可以大大提高这一种重要资源的利用效率。为达到上述目的,本发明所采用的技术方案是:水稻抗细菌性条斑病主效基因BLS1的分子标记,其由下述之一的引物对经PCR扩增获得:(1)标记引物RM19382左端引物序列:CTGTTCTAGTGTTCTGGTATGGAACG,右端引物序列:GGGTAGTGAATGGAATGCTAAGACC;(2)标记引物RM19391左端引物序列:GCTTTGTGTTACAGGATGTGCTGTCC,右端引物序列:CAAAGCTTGGTACCTGCAAGACG;(3)标记引物RM19400左端引物序列:ACTCCCACTGCATTCAGACTGG,右端引物序列:TGATGTCACAAGCCACAACTAGC;(4)标记引物RM19402左端引物序列:ACCATTTGTCAGTGAACTACCC,右端引物序列:ATCAGAGCACCTAACACATAGC;(5)标记引物RM510左端引物序列:GTTTGACGCGATAAACCGACAGC,右端引物序列:ATGAGGACGACGAGCAGATTCC;其中,所述主效基因BLS1来自水稻抗细条病普通野生稻DP3及其衍生品种(系),扩增模板为水稻抗细条病普通野生稻DP3基因组;所述标记引物(1)-(5)的扩增长度分别为160bp、270bp、121bp、191bp以及193bp。如上所述的抗水稻抗细菌性条斑病主效基因BLS1的分子标记的方法,其所述标记引物(1)-(5)之一扩增待检水稻基因组DNA,如果用引物RM19382能够扩增出160bp的扩增片段,或者用引物RM19391能够扩增出270bp的扩增片段,或者用引物RM19400能够扩增出121bp的扩增片段,或者用引物RM19402能够扩增出191bp的扩增片段,或者用引物RM510能够扩增出193bp的扩增片段,则标志着该待检水稻存在抗细菌性条斑病主效基因BLS1。该基因位点位于RM19382和RM510之间的区域内,本发明利用分布于水稻12条染色体上,在亲本DP3和93-11间具有多态性的150个SSR标记进行BSA分析,分析重组单株的基因型和抗虫级别后发现,BLS1定位在RM19400和RM510之间21-kb的物理范围内;同时,分子标记RM19391、RM19400也均能用于筛选含BLS1基因的抗细菌性条斑病水稻品种。在本发明中,如上所述的分子标记在选育抗水稻抗细菌性条斑病水稻中的应用。筛选上述分子标记引物的的过程如下:一、主效基因BLS1的由来:最早由黄大辉等(2008)利用抗性鉴定筛选发现普通野生稻DP3对细菌性条斑病菌Ⅲ型具有抗性(黄大辉,岑贞陆,刘驰,贺文爱,陈英之,马增凤,杨朗,韦绍丽,刘亚利,黄思良,杨新庆,李容柏。野生稻细菌性条斑病抗性资源筛选及遗传分析。植物遗传资源学报,2008,9(1):11-14)。He等(2012)通过遗传分析表明DP3携带一对隐性抗细菌性条斑病基因并将其暂时命名为bls1,将该基因定位在RM587和RM510之间4.0-cM的区域(HeWA,HuangDH*,LiRB,QiuYF,SongJD,YangHN,ZhengJX,HuangYY,LiXQ,LiuC,ZhangYX,MaZFandYanY.Identificationofaresistancegenebls1tobacterialleafstreakinwildriceOryzarufipogonGriff.JournalofIntegrativeAgriculture,11(6):962-969)。该基因已经在Oryzabase(http://www.shigen.nig.ac.jp/rice/oryzabase/top/top.jsp)上注册,并正式命名为BLS1。二、定位分离群体的构建:将抗细条病普通野生稻DP3作为供体(♂),感细条病籼稻品种93-11为受体(♀),通过杂交、回交和多代自交构建回交重组自交系(BC1F5);通过抗性鉴定,从回交重组自交系中筛选出抗病单株(♂),与93-11(♀)杂交,获得F1杂交种,杂交种自交收获F2代种子,再种植获得定位分离群体回交重组自交系F2。三、抗性鉴定:在水稻分蘖期,将广泛分布于广西的优势致病型细菌性条斑病代表菌株JZ28(Ⅲ型)采用针刺法对所有材料进行接种,然后将接种后的菌株JZ28首先在NA培养基上培养48h后,再用无菌水配成3×108cfu/ml悬浮液;将接种后的培养20天后,测量接种后稻株稻叶病斑长度,按照以下标准对病情进行分级评价抗性级别:0级,免疫(I),伤口无症状或仅有褐点;1级,高抗(HR),病斑长0.1-0.5cm;3级,抗(R),病斑长0.6-1.0cm;5级,中抗(MR),病斑长1.1-1.5cm;7级,感病(S),病斑长1.6-2.5cm;9级,高感(HS),病斑长度大于2.5cm。四、BLS1基因初步定位:采用CTAB法(Murray&Thompson,1980Rapidisolationofhigh-molecular-weightplantDNA.NucleicAcidsRes8:4321-4325)提取抗病亲本DP3(供体)、感病亲本93-11(受体)和F2群体各单株水稻叶片基因组DNA进行SSR分子标记分析。采用混合分组分析法(bulked.segregantanalysis,BSA)对分离群体进行分析,对抗性基因进行初步定位。选择分布于水稻12条染色体上,在亲本DP3和93-11间进行SSR标记进行BSA分析,选择出抗感池,再在亲本间表现出多态性的标记,对近等基因系F2分离群体单株进行分析,通过MapQTL5.0软件绘制连锁遗传图谱,将BLS1基因初步定位。五、BLS1基因紧密连锁标记开发:在初步定位的区域之间,新合成2个位于在初步定位的区域之间的多态性SSR引物RM19391和RM19400,通过SSR分子标记检测一定数量的极端抗性单株(抗性强于或等于抗性亲本DP3),对极端抗性单株进行分析,将BLS1定位范围缩小到RM19391和RM510之间的范围,再在RM19391和RM510之间再开发2个多态性标记RM19400和RM19402,检测由1021株极端抗性单株构成的大群体,检测重组单株的基因型和抗虫级别得到与抗细菌性条斑病主效基因BLS1共分离的分子标记。本发明具有以下有益效果:(1)通过本发明首次用SSR标记定位了水稻品种抗细条病普通野生稻DP3及其衍生品种(系)中的抗细菌性条斑病主效基因BLS1;(2)通过本发明分子标记定位的主效基因位点位置明确,鉴定方便。通过检测与该基因位点连锁的分子标记,即可以预测水稻植株的细菌性条斑病抗性,用于水稻品种或品系的基因型检测,以判断该品种或品系是否具有细菌性条斑病抗性,进而快速筛选抗虫品种或品系用于水稻育种,大大提高抗细条病水稻的选择效率,获得含有BLS1基因的抗细条病水稻品种,且其检测方便快速,不受环境影响;(3)辅助育种选择目标明确,节约成本。在传统育种方法中,首先要收集具有抗虫基因的亲本与栽培品种进行一系列杂交,而且要对水稻品种进行抗细菌性条斑病性状的鉴定并进行选择,操作非常复杂,同时还受环境的影响。此外,在进行抗虫鉴定之前,首先要获得虫源并饲养繁殖细菌性条斑病群体,同时还要求接种虫源与水稻秧苗苗龄较同步,这同样给育种工作带来麻烦,若不能有效地处理好虫源、秧苗以及环境之间的关系,抗细菌性条斑病的表型鉴定结果可靠性就很低。因此,抗虫育种不仅费时,而且难度大,成本高。然而,通过检测抗细菌性条斑病主效基因位点,可以在苗期就鉴定出高抗细菌性条斑病的单株,淘汰其它植株,不仅节约生产成本而且大大提高抗细菌性条斑病水稻材料的选择效率,极大地缩短水稻品种的育种周期。【附图说明】图1为近等基因系F2分离群体单株病斑长度分布图;图2为主效基因BLS1基因第六染色体初步定位图;附图标记:利用MapQTL5软件,通过整合F2群体的基因型和表型数据,计算出图谱遗传距离、LOD值和PEV值;LOD值和PEV值分别对应Y轴的左边和右边;分子标记在X轴,遗传单位距离为10kb;LOD值显著水平设为3.0;曲线深色和曲线浅色分别表示LOD值和PEV值;图3为主效基因BLS1基因精细定位图;附图标记:a表示确认BLS1位于RM19391和RM510之间;b表示将BLS1在RM510和RM19400之间21-kb的范围内;遗传图a、b上排数字表示分子标记间的遗传距离,遗传图a、b下排数据表示分子标记与BLS1之间的遗传重组单株;小写字母n表示检测的单株数;c表示精细定位区域基因型纯合重组单株检测。【具体实施方式】本说明书中公开的所有特征,或公开的所有方法或过程中的步骤,除了互相排斥的特征和/或步骤以外,均可以以任何方式组合。本说明书(包括任何附加权利要求、摘要)中公开的任一特征,除非特别叙述,均可被其他等效或具有类似目的的替代特征加以替换。即,除非特别叙述,每个特征只是一系列等效或类似特征中的一个例子而已。实施例1:一、主效基因BLS1的由来:最早由黄大辉等(2008)利用抗性鉴定筛选发现普通野生稻DP3对细菌性条斑病菌Ⅲ型具有抗性(黄大辉,岑贞陆,刘驰,贺文爱,陈英之,马增凤,杨朗,韦绍丽,刘亚利,黄思良,杨新庆,李容柏。野生稻细菌性条斑病抗性资源筛选及遗传分析。植物遗传资源学报,2008,9(1):11-14)。He等(2012)通过遗传分析表明DP3携带一对隐性抗细菌性条斑病基因并将其暂时命名为bls1,将该基因定位在RM587和RM510之间4.0-cM的区域(HeWA,HuangDH*,LiRB,QiuYF,SongJD,YangHN,ZhengJX,HuangYY,LiXQ,LiuC,ZhangYX,MaZFandYanY.Identificationofaresistancegenebls1tobacterialleafstreakinwildriceOryzarufipogonGriff.JournalofIntegrativeAgriculture,11(6):962-969)。该基因已经在Oryzabase(http://www.shigen.nig.ac.jp/rice/oryzabase/top/top.jsp)上注册,并正式命名为BLS1。二、定位分离群体的构建:将抗细条病普通野生稻DP3作为供体,感细条病籼稻品种93-11为受体,通过杂交、回交和多代自交构建近等基因系;通过抗性鉴定,从近等基因系中筛选出抗病单株,与93-11杂交,获得F1杂交种,杂交种自交收获F2代种子,再种植获得定位分离群体近等基因系F2。三、抗性鉴定:在水稻分蘖期,将广泛分布于广西的优势致病型细菌性条斑病代表菌株JZ28(Ⅲ型)对抗病亲本DP3(供体)、感病亲本93-11(受体)和F2群体各单株及相应后代家系进行接种,将接种的菌株JZ28首先在NA培养基上培养48h后,再用无菌水配成3×108cfu/ml悬浮液。其中接种为采用针刺法进行接种:把2根针距为0.8cm的大头针固定在橡皮上灭菌备用;用直径9cm、厚度2cm的无菌海绵碟吸足悬浮液后置于培养皿内;选择生长一致的完全展开叶片,将叶片中部平置于海绵碟上,用插入橡皮的大头针刺透稻叶后(稻叶中脉间隔2个针孔),轻摁压海绵挤出悬浮液每株接菌3张叶片,每叶6个针刺点,期间注意补充悬浮液。接种20天后,测量稻叶病斑长度,按照以下标准对病情进行分级:0级,免疫(I),伤口无症状或仅有褐点;1级,高抗(HR),病斑长0.1-0.5cm;3级,抗(R),病斑长0.6-1.0cm;5级,中抗(MR),病斑长1.1-1.5cm;7级,感病(S),病斑长1.6-2.5cm;9级,高感(HS),病斑长度大于2.5cm。经过本申请人研究得到图1抗性鉴定结果,从图1可以表明:普通野生稻DP3抗细条病,平均抗病指数为0.8;93-11感细条病,平均抗性指数为9.0;近等基因系F2分离群体单株病斑长度呈双峰分布,这说明细条病抗性为主效基因/QTL与微效基因/QTLs互作控制。四、BLS1基因初步定位:1.用CTAB法(Murray&Thompson,1980Rapidisolationofhigh-molecular-weightplantDNA.NucleicAcidsRes8:4321–4325)提取亲本及F2群体各单株的基因组DNA。2.根据gramene网站(http://www.gramene.org/)公布的SSR分子标记,按照较均匀的遗传距离选择一定数目分子标记进行合成。3.SSR标记的分析参照Temnykh的方法(Temnykhetal,2000Mappingandgenomeorganizationofmicrosatellitesequencesinrice.TheorApplGenet100:697–712)。10μl反应体系包括:10mMTris-HClpH8.3,50mMKCl,1.5mMMgCl2,50μMdNTPs,0.2μM引物,0.5UTaqpolymerase和20ngDNA模板。扩增反应在PTC-100PCR仪上进行:94℃2min;94℃15sec,55℃30sec,72℃1.5min,35个循环;72℃5min。扩增产物用6%的聚丙烯酰氨凝胶进行分离,通过银染显色(Zhuetal,2004Identificationandcharacterizationofanewblastresistancegenelocatedonricechromosome1throughlinkageanddifferentialanalyses.Phytipathology94:515-519)。扩增的DNA条带利用装有荧光灯的灯箱进行观察。记录结果,亲本间有多态的引物在F2群体中进行分析,获取群体基因型资料。4.采用混合分组分析法(bulked.segregantanalysis,BSA)对分离群体进行分析,对抗性基因进行初步定位。在前期研究中,我们把抗水稻细菌性条斑病主效基因BLS1定位于水稻第6染色体SSR标记和RM587和RM510之间4.0厘摩(cM)的范围。为进一步确定该结果,利用分布于水稻12条染色体上,在亲本DP3和93-11间具有多态性的150个SSR标记进行BSA分析。根据F2单株的抗病级别,分别选择10个极端抗虫单株和10个极端感病单株的DNA混合构建抗、感池。BSA分析结果表明只有连续分布在同一区域的3个标记RM510、RM587和RM584在抗感池间表现出多态性,说明BLS1分布于该区域;为了进一步缩小BLS1的定位区域,利用6个在亲本间表现出多态性的标记,对146个近等基因系F2分离群体单株进行分析,通过MapQTL5.0软件绘制连锁遗传图谱,将BLS1基因定位在RM19382和RM510之间的区域(见图2),且BLS1能够解释细条病抗性变异的81.3%(见图2)。五、BLS1基因紧密连锁标记及其结果与分析:为了开发获得与细条病抗性主效基因BLS1紧密连锁的分子标记,新合成2个位于RM19382和RM510之间的多态性SSR引物RM19391和RM19400,通过SSR标记检测364个极端抗性单株(抗性强于或等于抗性亲本DP3),发现在RM510能检测到1株重组单株,在RM19382能检测到5株重组单株(见图3的a部分);在5株RM19382能检测到的单株中,在RM19391有3株重组单株,在RM19400没检测到重组单株(见图3的a部分),因此,经分析364个极端抗性单株,BLS1定位范围缩小到RM19391和RM510之间的范围(见图3的a部分)。为了更进一步精细定位BLS1,在RM19391和RM510之间再开发2个多态性标记RM19400和RM19402,检测由1021株极端抗性单株构成的大群体(见图3的b部分),发现在RM510检测到1个重组单株,在RM19391检测到4株重组单株,在19400检测到2株重组单株,RM19402检测到0株重组单株(见图3的b部分),将RM19402与BLS1共分离。分析结果将BLS1定位在RM19400和RM510之间21-kb的物理范围内。表1分子标记筛选的重组单株的基因型及表现型单株编号RM19382RM19391RM19400RM19402RM510表型抗性值DP3AAAAA高抗0.893-11BBBBB高感9.0A1AAAAB高抗0.7A226BBBAA高抗0.8A1024BBBAA高抗0.6C1BBBBB高感9.0C2AAAAA高抗0.8由表1可知,BLS1位于RM19400和RM510之间21-kb的物理范围内。实施例2:分子标记的验证1、材料和方法1.1材料阴性品种:10份,感虫品种93-11、抗性亲本DP3、DP3X93-11育种组合中的不抗虫材料8份。阳性品种:抗虫品种DP3和93-11XDP3育种组合中的抗虫材料9份。分子标记引物:RM19382、RM19391、RM19400、RM19402、RM510。1.2方法CTAB抽提法提取水稻样品基因组DNA(方法同实施例1)。分别用引物RM19382、RM19391、RM19400、RM19402和RM510扩增样品DNA。反应体系中包括0.10μM的引物、250μMdNTP、1×PCR反应缓冲液(50mMKCl、10mMTris-HClpH8.3、1.5mMMgCl2)、100ng的DNA模板、1UTaq酶。反应程序为:94℃预变性5min,循环(94℃0.5min、55℃0.5min、72℃0.5min)30次,最后72℃延伸10min。PCR扩增产物在6%的聚丙烯胺凝胶电泳分离。电泳后用硝酸银银染法染色后读图分析。2、结果:用上述方法,分别对水稻品种DP3等二十份不同样本进行扩增。结果表明,在阳性样本中均能分别扩增出相应的160bp片段、270bp片段、121bp片段、191bp片段以及193bp片段,而在阴性样本中均不能扩增出这些片段。由此说明,本发明提供的分子标记方法能够准确筛选出含有抗细菌性条斑病的主效基因,从而大大提高育种效率。上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1