一种以聚氨基酸修饰的聚苯乙烯树脂为载体的固定化酶及其制备方法与流程
本发明属于酶工程技术领域,具体涉及一种固定化酶载体及其制备方法。
背景技术:
酶固定化是将酶分子束缚或限制于一定区域内,使其仍能进行特有的催化反应,并可回收及重复利用的一种酶工程技术。与游离酶相比,固定化酶在保持了酶特有的催化活性的同时,还呈现出稳定性高,分离回收容易,可重复操作使用,工艺简便等一系列优点。
固定化酶的性能主要取决于固定化方法和所用的载体材料。吸附法、共价结合法、交联法以及包埋法等都是比较常见的酶的固定化的传统方法。其中吸附法因操作简单方便、吸附容量较大、工艺成本低等优点,是固定化酶最常用的方法。常用的载体分为有机载体和无机载体,有机载体包括琼脂糖、葡聚糖、纤维素等天然高分子载体,及聚乙烯、聚苯乙烯和聚丙烯酸酯等合成有机高分子载体;无机载体包括氧化硅、氧化钛、氧化铝陶瓷、硅藻土等。载体的结构与性能对于固定化酶的催化活性以及稳定性有着重大影响。
研究表明,不同基质的酶固定化载体的表面电荷性质(电荷零点值,pzc)不同,导致它的表面微环境的pH值产生差异,而pH值的高低变化对酶的活性和酶分子的稳定性也有较大影响。因此,选择酶固定化载体时,不仅要考虑酶负载量的大小和连接的牢固性,同时也需兼顾载体表面的电荷性质,使载体表面电荷环境与酶的最适pH相匹配。但由于目前缺乏各类载体表面电荷性质的相关数据,且无法实现对载体表面电荷性质的调控方法,使得人们在选择酶固定化载体时的盲目性较大。
氨基酸是一类两性电解质,其基本结构中有1个α-NH2和1个α-COOH,而酸性或碱性氨基酸的侧链上还分别含有游离的-COOH和-NH2,这些活性基团在特定的酸碱环境下可电离成-NH3+和-COO-,具有一定的缓冲能力。不同聚合度、不同氨基酸组合的聚氨基酸具有不同的等电点和缓冲范围。因此,通过合理的序列设计,并结合固相合成的方法,将不同的聚氨基酸片段接枝于载体表面,便可得到各种具有不同表面电荷性质的酶固定化载体。这类功能性载体表面存在一定厚度,且具有缓冲能力的扩散双电层,其等电点即为接枝的聚氨基酸片段的pI值,当扩散双电层的pI值与目标酶的最适pH值相匹配时,可为酶分子提供一个稳定、适宜的催化微环境,减少外界条件(如pH值、温度等)对酶活的影响,提高固定化酶的稳定性。但目前有关这方面的方法、技术均未见报道。
技术实现要素:
本发明要解决的技术问题是提供一种以聚氨基酸修饰的聚苯乙烯树脂为载体的固定化β-葡萄糖苷酶,以提高β-葡萄糖苷酶的稳定性和使用效率。
本发明还要解决的技术问题是提供上述固定化酶的制备方法。
为解决上述技术问题,本发明的思路是,β-葡萄糖苷酶是一种应用广泛的工业生物催化剂,但稳定性较差。本发明以β-葡萄糖苷酶为目标酶,将等电点为4.09、聚合度为10的聚氨基酸片段接枝于氨甲基聚苯乙烯树脂,在载体表面形成一种稳定的弱酸性环境;通过物理吸附将β-葡萄糖苷酶(GLU)结合于经修饰的载体上,由于载体表面电荷环境与天然酶的最适pH值相近,且具有较强的缓冲能力,使天然酶的稳定性得到大幅提高。
本发明采用的技术方案如下:
一种以聚氨基酸修饰的聚苯乙烯树脂为载体的固定化酶,包括酶和固定所述酶的载体;
其中,
所述的酶为β-葡萄糖苷酶;
所述的载体为聚氨基酸修饰的氨甲基聚苯乙烯树脂颗粒,所述的聚氨基酸,其氨基酸序列为:Arg-Asp-Glu-Glu-Lys-Lys-Asp-Asp-Asp-Asp,等电点为4.09,表达式为RDEEKKDDDD,氨基酸序列中的羧基端氨基酸Asp与树脂上的氨甲基脱水缩合形成肽键相连。
其中,所述的氨甲基聚苯乙烯树脂为氨甲基、苯乙烯和二甲基丙烯酸乙二醇酯通过共聚作用形成的交联聚苯乙烯树脂;颗粒粒径为100-150μm,担载量为0.6-0.8mmol/g,表达式为DEG-AM,该树脂可以直接从市场上购买得到。
聚氨基酸修饰物通过多肽固相合成的方法接枝于聚苯乙烯树脂颗粒表面,形成弱酸性的,且具有一定缓冲能力的扩散双电层结构。本发明采用上述聚氨基酸修饰的聚苯乙烯树脂为载体固定化β-葡萄糖苷酶,由于载体表面的电荷环境与β-葡萄糖苷酶的最适pH值(约为4.5左右)相近,其表面的扩散双电层对酶分子结构具有保护作用,显著提高了固定化酶的操作稳定性。
上述以聚氨基酸修饰的聚苯乙烯树脂为载体的固定化酶的制备方法,它包括如下步骤:
步骤一、载体的制备:
采用多肽固相合成法,将聚氨基酸修饰物与氨甲基聚苯乙烯树脂偶联得到载体;
步骤二、固定化酶的制备:
将载体加入β-葡萄糖苷酶溶液中,低温振荡反应1~3h,将液体滤出,用缓冲液淋洗,抽干后即得。
步骤一包括如下步骤:
(1)向氨甲基聚苯乙烯树脂中加入溶剂,溶胀4-8h后,抽掉溶剂;
(2)按照氨基酸序列中的从羧基端到氨基端的顺序,依次将各个具有保护基的氨基酸偶联到树脂上;所述的具有保护基的氨基酸为Fmoc-Asp(OtBu)-OH、Fmoc-Lys(Boc)-OH、Fmoc-Glu(OtBu)-OH和Fmoc-Arg(Pbf)-OH;其中,-Fmoc为α-氨基保护基,括弧中的保护基为R基中的酸碱基团的保护基;
(3)切除氨基酸上的侧链保护基。
步骤(1)中,所述的溶剂为N,N-二甲基甲酰胺(DMF)。
步骤(2)中,偶联过程中,使用的缩合试剂为HoBt和DIC的组合物,所述的氨基酸、HoBt、DIC和树脂的物质的量的比为5~2:6~2:6~2:1;所述的脱除氨基保护基的方法是使用20%v/v哌啶的N,N-二甲基甲酰胺溶液,反应8-15min。
步骤(3)中,切除氨基酸上的侧链保护的方法是:将切割液加入具有保护基的载体中,切割反应2-3h后,过滤掉滤液,分别用甲醇和二氯甲烷交替洗涤4次,保证最后一遍使用甲醇进行洗涤,最后用水将其洗涤至中性,抽干既得所需的载体;所述的切割液包括如下体积百分比的组分:95%三氟乙酸,2.5%三异丙基硅烷,2.5%H2O。
步骤二中,β-葡萄糖苷酶溶液中,β-葡萄糖苷酶的浓度为0.3~30mg/mL,溶剂为50mM pH5.0的柠檬酸-磷酸氢二钠缓冲液;对于每g干重的载体,β-葡萄糖苷酶溶液的用量为5~15mL。
步骤二中,β-葡萄糖苷酶的酶活范围为0.112~48.99U/mg。
酶活定义如下:以对硝基苯酚-β-D-葡萄糖苷(pNPG)为底物,每分钟水解生成1μmol对硝基苯酚所需要的酶量。
步骤二中,所述的低温为3-10℃。
步骤二中,所述的缓冲液为50mM pH5.0的柠檬酸-磷酸氢二钠缓冲液。
本发明的技术路线如图1所示。
有益效果:本发明利用以氨甲基聚苯乙烯树脂为载体,通过固相合成方法接枝等电点为4.09的聚氨基酸片段,获得一种表面弱酸性(电荷零点值pzc为4.3)的功能性载体。这种功能性载体表面扩散双电层中的电荷环境与β-葡萄糖苷酶的最适pH接近,有利于酶分子保持稳定的催化活性;同时,扩散双电层还可减轻外界环境的改变对β-葡萄糖苷酶酶活的影响。以本发明方法制得的固定化酶载体DEG-AM-DDDDKKEEDR对GLU的吸附量较未改性树脂DEG-AM明显提高;固定化酶DEG-AM-DDDDKKEEDR-GLU的最适温度和最适pH值与游离的GLU相近,且稳定性有大幅提高。
附图说明
图1本发明的技术路线图。
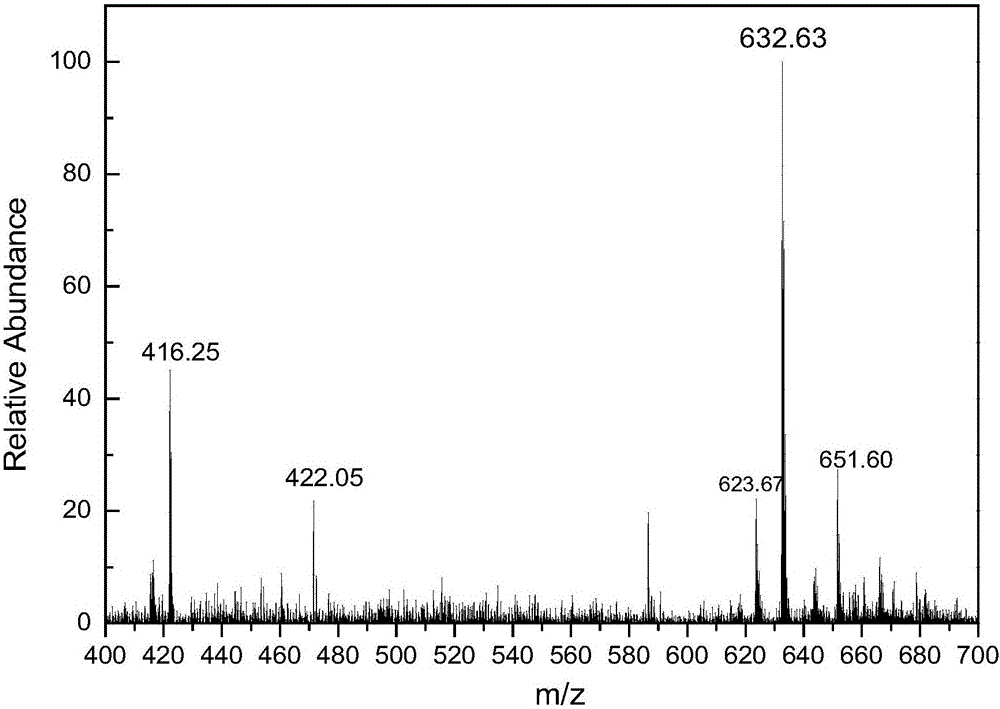
图2为肽链RDEEKKDDDD的质谱图,其分子量为1264.22,图中632.63对应肽链的双电荷峰[M+2]2+,证明RDEEKKDDDD的序列正确。
图3为表面改性前后DEG-AM载体的Zeta电位比较。图中显示,DEG-AM的pzc值为5.8,经聚氨基酸改性后的载体的pzc为4.3,说明接枝等电点为4.09的肽链对载体表面的电荷环境有显著的影响。
图4为游离酶和DEG-AM-DDDDKKEEDR-GLU的最适作用pH。图中显示,游离酶和固定化酶的最适pH值均为pH 5.0左右。
图5为游离酶和DEG-AM-DDDDKKEEDR-GLU的最适作用温度。图中显示,固定化酶的最适作用温度较游离酶提高了10℃。
图6为游离酶和DEG-AM-DDDDKKEEDR-GLU的操作稳定性。图中显示,DEG-AM-DDDDKKEEDR-GLU的半衰期长达24天以上,而游离酶的酶活半衰期不足6天。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
实施例中酶活力检测方法如下:
酶活定义:以对硝基苯酚-β-D-葡萄糖苷(pNPG)为底物,每分钟水解生成1μmol对硝基苯酚所需要的酶量。
测定方法:取0.1ml适当稀释的酶液或适量固定化酶与5mmol/l、pH5.0的pNPG溶液0.9ml(分别预热5min)混合后,于50℃水浴摇床振荡反应10min。立即加入2ml、1mol/lNa2CO3溶液终止反应,在410nm下测定吸光度。以0.1ml蒸馏水或空载体为空白对照。
以下实施例所述的DEG-AM Resin购自于天津南开合成科技有限公司。
以下实施例所述的GLU购自于sigma公司,酶活为≥6U/mg。
实施例1:DEG-AM-DDDDKKEEDR载体的制备
(1)称取DEG-AM Resin(担载量0.7mmol/g)3g(2.1mmol)置于带有过滤装置的固相合成反应管中,加入N,N-二甲基甲酰胺(DMF)溶胀4h后抽掉;称量4.2mmolFmoc-Asp(OtBu)-OH、4.2mmol HoBt和4.2mmol DIC用10ml DMF溶解后放入反应器中;N2鼓吹反应2.5h后过滤反应液,加入DMF洗涤树脂3次。
(2)取步骤(1)得到的少量树脂于离心管中,向其中依次加入乙醇溶液、茚三酮溶液,然后将其置于105℃的油锅中反应5分钟,反应结束后,观察离心管中的溶液颜色。
(3)若显色反应为明黄色,则加入20%v/v哌啶/二甲基甲酰胺溶液,反应10min,重复加入20%哌啶洗涤3次后,脱除氨基保护基。再用DMF洗涤3次。
(4)称量Fmoc-Asp(OtBu)-OH、HoBt、DIC各4.2mmol,用10ml DMF溶解后放入反应管中,进行鼓吹反应。使保护氨基酸活化,进行耦合反应形成肽键。
(5)按照Asp-Asp-Asp-Asp-Lys-Lys-Glu-Glu-Asp-Arg的氨基酸顺序,氨基酸和缩合试剂的用量和Fmoc-Asp(OtBu)-OH相同,重复缩合和脱保护反应,合成所需的肽链。
(6)将切割液10ml(95%v/v三氟乙酸(TIF),2.5%v/vTIS(三异丙基硅烷),2.5%v/v H2O)加入上面得到的保护肽-树脂中,切割反应2h后,过滤掉滤液,分别用甲醇(MeOH),二氯甲烷(DCM)交替洗涤4遍,保证最后一遍使用MeOH进行洗涤。最后用水将其洗涤至中性,抽干既得所需的改性树脂。测得氨基酸链与树脂的连接效率为78%。
实施例2:DEG-AM-DDDDKKEEDR载体的制备
(1)称取DEG-AM Resin(担载量0.7mmol/g)5g(3.5mmol)置于带有过滤装置的多肽固相合成反应管中,加入二甲基甲酰胺(DMF)溶胀8h后抽掉。按5倍担载量投料:称量17.5mmol Fmoc-Asp(OtBu)-OH、17.5mmol HoBt和17.5mmol DIC用20ml DMF溶解后放入反应器中,N2鼓吹,反应3h后过滤掉反应液,加入DMF洗涤树脂3次。
(2)取少量树脂于离心管中,向其中依次加入乙醇溶液、茚三酮溶液,然后将其置于105℃的油锅中反应5分钟,反应结束后,观察离心管中的溶液颜色。
(3)若显色反应为明黄色,加入20%v/v哌啶/二甲基甲酰胺溶液,反应10min,重复加入20%哌啶洗涤4次后,脱除氨基保护基。再用DMF洗涤3次。
(4)缩合氨基酸:称量Fmoc-Asp(OtBu)-OH、HoBt、DIC各17.5mmol,用20ml DMF溶解后放入反应管中,进行鼓吹反应。使保护氨基酸活化,进行耦合反应形成肽键。
(5)按照Asp-Asp-Asp-Asp-Lys-Lys-Glu-Glu-Asp-Arg的氨基酸顺序,氨基酸和缩合试剂的用量和Fmoc-Asp(OtBu)-OH相同,重复缩合和脱保护反应,合成所需的肽链。
(6)将切割液15ml(95%v/v三氟乙酸(TIF),2.5%v/vTIS(三异丙基硅烷),2.5%v/vH2O)加入上面得到的保护肽-树脂中,切割反应3h后,过滤掉滤液,分别别用甲醇(MeOH),二氯甲烷(DCM)交替洗涤4遍,保证最后一遍使用MeOH进行洗涤。最后用水将其洗涤至中性,抽干既得所需的改性树脂。测得氨基酸链与树脂的连接效率为85%。
实施例3:DEG-AM-DDDDKKEEDR-GLU的制备
将所获得的固定化酶载体应用于β-葡萄糖苷酶的固定化中。称取以实施例2中较优选方法制备好的DEG-AM-DDDDKKEEDR 0.5g置于反应管中,按固液比1g:15mL加入GLU酶液(酶液浓度为1.5mg/ml),于4℃,150rpm摇床振荡1h;反应结束后滤除反应液,用50mM pH5.0的柠檬酸-磷酸氢二钠缓冲反复淋洗4次,抽滤抽干后既得DEG-AM-DDDDKKEEDR-GLU。GLU吸附量为12mg/g树脂。
实施例4:DEG-AM-DDDDKKEEDR-GLU的制备
将所获得的固定化酶载体应用于β-葡萄糖苷酶的固定化中。称取以实施例2中较优选方法制备好的DEG-AM-DDDDKKEEDR 1.0g置于反应管中,按固液比1g:5mL加入GLU酶液(酶液浓度为10mg/ml),于4℃,150rpm摇床振荡1h;反应结束后滤除反应液,用50mM pH 5的柠檬酸-磷酸氢二钠缓冲反复淋洗4次,抽滤抽干后既得DEG-AM-DDDDKKEEDR-GLU。GLU吸附量为14.8mg/g树脂。
实施例5:DEG-AM-DDDDKKEEDR-GLU的最适pH
按照实施例4方法制得固定化酶。向相同体积、不同pH值(pH值分别为3.0、4.0、5.0、6.0、7.0)的柠檬酸-磷酸氢二钠缓冲液中加入pNPG至终浓度为5mmol/l,再分别加入等量酶活的固定化酶或游离酶,测定游离酶和固定化酶在不同pH条件下的酶活,以酶活最高值为100%,计算不同pH条件下的相对酶活力。结果如图4所示:
游离酶和DEG-AM-DDDDKKEEDR-GLU的最大酶活均出现在pH5.0左右,但pH值的变化对DEG-AM-DDDDKKEEDR-GLU的影响相对较小,在pH3.0的条件下,DEG-AM-DDDDKKEEDR-GLU的相对酶活有37.65%,而游离酶的相对酶活都不足6%。
实施例6:游离酶和DEG-AM-DDDDKKEEDR-GLU的最适温度比较
按照实施例4方法制得固定化酶。向相同体积、pH值均为5.0的柠檬酸-磷酸氢二钠缓冲液中加入pNPG至终浓度为5mmol/l,再分别加入等量酶活的固定化酶或游离酶;将上述反应液分别在在35℃,45℃,55℃,65℃,75℃的温度条件下测定酶活,以酶活最高值为100%,计算不同温度下的相对酶活力。结果如图5所示,游离酶的最适反应温度为55℃;固定化酶的酶活随温度的变化趋势与游离酶相似,但DEG-AM-DDDDKKEEDR-GLU的最高酶活出现在65℃左右,较游离酶提高了10℃。
实施例7:游离酶和DEG-AM-DDDDKKEEDR-GLU的操作稳定性
按照实施例4方法制得固定化酶。取一定量酶活的DEG-AM-DDDDKKEEDR-GLU或游离酶置于4℃冰箱贮存,定期取出测定酶活,初始酶活记为100%,计算固定化酶和游离酶经不同贮存时间和不同使用次数后的残余酶活。如图6所示,游离酶在存放3天后,残余酶活力为63.74%,存放15天后残余酶活下降到11.2%,24天后残余酶活为3.05%;而经氨基酸修饰后的载体固定化酶DEG-AM-DDDDKKEEDR-GLU,贮存15天后残余酶活为91.17%,24天后其残余酶活仍可达初始值的76.78%,显示出良好的稳定性。
- 还没有人留言评论。精彩留言会获得点赞!