一种与植物应对干旱胁迫相关的miRNA——ghr‑miR01及其应用的制作方法
本发明涉及一种抗旱相关的新miRNA,尤其是一种来源于棉花的、能够用于分析和调节棉花抗旱性的新miRNA;本发明还涉及此miRNA的前体、其前体的编码基因及其用途。
背景技术:
非生物胁迫影响植物的生长发育,影响农作物的产量,干旱胁迫是重要的非生物胁迫之一。在干旱胁迫下,棉花根系向土壤深层伸展,地上部分的主茎、果枝均受到抑制,节间缩短,植株变小,根茎比增大。另外,干旱胁迫下,棉花叶片气孔部分或完全关闭,光合作用受到影响,蕾铃脱落增加,降低产量。全世界干旱与半干旱地区耕地面积共约2.74亿公顷,占总耕地的20%,对棉花抗旱性进行研究,扩大干旱和半干旱地区棉花种植面积对解决棉花供需矛盾和棉粮争地矛盾意义重大。
miRNA是近年来研究发现的一种长20-24 nt的内源性非蛋白编码RNA。miRNA基因最初转录产生pri-miRNA,然后在核内被Drosha酶加工成大约70 nt的具有颈环结构的pre-miRNA。随后pre-miRNA被转运出核,在细胞质中被Dicer酶作用,加工成成熟的miRNA。通过序列互补与特定靶基因的mRNA结合,引起mRNA降解或抑制mRNA翻译从而对基因的表达起到负调节作用(Llave et al., 2002; Palatnik et al., 2003; Tang et al., 2003)。近年来,越来越多的研究表明miRNA在植物非生物胁迫应答机制中有非常重要的作用,相关miRNAs被不断报道。棉花中,已有研究证明miRNA在抗盐、抗旱等非生物胁迫响应机制中有重要作用。
本发明中,利用solexa技术,分别对正常条件下和干旱胁迫条件下生长的棉花叶片中小RNA进行测序,及前体序列分析,鉴定得到棉花中干旱胁迫相关的新的miRNA,并利用Real-time PCR技术对其在干旱胁迫下的表达模式进行了验证。
技术实现要素:
本发明要解决的技术问题是提供一种与植物应对干旱胁迫相关的miRNA——ghr-miR01,本发明同时提供此miRNA的前体序列及其前体的编码基因序列,利用此miRNA能够分析和调节棉花的抗旱性,对棉花应对环境胁迫的试验研究进而培育优良的棉花品种具有实际应用意义。
为解决上述技术问题,本发明所采取的技术方案如下。
一种与植物应对干旱胁迫相关的miRNA,其具有序列表中SEQ ID NO:1所示的核苷酸序列。
上述miRNA的前体序列,其具有序列表中SEQ ID NO:3所示的核苷酸序列。
上述miRNA前体序列的编码基因,其具有序列表中SEQ ID NO:4所示的核苷酸序列。
上述miRNA对应的DNA序列,其具有序列表中SEQ ID NO:2所示的核苷酸序列。
上述所述miRNA的cDNA Gene Specific RT Primer的引物序列,其具有序列表中SEQ ID NO:5所示的核苷酸序列。
上述miRNA在实时荧光定量PCR操作中的引物序列,ghr-miR01F具有序列表中SEQ ID NO:6所示的核苷酸序列,ghr-miR01R具有序列表中SEQ ID NO:7所示的核苷酸序列; U6-F具有序列表中SEQ ID NO:8所示的核苷酸序列;U6-R具有序列表中SEQ ID NO:9所示的核苷酸序列。
上述的miRNA在植物应对干旱胁迫试验分析中的应用,通过实时荧光定量PCR法测定所述miRNA在植物中的表达模式,如果与非胁迫植物相比所述miRNA在目的植物中表达未明显上调(比如上调不足2倍),提示目的植物未受到干旱胁迫,则返回修改试验设计。
上述的miRNA在植物应对非干旱胁迫试验分析中的应用,在植物应对非干旱胁迫试验的分析中,通过实时荧光定量PCR方法测定所述miRNA在植物中的表达模式,如果与非胁迫植物相比所述miRNA在目的植物中的表达未明显上调(比如上调不足2倍),则排除目的植物受到干旱胁迫的影响,从而排除干旱胁迫对非干旱胁迫试验数据的影响。
上述的miRNA在培育抗旱转基因植物中的应用,在目的植物中过表达SEQ ID NO:1所示的miRNA,或采用其反义寡核苷酸抑制SEQ ID NO:1所示miRNA的表达,或过表达SEQ ID NO:4所示miRNA前体的基因序列,培育出具有高抗旱性的转基因目的植物。
上述miRNA的应用优选实施在棉花作物品种上。
采用上述技术方案所产生的有益效果在于:
本发明提供了一种新的棉花miRNA,Solexa测序和实时荧光定量PCR检测结果表明,本发明miRNA的表达受到干旱胁迫的调节,说明其在棉花适应干旱胁迫机制中起重要作用。
基于此,可以在植物应对干旱胁迫的试验分析中,通过实时荧光定量PCR法测定miRNA在植物中的表达模式来确认目的植物是否受到干旱胁迫,避免实验操作失误导致的试验结果偏差。
在植物应对非干旱胁迫的应激试验研究中,还可以利用本发明的miRNA检测目的植物是否受干旱胁迫的影响。在植物应对非干旱胁迫试验的分析中,通过实时荧光定量PCR方法测定所述miRNA在植物中的表达模式,如果与非胁迫植物相比所述miRNA在目的植物中的表达未明显上调,则排除目的植物受到干旱胁迫的影响,从而排除干旱胁迫对非干旱胁迫试验数据的影响。
另外,本发明的研究强烈的提示上述miRNA还可应用于培育抗旱转基因植物,即在目的植物中过表达SEQ ID NO:1所示的miRNA,或采用其反义寡核苷酸抑制SEQ ID NO:1所示miRNA的表达,或过表达SEQ ID NO:4所示miRNA前体的基因序列,培育出具有高抗旱性的转基因目的植物。
附图说明
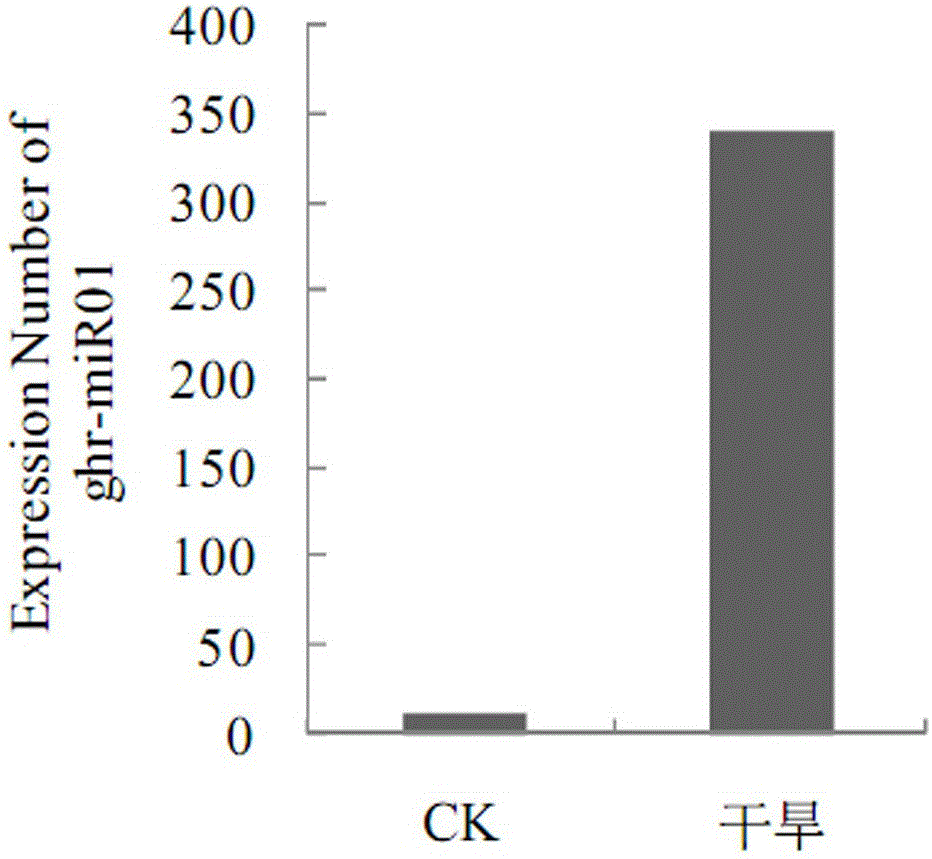
图1为ghr-miR01在Solexa测序中非干旱胁迫和干旱胁迫条件下表达次数的比较,结果显示,ghr-miR01在正常生长条件下表达数为12,干旱处理后表达次数为339,表明ghr-miR01的表达受到干旱胁迫的调节,说明其在棉花适应干旱胁迫机制中起重要作用。
图2为ghr-miR01前体序列的茎环结构图,可见其前体序列折叠成一种稳定的茎环结构,属于miRNA前体典型的二级结构,符合miRNA前体的结构特征。
图3为实时荧光定量PCR对ghr-miR01在干旱胁迫条件下和正常条件下表达特征的分析结果,结果显示ghr-miR01的表达受干旱诱导明显上调,达19.1倍,说明其在棉花适应干旱胁迫机制中起重要作用。
具体实施方式
以下实施例详细说明了本发明。本发明所使用的各种原料及各项设备均为常规市售产品,均能够通过市场购买直接获得。以下实施例中的定量试验,设置三次重复实验,结果取平均值。
本发明提供的miRNA来源于棉花(石早1号棉花)叶片,命名为ghr-miR01,其长度为21nt;参看附图2,其前体序列可折叠成一种稳定的茎环结构,属于miRNA前体典型的二级结构,符合miRNA前体的结构特征。
实施例1:Solexa测序分析验证ghr-miR01在棉花抗旱机制中的作用
一、材料培养及干旱处理:石早1号棉花种子播种于蛭石和营养土3:1混合的基质的培养盆中,温度为28 ℃,相对湿度为70%。对照材料分别于播种后第7、14、21、28天浇水,每次浇水150 mL,第35天取幼嫩叶片,液氮冷冻,-80 ℃储藏;干旱处理材料分别于播种后第7、14、21浇水,每次浇水150 mL,第35天取幼嫩叶片,液氮冷冻,-80 ℃储藏。
二、Solexa测序分析及新miRNA的鉴定:上步所得样品送往上海美吉生物公司,进行solexa测序及分析。参看图1,结果显示,ghr-miR01在正常生长条件下表达数为12,干旱处理后表达次数为339,这表明ghr-miR01的表达受到干旱胁迫的调节,说明其在棉花适应干旱胁迫机制中起重要作用,在棉花中过表达ghr-miR01,或采用其反义寡核苷酸抑制ghr-miR01的表达,将影响棉花对干旱胁迫的适应能力,培育出具有高抗旱性的转基因棉花,对提高棉花的产量具有重大的意义。用Mfold在线软件对其前体序列进行二级结构预测,结果显示符合miRNA前体的发夹结构特征(图2):要有较低的折叠自由能能量,RNA和其周围序列应该形成一个发夹式的二级结构;小RNA序列在二级结构的臂部即位于5′arm或3′臂上;在前体发夹结构上,miRNA最多只能有6 nt的错配;前体发夹结构上,miRNA与miRNA*之间没有大的loop 或break。
实施例2:Real-time PCR分析验证ghr-miR01在棉花抗旱机制中的作用
一、材料培养及NaCl处理
石早1号棉花种子播种与蛭石和营养土3:1混合的基质的培养盆中,温度为28 ℃,相对湿度为70%。对照材料分别于播种后第7、14、21、28天浇水,每次浇水150 mL,第35天取幼嫩叶片,液氮冷冻,-80 ℃储藏;干旱处理材料分别于播种后第7、14、21浇水,每次浇水150 mL,第35天取幼嫩叶片,液氮冷冻,-80℃储藏。
二、RNA的分离
用GIANGEN公司的多糖多酚植物总RNA提取试剂盒(目录号:DP441)提取总RNA,提取方法如下:
1、匀浆处理。50-100 mg叶样用液氮在研钵内快速磨碎,加入500 μL已加入β-巯基乙醇的SL液,立即涡旋剧烈震荡;
2、12,000 rpm 离心2 min;
3、将上清液转移至过滤柱CS上,12,000 rpm 离心2 min,小心吸取收集管中的上清至新的RNase-Free的离心管中,吸头避免接触收集管中的细胞碎片沉淀;
4、缓慢加入0.4倍上清体积的无水乙醇,混匀,将得到的溶液和沉淀一起转入吸附柱CR3中,12,000 rpm离心15 sec,倒掉收集管中的废液,将吸附柱CR3放回收集管中;
5、向吸附柱CR3中加入350 μl 去蛋白液RW1,12,000 rpm离心15 sec,倒掉收集管中的废液,将吸附柱CR3放回收集管中;
6、DNase I 工作液的配制:取10 μl DNase I 储存液放入新的RNase-Free离心管中,加入70 μl RDD溶液,轻柔混匀;
7、 向吸附柱CR3中央加入80 μl的DNase I 工作液,室温放置15 min;
8、向吸附柱CR3中加入350 μl 去蛋白液RW1,12,000 rpm离心15 sec,倒掉收集管中的废液,将吸附柱CR3放回收集管中;
9、向吸附柱CR3中加入500 μl漂洗液RW(使用前先加入乙醇),12,000 rpm离心15 sec,倒掉收集管中的废液,将吸附柱CR3放回收集管中;
10、 重复步骤9;
11、12,000 rpm离心2 min,将吸附柱CR3放入一个新的RNase-Free离心管中,向吸附膜的中间部位悬空滴加30-50 μl RNase-Free ddH2O,室温放置2 min,12,000 rpm离心1 min,得到RNA溶液。
三、反转录为cDNA
用TaKaRa公司的PrimeScript RT reagent kit with gDNA Eraser试剂盒,将提取的RNA转录为cDNA。
1、去除基因组DNA。在冰上配置10.0 μl反应体系混合液:5×gDNA Eraser Buffer, 2.0 μl; gDNA Eraser, 1.0 μl; Total RNA, 2.0 μl; RNase Free dH2O, 5.0 μl。轻轻混匀上述配制的反应液,短暂离心使得管壁上的反应液沉落,42 ℃反应2 min,4 ℃存放用于下步实验。
2、反转录反应。在冰上配置内参基因U6所用混合液:步骤1的反应液,10.0 μl;PrimeScript RT Enzyme Mix 1, 1.0 μl; RT Primer Mix, 4.0 μl; 5×PrimeScript Buffer 2,4.0 μl;RNase Free dH2O, 1.0 μl;总体积,20 μl,轻轻混匀上述配制的反应液,短暂离心使得管壁上的反应液沉落。在冰上配置miRNA所用混合液:步骤1的反应液,10.0 μl;PrimeScript RT Enzyme Mix 1, 1.0 μl; Gene Specific RT Primer , 1.0 μl; 5×PrimeScript Buffer 2,4.0 μl;RNase Free dH2O, 4.0 μl;总体积,20 μl,轻轻混匀上述配制的反应液,短暂离心使得管壁上的反应液沉落。37 ℃,15 min; 85℃, 5 sec; 合成的cDNA反应液放置-20 ℃保存,也可以直接进行下游荧光定量检测。
Gene Specific RT Primer 引物序列为:GTCGTATCCAGTGCAGGGTCCGAGGTATTC GCACTGGATACGACCGTCGT(SEQ ID NO:5)。
四、实时荧光定量PCR
混匀如下反应体系,然后分装入96孔光学板中,并覆盖上专用光学膜。扩增使用的仪器为ABI公司的荧光定量PCR仪。
20 μl反应体系配制如下:反转录cDNA模板,2 μl;正向引物(10 μM),1 μl;反向引物(10 μM),1 μl;2×RealStar Green Power Mixture,10 μl;RNase Free dH2O,6 μl。
扩增程序为:扩增程序为:95 ℃, 30 sec;95 ℃, 15 s,60 ℃, 34 s,40 cycles;72 ℃ 30 s。
引物序列为:ghr-miR01F:GGACCGTGTTTCGCGCGTGG(SEQ ID NO:6);ghr-miR01R: GTGCAGGGTCCGAGGT(SEQ ID NO:7); U6-F:GGGGACATCCGATAAAATTGG(SEQ ID NO:8);U6-R:CATTTCTCGATTTGTGCGTGTC(SEQ ID NO:9);(U6为内参基因)。
五、结果分析
参看图3,实时荧光定量PCR分析的结果显示ghr-miR01的表达受干旱诱导明显上调,达19.1倍,这同样表明ghr-miR01的表达受到干旱胁迫的调节。基于此,可以通过实时荧光定量PCR法测定所述miRNA在植物中的表达模式,从而确认或排除目的植物受到干旱胁迫,同时上述试验结果强烈的提示上述miRNA还可应用于培育抗旱转基因植物。
上述描述仅作为本发明可实施的技术方案提出,不作为对其技术方案本身的单一限制条件。
序 列 表
<110> 石家庄市农林科学研究院
<120> 一种与植物应对干旱胁迫相关的miRNA——ghr-miR01及其应用
<160> 9
<210> 1
<211> 21
<212> RNA
<213> 棉花(Anemone vitifolia Buch)
<400> 1
GUGUUUCGCG CGUGGACGAC G 21
<210> 2
<211> 21
<212> DNA
<213> 人工序列
<400> 2
GTGTTTCGCG CGTGGACGAC G 21
<210> 3
<211> 73
<212> RNA
<213> 棉花(Anemone vitifolia Buch)
<400> 3
UUGUCCACGC GCGACACGCA CUGCAUUUGU GCUUUUUCAA AGCUUUGUAU GUGUGUUUCG 60
CGCGUGGACG ACG 73
<210> 4
<211> 73
<212> DNA
<213> 棉花(Anemone vitifolia Buch)
<400> 4
TTGTCCACGC GCGACACGCA CTGCATTTGT GCTTTTTCAA AGCTTTGTAT GTGTGTTTCG 60
CGCGTGGACG ACG 73
<210> 5
<211> 50
<212> DNA
<213> 人工序列
<400> 5
GTCGTATCCA GTGCAGGGTC CGAGGTATTC GCACTGGATA CGACCGTCGT 50
<210> 6
<211> 20
<212> DNA
<213> 人工序列
<400> 6
GGACCGTGTT TCGCGCGTGG 20
<210> 7
<211> 16
<212> DNA
<213> 人工序列
<400> 7
GTGCAGGGTC CGAGGT 16
<210> 8
<211> 21
<212> DNA
<213> 人工序列
<400> 8
GGGGACATCC GATAAAATTG G 21
<210> 9
<211> 22
<212> DNA
<213> 人工序列
<400> 9
CATTTCTCGA TTTGTGCGTG TC 22
- 还没有人留言评论。精彩留言会获得点赞!