一株酵母菌及其在催化2,5‑二羟甲基呋喃合成中的应用的制作方法
本发明属于生物催化及化学工程领域,具体涉及一种季也蒙毕赤酵母及其催化5-羟甲基糠醛选择性还原合成2,5-二羟甲基呋喃的方法。
背景技术:
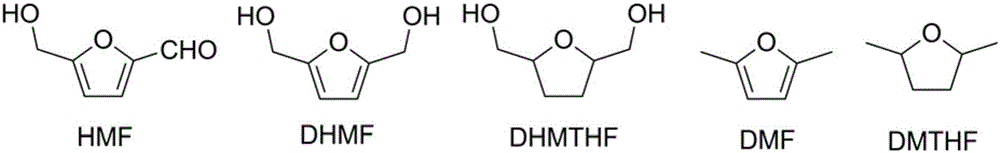
近年来,生物基能源和平台化合物的开发和利用逐渐受到了重视。5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)是一种重要的生物基平台化合物,位居美国能源部宣布的“Top 10+4”平台化合物之列(Green Chem.,2010,12,539)。该生物基平台化合物可以通过碳水化合物脱水制备得到。HMF分子有多个活性基团如羟基、醛基及碳碳双键,故可对其进行化学修饰合成各种有用的中间体。HMF经选择性还原可分别转化为2,5-二羟甲基呋喃(2,5-dihydroxymethylfuran,DHMF)、2,5-二羟甲基四氢呋喃(DHMTHF)、2,5-二甲基呋喃(DMF)及2,5-二甲基四氢呋喃(DMTHF)等,结构如图1所示。这些还原产物都是重要的能源替代物或合成砌块,在能源、医药、高分子等领域具有重要的应用价值。例如,DHMF是一种具有广阔应用前景的化合物,既可用于生产医药中间体及冠醚等(J.Am.Chem.Soc.,1974,96,7159),又可用于合成具有特定功能的生物基高分子材料如具有形状记忆和自我修复功能的聚合物(Macromolecules,2013,46,1794;ACS Appl.Mater.Interfaces,2014,6,2753)。
当前,DHMF主要通过化学法制备。例如,Cottier等在4℃下,利用2倍当量的NaBH4还原HMF,DHMF产率达97%(Synth.Commun.,2003,33,4285)。Alamillo等利用固定化在CeOx载体上的钌催化HMF还原,在130℃下,反应2h后,底物完全转化,产物中DHMF含量为81%(Green Chem.,2012,14,1413)。Ohyama等利用固定化在Al2O3的金纳米簇作为催化剂,在6.5MPa氢气、120℃下选择性将HMF还原为DHMF,产率达96%(RSC Adv.,2013,3,1033)。Lin等报道了廉价的ZrO(OH)2能高效催化HMF还原为DHMF,在150℃下反应2.5h后,HMF转化率达94%,合成DHMF的选择性为89%(Green Chem.2016,18,1080)。
尽管化学法合成DHMF已取得了一定进展,但仍存在反应条件不温和、选择性不佳、需要使用有毒或化学计量的催化剂及有机溶剂等问题。近年来,生物催化无论是在工业上还是在学术上均受到了广泛的关注,因为该法能有效克服化学法的上述诸多问题。然而,生物催化HMF还原合成DHMF仍颇具挑战,其原因如下:(1)以醇脱氢酶为催化剂,须按化学剂量添加大量昂贵的辅酶NAD(P)H或辅以复杂的辅酶再生过程反应方能持续进行;(2)以微生物全细胞作为生物催化剂,尽管能很好地克服上述辅酶循环问题,但HMF是一种木质纤维素酸水解液中常见的抑制剂,对微生物具有强烈的抑制作用(Bioresour.Technol.,2000,74,25),故微生物通常对HMF的耐受性较差、且反应速度慢等。尽管已有关于微生物细胞催化HMF转化的报道,但其目的主要是用于木质纤维素酸水解液的生物脱毒,即利用微生物将木质纤维素酸水解液中的抑制剂HMF转化为低毒性化合物(Appl.Microbiol.Biotechnol.,2004,64,125)。但已报道的用于生物脱毒的微生物远不能满足生物催化HMF还原合成DHMF的要求(底物浓度高、转化速度快,且反应选择性好等),其原因如下:(1)生物脱毒效率仍非常低,即微生物转化HMF的速度慢。例如,Lopez等利用Coniochaeta ligniaria NRRL 30616进行生物脱毒,发现即使在低HMF浓度(15mM)下,该菌仍需要近70h才能将HMF完成转化(Appl.Microbiol.Biotechnol.,2004,64,125)。尽管Zhang等最近报道了一株能够高效降解HMF的微生物Enterobacter sp.FDS8,但HMF浓度仅为3.2mM(Biochem.Eng.J.,2013,72,77)。(2)微生物可耐受的HMF浓度较低(Biotechnol.Biofuels,2014,7,51)。据文献调研,当HMF浓度较高时,对生物脱毒效率产生严重的副作用(Biotechnol.Biofuels,2015,78,63)。(3)微生物催化HMF转化的选择性不高。例如,Feldman等报道了Pleurotus ostreatus能在48h内将30mM的HMF完全转化成产物,但产物中既有还原产物DHMF,又含有氧化产物2,5-呋喃二甲酸(Biotechnol.Biofuels,2015,78,63)。因此,筛选获得能耐受高浓度HMF、转化速度快,且选择性好的微生物对于以HMF为原料合成DHMF生物催化路径的建立尤为重要。
技术实现要素:
针对现有技术存在的问题,本发明筛选获得一株能高效催化HMF选择性还原合成DHMF、且具有高HMF耐受性的季也蒙毕赤酵母。本发明的目的在于提供该季也蒙毕赤酵母及其催化HMF选择性还原制备DHMF的方法。
本发明的目的通过以下技术方案实现:
一种季也蒙毕赤酵母,该菌菌落表面光滑、湿润、质地均匀,呈乳白色、颜色均一,如图2所示。
所述酵母菌在催化2,5-二羟甲基呋喃合成中的应用。包括如下步骤:
(1)季也蒙毕赤酵母SC 1103在液体培养基中活化和培养,收集菌体细胞;
(2)将上述收集的菌体细胞加入含有5-羟甲基糠醛和葡萄糖的缓冲液中,所述5-羟甲基糠醛浓度为10~200mM,所述葡萄糖的浓度为10~200mM,在温度10~40℃条件下反应,得到2,5-二羟甲基呋喃。
步骤(1)所述液体培养基为酵母浸出粉胨葡萄糖(YPD)液体培养基,其组成为1%酵母膏,2%蛋白胨,2%葡萄糖;所述的活性和培养条件为30℃及200r/min;经活化后的季也蒙毕赤酵母(Meyerozyma guilliermondii)SC 1103接入液体培养基的接种量为2%。
步骤(2)所述菌体细胞浓度为10~30mg/mL。
步骤(2)所述5-羟甲基糠醛浓度为20~110mM,所述葡萄糖的浓度为10~100mM。
步骤(2)所述5-羟甲基糠醛浓度为20~40mM,所述葡萄糖的浓度为30~100mM。
步骤(2)所述缓冲液为柠檬酸盐缓冲液、磷酸盐缓冲液、Tris-HCl缓冲液或甘氨酸-NaOH缓冲液;所述缓冲液pH介于4.0~10.0。
步骤(2)反应条件为温度20~35℃、转速为200r/min。
步骤(2)通过分配流加5-羟甲基糠醛和葡萄糖,以在反应体系中积累高浓度的2,5-二羟甲基呋喃。
分配流加的具体步骤如下:利用液相色谱监控反应过程,当5-羟甲基糠醛几乎耗尽时,向反应液中加入5-羟甲基糠醛和葡萄糖,继续进行反应,重复上述底物添加步骤以积累高浓度的2,5-二羟甲基呋喃。
本发明与现有的技术相比,具有如下的优点:
1)利用季也蒙毕赤酵母SC 1103作为催化剂,能高效、高选择性地催化HMF转化为目标产物DHMF,并且克服了化学催化剂环境不友好的缺点。
2)本发明反应过程简单,不需要添加氮源和无机盐(添加一些额外的东西会使反应体系更加复杂),易控、条件温和,活泼的HMF在反应过程中不易发生副反应,不仅提高产品品质高、降低了能耗,而且有利于简化后续目标产物的分离纯化工艺。
3)本发明以微生物细胞作为催化剂,在反应结束后可以通过简单的离心回收生物催化剂,既可实现催化剂的重复利用,又易于产物的分离纯化。
本发明菌株为季也蒙毕赤酵母(Meyerozyma guilliermondii)SC1103,于2016年3月24日,保藏于中国典型培养物保藏中心,简称CCTCC,保藏号:CCTCC NO.M 2016144,保藏地址:中国,武汉,武汉大学。
附图说明
图1为HMF及其还原产物的结构。
图2为季也蒙毕赤酵母SC1103在pH 6.5的马铃薯葡萄糖琼脂培养基中,于30℃下培养3天后的菌落形态图。
图3为HMF及DHMF分析的液相色谱图(DHMF及HMF的保留时间分别为8.3及10.1min)。
具体实施方式
通过实施例进一步说明本发明,但不局限于实施例。
实施例1
季也蒙毕赤酵母(Meyerozyma guilliermondii)SC 1103活化与培养:接种于酵母浸出粉胨葡萄糖(YPD)液体培养基(1%酵母膏,2%蛋白胨及2%葡萄糖)中,在30℃及200r/min下,活化12h;随后,按2%的接种量接入新鲜YPD液体培养基中,于30℃及200r/min下,培养12h,收集菌体细胞。
实施例2
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.16mmol HMF和0.12mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。利用液相色谱监控反应(图3)。7h后,液相色谱分析表明DHMF产率为89%,选择性为99%。
实施例3
在4mL柠檬酸盐缓冲液(100mM,pH 4.0)中加入0.16mmol HMF和0.12mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。7h后,液相色谱分析表明DHMF产率为89%,选择性为99%。
实施例4
在4mL甘氨酸-NaOH缓冲液(100mM,pH 10.0)中加入0.16mmol HMF和0.12mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。5h后,液相色谱分析表明DHMF产率为90%,选择性为99%。
实施例5
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.16mmol HMF和0.12mmol葡萄糖,混合均匀后,按10mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。9h后,液相色谱分析表明DHMF产率为91%,选择性为98%。
实施例6
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.16mmol HMF和0.12mmol葡萄糖,混合均匀后,按30mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。5h后,液相色谱分析表明DHMF产率为91%,选择性为99%。
实施例7
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.16mmol HMF和0.12mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于20℃及200r/min下反应。24h后,液相色谱分析表明DHMF产率为93%,选择性为99%。
实施例8
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.16mmol HMF和0.12mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于40℃及200r/min下反应。5h后,液相色谱分析表明DHMF产率为86%,选择性为99%。
实施例9
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.08mmol HMF和0.12mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于35℃及200r/min下反应。3h后,液相色谱分析表明DHMF产率为93%,选择性为99%。
实施例10
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.4mmol HMF和0.4mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于35℃及200r/min下反应。12h后,液相色谱分析表明DHMF产率为86%,选择性为99%。
实施例11
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.44mmol HMF和0.4mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于35℃及200r/min下反应。36h后,液相色谱分析表明DHMF产率为87%,选择性为99%。
实施例12
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.6mmol HMF和0.4mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于35℃及200r/min下反应。48h后,液相色谱分析表明DHMF产率为51%,选择性为99%。
实施例13
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.8mmol HMF和0.8mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于35℃及200r/min下反应。48h后,液相色谱分析表明DHMF产率为42%,选择性为99%。
实施例14
底物分批流加:在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入0.2mmol HMF和0.12mmol葡萄糖,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于35℃及200r/min下反应。6h后,HMF浓度降至1.8mM,DHMF浓度达46.1mM,随后加入0.2mmol HMF和0.12mmol葡萄糖;再反应7h后,HMF浓度降至2.8mM DHMF浓度达88.7mM,随后再加入0.2mmol HMF和0.12mmol葡萄糖;再反应5h后,HMF浓度降至6.1mM,DHMF浓度达132.1mM,随后再加入0.2mmol HMF和0.12mmol葡萄糖,再反应6.5h后,HMF浓度降至2.4mM,DHMF浓度达190.6mM。DHMF总产率达95%,选择性为99%。
对比例1
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入40mM HMF、30mM葡萄糖、2g/L硫酸铵及无机盐(0.1g/L MgCl2·6H2O,10mg/L EDTA,2mg/L ZnSO4·7H2O,1mg/L CaCl2·2H2O,5mg/L FeSO4·7H2O,0.2mg/L Na2MoO4·2H2O,0.2mg/L CuSO4·5H2O,0.4mg/L CoCl2·6H2O及1mg/L MnCl2·2H2O),混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。7h后,液相色谱分析表明DHMF产率为88%,选择性为99%。
对比例2
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入40mM HMF、30mM甘油、2g/L硫酸铵及无机盐(0.1g/L MgCl2·6H2O,10mg/L EDTA,2mg/L ZnSO4·7H2O,1mg/L CaCl2·2H2O,5mg/L FeSO4·7H2O,0.2mg/L Na2MoO4·2H2O,0.2mg/L CuSO4·5H2O,0.4mg/L CoCl2·6H2O及1mg/L MnCl2·2H2O),混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。24h后,液相色谱分析表明DHMF产率为88%,选择性为93%。
对比例3
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入40mM HMF、15mM葡萄糖、2g/L硫酸铵及无机盐(0.1g/L MgCl2·6H2O,10mg/L EDTA,2mg/L ZnSO4·7H2O,1mg/L CaCl2·2H2O,5mg/L FeSO4·7H2O,0.2mg/L Na2MoO4·2H2O,0.2mg/L CuSO4·5H2O,0.4mg/L CoCl2·6H2O及1mg/L MnCl2·2H2O),混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。12h后,液相色谱分析表明DHMF产率为88%,选择性为98%。
对比例4
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入40mM HMF、2g/L硫酸铵及无机盐(0.1g/L MgCl2·6H2O,10mg/L EDTA,2mg/L ZnSO4·7H2O,1mg/L CaCl2·2H2O,5mg/L FeSO4·7H2O,0.2mg/L Na2MoO4·2H2O,0.2mg/L CuSO4·5H2O,0.4mg/L CoCl2·6H2O及1mg/L MnCl2·2H2O),混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。24h后,液相色谱分析表明DHMF产率为55%,选择性为61%。
对比例5
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入40mM HMF、30mM葡萄糖及无机盐(0.1g/L MgCl2·6H2O,10mg/L EDTA,2mg/L ZnSO4·7H2O,1mg/L CaCl2·2H2O,5mg/L FeSO4·7H2O,0.2mg/L Na2MoO4·2H2O,0.2mg/L CuSO4·5H2O,0.4mg/L CoCl2·6H2O及1mg/L MnCl2·2H2O),混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。7h后,液相色谱分析表明DHMF产率为91%,选择性为99%。
对比例6
在4mL磷酸盐缓冲液(100mM,pH 7.2)中加入40mM HMF、30mM葡萄糖及2g/L硫酸铵,混合均匀后,按20mg/mL(按细胞湿重计)的浓度加入经实施例1活化和培养的季也蒙毕赤酵母SC 1103细胞,于30℃及200r/min下反应。7h后,液相色谱分析表明DHMF产率为86%,选择性为99%。
- 还没有人留言评论。精彩留言会获得点赞!