一种产脂肪酸乙酯的解脂耶氏酵母基因工程菌及其应用的制作方法
本发明属于基因工程领域,具体地涉及一种产脂肪酸乙酯的解脂耶氏酵母基因工程菌及其应用。
背景技术:
生物燃料相对于化石燃料被认为是一种更清洁和更能被可持续利用的能源,从而越来越受到人们的关注,逐渐被各国研究和利用。目前生物柴油作为一种重要的生物燃料,主要从植物油中提取获得,但是这种来源存在成本较高,利用率较低等不足,因而难以用于大规模的商业性生产,因此探究利用微生物生产生物柴油具有很高的发展前景。
生物柴油的主要类型是脂肪酸乙酯和脂肪酸甲酯,它们具有相似的燃料性质和发动机特性。由于甲醇比乙醇的价格更低廉,所以目前工业规模生产的生物柴油基本上都是脂肪酸甲酯。然而由于甲醇具有一定的毒害作用,使用时需要特别的预防措施;并且目前生产甲醇的原料为天然气,因此基于脂肪酸甲酯的生物柴油也不能算是真正的可再生产品。可见使用乙醇生产的脂肪酸乙酯才是一种完全可再生的燃料。
目前生产脂肪酸乙酯的微生物主要是大肠杆菌和酿酒酵母。生产脂肪酸乙酯需要在微生物中外源引入蜡酯合成酶(ws)基因,其机理参见图1。蜡酯合成酶是催化乙醇和酰基辅酶a(coas)合成蜡酯的一类酶。一方面,不同的ws对具有不同的链长的底物存在偏好性。其中来源于marinobacterhydrocarbonoclasticusdsm8798的ws对短链醇的活性更高,能够更好地利用乙醇,适合脂肪酸乙酯的生产。另一方面,dgat活性促使脂肪酰辅酶a向tag途径的生物合成会减少生物合成脂肪酸乙酯的产量。之前改造酿酒酵母和大肠杆菌进行酯类生产所使用的蜡酯合成酶几乎都来自于acinetobacterbaylyiadp1,该来源的ws含有dgat活性,而来源于marinobacterhydrocarbonoclasticusdsm8798的ws不含有dgat活性,这一性质使得该来源的ws更适合生产生物柴油。酵母中存在完整的酰基辅酶a合成途径,因此很适合用于胞内生产脂肪酸乙酯,然而酵母中脂肪酸途径中的酰基辅酶a作为faees的前体物质相对不足,从而直接抑制了脂肪酸乙酯的产量。
不同的脂肪酸乙酯的组分会影响生物柴油的性质。在柴油的使用性能中,最重要的是抗爆性和低温流动性,其技术指标分别是十六烷值和凝点,这与脂肪酸的碳链长度和不饱和度都有关系。目前研究发现,生物柴油中的脂肪酸碳链长度为16-18个碳原子时,即可获得较高的十六烷值;虽然继续增加碳链长度可提高十六烷值,但同时会使黏度增高,从而影响生物柴油的低温流动性。同时,研究还发现,高不饱和脂肪酸的十六烷值很低,容易导致生物柴油十六烷值下降,但过高的饱和度又会导致较高的冷凝点。因此当前最普遍的用于发动机的脂肪酸组分主要包括c14、c16、c18、c16:1、c18:1和c18:2。目前利用大肠杆菌和酿酒酵母生产的脂肪酸乙酯组分中都存在较多的c14,c12甚至是c20。
目前亟需完善地利用外源ws基因从而高产脂肪酸乙酯的酵母基因工程菌。
技术实现要素:
本发明要解决的技术问题是为了克服现有技术中缺乏完善地利用外源ws基因从而高产碳链长度适宜的、完全可再生的脂肪酸乙酯的酵母基因工程菌的不足,提供一种产脂肪酸乙酯的解脂耶氏酵母基因工程菌及其应用。
本发明人经过深入的研究和反复的试验发现,通过外源添加油酸能够极大地提高faees的产量,而解脂耶氏酵母(yarrowialipolytica)作为产油酵母,具有强大的脂肪酸生产能力,可以提供更多的酰基辅酶a作为前体物质,因此选择解脂耶氏酵母作为基因工程菌的出发菌种。同时,发明人经研究后,获得了优化的编码来源于marinobacterhydrocarbonoclasticusdsm8798的ws的核苷酸序列,同时发现,若在此基础上进一步敲除与β氧化相关的pex10基因,则能够使获得的基因工程菌达到产脂肪酸乙酯1593.4g/ml的优异效果。
本发明提供的技术方案如下:
本发明的技术方案之一为:一种产脂肪酸乙酯解脂耶氏酵母基因工程菌,其是将含有蜡酯合成酶基因ows的重组载体转化尿嘧啶和亮氨酸营养缺陷型解脂耶氏酵母(yarrowialipolytica)构建而成,所述蜡酯合成酶基因ows的核苷酸序列如序列表seqidno.1所示。
本发明中,所述尿嘧啶和亮氨酸营养缺陷型解脂耶氏酵母为本领域常规的尿嘧啶和亮氨酸营养缺陷型解脂耶氏酵母,即自身难以合成尿嘧啶和亮氨酸的解脂耶氏酵母。较佳地,所述尿嘧啶和亮氨酸营养缺陷型解脂耶氏酵母为解脂耶氏酵母po1f,其按照madzakc,trétonbandrolandsb.stronghybridpromotersandintegrativeexpression/secretionvectorsforquasi-constitutiveexpressionofheterologousproteinsintheyeastyarrowialipolytica.jmolmicrobiolbiotechnol.2000,2(2):207-216中记载的制备方法制得。
所述的蜡酯合成酶基因ows为将源自marinobacterhydrocarbonoclasticusdsm8798的蜡酯合成酶(ws)的核苷酸序列进行特殊优化。
本发明中,较佳地,所述的重组载体含有pmli、bamhi的酶切位点。较佳地,所述重组载体还含有启动子和/或终止子序列。
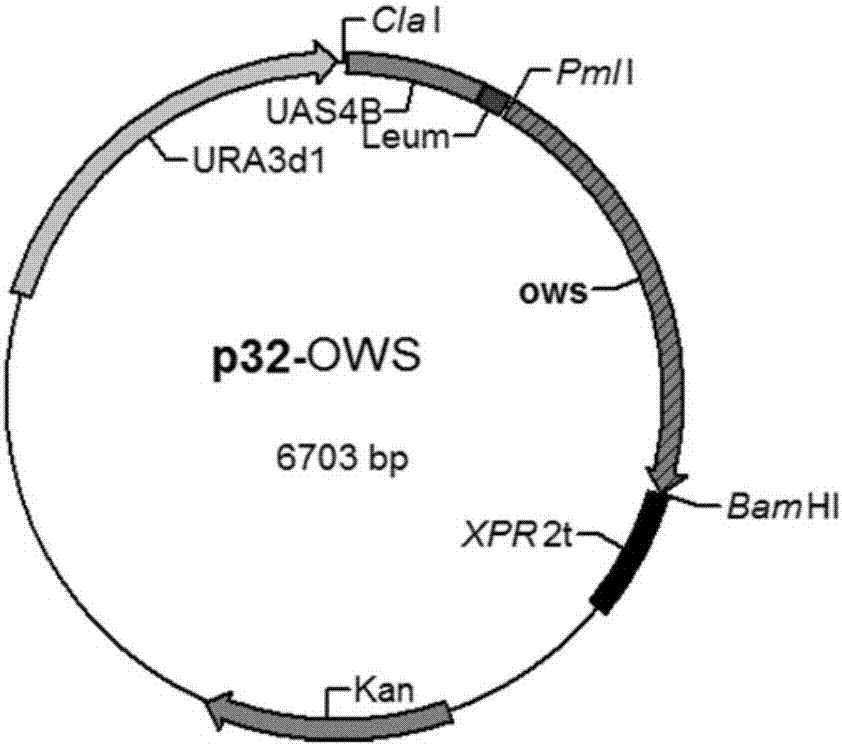
本发明所述的重组载体为本领域常规的重组载体,较佳地为质粒pina1312。其中,将蜡酯合成酶基因ows导入质粒pina1312获得的重组质粒为质粒p32-ows,所述质粒p32-ows的核苷酸序列如序列表seqidno.2所示。
本发明中,将所述质粒p32-ows转化入所述解脂耶氏酵母po1f中获得菌株命名为菌株gqy001。
较佳地,所述的含有蜡酯合成酶基因ows重组载体为质粒p32-uto,质粒p32-uto的核苷酸序列如序列表seqidno.3所示。
本发明所述质粒p32-uto的启动子为uas4b-tef,uas4b-tef即为由来源于质粒pina1312启动子hp4d中的增强子部分uas4b和来源于解脂耶氏酵母菌po1f中dna的强启动子tef组成的启动子。质粒p32-uto中,蜡酯合成酶基因ows的表达量增加。
本发明中,将所述质粒p32-uto转化入所述解脂耶氏酵母po1f中获得菌株命名为菌株gqy004。
更佳地,所述的产脂肪酸乙酯解脂耶氏酵母基因工程菌是将上述的质粒p32-uto转化解脂耶氏酵母菌株gqy006构建而成,所述解脂耶氏酵母菌株gqy006由将重组质粒psk-pex10::ura和能够回收尿嘧啶筛选标记ura3的质粒pub4-cre转化入解脂耶氏酵母po1f后构建而成,所述重组质粒psk-pex10::ura的核苷酸序列如序列表seqidno.4所示;所述质粒pub4-cre的制备方法参见fickersp,ledallm.t,gaillardinc,thonartp,nicaudj.m.newdisruptioncassettesforrapidgenedisruptionandmarkerrescueintheyeastyarrowialipolytica.jmicrobiolmethods.2003,55(3):727-737。
本发明所述重组质粒psk-pex10::ura用以敲除解脂耶氏酵母基因工程菌中与β氧化相关的基因pex10,从而进一步提高解脂耶氏酵母基因工程菌的脂肪酸乙酯的产量。
本发明中,将所述质粒p32-uto转化入所述解脂耶氏酵母gqy006中获得菌株命名为菌株gqy007。
本发明的技术方案之二为:一种产脂肪酸乙酯的方法,其包括以下的步骤:培养上述的解脂耶氏酵母基因工程菌,添加十二烷进行两相发酵得发酵液,萃取发酵液的十二烷相。
本发明中,所述培养的培养基为本领域常规的培养基,较佳地为ypd培养基。
较佳地,添加所述十二烷的时间为所述培养开始时。较佳地,添加所述十二烷的体积为所述培养基体积的10%。
较佳地,所述方法还包括在所述两相发酵时添加外源的乙醇。
其中,开始添加所述乙醇的时间为本领域常规的时间,较佳地为所述两相发酵的第12小时。添加所述乙醇的频率为本领域常规的频率,较佳地为每12小时添加1次。所述乙醇的浓度为本领域常规的浓度,较佳地为2~7%,更佳地为5%~7%,所述百分比为乙醇和发酵体系的体积百分比。
本发明的技术方案之三为:一种制备上述的解脂耶氏酵母基因工程菌的方法,其包括以下的步骤,
(1)构建含有蜡酯合成酶基因ows重组载体,所述蜡酯合成酶基因ows的核苷酸序列如序列表seqidno.1所示;
(2)将步骤(1)构建的含有蜡酯合成酶基因ows重组载体转化解脂耶氏酵母(yarrowialipolytica)。
本发明的技术方案之四为:一种用于制备上述的解脂耶氏酵母基因工程菌的重组载体,其含有蜡酯合成酶基因ows,所述蜡酯合成酶基因ows的核苷酸序列如序列表seqidno.1所示。
较佳地,所述的重组载体为质粒p32-ows,所述质粒p32-ows的核苷酸序列如序列表seqidno.2所示。
较佳地,所述的重组载体为质粒p32-uto,所述质粒p32-uto的核苷酸序列如序列表seqidno.3所示。
本发明的技术方案之五为:一种上述的解脂耶氏酵母基因工程菌在制备脂肪酸乙酯中的应用。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明通过将编码来源于marinobacterhydrocarbonoclasticusdsm8798的ws的核苷酸序列优化(即得蜡酯合成酶基因ows),能够提高所获得的解脂耶氏酵母基因工程菌产脂肪酸乙酯的产量。并且通过提高蜡酯合成酶基因ows的表达量,并进一步敲除与β氧化相关的pex10基因,更加提高脂肪酸乙酯的产量,达到1593.4g/ml这一目前使用酵母生产脂肪酸乙酯最高产量的优异效果。并且,所产生的脂肪酸乙酯的组分则主要集中在c16、c18、c16:1、c18:1和c18:2,具有更为优良的使用性能。
同时,通过对不同的解脂耶氏酵母基因工程菌两相发酵时添加的外源乙醇的浓度的选择,能够针对性地进一步提高脂肪酸乙酯的产量。此外,利用本发明提供的解脂耶氏酵母基因工程菌产脂肪酸乙酯是一种使用完全可再生的能源,通过微生物法获得生物柴油脂肪酸乙酯的方法,操作简便,反应稳定可靠,能够利用于大规模的商业化生产,有利于生物柴油的产业化应用,节能环保,前景良好。
附图说明
图1为引入蜡酯合成酶基因后解脂耶氏酵母生物合成脂肪酸乙酯示意图。
图2为质粒p32-ows的结构示意图。
图3为质粒p32-uto的结构示意图。
图4为重组质粒psk-pex10::ura的构建示意图。
图5为菌株gqy001、gqy004和gqy007摇瓶发酵生产脂肪酸乙酯的结果图。
图6为菌株gqy001在不同的乙醇添加量下发酵生产脂肪酸乙酯的结果图。
图7为菌株gqy007在不同的乙醇添加量下发酵生产脂肪酸乙酯的结果图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
本发明实施例尽管采用菌株po1f作为出发菌株,但是常规的尿嘧啶和亮氨酸营养缺陷型解脂耶氏酵母(yarrowialipolytica)均能够作为出发菌株,用以转化,以进行实施例中的试验。
实施例中的解脂耶氏酵母(yarrowialipolytica)的出发菌株po1f根据madzakc,trétonbandrolandsb.stronghybridpromotersandintegrativeexpression/secretionvectorsforquasi-constitutiveexpressionofheterologousproteinsintheyeastyarrowialipolytica.jmolmicrobiolbiotechnol.(2000)2(2):207-216所记载的制备方法制得。
质粒pina1312的制备方法参见nicaudjm,madzakc,vandenbroekp,gyslerc,dubocp,niederbergerp,etal.proteinexpressionandsecretionintheyeastyarrowialipolytica.femsyeastres2002;2:371-9。
质粒pub4-cre、质粒jmp113和质粒pbluskp的制备方法参见fickersp,ledallm.t,gaillardinc,thonartp,nicaudj.m.newdisruptioncassettesforrapidgenedisruptionandmarkerrescueintheyeastyarrowialipolytica.jmicrobiolmethods.2003,55(3):727-737。
实施例1高产脂肪酸乙酯解脂耶氏酵母基因工程菌的构建
a、基因工程菌株gqy001的构建
(1)将来源于marinobacterhydrocarbonoclasticusdsm8798的蜡酯合成酶ws优化后进行合成(由上海捷瑞生物工程有限公司完成)得到优化的蜡酯合成酶基因ows,ows的核苷酸序列如序列表seqidno.1所示。
(2)将步骤(1)合成的ows作为模板,使用引物ws_f和ws_r进行pcr扩增(其核苷酸序列分别如序列表seqidno.5~6所示),得扩增片段a。其中,pcr的扩增程序为:94℃5分钟,94℃30秒、63℃30秒、72℃1分钟(其中94℃30秒、63℃30秒、72℃1分钟重复循环35次),72℃10分钟,12℃保持至终止;pcr的扩增的体系为25μltaqpcrmaster、1μl模板、2μl正向引物f、2μl反向引物r和20μlddh2o。
(3)通过pmli/bamhi双酶切将步骤(2)获得的扩增片段a连入质粒pina1312中得到质粒p32-ows,质粒p32-ows核苷酸序列如序列表seqidno.2所示,其结构图参见图2。
(4)将步骤(3)获得的质粒p32-ows转化入解脂耶氏酵母po1f中,获得菌株gqy001。其中,转化的方法参见chen,d.c.,beckerich,j.m.,gaillardin,c.,1997.one-steptransformationofthedimorphicyeastyarrowialipolytica.appl.microbiol.biotechnol.48,232–235。
b、基因工程菌株gqy004的构建
(1)、使用引物uas4b_f和uas4b_r(其核苷酸序列分别如序列表seqidno.9~10所示)将来源于质粒pina1312启动子hp4d中的增强子部分uas4b片段进行pcr扩增,得扩增片段b。其中,pcr的扩增程序和pcr的扩增体系与步骤a中(1)所述的扩增程序和扩增体系相同。
使用引物tef_f2和tef_r(其核苷酸序列分别如序列表seqidno.7~8所示)将来源于解脂耶氏酵母菌po1f中dna的强启动子tef进行pcr扩增,得扩增片段c。其中,pcr的扩增程序和pcr的扩增体系与步骤a中(1)所述的扩增程序和扩增体系相同。
(2)、通过pmli/clai双酶切将步骤(1)获得的扩增片段b和扩增片段c无缝克隆到步骤a中获得的质粒p32-ows中,获得质粒p32-uto。质粒p32-uto中的新启动子uas4b-tef,替换了质粒p32-ows中的原启动子hp4d,质粒p32-uto的核苷酸序列如序列表seqidno.3所示,其结构图参见图3。
(3)将步骤(3)获得的质粒p32-uto转化入解脂耶氏酵母po1f中,获得菌株gqy004。其中,转化的方法参见步骤a。
c、基因工程菌株gqy007的构建
c1、敲除菌株gqy006(δpex10)的构建。
(1)提取解脂耶氏酵母po1f的全基因组dna(其中提取dna的方法参见酵母基因组dna提取试剂盒的说明书,购自生工生物工程上海有限公司),以其为模板,利用引物pex10_f和pex10_r(其核苷酸序列分别如序列表seqidno.11~12所示)对含有上下游片段的pex10片段进行pcr扩增,得扩增片段d。其中,pcr的扩增程序和pcr的扩增体系与步骤a中(1)所述的扩增程序和扩增体系相同。
(2)将步骤(1)获得的扩增片段d连接到pbluskp质粒上得到质粒psk-pex10。
(3)将步骤(2)获得的质粒psk-pex10为模板,以引物sk_pex10_f和sk_pex10_r(其核苷酸序列分别如序列表seqidno.13~14所示)反向pcr扩增得到载体pex10的“上—sk—pex10下”片段。其中,pcr的扩增程序和pcr的扩增体系与步骤a中(1)所述的扩增程序和扩增体系相同。
将质粒jmp113为模板,以引物ura3_f和ura3_r(其核苷酸序列分别如序列表seqidno.15~16所示)进行pcr扩增,得到含尿嘧啶基因的扩增片段loxp-ura3-loxr。其中,pcr的扩增程序和pcr的扩增体系与步骤a中(1)所述的扩增程序和扩增体系相同。
(4)将步骤(3)获得的“上—sk—pex10下”片段和loxp-ura3-loxr通过无缝克隆的方法相连,从而得到重组质粒psk-pex10::ura。重组质粒psk-pex10::ura的核苷酸序列如序列表seqidno.4所示,其构建的步骤参见图4。
(5)将步骤(4)获得的重组质粒psk-pex10::ura转化入解脂耶氏酵母po1f中,并同时转化入能够回收尿嘧啶筛选标记ura3的质粒pub4-cre,获得菌株gqy006。其中,转化的方法参见步骤a。
c2、构建基因工程菌株gqy007
(1)将步骤b获得的质粒p32-uto线性化后通过同源重组的方法转化入步骤c1获得的菌株gqy006中,得到高产脂肪酸乙酯的酵母工程菌株gqy007。其中,转化的方法参见步骤a。
实施例2解脂耶氏酵母基因工程菌的发酵的和脂肪酸乙酯的测定
将实施例1获得的解脂耶氏酵母基因工程菌菌株gqy001、gqy004和gqy007分别接种于2mlypd培养基(ypd培养基由2g/l葡萄糖、2g/l蛋白胨和1g/l酵母提取物组成,余量为水),培养24小时。然后以初始od为0.01的接种量再分别接种于50ml新的ypd培养基中,并添加5ml的十二烷作为萃取剂进行两相发酵。从发酵的第12小时开始每隔12小时向培养基内外源添加500μl无水乙醇,一共加入5次,即共2.5ml,5%(v/v)乙醇。发酵培养3天后,用gc-ms(气相色谱与质谱联用)检测脂肪酸乙酯含量。
脂肪酸乙酯含量的测定:发酵结束后,取100μl发酵液的十二烷相与内标十七烷酸乙酯混合,用乙酸乙酯稀释2倍后采用气相质谱法测定。
气象色谱仪为agilent6890;质谱仪为agilent5975配四极杆质谱检测器;色谱柱为hp-5(30m×0.25mm×0.25μm)。载气为高纯氦气,流速1ml/min。
起始柱温为180℃,保持2min,然后以8℃/min的升温速度升至200℃后保持0.5min,接着又以4℃/min的升温速度升至215℃,保持1.5min,最后以20℃/min的升温速度升至280℃。进样量为1μl,检测器温度为200℃,进样口温度为280℃,分流比为20:1。
对脂肪酸乙酯进行定量使用的标准品有十四烷酸乙酯、棕榈酸乙酯、棕榈油酸乙酯、硬脂酸乙酯、油酸乙酯和亚油酸乙酯。
测定脂肪酸乙酯的结果如图5和表1所示。结果说明,在发酵72小时时,gqy001菌株产脂肪酸乙酯的产量为518.3mg/l,gqy004为1130.6mg/l,gqy007则高达1411.7mg/l。其中,c14∶0的含量在三个菌株中占的比例都很少,脂肪酸乙酯的成分主要集中在c16:0、c16:1、c18:0、c18:1和c18:2中。值得注意的是,与前两个菌株相比,菌株gqy007发酵所得的脂肪酸乙酯的组分中,c16:1、c18:1和c18:2的比例增加,可见脂肪酸乙酯的不饱和程度有了明显的提高。这说明敲除pex10与增加脂肪酸不饱和度有关,而一定的不饱和度对生物柴油的性能有益。
表1发酵产生脂肪酸乙酯的结果
实施例3发酵产脂肪酸乙酯中外源乙醇添加量的优化
(1)在解脂耶氏酵母工程菌株gqy001和gqy007的摇瓶发酵过程中,从发酵的第12小时开始每隔12小时向培养基内添加等量的一定量的外源乙醇,使乙醇占总体积的2%、3%、4%、5%、6%、7%、8%、9%和10%,所述百分比为已添加的乙醇占当时发酵体系的体积百分比,其余条件与实施例2的发酵条件完全一致。
(2)参照实施例2中的测定方法测定步骤(1)中gqy001和gqy007的脂肪酸乙酯产量。结果如表2~3和图6~7所示,其中dcw的含义为单位体积的干的细胞重量。
表2不同乙醇添加量下发酵产生脂肪酸乙酯的结果
结果说明,gqy001菌株和gqy007菌株在乙醇添加量2%到5%之间时,脂肪酸乙酯的产量都随着乙醇的增加显著提高;但当乙醇添加量超过5%时脂肪酸乙酯的产量开始不明显变化。对于菌株gqy001来说,5%的乙醇下脂肪酸乙酯的产量为599.8mg/l,这与6%的乙醇下脂肪酸乙酯的最高产量601.3mg/l几乎一样。而且当乙醇添加量超过7%时,由于乙醇的抑制作用,脂肪酸乙酯的产量开始逐渐下降。对于菌株gqy007来说,5%的乙醇下脂肪酸乙酯的产量为1411.7mg/l,在7%的乙醇下脂肪酸乙酯达到最高产量1593.4mg/l。
表3不同乙醇添加量下发酵产生脂肪酸乙酯的结果
结果说明,对菌株gqy001来说,当乙醇的体积超过5%时,脂肪酸乙酯的总量开始下降。这主要体现在c16:0和c18:0这两个脂肪酸乙酯的饱和组分的下降,但对于其他脂肪酸乙酯的组分尤其是不饱和组分来说,随着乙醇添加量的提高,产量并不明显变化,甚至有少量提高。与菌株gqy001相比,菌株gqy007在10%(v/v)的乙醇条件下,脂肪酸乙酯的各组分产量都并没有显著变化,说明其对乙醇的耐受性更好,更好、更充分地利用乙醇。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!