一种基于光片照明的免标记细胞检测装置及方法与流程
本发明涉及一种基于光片照明的免标记细胞检测装置及方法,可实现亚微米的微粒尺寸识别,并可用于衰老细胞与正常细胞的分类,而细胞衰老涉及多种衰老性疾病比如恶性肿瘤以及心血管疾病等。
背景技术:
临床上对细胞的检测分类主要依赖于流式细胞仪。传统流式细胞仪通过利用复杂光路系统将激光光束整形成与细胞体积相近的椭圆光束来限制激发区域,减小干扰,并严格控制鞘流系统,保持激光束与样本流正交,从而达到单个样本信号检测和采集的目的,控制过程复杂,成本高。在对生物细胞的检测与分类方面,传统细胞仪通常需要使用各种荧光试剂或染料对细胞进行复杂的染色标记,染色操作过程繁琐复杂,外力操作会对细胞的结构和功能产生一定的损害,此外,荧光信号较弱,测量光路相对复杂。传统流式细胞仪通过探测颗粒一维光散射信号,即前向光散射强度,可实现对颗粒的尺寸鉴别。这种根据光强度相对大小的尺寸测量方法对激发光源的稳定性,检测器灵敏度以信号转换器的性能提出较高要求。
光片照明是一种将光束调制成薄片照明光源的技术。该技术主要应用于荧光显微成像,利用光片仅激发焦平面上的荧光分子的优点来提高成像分辨率,可实现对生物组织、胚胎、神经网络、细胞团等的高分辨率成像。但是,目前光片照明方法的应用主要依赖于荧光标记技术,应用范围存在一定局限性。
临床上对衰老细胞的检测主要借助于生物标记技术,即SA-β-Gal染色检测。衰老细胞由于β-半乳糖苷酶的催化呈现深蓝色,从而通过光学显微镜镜检可区别衰老细胞与未衰老细胞,该技术已被广泛应用于生物学衰老研究。另一种方法是通过流式细胞仪技术分选衰老细胞与未衰老细胞。在流式细胞仪检测中,需要在细胞衰老的转录调控区域构建表达绿色荧光蛋白(GFP)的报告基因,从而定量检测未衰老细胞与衰老细胞。流式细胞仪测量方法能够更清楚地区分衰老细胞,但是报告基因的随机插入会出现额外的差异表达,导致报告基因不均一,影响检测效果。总而言之,以上方法易于检测,准确度较高,但过程步骤复杂,且用时较长,成本较高,同时人工阅片主观性较强又耗时耗力,而细胞标记、染色过程也可能会改变细胞结构,影响实验结果。
技术实现要素:
本发明为了解决上述问题,提出了一种基于光片照明的免标记细胞检测装置及方法。本发明采用光片照明技术作为激发方式均匀激发单个微颗粒或细胞,获得样本的低背景噪声的二维光散射图样,并应用于单个微颗粒的快速尺寸鉴定以及衰老细胞的免标记检测分类。
为了实现上述目的,本发明采用如下技术方案:
一种基于光片照明的免标记细胞检测装置,包括将激光光束整形成薄光片的光片发生单元,该薄光片均匀激发由样本控制单元带动的在垂直和水平面上的三维空间移动的待测样本,样本的形态显微图像和二维光散射图像由图像采集单元捕获,交由成像分析单元在提取图像特征参数的基础上实现自动分类;
所述光片发生单元,包括激光光源、反射镜片、中性密度片以及柱面透镜,激光光源发射圆柱状光束,经过反射镜控制传播方向以及中性密度片调整光强后,投射到柱面透镜,柱面透镜调制光束宽度产生厚度为几微米到几十微米的照明光片。
所述样本控制单元,包括承载样本悬液的样本芯片,用于固定样本芯片的固定器,和带动样本沿x轴,y轴以及z轴移动的电动位移台。
所述图像采集单元包括显微物镜和CMOS探测器,图像采集单元具有聚焦模式和去焦模式两种工作模式;在聚焦模式下,物镜对准精确定位后的待测样本聚焦,通过CMOS探测器记录单个样本的形态显微图像;在去焦模式下,物镜在远离待测样本一定距离捕获样本分布于空间的散射光,该距离定义为正向去焦距离,被捕获的散射光投射到CMOS探测器平面,探测器记录该样本的二维光散射图像。
所述成像分析单元包括Mie光散射模型模拟模块、特征参数提取模块和支持向量机自动分类模块,所述Mie光散射模型模拟模块,根据Mie光散射理论模型,实现对微粒的二维光散射模拟;所述特征参数提取模块,根据捕获的样本二维光散射图样提取特征参数,包括图样的光强度扫描和傅里叶方法分析;所述支持向量机自动分类模块,将采集的样本结果分为训练集和测试集,根据输入的特征值,通过寻找最优参数,自动优化分类函数,实现样本的自动分类。
基于光片照明的免标记细胞检测方法,包括以下步骤:
(1)构建样本芯片,选用两片常规玻璃薄片作为样本腔室的上下表面,两片盖玻片作为垫片,分别置于两端,并被夹持在玻璃薄片之间,构成可承载样本液溶液的微腔室。
(2)配置样本悬液并通过移液管导入样本微腔室中,将准备好的样本芯片通过自制固定器固定在精密三维电动位移台上;
(3)控制电动位移台移动样本,确定待成像样本,使待测样本位于物镜中心,并对样本聚焦,触发CMOS探测器记录该样本的形态显微图像;
(4)启动光片发生装置,校准光路,确定激光光束依次通过光片发生单元中反射镜、中性密度片、以及柱面透镜的光轴,保持光束水平传播,水平调整柱面透镜位置,使照明光片的束腰位置处于探测物镜中心;
(5)照明光片激发悬液中的待测样本,来自单个颗粒或单个细胞的散射光分布于三维空间,调整显微物镜远离待测样本,使物镜在去焦模式下采集相应角度范围内的散射光,触发CMOS探测器记录该样本的二维光散射图样;
(6)将CMOS探测器捕获的二维光散射图样输入至成像分析系统进行图像处理和样本识别及分类。
所述步骤(2)中,自制固定器由夹片和固定螺丝组成,可稳定夹持样本芯片,并兼容于光学倒置显微镜。
所述步骤(6)中,采用支持向量机算法对实验结果自动分类,对预处理后的实验结果进行分组学习训练和预测,提供分类结果以及分类评估值。
一种对亚微米微粒的尺寸识别系统,应用上述基于光片照明的免标记细胞检测装置。
一种对衰老细胞与正常细胞的分类系统,应用上述基于光片照明的免标记细胞检测装置。
本发明的有益效果为:
(1)本发明采用探测侧向二维光散射图样实现颗粒亚微米水平的尺度差异的灵敏检测,比传统流式细胞仪中根据一维前向光强信号的方法相对稳定;
(2)本发明采用静态细胞悬液扫描成像方式,摆脱了传统流式细胞仪中复杂的液流控制系统,操作方便,成本相对低廉,具备广泛适用性;
(3)在传统镜检时,制备生物样本涂片时往往需要通过干燥、固定以及冷冻等处理,对样本的结构会造成一定的破坏,影响观察效果。本发明中,待测样本置于悬液状态下观测与成像,为样本提供了较好的结构与功能保护,并且能够让样本在更接近其原始状态下进行测量,尤其适用于活细胞成像,保证了数据测量的真实性和有效性;
(4)本发明采用光片照明方式作为激发光源,提供高质量的激发光片限制激发区域,避免了同时激发其他细胞引起干扰,提供较好的成像信噪比,灵活的光片厚度与位置控制易于对细胞进行快速定位和扫描,高效的能量利用率可降低成像所需激发功率,减少光毒性对细胞活性的影响;
(5)本发明采集装置具备两个工作模式,可以同时捕获单个细胞的形态图像和二维光散射图样,有助于建立细胞结构与光学性质的对应关系,实现对单个细胞行为的成像和分析,弥补了传统流式细胞仪对单个颗粒或细胞分析时仅提供光强信号的不足;
(6)本发明采用免标记方法对衰老细胞检测,能够实现对衰老与正常细胞的快速自动分类,摆脱了传统方法对细胞染色以及人工阅片的繁琐过程;
(7)本发明适用于其他生物细胞的成像识别与分类,具备普遍推广性。
附图说明
图1为本发明装置的结构和原理示意图;
图2(a)-图2(c)为本发明实例提供的不同光片厚度光片及其测量结果;
图3(a)-图3(f)为本发明实例提供的不同粒径聚苯乙烯微球的显微图像和二维光散射图样;
图4为实验和模拟聚苯乙烯微球光散射的快速傅里叶(FFT)分析结果示意图;
图5(a)-图5(f)为本发明实例提供的正常细胞与衰老细胞的显微图像和二维光散射图样;
图6为人体成纤维衰老和正常细胞光散射图样的特征参数分布示意图。
其中,1、激光器,2、反射镜,3、中性密度滤光片,4、柱面透镜,5、样本腔室,6、样本室固定器,7、三维电动位移台,8、显微物镜,9、CMOS探测器,10、数据分析系统。
具体实施方式:
下面结合附图与实例对本发明作进一步说明。
一种基于光片照明的免标记细胞检测装置及方法,本发明采用的光片照明能够有效限制激发区域,抑制光散射成像中的背景干扰,控制过程简易且灵活。二维光散射技术提供待测样本极角和方位角两个角度范围上的光散射,可获得比一维光散射更加丰富的信息,实现在亚微米分辨率水平的微颗粒尺寸鉴别,并能够避免复杂的染色操作和荧光信号探测过程,对衰老细胞实现免标记识别和分类。在本发明的图像采集过程中,待测样本自然置于悬液状态下,既不需要流式细胞仪的鞘流控制系统,也摆脱了光学显微镜镜检中处理涂片涉及的干燥、固定等损伤性操作,保证了测量的真实性和有效性。
一种基于光片照明的免标记细胞检测装置及方法,包括光片发生单元,样本控制单元,图像采集单元以及数据处理单元。光片发生单元将激光光束整形成微米级厚度的薄光片,产生的光片进入样本控制单元激发待测样本,样本控制单元用于控制待测样本在垂直和水平面上的三维空间移动,图像采集单元捕获样本的形态显微图像和二维光散射图像,并传送到成像分析单元进行图像处理、特征提取和数据分析。
光片发生单元包括激光光源,反射镜片,中性密度片以及柱面透镜。激光光源发射圆柱状光束,经过反射镜和中性密度片后,投射到柱面透镜,柱面透镜在一维方向上压缩光束宽度,形成厚度为几微米到几十微米的照明光片。激光光源所选类型是二极管半导体固体激光器,波长是532nm,产生的激光光束直径为1.052mm。中性密度片用于调节激光光束强度,可选透过率为50%,32%,10%,1%,0.1%。
样本控制单元包括特制的样本芯片,固定器和电动位移台。样本芯片由四片170μm厚的玻璃薄片组合而成,其中,两片玻璃薄片作为样本芯片上下表面,另外两片作为垫片放置在两端,夹持在上下表面之间,形成体积约为 25.4mm x 10.0mm x 0.17mm的腔室,用于装载样本悬液。样本芯片用夹片夹持并固定在电动位移台上。所述电动位移台是三轴精密位移台,可以分别控制样本在x轴,y轴以及z轴移动,位移分辨率可达20nm以上。
图像采集单元包括显微物镜和CMOS探测器。图像采集单元具有聚焦模式和去焦模式两种工作模式。在聚焦模式下,物镜对准精确定位后的待测样本聚焦,通过CMOS探测器记录单个样本的形态显微图像;在去焦模式下,物镜在远离待测样本一定距离工作,该距离定义为正向去焦距离,在正向去焦距离下获得待测样本的二维光散射图像。在本发明中,去焦距离为200μm。物镜在对应的角度范围内收集该样本的二维散射光,通过CMOS探测器记录单个样本的二维光散射图样。
成像分析单元包括Mie光散射模型模拟,图像的特征提取以及支持向量机(SVM)自动分类算法。支持向量机算法中,将采集的样本结果分为训练集和测试集,通过寻找最优参数,自动优化分类函数,获得分类结果及评估结果。
如图1所示,一种基于光片照明的免标记细胞检测装置,包括激光器1,反射镜2,中性密度滤光片3,柱面透镜4,样本腔室5,样本室固定器6,三维电动位移台7,显微物镜8,CMOS探测器9,数据分析系统10。
具体包括以下过程:
激光器1发出的激光光束经过反射镜2调整传播方向,并通过中性密度滤光片3控制激光强度,调整方向和能量后的激光光束投射到柱面透镜4,柱面透镜4垂直方向调制光束,使光束在一维方向上被压缩,整形成微米级厚度的薄光片,而光片厚度的大小取决于光束投射到柱面透镜的有效数值孔径大小;
照明光片从样本腔室5侧面照明样本悬液,从而激发悬液中的待测样本。固定器6将样本室5固定在三维电动位移台7上,三维电动位移台7控制样本在垂直方向和水平平面上的精确移动;
样本被激光光片激发后,分布于三维空间的散射光被探测物镜8检测和收集,CMOS探测器9捕获二维光散射图样并记录;
记录的图像数据传送到分析系统10进行数据处理和分析。
实施例1
使用基于光片照明的免标记细胞检测装置及方法,实现不同厚度的均匀照明光片。在光散射成像中,为降低成像过程中的背景噪声,并同时保证待测样本受到均匀照明,本发明中对于不同大小尺度的样本提供不同厚度的光片激发,具有针对性地控制光片厚度,限制激发区域,避免来自于其他样本散射光的干扰。通过控制光束的扩束倍数和柱面透镜的焦距产生所需厚度的光片。本实例中通过转换不同焦距柱面透镜实现不同厚度的光片。不同的厚度通过若丹明溶液进行可视化,并通过垂直扫描图像像素测量光片厚度。
具体操作步骤:
(1)配置若丹明6G溶液,并将溶液导入构建好的样本腔室中;
(2)打开激光光源,校准光路,使激光光束依次通过光学元件包括反射镜、中性密度片和柱面透镜的光轴,保持水平传播。90°旋转柱面透镜,使光束在水平方向上进行压缩,调整柱面透镜位置,使照明光片束腰位置处于探测物镜中心;
(3)在CMOS探测器前增加波长过滤片,滤除激发光波长(532nm),允许若丹明溶液的发射波长(575nm)通过,触发CMOS探测器记录光片可视化后的图像;
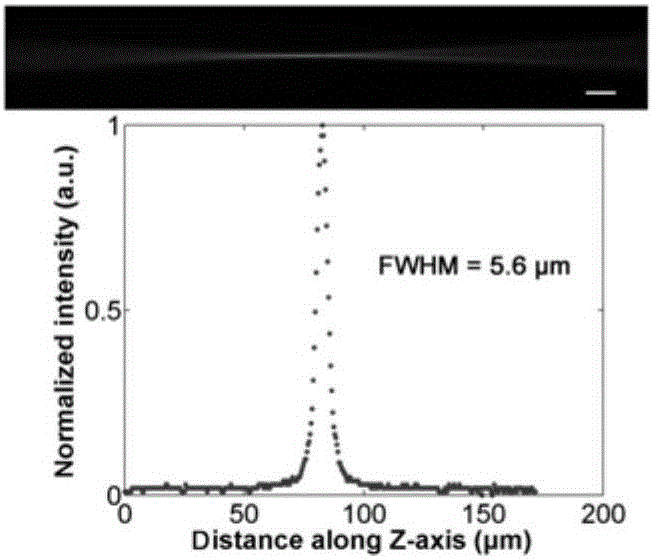
(4)通过垂直扫描图像像素,获得灰度值,确定光片的束腰,并测量其光片厚度,此处使用半高宽(FWHM)作为厚度的刻画参数;结果如图2(a)、图2(b)、图2(c)所示,光片厚度分别为5.6μm,13.7μm和53.3μm。
实施例2
为了验证本发明对于微米水平颗粒尺寸鉴别的灵敏度和准确性,使用聚苯乙烯标准微球进行实验验证和装置校准。在本发明中,选择粒径为3.87μm和4.19μm的标准微球为成像样品,获得其显微图像以及二维散射图,并将实验结果与Mie模拟的结果进行FFT对比分析。本发明中所选用的显微物镜是数值孔径为0.4的20倍物镜,其对应的可探测角度范围是72.5°-107.5°,所以在Mie模拟中,散射极角和方位角值均为此范围。本实例中调整光片厚度为13μm左右。
具体操作步骤:
(1)吸取适量聚苯乙烯微球原液,用超纯水进行稀释,并将微球悬液导入样本微腔室;
(2)将制备好的载有微球悬液的样本芯片通过固定器固定在三维位移台上,控制位移台,聚焦物镜,确定视场中的成像目标,微调位移台,使目标微球位于物镜中间位置;
(3)触发CMOS探测器,记录微球的在聚焦模式下的形态显微图像;
(4)打开激光光源,调整光片发生单元装置,使激光光束保持水平并在光学元件的中心光轴上,形成的光片与目标微球处在同一高度上,并且光片束腰位置保持在物镜视野中心;
(5)微调物镜,正向去焦200μm,使物镜工作在去焦模式下采集散射光,触发CMOS探测器,记录该微球的二维光散射图样;
(6)根据Mie光散射理论模型,模拟微球的二维光散射结果。模拟条件为光源波长532nm,微球折射率1.59,微球所处溶液介质折射率1.334,散射极角和方位角的角度范围是72.5°-107.5°;
(7)分别对实验和模拟的二维光散射图像进行水平扫描,获得光散射强度的灰度值曲线。通过傅里叶变换进行一维FFT的量化分析,FFT图谱中的频率主峰值可量化光散射图样的条纹分布。根据不同尺寸的微球的光散射条纹分布产生的频率主峰值的不同,实现对微球的尺寸鉴定和分类。本实例中,FFT采样的频率步长设置为0.0138(1/degree)。
本实例的实验结果如图3(a)-图3(f)所示。图3(a)与图3(d)分别是3.87μm和4.19μm的微球在20倍物镜聚焦工作模式下获得的显微图像。图3(b)与图3(e)分别是去焦模式下获得的两种小球的二维光散射图样。两种微球的尺寸差异为320nm,在普通光学物镜聚焦模式下较难直观区分两种颗粒。相比之下,两种小球的二维光散射图样在条纹数量和分布上呈现明显差异性,3.87μm微球的光散射图样出现7条明条纹,4.19μm微球中出现8条明条纹,因此,可以通过判断光散射图样的条纹数量直接快速区分两种微球。图3(c)与图3(f)是根据Mie模型模拟的两种小球的光散射图样结果,该结果与实验结果呈现比较一致的散射条纹分布。进一步利用快速傅里叶FFT方法量化分析两种小球的差异以及实验与模拟结果的吻合性,结果如图4所示。对于4.19μm微球,模拟与实验结果的FFT频率主峰值均为1.432(1/degree);对于3.87μm微球,实验结果的频率主峰值为1.2963(1/degree),模拟结果为1.2825(1/degree),仅为一个采样步长的差异,也比较一致。本实例证明了本发明用于亚微米分辨率颗粒尺寸鉴别的可行性以及准确性。
实施例3
使用基于光片照明的免标记细胞检测装置及方法,对人体成纤维衰老细胞和正常细胞进行细胞识别和自动分类。本实例中调整光片厚度约为50μm。对经过双氧水诱导衰老的人体成纤维衰老细胞和正常细胞进行细胞形态图像及其二维光散射图样采集,每类随机采集55个实验结果。对获得的110个光散射图像进行特征参数提取,并输入支持向量机(SVM)算法作为特征参数,对两类细胞进行自动分类。
具体实现:
(1)准备双氧水处理过的人体成纤维衰老细胞和正常细胞,用PBS缓冲液配置成细胞悬液,导入样本微腔室,控制位移台和成像单元装置,在聚焦模式下获得细胞的显微图像;如图5(a),图5(b)。
(2)启动光片照明装置,在去焦200μm模式下,分别获得两类细胞的二维光散射图样,如图5(c),图5(d)。
(3)算法检测并提取散斑分布的特征参数。首先检测局部强度最大值点,确定斑点位置和中心。在本发明中,强度比周围像素大6个单位以上的像素点定义为最大强度值点。确定斑点中心之后,将小于该中心点6个强度差异范围内的像素区域定义为以该局部最大强度点为中心的散斑面积。扫描110个实验结果,提取对应的散斑数量和散斑面积的数值参数,根据散斑数量与散斑面积的分布关系表征不同的细胞,实现对衰老细胞和正常细胞的分类,如图6所示。
(4)将散斑数量和散斑面积的数值作为支持向量机的分类特征值,执行SVM算法时选取线性核函数,并采用5-折交叉验证法构建分类器。将两类细胞结果的110个数据随机分为5个数据集,每个数据集有22个样本,轮流将其中的4个数据集作为训练集,剩余的一个数据集作为测试集,重复交叉验证5次后,将5次预测结果的正确率的平均值作为最终的准确度。分类结果如表1所示。其中,准确率定义为能够被正确分类的细胞数量占全部细胞数量的百分比;灵敏度定义为衰老细胞能被正确分类的数量与衰老细胞总数量的比值;特异度定义为正常细胞被正确分类的数量与正常细胞总数量的比值。AUC参数用于评估分类器的性能,值越接近于1,表示分类器性能越好。
表1人体成纤维衰老和正常细胞的SVM分类结果
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
- 还没有人留言评论。精彩留言会获得点赞!