miR399在促进大豆氮磷吸收利用及开花方面的应用的制作方法
本发明属于基因工程技术领域。涉及miR399在促进大豆氮磷吸收利用及开花方面的应用。更具体地,涉及大豆miR399在促进大豆根系发育、增加氮磷含量与生物量、促进开花的新功能,以及利用该基因在培育氮磷协同高效植物方面以及促进豆科作物开花方面的应用。
背景技术:
MicroRNA(miRNA)是一类长度为20-24个核苷酸的非编码小分子RNA,在植物体内大量存在,能在转录后水平抑制基因的表达(Jones-Rhoades et al., 2006;Rogers et al., 2013)。植物中miRNA的生物合成过程较为复杂(Kai et al., 2010)。已有研究表明:在植物适应养分胁迫方面,miRNA有十分重要的作用。作为植物不可缺少的矿质养分,磷不仅是构成核酸、磷脂、ATP等的结构组分,而且参与了光合作用、呼吸作用、能量传递及酶活性调节等生理生化过程。磷也是维持现代农业所必需的肥料主要成分之一(López-Arredondo et al., 2014)。虽然土壤中的总磷丰富,但大部分磷难以移动而且通常容易被钙、铁、铝等固定,导致土壤有效磷不足,而磷缺乏必然会导致作物减产(Raghothama, 1999;Wang et al., 2010)。土壤有效磷含量低,已成为限制农业生产的重要因素之一(Kochian, 2012)。因此研究如何更有效地利用磷资源,已经成为农业和基础科学研究的重要问题。
通过多年的研究,人们已对植物低磷胁迫响应的miRNA有较深入的认识。MiR399是一种受低磷诱导表达的miRNA,在植物中比较保守,其靶基因是一种编码E2结合酶基因PHO2(Fujii et al., 2005;Aung, 2006)。低磷条件下,miR399通过负调控PHO2,解除其对下游磷响应基因如磷转运子的抑制,从而促进磷的吸收。高磷条件下,过量表达miR399的拟南芥地上部积累了大量的磷,而对根部磷积累没有影响(Chiou et al., 2006)。与此一致的是,在拟南芥pho2突变体中也观察到相似表型,表明miR399通过调节PHO2的表达,不仅改变根部磷的吸收,而且影响植株地上部磷的分配(Bari, 2006;Chiou et al., 2006),说明miR399在调节植物体内磷平衡方面起重要作用。此外拟南芥嫁接实验还证实miR399能从地上部向根部转运,从而影响根部PHO2的有效转录本水平,暗示miR399从地上部到根部长距离运输是植物适应低磷胁迫的一个重要机制(Lin et al., 2008)。最近的研究揭示,PHO2参与泛素化磷转运蛋白PHT,它能在内质网与PHT1相互作用,从而通过调节磷转运蛋白在膜上的量而调控植物对磷的吸收(Huang et al., 2013)。
大豆(Glycine max)是世界上重要的粮油作物,但全球大面积的酸性土壤普遍缺磷,限制了其生长发育并降低产量(Kutama et al., 2009)。作为豆科作物,它能与根瘤菌共生形成根瘤,固定空气中的氮气,为植物提供氮源,改善土壤质量(Unkovich et al., 2000)。大豆生长发育与固氮过程均需要大量磷营养(Sa et al., 1991)。豆科作物生产上常存在“以磷增氮”效应(杨俊丰,1992)。一般认为,第一,磷能促进植株地上部和根系的生长,提供更多碳源供给根瘤生长;第二,磷对根瘤的形成与固氮过程起直接作用,从而提高固氮量,改善作物氮营养(Graham et al., 1979;Israel, 1993),达到氮磷协同高效。但与其他作物一样,同样遭受着土壤低磷胁迫,限制了大豆的生长发育与共生固氮,使产量降低(Olivera et al., 2004;Kutama et al., 2009)。一方面可能低磷限制了作物生长进而限制了固氮作用;另一方面可能缺磷直接影响了根瘤的发育和固氮功能(Crews, 1993;Almeida et al., 2000;Chen et al., 2011)。很多研究表明,低磷胁迫下,豆科作物根瘤生物量、固氮酶活性、固氮能量均下降,导致作物减产(Israel, 1987;Ribet et al., 1995;Schulze et al., 2006)。要适应低磷胁迫,需要通过协调磷的吸收、分配、再利用以及对生长发育的调控,来维持体内磷动态平衡(Chiou et al., 2011;Liang et al., 2014)。但遗憾的是,我们对大豆低磷响应miRNA如何调控磷养分平衡尚不清楚。miR399与大豆氮磷养分平衡直接的关系仍不明确,miR399对豆科植物的生长发育有怎么的影响都不清楚,限制了其实践应用。
技术实现要素:
本发明要解决的技术问题是克服上述现有技术的缺陷和不足,明确了miR399基因,包括miR399e和miR399g,在促进转基因大豆根系发育、提高了植株氮含量,最终增加转基因植株生物量方面的作用。明确了miR399,尤其是miR399e,促进转基因大豆开花的作用。基于发掘该基因的功能,可应用于豆科植物的氮磷协同高效育种,降低农业生产成本,提高作物产量。
本发明的目的是提miR399在调控促进大豆氮磷吸收利用方面的应用。
本发明另一目的是提供miR399在促进大豆开花方面的应用。
本发明上述目的通过以下技术方案实现:
本发明首先进行了miR399e和miR399g前体序列的cDNA克隆,然后分别构建了过量表达miR399e和miR399g的整株转基因大豆株系,比较研究了在不同氮磷养分条件下过量表达miR399e和miR399g的转基因株系与对照非转基因株系的氮磷含量及生长表型。
结果显示:
(1)在高磷高氮和低磷高氮条件下,过表达miR399e和miR399g转基因大豆的生物量、总根长和根表面积均增加。
(2)高磷高氮条件下,过表达miR399e和miR399g转基因大豆总磷和总氮含量增加。
(3)高磷高氮和高磷低氮条件下,过表达miR399e转基因株系在老叶中积累可溶性磷。
(4)在高磷高氮和低磷高氮条件下,过表达miR399e促进转基因大豆开花。
研究得出以下结论:
(1)miR399具有促进豆科作物吸收和利用氮磷能力,从而在提高植株氮磷协同高效方面以及促进豆科作物开花方面具有很好的应用。
(2)miR399具有增加大豆根系发育的功能,过表达miR399的转基因大豆显著增加了总根长和跟表面积,进而增加了根系与土壤的接触面积,有利于根系吸收养分。
(3)miR399具有增加大豆氮磷含量、提高氮磷吸收利用能力从而促进生物量的功能,与野生型大豆相比,过量表达miR399的转基因大豆氮磷含量显著增加,氮磷吸收利用能力提高,进而增加了转基因大豆生物量。
(4)miR399在促进大豆开花方面具有很好的应用,与野生型非转基因大豆相比,过量表达miR399e的转基因大豆开花时间。
因此,以下所述应用均应在本发明的保护范围之内:
miR399在促进豆科植物吸收和/或利用氮磷能力方面的应用。
进一步地,是指miR399在促进豆科植物根系发育方面的应用,或miR399在促进豆科植物氮磷含量和/或生物量增加方面的应用。
更进一步地,是指miR399在促进豆科植物总根长和/或根表面积的增加方面的应用。
优选地,所述miR399是指miR399e或miR399g。
miR399在促进豆科植物开花方面的应用。优选地,所述miR399是指miR399e。
miR399在促进豆科植物老叶中可溶性磷的积累方面的应用。优选地,所述miR399是指miR399e。
另外,优选地,上述豆科植物是指大豆。
本发明为了探明miR399与豆科植物氮磷养分平衡调控以及miR399对豆科植物生长发育的影响,通过大豆低磷响应小分子RNA建库测序分析发现大豆有5个miR399家族成员,均受低磷诱导表达。通过生物信息学分析预测以及RLMRACE实验证实大豆PHO2和磷转运蛋白的基因GmPT5是miR399的靶基因。利用大豆转基因技术分别过量表达该基因家族的miR399e和miR399g,研究发现miR399e和miR399g促进转基因大豆根系发育、提高了植株氮含量,最终增加了转基因植株的生物量。与野生型相比,过表达miR399e促进转基因大豆开花。本发明的研究成果将为包括大豆在内的豆科作物氮磷协同高效和高产分子育种提供基因资源。
本发明具有以下有益效果:
本发明公开了miR399调控大豆氮磷养分平衡和开花的功能,明确了miR399e和miR399g在豆科植物中的磷养分调节方面的功能及,为深入解析大豆适应低磷胁迫和揭示豆科作物氮磷协同高效提供理论依据。过量表达miR399e/g能够增加总根长和根表面积、增加大豆氮磷含量,从而增加生物量。过量表达miR399e可促进转基因大豆开花。
本发明可应用于通过转基因技术促进豆科作物吸收和利用氮磷能力,对大豆适应低磷胁迫和揭示豆科作物氮磷协同高效具有重要的理论和实践意义。
附图说明
图1为过量miR399e和miR399g转基因整株材料的miR399表达量。
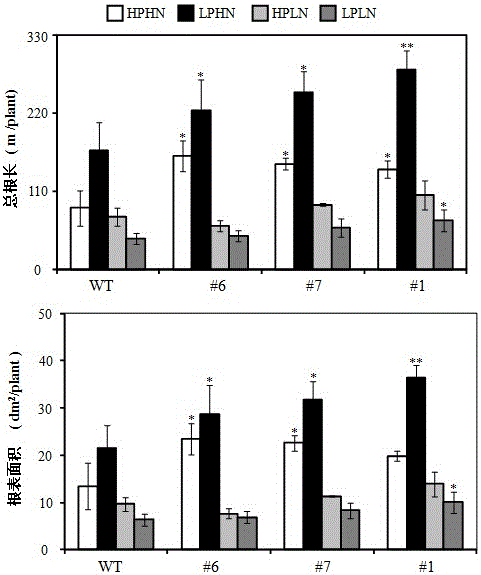
图2为过量miR399e和miR399g对大豆转基因植株根系(总根长和根表面积)的影响。
图3为过量miR399e和miR399g在不同氮磷养分处理下对转基因大豆植株生长的影响。
图4为过量miR399e和miR399g在不同氮磷养分处理下对转基因大豆植株氮/磷含量的影响。
图5为过量miR399e对转基因大豆植株开花的影响。
注:以上图中WT为野生型(YC03-3,即粤春03-3),#6、#7为过量表达MIR399e株系,#1为过量表达MIR399g株系。HPHN为高磷高氮处理,LPHN为低磷高氮处理,HPLN为高磷低氮处理,LPLN为低磷低氮处理,处理40天。图中数据为4个生物学重复的平均值和标准差(SE),星号代表同一处理下不同植株与野生型间的差异(Student’s t-test), *表示差异显著(ρ<0.05),**表示差异极显著(ρ<0.01)。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1 构建过量表达miR399e和miR399g的整株转基因大豆株系
1、miR399e和miR399g过表达载体构建
(1)引物设计
从网站下载miR399e和miR399g的前体全长序列,分别设计特异的扩增引物,OE-miR399e(F(Sac I):AAgagctcCATGCAACGCAAAATAAAGG;R(Xba I):AAtctagaAAATATGGCATATGAATGGT),
OE-miR399g(F(Sac I):AAgagctcCCACCAACGCATATTATAACC;R(Xba I):AAtctagaCATGAAGCAGTACTTTAAGCC)。
(2)片段扩增及装载pTF101.1
以大豆YCO3-3的cDNA为模板,分别用OE-miR399e和OE-miR399g的特异引物扩增相应片段,反应体系及反应条件见下表1和表2。
表 1 PCR反应体系
表 2 PCR反应条件
(3)PCR扩增产物纯化及T载体连接
使用琼脂糖凝胶DNA回收试剂盒回收PCR产物,将回收片段与pMD18-T载体连接后转化大肠杆菌DH10B,PCR检测后送测序公司测序。
(4)目的载体连接
测序正确,提取该质粒与pTF101.1质粒,用同样的内切酶分别进行双酶切,使用琼脂糖凝胶DNA回收试剂盒分别回收酶切产物。用连接酶将两者连接后转化大肠杆菌DH10B,PCR检测后送测序公司测序。测序正确后将菌液和质粒分别保存备用。同时将重组的目的载体转化农杆菌菌株GV3101、EHA101,检测无误后保存菌液备用。
2、大豆整株遗传转化
(1)种子萌发
将完好的大豆YC03-3种子单层排列在培养皿中,放入干燥器中,并将培养皿打开,盖子紧挨着培养皿。将100 ml的次氯酸钠加至干燥器中250 ml烧杯中,然后沿着杯壁缓缓加入4.2 ml 浓盐酸(HCl),立即密闭干燥器,静置过夜。次日,盖上培养皿取出,将培养皿放到超净工作台中打开除去过多的氯气。将消毒的种子种脐朝下播种至萌发培养基(GM)中,每皿25颗。然后放置在人工气候室(16小时光照24 ℃/8小时黑暗24 ℃)培养4-5天。
(2)农杆菌接种
将携带目的载体的农杆菌EHA101在50 ml液体YEP培养基(添加壮观霉素、卡那霉素、氯霉素)中扩大培养,28 ℃下200 rpm培养20小时。5000 rpm下将菌液离心10分钟,弃上清,用液体共培养基(CM)重悬菌液至OD650值为1.0-1.2。
(3)共培养
用已灭菌的解剖刀从离子叶节大约0.5 cm的下胚轴切下萌发的种子,沿着子叶剖开种子,并剔除子叶节上幼芽。在子叶、下胚轴和子叶节区域垂直于轴切出7-8个切口。向装有外植体的培养皿中加入重悬的农杆菌菌液,充分浸泡外植体30分钟。随后将外植体转移到固体CM培养基上,切口向下,用保鲜膜封住培养皿,水平放置在人工气候室暗培养3天。
(4)幼芽的诱导
在液体幼芽诱导培养基(SI)中清洗后,将外植体45°角斜插在固体SI培养基上,培养皿用医用透气胶带封口,人工气候室(16小时光照24 ℃/8小时黑暗24 ℃)培养。2周后,在子叶节切去下胚轴,将新的切面插入至新的SI培养基中继代培养2周。
(5)幼芽伸长
切除未分化的外植体及子叶,并在分化的外植体基部切一个新切口,然后转移到幼芽伸长培养基(SE)上,培养皿用医用透气胶带封口,人工气候室(16小时光照24 ℃/8小时黑暗24 ℃)培养2-8周。每2周更换一次SE培养基,每次剔除老化的愈伤组织,在外植体基部切一个新切口。
(6)生根培养
待幼芽生长到3 cm长时,把它们从愈伤组织上切下来,转移到装有生根培养基(RM)的培养瓶中进行生根培养2周左右。茎上长出几条根时,从培养基中取出转化苗,用自来水冲洗根部去除培养基,移植到水培瓶中。在培养箱中生长4周(16小时光照24 ℃/8小时黑暗24 ℃)后,将转化苗移植到温室中,用1/2浓度的Hoagland营养液培养至结荚,每2周换一次营养液。
(7)转基因大豆后代鉴定
转化苗(T0代植株)转移至水培后,用除草剂涂半片叶片上检测植株是否具有除草剂抗性。同时采样提取DNA,进行Bar基因检测。待T0代收种后,将种子播种进行水培繁种,期间对过量表达转基因株系采样提取RNA,反转录成cDNA后利用荧光定量PCR检测基因相对表达量。
实施例2 过量miR399e和miR399g分析实验
1、实验方法
(1)种子消毒
将成熟、饱满的大豆种子单层排列在培养皿中,放入干燥器中,并将培养皿打开,盖子紧挨着培养皿。将100 ml的次氯酸钠加至干燥器中的250 ml烧杯中,然后沿着杯壁缓缓加入4.2 ml 浓盐酸(HCl),立即密闭干燥器,静置10小时。从干燥器中拿出后除去过多的氯气。
(2)催芽
将消毒后的种子点入湿润的石英砂中催芽萌发。
(3)移苗
一周后两叶一心时选择正常、长势一致的幼苗移栽至水培系统,于温室中用1/2大豆营养液培养。
(4)处理
一周左右待第一片三出复叶完全展开后进行处理:低磷低氮结瘤(LP: 25 μM,LN: 530 μM)、高磷低氮结瘤(HP: 500 μM,LN: 530 μM ) 、低磷高氮(LP: 25 μM, HN: 5.3 mM)、高磷高氮(HP: 500 μM,HN: 5.3 mM ),每个处理5个生物学重复。每周换一次营养液,每3天调一次pH。
(5)采样
对处理后0天、7 天、35天、40天的根、叶、根瘤采样,液氮冷冻,-80℃保存。
2、结果
为了明确过表达大豆miR399e和miR399g对大豆磷营养的影响,本文通过大豆整株转化体系获得了过表达miR399e和miR399g的转基因大豆株系,并通过除草剂筛选、Bar基因检测以及荧光定量PCR鉴定,确定了2个过表达miR399e和1个miR399g过表达株系,即OE-miR399e-6(#6)、OE-miR399e-7(#7)和OE-miR399g-1(#1)。由于真正行使功能的是成熟miRNA,而miR399d/e/f/g的成熟序列一样,荧光定量PCR并不能区分miR399d/e/f/g,因此我们首先通过荧光定量PCR检测了转基因大豆和野生型中叶部成熟miR399d/e/f/g的表达量,miR1520d作为看家基因。
图1为过量miR399e和miR399g转基因整株材料的miR399表达量检测。结果显示:过表达miR399e(#6、#7)和miR399g(#1)的株系中miR399的表达水平明显高于野生型,其中OE-miR399e-6 (#6)、OE-miR399e-7 (#7)、OE-miR399g-1 (#1)株系分别为野生型的12.0倍、4.7倍和2.8倍,统计分析显示差异达到显著(*,ρ<0.05)或极显著水平(**,ρ<0.01)。
实施例3 过量miR399e和miR399g对转基因大豆植株根系的影响
1、根系是植物吸收磷的主要器官,根表面积代表根系与土壤的接触面积,是与养分吸收相关的重要指标。
我们对过表达miR399e和miR399g的转基因大豆与野生型大豆进行处理40天,然后收样对根系性状进行分析。
2、结果
图2为过量miR399e和miR399g对转基因大豆植株根系的影响。结果表明:在HPHN条件下,两个OE-miR399e株系(#6、#7)的总根长分别为野生型的1.85和1.72倍,OE-miR399g-1为野生型的1.63倍。在LPHN条件下,两个OE-miR399e株系(#6、#7)的总根长分别为野生型的1.34和1.49倍,OE-miR399g-1为野生型的1.68倍;HPLN条件下过表达株系与野生型总根长差异不显著;而LPLN条件下,OE-miR399g-1为野生型的1.58倍,其它过表达株系与野生型差异不显著。HPHN条件下,两个OE-miR399e株系(#6、#7)的根表面积分别为野生型的1.73和1.67倍,OE-miR399g-1为野生型的1.47倍(ρ= 0.078)。LPHN条件下,两个OE-miR399e株系(#6、#7)的根表面积分别为野生型的1.33、1.47倍,OE-miR399g-1为野生型的1.69倍。HPLN条件下过表达株系与野生型根表面积差异不显著;LPLN条件下,OE-miR399g-1为野生型的1.58倍,其它过表达株系与野生型差异不显著。
实施例4 过量miR399e和miR399g在不同氮磷养分处理下对转基因大豆植株生长和氮/磷含量的影响
1、植株生物量测定
称量地上部和根部样品鲜重,所有样品在105 ℃烘箱杀青30分钟后置于75 ℃烘干至恒重,称取干重。
2、全磷、全氮含量的测定
(1)待测液制备(H2SO4- H2O2消煮法)
1)称取粉碎的植物干样和标准样品0.2 g,分别置于50 mL的消煮管底部。加1 mL二级水润湿后,加入5 mL浓H2SO4,轻轻摇匀,另取干净消煮管作为空白对照(加1 mL 二级水和5 mL浓H2SO4)。弯颈小漏斗扣住管口,静置过夜;
2)用消煮炉先180 ℃消煮,待H2SO4分解冒大量白烟后升高温度至350℃。溶液呈均匀棕黑色时取下,稍冷却后加10滴双氧水(H2O2),摇匀,再消煮5分钟,重复3-5次,每次逐次减少H2O2的量。溶液清亮或无色后,再消煮10分钟,去除多余的H2O2,取下,冷却;
3)二级水冲洗弯颈漏斗后,定容至50 mL,摇匀,留存待测。
(2)全磷、全氮含量测定(流动分析法)
1)磷酸盐模块试剂
硫酸溶液:取浓H2SO4 40 mL加入960 mL蒸馏水中,转移至聚乙烯瓶中,加入2 mL FDD6混匀,保存于冰箱中;
蒸馏水+FFD6:取1 L蒸馏水于聚乙烯瓶中,加入2 mL FDD6摇匀,保存于冰箱中;
钼酸铵溶液:取0.12 g酒石酸(氧)锑钾(K(SbO)C4H4O6·1/2H2O)和3.0 g钼酸铵((NH4)Mo7O24·4H2O)溶于485 mL蒸馏水中,加入15 mL浓硫酸(H2SO4)混匀,保存于冰箱中;
抗坏血酸溶液:取5.5 g抗坏血酸(Vc)溶于470 mL蒸馏水中,加入30 mL丙酮,保存于冰箱中;
冲洗液: 800 mL蒸馏水中加入25 mL浓硫酸混匀,定容至1000 mL;
氮磷混合标准液:取0.9548 g无水NH4Cl和0.2197 g无水KH2PO4溶于蒸馏水中,定容至1000 mL,配制成氮磷混标储存液, 保存于冰箱中;
工作标准曲线:见表3。
表3 氮磷混标工作标准曲线制作
2)氨氮模块试剂
氯化钠/硫酸溶液:取10.0 g NaCl溶于800 mL蒸馏水,加入7.5 mL浓硫酸以及1mL Brij35,定容至1 L,保存于冰箱中;
缓冲溶液:取25.0g酒石酸钾钠(NaKC4H4O6.4H2O)、27.0g氢氧化钠(NaOH)和17.9 g磷酸氢二钠(Na2HPO4.12H2O)溶于300 mL蒸馏水,加入0.5 mL Brij35,定容至500 mL,保存于冰箱中;
水杨酸钠/亚硝基铁氰化钠溶液:取75.0g水杨酸钠(Na2C7H5O3),0.15g亚硝基铁氰化钠(Na2[Fe(CN)5NO].2H2O)溶于蒸馏水,加入0.5 mL Brij35,定容至500mL,保存于冰箱中;
0.3%次氯酸钠溶液:取4.3mL 7%次氯酸钠(NaClO),蒸馏水稀释定容至100 mL,加0.5 mL Brij35,储存在棕色瓶中,保存于冰箱中;
冲洗液:同磷酸盐模块;
氮磷混合标准液:同磷酸盐模块;
工作标准曲线:同磷酸盐模块。
3)上机测定全磷、全氮含量
取0.5mL待测液于测量杯,加入1.5mL蒸馏水稀释4倍,按顺序放在连续流动分析仪的取样器转盘上,收集并处理数据。
3、结果
图3和图4为过量miR399e和miR399g在不同氮磷养分处理下对转基因大豆植株生长和氮/磷含量的影响。
结果显示:过量表达miR399e和miR399g促进了氮磷的吸收,提高了氮磷协同利用效率,进而促进了大豆生长,显著提高了植株的氮、磷含量和生物量。
实施例4 过量miR399e对转基因大豆植株开花的影响
以实验大豆材料第一朵花开放的时间(天数)统计为开花时间进行统计。
图5为过量miR399e对转基因大豆植株开花的影响。结果发现:大豆中过表达miR399e导致提前开花,与野生型相比,在HPHN条件下 OE-MIR399e两个株系分别提前4天和7天开花;LPHN条件下OE-MIR399e两个株系分别提前4天和5天开花。
- 还没有人留言评论。精彩留言会获得点赞!