1,5-二芳香基-1,2,4-三氮唑类化合物及其制药用途的制作方法
本发明涉及一类1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物,以及该类化合物或含 有此类化合物的药物组合物可用作制备治疗各种恶性肿瘤以及肿瘤转移的相关疾病的药物。 本发明还涉及该1,5-二芳香基-1,2,4-三氮唑类化合物的制备方法。
背景技术:
癌症又称为恶性肿瘤,是全球疾病性死亡的主要原因之一。现今众多癌症的发病率和死 亡率依然呈现迅猛增长的态势,严重危害着人类的健康。据美国癌症协会的统计显示,临床 上90%以上的癌症患者死亡的主要原因并不是原位肿瘤的生长,而是肿瘤细胞发生了远端转 移。
肿瘤转移是一个复杂的过程:肿瘤细胞从原发肿瘤部位中释放并侵入周围组织、进入血 液循环或淋巴循环中转移、被远端器官的毛细血管床捕获、从循环系统中侵袭到其它组织器 官中,引起器官功能衰竭,最终引起患者死亡。因此,细胞迁移是肿瘤转移的关键环节,通 过抑制肿瘤细胞迁移是抗肿瘤的有效途径(Iiizumi,M.,et al.Biochimica et biophysica acta.2008, 1786,87-104)。目前,临床上针对转移性肿瘤治疗主要以化疗为主,但是疗效仍然不容乐观。 分子靶向药物是一类以细胞信号通路中的致癌蛋白为靶点,通过调控与癌症的发生发展密切 相关的信号通路,治疗肿瘤的化学药物。相比于传统的化疗药物,它的治疗选择性更好,作 用更加显著,而且副作用更小。因此,目前急需寻找治疗肿瘤的合适靶点和开发能有效抑制 肿瘤转移的靶向药物。
Myoferlin蛋白隶属于ferlin膜蛋白家族,它与肿瘤细胞的迁移和侵袭密切相关,参与细 胞中一系列膜系统的功能,包括细胞膜内吞作用和修复、囊泡运输、蛋白稳定和细胞运动。 人类蛋白质图谱中的免疫组织化学表明myoferlin在多种类型的癌症中都有不同程度的表达 上调,包括黑色素瘤、乳腺癌、卵巢癌、宫颈癌、子宫内膜癌、前列腺癌、胰腺癌和神经胶 质瘤等,而且随着癌症恶性程度增高,其表达量也越高(www.proteinatalas.org; www.cbioportal.org)。蛋白质组学分析表明,myoferlin在内皮细胞核血管组织中大量表达,它 的缺失会导致对血管内皮生长因子应答的降低,影响内皮细胞的增殖、迁移和NO的释放等 生理活动。缺失myoferlin可导致内皮细胞VEGFR-2的表达水平和磷酸化能力的下降。 VEGFR-2在肿瘤组织的生长和迁移的过程中都有着非常重要的作用,myoferlin可以与 dynamin-2、VEGFR-2形成一个复合物,阻碍了CBL依赖的VEGFR-2的泛素化和蛋白酶体 的降解(Bernatchez P N,et al.J Biol Chem.2007,282(42):30745-30753)。研究表明myoferlin可 能在癌细胞的运动上扮演着重要的角色,能够调节局部质膜以及影响受体和蛋白在质膜上的 转运。已有报道在MDA-MB-231细胞株上,缺失myoferlin可以促使间质-上皮转化(MET), 在基质胶细胞侵袭实验中降低乳腺癌细胞的侵袭能力,在一定程度上下调基质金属蛋白酶 (MMPs)的表达。相反,降解myoferlin可以促使上皮-间质转化(EMT)从而抑制乳腺癌的 转移(Ruth Li,PLoS ONE 7(6):e39766)。在乳腺癌与Myoferlin相关的信号途径中,在乳腺癌 中高表达的Myoferlin能够调节表皮生长因子受体的活性。Myoferlin与小窝蛋白共定位能够 调节细胞中被激活的表皮生长因子受体(EGFR)。在Myoferlin缺失条件下,被激活的表皮 生长因子受体不能在乳腺癌细胞中被降解,因此能够持续激活下游EGFR信号通路,显著地 抑制乳腺癌细胞的上皮间质转化和迁移。
鉴于myoferlin蛋白在肿瘤转移过程中的重要作用,而目前市场上又没有特异性针对 myoferlin靶点的化疗药物,因此myoferlin作为一个潜在的药物靶点具有良好的靶点创新性, 且研发靶向myoferlin蛋白的抗肿瘤药物具有广阔的市场前景。靶向myoferlin蛋白的小分子抑 制剂可以结合到myoferlin蛋白上影响其构象变化或者阻止与其他蛋白形成功能复合体,从而 有效抑制肿瘤的生长和转移。Myoferlin蛋白共由2061个氨基酸组成,全长蛋白包含有6个 不同的具有重要调节功能的C2结构域,它们能够参与细胞内的蛋白互作。我们可以通过对 全长蛋白进行不同缺失突变,每一个缺失突变体包含不同的C2结构域,从而确定myoferlin 与靶向myoferlin蛋白的小分子抑制剂结合的具体结构域。
1,2,4-三氮唑类化合物是一类包含三个氮原子的五元芳香杂环的化合物总称。在抗抑郁、 抗痉挛、抗细菌、抗病毒、抗真菌和抗寄生虫等药物研发上都发挥着重要的生理药理作用, 是药学上一类重要的药效团,广泛地出现于多种药物及生物活性化合物中:例如抗偏头痛药 利扎曲坦(Rizatriptan,式IV),与干扰素联合治疗丙型肝炎的利巴韦林(Ribavirin,式IV), 以及芳香酶抑制剂来曲唑(Letrozole,式IV)等。并且部分含有三氮唑的化合物被证明有抗 癌的活性,目前已有包括来曲唑在内的部分药物进入了抗癌临床的研究(式V) (www.clinicaltrials.gov)。本发明为创造一类靶向myoferlin蛋白的新型抑制剂并用于制备抗 肿瘤转移的新型候选药物,在前期大量研究工作的基础上创造性地设计与合成一类新型的1, 5-二芳香基-1,2,4-三氮唑结构的化合物。经大量研究后发现,本发明化合物可与myoferlin蛋 白结合,强烈抑制肿瘤细胞的增殖和迁移,体内实验也表明该类化合物可显著抑制多种肿瘤 的生长和转移,可发展为潜在的肿瘤候选药物。
技术实现要素:
本发明的目的在于提供一类1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物可作为抗 肿瘤先导化合物,包括其可用盐以及酯等。
本发明的另一目的在于提供此类1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物为制 备肿瘤血管新生所引起的相关疾病药物的应用。
本发明的目的还在于寻找上述化合物或含有上述化合物的药物组合物在制备治疗各种恶 性肿瘤,特别是乳腺癌、肺癌、肝癌、前列腺癌、皮肤癌、结肠癌、胰腺癌、白血病、卵巢 癌、胃癌、膀胱癌、肾癌、口腔癌等疾病以及相关的癌症转移和复发过程中的药物应用。
本发明提出了一种1,5-二芳香基-1,2,4-三氮唑类化合物或药学上可接受的盐,其由下述结 构式(I)表示:
其中,
m是0-3;
n是1-6;
X为CH2、O或者S;
D和E中有一个为C,另一个为N,且二者不同;
分别为苯环或下列芳香杂环中的一个:吡啶环,嘧啶环,噻唑环,噻吩 环,呋喃环,吡咯环,咪唑环,吲哚环。
R1独自选自下列基团中的一个:C1-C3烷基、C1-C3烷氧基烷基、C3-C6环烷基;
R2是指上的取代基,独立选自下列基团中的一个或多个:羟基、C1-C3烷氧基、卤 素、C1-C3烷基,氟代甲氧基;
R3独自选自下列基团中的一个或多个:氢、C1-C3烷基,卤素、C1-C3烷氧基。
本发明还提出了一种1,5-二芳香基-1,2,4-三氮唑类化合物或药学上可接受的盐,当式(I) 1,5-二芳香基-1,2,4-三氮唑类化合物中,m=0,X为CH2取代,且都为苯环 时,其由下述结构式(II)表示:
其中,
n是1-6;
D和E中有一个为C,另一个为N,且二者不同;
R1独自选自下列基团中的一个:C1-C3烷基、C1-C3烷氧基烷基、C3-C6环烷基;
R2独立选自下列基团中的一个或多个:羟基、C1-C3烷氧基、卤素、C1-C3烷基、氟代 甲氧基;
R3独自选自下列基团中的一个或多个:氢、C1-C3烷基、C1-C3烷氧基,卤素。
本发明还提出了一种1,5-二芳香基-1,2,4-三氮唑类化合物或药学上可接受的盐,当式(I) 1,5-二芳香基-1,2,4-三氮唑类化合物中,m=0,X为CH2取代,且独立为吡啶环或 苯环时(且不同时为苯环),其由下述结构式(III)表示:
其中,
n是1-6;
D和E中有一个为C,另一个为N,且二者不同;
F和G独立选自C或者N,且二者不同时选C;
分别为苯环或下列芳香杂环中的一个:吡啶环,嘧啶环,噻唑环,噻吩环,呋喃环, 吡咯环,咪唑环,吲哚环。
R1独自选自下列基团中的一个:C1-C3烷基、C1-C3烷氧基烷基、C3-C6环烷基;
R2独立选自下列基团中的一个或多个:羟基、C1-C3烷氧基、卤素、C1-C3烷基、氟代 甲氧基;
R3独自选自下列基团中的一个或多个:氢、C1-C3烷基、C1-C3烷氧基,卤素。
本发明还提出了一种1,5-二芳香基-1,2,4-三氮唑类化合物或其水合物或药学上可接受的 盐,是所述1,5-二芳香基-1,2,4-三氮唑类化合物与酸形成的酸加成盐;其中,所述酸是盐酸、 氢溴酸、硫酸、磷酸、乙酸、酒石酸、水杨酸、柠檬酸、甲磺酸、对甲苯磺酸、乳酸、丙酮 酸、马来酸或琥珀酸。
本发明还提出了一种1,5-二芳香基-1,2,4-三氮唑类化合物或药学上可接受的盐,是所述 1,5-二芳香基-1,2,4-三氮唑类化合物与放射性基团、荧光基团或者生物素结合形成标记物。
本发明还提出了1,5-二芳香基-1,2,4-三氮唑类化合物或药学上可接受的盐,包括:
3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(2-(吡啶-4-基)乙基)苯甲酰胺,
3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(2-(吡啶-2-基)乙基)苯甲酰胺,
3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(2-(噻吩-2-基)乙基)苯甲酰胺,
3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(2-(噻吩-3-基)乙基)苯甲酰胺,
N-(4-羟基-3-甲氧基苯乙基)-3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
N-(2-(1H-咪唑-1-基)乙基)-3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
N-(2-(1H-咪唑-5-基)乙基)-3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
3-(1-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-苯乙基苯甲酰胺,
3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-(4-氟苯基)丁基)苯甲酰胺,
3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(2-((呋喃-2-基甲基)硫)乙基)苯甲酰 胺,
3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-甲基苯乙基)苯甲酰胺,
N-(2-(5-溴-1H-吲哚-3-基)乙基)-3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)苯甲酰 胺,
N-(2-(苄基氧)乙基)-3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)苯甲酰胺,
3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(3-(吡啶-4-基)丙基)苯甲酰胺,
3-(5-(4-甲氧基苯基)-3-丙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
N-(4-氟苯乙基)-3-(5-(4-甲氧基苯基)-3-丙基-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
3-(3-(甲氧基甲基)-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
N-(4-氟苯乙胺)-3-(3-甲氧基甲基)-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
3-(3-异丙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-环丙烷基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-乙基-5-(6-甲氧基吡啶-3-基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-乙基-5-(5-氟吡啶-3-基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(1-(2,4-二甲氧基苯基)-3-乙基-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)苯甲酰胺,
3-(5-(5-氯-2-甲基苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(5-(5-氯-2-甲基苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(3-苯氧丙基)苯甲酰胺,
3-(3-乙基-5-(2-氟吡啶-3-基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(5-(5-氯吡啶-3-基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-乙基-5-(4-三氟甲氧基)苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(5-(4-二氟甲氧基)苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
6-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)吡啶甲酰胺,
6-(3-乙基-1-(4-羟基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)吡啶甲酰胺,
3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-N-(3-苯氧丙基)苯甲酰胺,
3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-N-(4-硝基苯乙基)苯甲酰胺,
3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-N-(4-氟苯基)丁基)苯甲酰胺,
N-(2-(1H-苯并咪唑-2-基)乙基),
3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-苯甲酰胺,
3-(5-(4-乙氧基)苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
3-(3-乙基-5-(4-羟基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,
N-(2,4-二氯苯乙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
N-(4-溴苯乙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-(4-氟苯基)丁基)苯甲酰胺,
N-(2-溴苯乙胺)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-碘苯乙胺)苯甲酰胺,
N-(3-(4-氯苯基)丙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
N-(4-(4-溴苯基)丁基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-羟基苯乙基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(2-(4-甲基噻唑-5-基)乙基)苯甲酰 胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-甲氧基苯乙基)苯甲酰胺,
N-(4-氯苯乙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-(三氟甲基)苯乙基)-苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(3-(4-甲氧基苯基)丙基)-苯甲酰胺,
N-(2-(苯并呋喃-2-基)乙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-(甲磺酰基)苯基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(3-(三氟甲基)苯基)苯甲酰胺,
3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(3-碘苯乙基)苯甲酰胺,
3-(5-(4-氯-2-甲基苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺,和
3-(5-(4-氯-2-甲基苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(3-苯氧丙基)苯甲酰胺。
上述1,5-二芳香基1,2,4-三氮唑类化合物或药学上可以与可接受的盐、放射性基团、荧光 基团或者生物素结合形成标记物。
本发明还提出了一种药物组合物,其中含有本发明所述的1,5-二芳香基1,2,4-三氮唑类化 合物及相关类似物或药学上可接受的盐,以及药学上可接受的载体。本发明所述药物组合物 被配制成可注射流体、气雾剂、乳膏、凝胶剂、丸剂、胶囊剂、糖浆剂、透皮贴剂或赋形剂。
本发明还提出了1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物或药学上可接受的盐 在制备抑制或者结合myoferlin蛋白药物中的运用。
本发明还提出了所述的1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物或药学上可接 受的盐在制备抗肿瘤药物中的应用。
本发明还提出了所述的1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物或药学上可接 受的盐在制备抑制肿瘤细胞增殖、生长、迁移和浸润的药物中的应用;其中,所述肿瘤细胞 包括黑色素瘤细胞、肝癌细胞、肺癌细胞、前列腺癌细胞、乳腺癌细胞、皮肤癌细胞、结肠 癌细胞、胰腺癌细胞、白血病细胞、卵巢癌细胞、胃癌细胞、膀胱癌细胞、肾癌细胞和口腔 癌细胞。
本发明还提出了所述的1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物或药学上可接 受的盐在制备治疗恶性肿瘤的药物中的应用;其中,所述恶性肿瘤包括黑色素、瘤肝癌、肺 癌、前列腺癌、皮肤癌、结肠癌、胰腺癌、乳腺癌、白血病、卵巢癌、胃癌、膀胱癌、肾癌、 口腔癌。
本发明还提出了所述的1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物或药学上可接 受的盐在制备治疗恶性肿瘤转移与复发的药物中的应用;其中,所述恶性肿瘤包括肝癌、肺 癌、前列腺癌、皮肤癌、结肠癌、胰腺癌、乳腺癌、白血病、卵巢癌、胃癌、膀胱癌、肾癌、 口腔癌。
本发明中,1,5-二芳香基-1,2,4-三氮唑类化合物及相关类似物或其水合物或药学上可接受 的盐可以单独使用或与其他药物联合使用。
附图说明
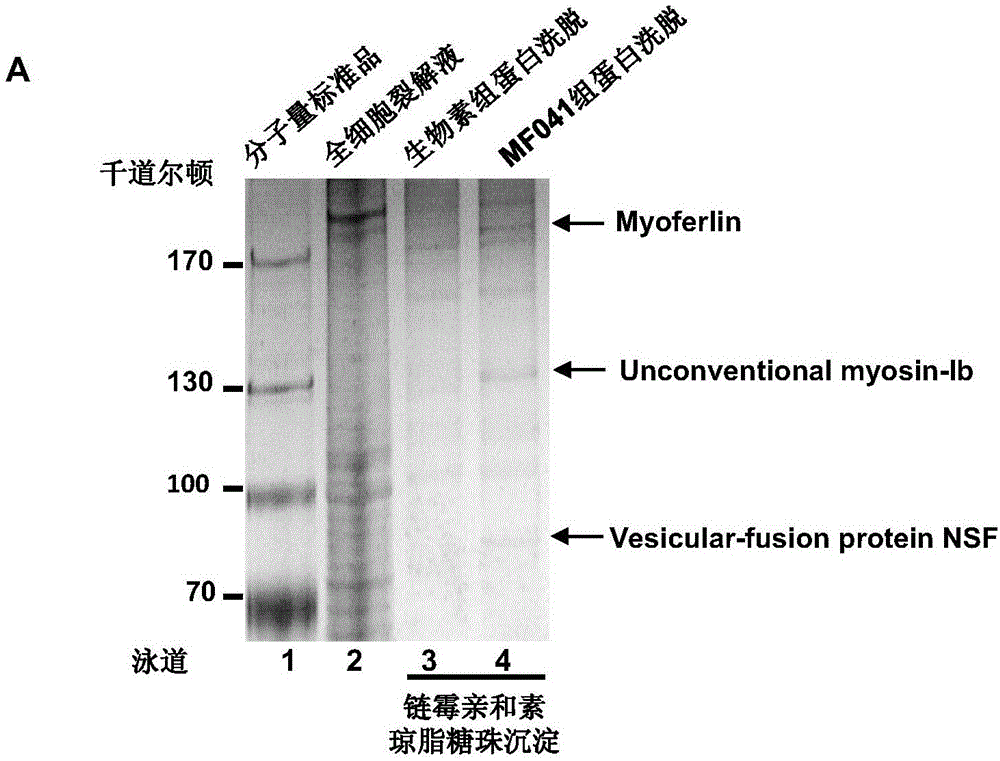
图1为pull-down实验鉴定偶联生物素的MF041组和生物素组的差异条带,后续质谱分 析证实Myoferlin为该类化合物的靶蛋白。
图2为Biacore结合实验中不同浓度本发明化合物MF041,MF010,MF040,MF001, MF009和MF042与myoferlin蛋白之间的结合响应值曲线图。
图3为本发明化合物MF001-MF061在无毒剂量下对多种高表达myoferlin的肿瘤细胞增 殖的抑制效果图;A为本发明化合物在1μmol/L对乳腺癌细胞MDA-MB231增殖的抑制百分 率,B为本发明化合物MF041浓度梯度依赖性地抑制乳腺癌细胞、前列腺癌细胞、结肠癌细 胞、肝癌细胞、非小细胞肺癌细胞和膀胱癌细胞的增殖,C为本发明化合物MF041对正常乳 腺组织细胞MCF-10A毒性较低。
图4为MF041在低浓度下对乳腺癌细胞MDA-MB231和BT549侵袭浸润的抑制效果图; A为MF041在100nM时抑制乳腺癌细胞MDA-MB231和BT549侵袭的代表图,B为MF041 浓度梯度依赖性抑制乳腺癌细胞MDA-MB231和BT549侵袭的统计图。
图5为MF041对小鼠乳腺癌原位生长和自发转移的抑制效果图;A为MF041能够浓度 梯度依赖性抑制小鼠乳腺癌原位生长和自发转移,B为化合物MF041处理组肿瘤的荧光信号 值相较对照组明显减弱,C为动物实验结束时化合物MF041处理组相较对照组肿瘤重量明显 减小,D为化合物MF041处理后各组原位肿瘤发生远端转移到其他组织器官的小鼠数目明显 减少。
图6为MF041对小鼠乳腺癌肺转移的抑制效果图;A为在乳腺癌细胞MDA-MB231中 myoferlin蛋白敲低效率图,B为小鼠尾静脉注射乳腺癌细胞MDA-MB231后化合物MF041 处理组和myoferlin敲低组都能有效抑制肿瘤细胞的肺转移,C为化合物MF041处理组和 myoferlin敲低组中的肿瘤荧光信号值相较对照组明显减弱,D为化合物MF041处理组和 myoferlin敲低组中的肺部转移结节数相较对照组明显减少。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限 于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点 都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试 剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明 没有特别限制内容。
1H-NMR用Bruker 500MHz型仪测定。所有溶剂在使用前均经过重新蒸馏,所使用的无 水溶剂均是按标准方法干燥处理获得;除说明外,所有反应均是在氩气保护下进行并用TLC 跟踪,后处理时均经饱和食盐水洗和无水硫酸钠干燥过程;产品的纯化除说明外均使用硅胶 (200-300目)的柱色谱法;所使用的硅胶,包括200-300目和GF254为青岛海洋化工厂或烟台 缘博硅胶公司生产。
实施例一:各化合物的制备
实施例1-1、3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲 酰胺
取化合物4-甲氧基苯甲酸(304mg,2.0mmol)和乙脒盐酸盐(284mg,3.0mmol)于 N,N-二甲基甲酰胺中,在氩气氛围下,冰浴条件下加入HATU(826mg,2.2mmol)和DIEA (1.39mL,8.0mmol)搅拌5min后,换成室温(25℃)搅拌4h,完毕后冷却,加入化合物3- 肼基苯甲酸甲酯(1329mg,8.0mmol)和冰乙酸(1.14mL,20mmol)升温至80℃,反应3h 后冷却至室温,反应液经饱和碳酸氢钠水溶液洗两次至无气泡产生,用乙酸乙酯萃取,饱和 食盐水洗乙酸乙酯层后,用无水硫酸钠干燥,蒸干有机相。柱层析纯化后得到化合物3-(5-(4- 甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲酸甲酯(518mg,产率:80%):1H NMR(500 MHz,DMSO)δ8.05(dd,J=4.9,1.6Hz,1H),7.98(s,1H),7.64(d,J=6.4Hz,2H),7.39(d,J= 8.6Hz,2H),6.96(d,J=8.7Hz,2H),3.86(s,3H),3.77(s,3H),2.44(s,3H)。取化合物3-(5-(4-甲 氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲酸甲酯(323mg,1mmol)溶于6mL的甲醇中,在 氩气的氛围下冰浴滴加LiOH·H2O(168mg,4mmol)的水溶液(1.5mL),然后在室温条件下 反应过夜。加3M盐酸调成酸性,用乙酸乙酯萃取两次,有机相经水、饱和食盐水洗涤后, 无水硫酸钠干燥,减压浓缩得到粗产物3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲 酸,产率90%。取化合物3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲酸(62mg,0.2 mmol),EDC·HCl(50mg,0.26mmol)和HOBt(30mg,0.22mmol)与烧瓶中,在0℃时,氩气 保护冰浴下注入2mL DMF,5min后滴加4-苯基丁胺(45mg,0.3mmol),15min后撤去冰浴, 常温反应3h。乙酸乙酯萃取后减压浓缩成相应的酰胺粗产物。柱层析纯化后得到产物MF001 (75mg,产率:85%):1H NMR(500MHz,CDCl3)δ7.83(d,J=7.6Hz,1H),7.79(s,1H),7.40(m, 1H),7.34(m,3H),7.25(m,2H),7.16(m,3H),6.80(d,J=8.7Hz,2H),6.68(m,1H),3.77(s,3H), 3.40(m,2H),2.62(t,J=7.3Hz,2H),2.44(s,3H),1.70–1.57(m,4H)。
表1实施例1-2到1-61(MF002-061)所示1,2,4-三氮唑类化合物的制备
实施例二:本发明化合物靶点验证实验
将乳腺癌细胞MDA-MB231的细胞裂解液与生物素或偶联生物素的MF041在4℃共孵 育12h。随后各组分别加入链霉亲和素的琼脂糖珠继续孵育2h。离心收集琼脂糖珠,用2× 上样缓冲液将蛋白洗脱,并用SDS-聚丙烯酰氨凝胶电泳分离。聚丙烯酰氨凝胶银染后,将特 异性目标条带切下进行质谱分析鉴定,结果发现本发明化合物可与myoferlin有效结合。以 MF041为例说明:银染结果如图1所示,靶点验证结合实验中经对比发现3种蛋白仅在生物 素偶联MF041组中出现,在生物素组未见出现,说明是细胞中与MF041结合的蛋白。后续 质谱分析表明这3种蛋白分别是人源的myoferlin,unconventional myosin-Ib和vesicular-fusion protein NSF。经过文献查阅分析三种蛋白在癌症中的功能,以及结合前期实验化合物的抗迁 移和增殖的作用,我们判断myoferlin为化合物MF041发挥抗癌作用的主要蛋白,通过进一 步进行myoferlin分段表达pull-down实验,得出其C2D结构域是化合物MF041的直接结合 区域。从以上结果和相关类似实验可以得出本发明化合物MF001-062可通过抑制myoferlin 蛋白的活性或者影响其构象变化或者阻止它与其他相关蛋白形成功能复合体而发挥显著的抗 癌作用。
实施例三:本发明化合物抑制myoferlin蛋白的效果检测
BIACORE是基于表面等离子共振开发的新型生物分析传感技术,是检测生物分子之间是 否存在直接结合的经典方法。实验时将一种配体生物分子固定在传感器芯片的葡聚糖表面, 将与之相互作用的待测分析物溶于溶液流过芯片表面。SPR检测器能根据跟踪溶液中的待测 分析物与芯片表面的分子结合、解离整个过程的变化,传感器记录对应的信号响应值,并提 供动力学和亲和力数据。本实验中我们采用Biacore生物大分子相互作用仪检测本发明化合物 与含有C2D结构域的myoferlin片段蛋白之间的亲和力,进而反映本发明化合物对myoferlin 蛋白生物活性的抑制效果。
1、Myoferlin片段蛋白的固定:首先,利用氨基偶联法将myoferlin片段蛋白固定到芯片 表面。通过NHS与EDC现混溶液活化CM5芯片Fc2通道表面的羧基,持续时间为420s。 然后,将myoferlin片段蛋白稀释到pH4.5的醋酸钠缓冲液中通过Fc2通道进行偶联,偶联时 间为420s。最后,利用乙醇胺将活化后未结合myoferlin片段蛋白的羧基进行封闭,封闭时间 为420s。
2、结合活性筛选:将本系列化合物稀释到PBS缓冲液中,制备成1uM及10uM的测试 样品。以未结合myoferlin片段蛋白的Fc1通道作为参比,以Fc2作为测试通道,将化合物测 试样品分别流经上述两个通道,将其响应值之差作为评价标准。通过与空白样品及阴性、阳 性对照样品响应值的比较,初步判断所测化合物是否具有myoferlin片段蛋白结合活性。
3、亲和力测试:选择步骤2中所获得的具有myoferlin片段蛋白结合活性的化合物作为 待测化合物,将待测化合物稀释至0.1-10uM的多个浓度。针对同一化合物测试多个不同浓度 与myoferlin片段蛋白结合的响应值,获得浓度依赖性曲线,并基于1:1结合模型拟合出所测 化合物与蛋白之间的亲和力。
实验结果如图2所示,根据不同浓度本发明化合物与含C2D结构域的myoferlin蛋白之 间的结合响应值曲线作图,基于1:1结合模型拟合出所测化合物与蛋白之间的亲和力。图中 随着化合物MF001,MF009,MF010,MF041,MF042和MF040浓度上升与myoferlin片段蛋白 的响应值也随之提高,两者的结合具有浓度依赖性,说明化合物和myoferlin片段蛋白能特异 性的结合。化合物的平衡解离常数KD处于10-6-10-7,KD值越小,代表两者之间亲和力越 强。结果发现本发明化合物绝大部分都能与myoferlin蛋白强烈结合,举例说明:化合物MF001, MF009,MF010,MF041,MF042,MF040与myoferlin亲和力大小MF041(1.99E-7)>MF010 (8.51E-7)>MF040(1.02E-6)>MF001(1.12E-6)>MF009(1.33E-6)>MF042(1.83E-6)。
相似的实验结果也发现,本发明其它化合物都能与myoferlin蛋白强烈结合,显示出明显 的亲和作用。
实施例四:本发明化合物抑制多种肿瘤细胞增殖
1、细胞的培养
本实验中所用细胞均购买于美国标准生物收藏中心(ATCC)。各株细胞所用培养基中均 加入10%胎牛血清(Front)和100U/mL青霉素、100μg/mL链霉素(Gibco),将细胞贴壁培养 在37℃恒温培养箱(湿度95%,CO2 5%)中。
2、SRB(磺酰罗丹明)法测定细胞增殖
将各株高表达myoferlin的肿瘤细胞以适当密度接种至96孔板(Corning),培养24h后, 依次加入不同浓度本发明化合物,使其终浓度分别为0.01μmol/L,0.05μmol/L,0.1μmol/L, 0.5μmol/L,1μmol/L,对照组加入等量的DMSO,各组设3个副孔。继续培养48h后,加入 预冷的TCA(三氯乙酸,50%,w/V)25μl/孔,轻轻混匀。4℃孵育2h固定细胞,蒸馏水轻 轻冲洗5遍,风干。每孔加入50 l SRB染液(4%,w/V),室温孵育10min染色。将染液 吸出,每孔加入1%醋酸100l冲洗5遍,除去未结合染料。风干后,每孔加入浓度为10mmol/L Tris溶液100μl,震荡溶解结合的SRB染料。将96孔板置于酶标仪(SPECTRA MAX 190) 中,在515nm波长下测定OD值。按照以下公式计算细胞存活率,统计分析化合物对于细胞 增殖的影响。
图3中的A显示本发明化合物在1μmol/L对乳腺癌MDA-MB231细胞增殖的抑制效果。 由图可见绝大多数化合物在1μmol/L浓度下对此株乳腺癌细胞生长的抑制效果非常明显,在 所列举的化合物中,化合物MF001,MF009,MF010,MF012,MF016,MF024,MF025, MF026,MF029,MF031,MF032,MF033,MF034,MF035,MF038,MF040,MF041, MF042,MF044,MF045,MF047,MF49,MF050,MF052,MF053和MF059等在1μmol/L 浓度下对乳腺癌MDA-MB231细胞生长抑制的抑制率都达到50%以上,说明这些化合物对此 肿瘤细胞增殖的半数抑制浓度(IC50)都在1μmol/L以下;部分化合物在此浓度下更达到80% 以上,可见本发明化合物能显著抑制乳腺癌MDA-MB231细胞的增殖:图3中的B显示的是 部分结果,显示本发明化合物MF041能够浓度梯度依赖性地抑制乳腺癌细胞、前列腺癌细胞、 结肠癌细胞、肝癌细胞、非小细胞肺癌细胞和膀胱癌细胞的增殖,在1μmol/L均取得了显著 的抑制效果。同时,如图3中的C所示,本发明化合物MF041在抗癌有效浓度下对低表达 myoferlin的乳腺正常细胞MCF10A没有明显的细胞毒性,表现出良好的myoferlin靶向性和 抗肿瘤选择性。化合物MF001,MF009,MF010,MF012,MF016,MF024,MF025,MF026, MF029,MF031,MF032,MF033,MF034,MF035,MF038,MF040,MF041,MF042, MF044,MF045,MF047,MF49,MF050,MF052,MF053和MF059也表现出类似的抑制效 果。
此外,将本发明化合物对其它肝癌细胞、肺癌细胞、前列腺癌细胞、皮肤癌细胞、结肠 癌细胞、胰腺癌细胞、乳腺癌细胞、白血病细胞、卵巢癌细胞、胃癌细胞、膀胱癌细胞、肾 癌细胞和口腔癌细胞等多种肿瘤细胞进行增殖抑制效果实验,均取得了相似的显著抑制效果。
实施例五:本发明化合物抑制乳腺癌细胞的侵袭和浸润
Transwell浸润实验采用Boyden小室。Transwell小室上室预先铺一层胶原基质Matrigel, 再将细胞重悬于无血清培养基后接种在上室。在下室中加入含有血清的完全培养基,具有侵 袭能力的细胞在血清诱导下开始穿膜运动。上室面的肿瘤细胞若要成功侵袭至下室,必须先 利用自身释放的各种生物因子如基质金属蛋白酶溶解胶原基质,再通过溶解出的空洞迁移至 下室面。这一实验过程可模拟肿瘤细胞在体内的浸润过程,可以用来反映肿瘤细胞的侵袭浸 润能力。
取对数生长期的乳腺癌细胞细胞MDA-MB231和BT549,以5×104个/孔接种于Transwell 小室的上室中,分别加入25nmol/L,50nmol/L,100nmol/L的本发明化合物MF001,MF009, MF010,MF012,MF016,MF024,MF025,MF026,MF029,MF031,MF032,MF033, MF034,MF035,MF038,MF040,MF041,MF042,MF044,MF045,MF047,MF49,MF050, MF052,MF053和MF059等,对照组加入等量的DMSO。下室中加入完全培养基。在培养箱 中培养12h后,取出Transwell小室,用棉签蘸擦拭Transwell小室的上室一面,将未穿膜的 细胞擦掉。用4%多聚甲醛室温固定小室30min后用1%结晶紫染色10min,自来水充分清洗。 显微镜下拍照,对每孔内上下左右中5个视野的细胞数目计数,获得穿膜细胞数/视野。每组 平均设3个重复。统计比较不同剂量药物组穿膜细胞数量,确定药物对细胞浸润能力的影响。
图4中的A是对照组和100nmol/L化合物MF041组的代表图。图4中的B是各组浸润 率的统计。结果表明,在乳腺癌细胞MDA-MB231和BT549的Transwell浸润实验模型中, 本发明化合物MF001,MF009,MF010,MF012,MF016,MF024,MF025,MF026,MF029, MF031,MF032,MF033,MF034,MF035,MF038,MF040,MF041,MF042,MF044, MF045,MF047,MF49,MF050,MF052,MF053和MF059等抑制这两株乳腺癌细胞浸润的 半数有效浓度IC50在50-100nmol/L之间,说明此类化合物在浸润模型中表现出显著的抑制乳 腺癌细胞浸润的能力。
此外,将本发明化合物对肝癌细胞、肺癌细胞、前列腺癌细胞、皮肤癌细胞、结肠癌细 胞、胰腺癌细胞、白血病细胞、卵巢癌细胞、胃癌细胞、膀胱癌细胞、肾癌细胞和口腔癌细 胞等多种肿瘤细胞进行迁移抑制效果实验,均取得了相似的显著抑制效果。
实施例六:本发明化合物抑制小鼠乳腺癌原位生长和自发转移
本实验采用乳腺癌细胞皮下脂肪垫荷瘤模型。将带有荧光素酶报告质粒的乳腺癌细胞 MDA-MB231-luciferase通过原位注射到小鼠乳腺脂肪垫。向小鼠体内腹腔注射荧光素酶底物 后,肿瘤细胞内的荧光素酶能氧化荧光素酶底物,发出生物荧光,这种生物荧光能被小动物 活体成像系统所捕获并量化,从而反映肿瘤的位置和大小。
取4-6周雌性裸鼠,乳腺脂肪垫原位注射1×106个人乳腺癌细胞MDA-MB-231-luciferase。7 天后,小鼠随机分为三组,分别为阴性对照组、5mg/kg/day和10mg/kg/day剂量给药组(MF001, MF009,MF010,MF012,MF016,MF024,MF025,MF026,MF029,MF031,MF032,MF033,MF034,MF035,MF038,MF040,MF041,MF042,MF044,MF045,MF047, MF49,MF050,MF052,MF053和MF059等)。实验进行6周,每周通过IVIS-2000型动物活体荧 光成像系统监测肿瘤大小。化合物MF041实验结果如图5中的A(阴影代表荧光信号强弱,表 明该区域有肿瘤细胞聚集,且由外到内细胞聚集程度加深,颜色越深表明肿瘤细胞聚集越严 重)和5中的B所示,经本发明化合物给药后,治疗组原位肿瘤平均体积显著小于对照组体积, 并且具有药物的浓度依赖性。实验6周后,处死各组实验小鼠,剥离原位肿瘤测量其重量。结 果表明,阴性对照组小鼠的原位肿瘤的重量显著大于各剂量给药组(如图5中的C所示)。此 外,我们也对主要脏器肺、肝、脾、肾以及淋巴结节进行成像检测以统计转移情况,结果显 示本发明化合物有效抑制乳腺癌向各个器官的自发转移(如图5中的D示)。化合物MF001, MF009,MF010,MF012,MF016,MF024,MF025,MF026,MF029,MF031,MF032, MF033,MF034,MF035,MF038,MF040,MF042,MF044,MF045,MF047,MF49,MF050, MF052,MF053和MF059等在本实验中都表现出类似的抑制肿瘤转移的效果。本实验结果说 明,本发明化合物显著抑制乳腺癌细胞的原位肿瘤生长和转移。
此外,将本发明化合物对黑色素瘤、肝癌、肺癌、前列腺癌、皮肤癌、结肠癌、胰腺癌、 白血病、卵巢癌、胃癌、膀胱癌、肾癌和口腔癌等多种肿瘤进行原位生长和自发转移实验, 均取得了相似的显著抑制效果。
实施例七:本发明化合物抑制小鼠乳腺癌肺转移
该实验通过小鼠尾静脉注射乳腺癌细胞,体积较大的乳腺癌细胞会随着血液循环会被 “困”在肺组织中,从而模拟了乳腺癌的肺转移。
取4-6周雌性裸鼠,尾静脉注射1×106个野生型人乳腺癌细胞MDA-MB-231-luciferase。 同时,我们构建了两株myoferlin沉默的MDA-MB-231-luciferase,沉默效率如图6中的A。 由于两组沉默效率类似,后续实验采用沉默组1。每只小鼠通过尾静脉注射1X106myoferlin 沉默的MDA-MB231-luciferase。半小时通过活体成像系统拍照并统计荧光值。注射野生型 MDA-MB-231-luciferase细胞的小鼠进一步分为阴性对照组、1mg/kg/day、5mg/kg/day和10 mg/kg/day剂量给药组。实验共进行4周,每周通过IVIS-2000型动物活体荧光成像系统监 测。
图6中的B为本发明化合物MF041每周用活体成像系统检测的小鼠乳腺癌肺转移情况。 图6中的C是对图6中的B的量化统计结果。结果显示,经本发明化合物给药一段时间后, 治疗组肿瘤肺转移情况明显少于对照组(肺部阴影代表荧光信号强弱,表明该区域有肿瘤细 胞聚集,且由外到内细胞聚集程度加深,颜色越深表明肿瘤细胞聚集越严重),并且具有药物 的浓度依赖性。与此类似,myoferlin沉默能显著抑制小鼠乳腺癌肺转移。实验4周后,处死 实验小鼠,取其肺部进行H&E染色,观测到给药组小鼠和myoferlin沉默组小鼠肺部结节数 明显少于野生型对照组(如图6中的D所示)。化合物MF001,MF009,MF010,MF012, MF016,MF024,MF025,MF026,MF029,MF031,MF032,MF033,MF034,MF035, MF038,MF040,MF042,MF044,MF045,MF047,MF49,MF050,MF052,MF053和MF059 等在本实验中都表现出类似的抑制乳腺癌肺转移的效果。本实验结果说明,本发明化合物能 够显著抑制小鼠乳腺癌肺转移。此外,当myofelin沉默后,肿瘤逐渐减小甚至消失,这从另 外一个方面说明本发明化合物通过抑制myoferlin的活性达到抑制肿瘤转移的目的。
以下实施例1-2到1-61提供了本发明化合物MF002-61的制备方法及产物检测结果。
实施例1-2、3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(2-(吡啶-4-基)乙基)苯 甲酰胺
采用与制备化合物MF001类似的方法,将4-苯基丁胺置换为2-(吡啶-4-基)乙胺,柱层析 纯化后得化合物MF002,产率88%:1HNMR(500MHz,DMSO)δ8.70(t,J=5.5Hz,1H),8.44 (d,J=4.5Hz,2H),7.96–7.84(m,2H),7.56(d,J=7.8Hz,1H),7.46(d,J=7.9Hz,1H),7.40– 7.32(m,2H),7.24(m,2H),7.02–6.90(m,2H),3.76(s,3H),3.52(m,2H),2.86(t,J=7.1Hz,2H), 2.37(s,3H)。
实施例1-3、3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(2-(吡啶-2-基)乙基)苯 甲酰胺(MF003)
采用与制备化合物MF001类似的方法,将4-苯基丁胺置换为2-(吡啶-2-基)乙胺,柱层析 纯化后得化合物MF003,产率89%:1HNMR(500MHz,DMSO)δ8.70(t,J=5.5Hz,1H),8.48 (d,J=4.0Hz,1H),7.90(m,2H),7.68(m,1H),7.55(dd,J=7.9,7.9Hz,1H),7.48–7.43(m,1H), 7.38–7.32(m,2H),7.25(m,1H),7.21(m,1H),6.99–6.92(m,2H),3.76(s,3H),3.60(m,2H), 3.02–2.95(m,2H),2.37(s,3H)。
实施例1-4、3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(2-(噻吩-2-基)乙基)苯 甲酰胺(MF004)
采用与制备化合物MF001类似的方法,将4-苯基丁胺置换为2-(噻吩-2-基)乙胺,柱层析 纯化后得化合物MF004,产率86%:1HNMR(500MHz,DMSO)δ8.75(t,J=5.5Hz,1H),7.97 –7.91(m,1H),7.89(dd,J=1.8Hz,1.7Hz,1H),7.58(m,1H),7.48(m,1H),7.39–7.33(m,2H), 7.31(dd,J=5.1,1.2Hz,1H),6.95(m,3H),6.88(dd,J=3.4,1.0Hz,1H),3.76(s,3H),3.48(m, 2H),3.05(t,J=7.1Hz,2H),2.37(s,3H)。
实施例1-5、3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)-N-(2-(噻吩-3-基)乙基)苯甲酰 胺(MF005)
采用与制备化合物MF001类似的方法,4-苯基丁胺置换为2-(噻吩-3-基)乙胺,柱层析纯 化后得化合物MF005,产率86%:1H NMR(500MHz,DMSO)δ8.69(t,J=5.3Hz,1H),7.92(m, 3H),7.56(m,1H),7.46(d,J=7.1Hz,2H),7.40–7.27(m,2H),6.96(m,3H),3.76(d,J=2.6Hz, 3H),3.48(d,J=6.3Hz,2H),2.85(t,J=6.2Hz,2H),,2.37(s,3H)。
实施例1-6、N-(4-羟基-3-甲氧基苯乙基)-3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯 甲酰胺(MF006)
采用与制备化合物MF001类似的方法,将4-苯基丁胺置换为4-(2-氨基乙基)-2-甲氧基苯 酚,柱层析纯化后得化合物MF006,产率89%:1H NMR(500MHz,DMSO)δ8.69(s,1H),8.65 (t,J=5.5Hz,1H),7.92(m,2H),7.56(m,1H),7.47–7.41(m,1H),7.38–7.30(m,2H),6.98– 6.91(m,2H),6.77(m,1H),6.67(m,1H),6.59(m,1H),3.76(s,3H),3.71(s,3H),3.43(m,2H), 2.72(t,J=7.4Hz,2H),2.37(s,3H)。
实施例1-7、N-(2-(1H-咪唑-1-基)乙基)-3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲 酰胺(MF007)
采用与制备化合物MF001类似的方法,将4-苯基丁胺置换为2-(1H-咪唑-1-基)乙胺,柱 层析纯化后得化合物MF007,产率80%:1H NMR(500MHz,DMSO)δ8.73(d,J=6.0Hz,1H), 7.89(m,2H),7.70–7.52(m,2H),7.47(m,1H),7.35(m,2H),7.19–7.04(m,1H),7.05–6.92(m, 2H),6.90–6.71(m,1H),4.27–4.07(m,2H),3.76(s,3H),3.55(m,2H),2.36(s,3H)。
实施例1-8、N-(2-(1H-咪唑-5-基)乙基)-3-(5-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-1-基)苯甲 酰胺(MF008)
采用与制备化合物MF001类似的方法,将2-(1H-咪唑-1-基)乙胺置换为2-(1H-咪唑-5-基) 乙胺,柱层析纯化后得化合物MF008,产率81%:1H NMR(500MHz,DMSO)δ11.96(s,1H), 8.71(t,J=5.2Hz,1H),7.93(d,J=9.0Hz,2H),7.66–7.51(m,2H),7.44(d,J=7.9Hz,1H),7.35 (d,J=8.3Hz,2H),6.94(d,J=8.3Hz,2H),6.82(s,1H),3.76(s,3H),3.47(m,2H),2.75(t,J= 7.4Hz,2H),2.37(s,3H)。
实施例1-9、3-(1-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)苯甲酰胺(MF009)
采用与制备化合物MF003类似的方法,将4-甲氧基苯甲酸置换为间苯二甲酸单甲酯;将 3-肼基苯甲酸甲酯置换成4-甲氧基苯肼盐酸盐。中间体3-(1-(4-甲氧基苯基)-3-甲基-1H-1,2,4- 三氮唑-5-基)苯甲酸甲酯,产率:75%:1H NMR(500MHz,CDCl3)δ7.97(s,1H),7.89(d,J=7.7 Hz,1H),7.43(d,J=7.8Hz,1H),7.37(dd,J=7.7Hz,7.8Hz,1H),7.23–7.17(m,2H),6.96–6.91 (m,2H),3.85(s,3H),3.77(s,3H),2.52(s,3H)。粗产物3-(1-(4-甲氧基苯基)-3-甲基-1H-1,2,4-三 氮唑-5-基)苯甲酸,产率89%。终产物MF009,产率86%:1H NMR(500MHz,CDCl3)δ7.97 (s,1H),7.89(d,J=7.7Hz,1H),7.43(d,J=7.8Hz,1H),7.37(dd,J=7.7Hz,7.8Hz,1H),7.32–7.24(m,5H),7.23–7.17(m,2H),6.96–6.91(m,2H),3.85(s,3H),3.47(m,2H),2.67(t,J=11.6, 7.4Hz,2H),2.52(s,3H),1.75–1.63(m,4H)。
实施例1-10、3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)苯甲酰胺 (MF010)
采用与制备化合物MF009类似的方法,将乙脒盐酸盐置换为丙脒盐酸盐,柱层析纯化后 得中间体化合物3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)苯甲酸甲酯,产率:78%: 1H NMR(500MHz,DMSO)δ8.06(d,J=1.4Hz,1H),7.90–7.83(m,1H),7.40(m,2H),7.23– 7.12(m,2H),7.04–6.96(m,2H),3.85(s,3H),3.78(s,3H),2.60(q,J=7.5Hz,2H),1.30(t,J= 7.5Hz,3H)。粗产物3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)苯甲酸,产率89%。柱 层析纯化后得终产物MF010,产率85%:1HNMR(500MHz,DMSO)δ8.53(t,J=5.5Hz,1H), 8.06(d,J=1.4Hz,1H),7.90–7.83(m,1H),7.40(m,2H),7.34–7.23(m,4H),7.23–7.12(m, 3H),7.04–6.96(m,2H),3.78(s,3H),3.27(m,2H),2.79–2.71(m,2H),2.60(q,J=7.5Hz,2H), 1.66–1.47(m,4H),1.30(t,J=7.5Hz,3H)。
实施例1-11、3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-苯乙基苯甲酰胺(MF011)
采用与制备化合物MF010类似的方法,将4-苯基丁胺置换为苯乙胺,柱层析纯化后得化 合物MF011,产率:84%:1H NMR(500MHz,DMSO)δ8.67(t,J=5.5Hz,1H),8.07(s,1H),7.85 (d,J=7.6Hz,1H),7.48–7.37(m,2H),7.30(m,4H),7.21(m,3H),7.07–6.97(m,2H),3.79(s, 3H),3.47(m,2H),2.83(t,J=7.4Hz,2H),2.75(q,J=7.6Hz,2H),1.31(t,J=7.6Hz,3H)。
实施例1-12、3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-(4-氟苯基)丁基)苯甲酰 胺(MF012)
采用与制备化合物MF010类似的方法,将4-苯基丁胺置换为4-(4-氟苯基)丁胺,柱层析 纯化后得化合物MF012,产率82%:1H NMR(500MHz,DMSO)δ8.54(t,J=5.1Hz,1H),8.06 (d,J=1.0Hz,1H),7.86(m,1H),7.46–7.38(m,2H),7.33–7.27(m,2H),7.27–7.20(m,2H), 7.09(m,2H),7.03–6.97(m,2H),3.79(s,3H),3.26(m,2H),2.79–2.74(m,2H),2.59(t,J=7.3 Hz,2H),1.62–1.54(m,2H),1.50(m,2H),1.31(t,J=7.5,Hz,3H)。
实施例1-13、3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(2-((呋喃-2-基甲基)硫)乙基) 苯甲酰胺(MF013)
采用与制备化合物MF010类似的方法,将4-苯基丁胺置换为2-氨乙硫代甲基呋喃,柱层 析纯化后得化合物MF013,产率81%:1H NMR(500MHz,DMSO)δ8.53(t,J=5.5Hz,1H), 8.06(d,J=1.4Hz,1H),7.90–7.83(m,1H),7.40(m,2H),7.34–7.23(m,4H),7.23–7.12(m, 3H),7.04–6.96(m,2H),3.78(s,3H),3.27(m,2H),2.79–2.71(m,2H),2.60(q,J=7.5Hz,2H), 1.66–1.47(m,2H),1.30(t,J=7.5Hz,3H)。
实施例1-14、3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-甲基苯乙基)苯甲酰胺 (MF014)
采用与制备化合物MF010类似的方法,将4-苯基丁胺置换为对甲基苯乙胺,柱层析纯化 后得化合物MF014,产率81%:1H NMR(500MHz,DMSO)δ8.62(t,J=5.5Hz,1H),8.06(s, 1H),7.84(m,1H),7.47–7.37(m,2H),7.34–7.28(m,2H),7.18–7.07(m,4H),7.06–6.99(m, 2H),3.79(s,3H),3.43(m,2H),2.76(m,4H),2.26(s,3H),1.31(t,J=7.6Hz,3H)。
实施例1-15、N-(2-(5-溴-1H-吲哚-3-基)乙基)-3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5- 基)苯甲酰胺(MF015)
采用与制备化合物MF010类似的方法,将4-苯基丁胺置换为2-(5-溴-1H-吲哚-3-基)乙胺, 柱层析纯化后得到化合物MF015,产率79%:1HNMR(500MHz,DMSO)δ11.04(s,1H),8.69 (s,1H),8.09(s,1H),7.86(d,J=7.7Hz,1H),7.74(s,1H),7.43(dd,J=7.7,7.7Hz,1H),7.38(d,J =7.7Hz,1H),7.31(dd,J=8.8,2.2Hz,3H),7.24(s,1H),7.16(dd,J=8.6,1.8Hz,1H),7.02(d,J =8.9Hz,2H),3.79(s,3H),3.49(m,2H),2.91(t,J=7.4Hz,2H),2.75(q,J=7.6Hz,2H),1.31(t, J=7.6Hz,3H)。
实施例1-16、N-(2-(苄基氧)乙基)-3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)苯甲酰胺 (MF016)
采用与制备化合物MF010类似的方法,将4-苯基丁胺置换为2-(苄基氧)乙胺,柱层析纯 化后得到化合物MF016,产率80%:1H NMR(500MHz,DMSO)δ8.66(t,J=5.0Hz,1H),8.10 (s,1H),7.87(d,J=7.6Hz,1H),7.43(dd,J=7.77.7Hz,1H),7.39–7.21(m,8H),7.04–6.97(m, 2H),4.50(s,2H),3.78(s,3H),3.55(m,2H),3.49–3.39(m,2H),2.81–2.70(m,2H),1.35–1.27 (m,3H)。
实施例1-17、3-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(3-(吡啶-4-基)丙基)苯甲酰 胺(MF017)
采用与制备化合物MF010类似的方法,将4-苯基丁胺置换为3-(吡啶-4-基)丙胺,柱层析纯化 后得化合物MF017,产率70%:1HNMR(500MHz,DMSO)δ8.57(t,J=5.5Hz,1H),8.45(dd, J=4.4,1.6Hz,2H),8.05(m,1H),7.86(dt,J=7.5,1.6Hz,1H),7.42(m,2H),7.34–7.28(m,2H), 7.25(dd,J=4.4,1.5Hz,2H),7.05–6.97(m,2H),3.77(s,3H),3.26(m,2H),2.81–2.71(m,2H), 2.67–2.59(m,2H),1.83(m,2H),1.31(t,J=7.6Hz,3H)。
实施例1-18、3-(5-(4-甲氧基苯基)-3-丙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF018)
采用与制备化合物MF001类似的方法,将乙脒盐酸盐置换为丁脒盐酸盐,柱层析纯化后 得中间体化合物3-(5-(4-甲氧基苯基)-3-丙基-1H-1,2,4-三氮唑-1-基)苯甲酸酯,产率68%。粗 产物3-(5-(4-甲氧基苯基)-3-丙基-1H-1,2,4-三氮唑-1-基)苯甲酸,产率86%。柱层析纯化后得 终产物MF018,产率81%:1H NMR(500MHz,DMSO)δ8.51(t,J=5.1,1H),8.01(s,1H),7.83 (d,J=7.6Hz,1H),7.52(d,J=7.7Hz,1H),7.46(dd,J=7.7,7.7Hz,1H),7.38(d,J=8.7Hz,2H), 7.26(m,2H),7.23–7.13(m,3H),6.96(d,J=8.7Hz,2H),4.44(t,J=6.9Hz,2H),3.77(s,3H), 3.30–3.20(m,2H),2.69–2.57(m,2H),1.97(dd,J=14.3,7.1Hz,2H),1.68–1.45(m,4H),0.94 (t,J=7.4Hz,3H)。
实施例1-19、N-(4-氟苯乙基)-3-(5-(4-甲氧基苯基)-3-丙基-1H-1,2,4-三氮唑-1-基)苯甲酰胺 (MF019)
采用与制备化合物MF018类似的方法,将4-苯基丁胺置换为4-氟苯乙胺,柱层析纯化后 得化合物MF019,产率84%:1HNMR(500MHz,DMSO)δ8.67(t,J=5.5Hz,1H),7.94–7.89 (m,1H),7.87(m,1H),7.56(m,1H),7.49–7.44(m,1H),7.38–7.33(m,2H),7.29–7.20(m,2H), 7.08(m,2H),6.99–6.92(m,2H),3.76(s,3H),3.46(m,2H),2.82(t,J=7.3Hz,2H),2.69(t,J= 7.5Hz,2H),1.84–1.71(m,2H),1.00(t,J=7.4Hz,3H)。
实施例1-20、3-(3-(甲氧基甲基)-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰 胺(MF020)
采用与制备化合物MF001类似的方法,将乙脒盐酸盐置换为2-甲氧基乙脒盐酸盐,柱层 析纯化后得中间体化合物3-(3-(甲氧基甲基)-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酸 酯,产率69%。中间体化合物3-(3-(甲氧基甲基)-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲 酸,产率84%。柱层析纯化后得化合物MF020,产率84%:1H NMR(500MHz,DMSO)δ8.60 (t,J=5.6Hz,1H),7.99–7.92(m,2H),7.57(dd,J=7.8,7.8Hz,1H),7.48(m,1H),7.42–7.33(m, 2H),7.26(m,2H),7.21–7.12(m,3H),6.99–6.91(m,2H),4.50(s,2H),3.76(s,3H),3.38(s,3H), 3.30–3.24(m,2H),2.59(t,J=7.4Hz,2H),1.64–1.47(m,4H)。
实施例1-21、N-(4-氟苯乙胺)-3-(3-(甲氧基甲基)-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲 酰胺(MF021)
采用与制备化合物MF020类似的方法,将4-苯基丁胺置换为4-氟苯乙胺,柱层析纯化后 得化合物MF021,产率83%:1HNMR(500MHz,DMSO)δ8.69(t,J=5.4Hz,1H),7.98–7.86 (m,2H),7.58(m,1H),7.51(s,1H),7.38(d,J=8.9Hz,2H),7.24(m,2H),7.08(d,J=8.9Hz,2H), 6.96(d,J=8.9Hz,2H),4.50(s,2H),3.77(s,3H),3.46(m,2H),3.39(s,3H),2.82(t,J=7.2Hz, 2H)。
实施例1-22、3-(3-异丙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF022)
采用与制备化合物MF001类似的方法,将乙脒盐酸盐置换为2-甲基丙脒盐酸盐,柱层析 纯化后得化合物3-(3-异丙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酸酯,产率76%。 粗产物3-(3-异丙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酸,产率89%。柱层析纯化 后得化合物MF022,产率72%:1HNMR(500MHz,DMSO)δ8.58(t,J=5.2Hz,1H),8.01–7.85 (m,2H),7.54(m,1H),7.45(d,J=7.6Hz,1H),7.35(d,J=8.7Hz,2H),7.26(m,2H),7.17(m, 3H),6.93(d,J=8.7Hz,2H),3.75(s,3H),3.27(m,2H),3.06(m,1H),2.59(t,J=7.4Hz,2H), 1.68–1.46(m,4H),1.33(d,J=6.9Hz,6H)。
实施例1-23、3-(3-环丙烷基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)苯甲酰胺 (MF023)
采用与制备化合物MF010类似的方法,丙脒盐酸盐置换为环丙基甲脒盐酸盐,柱层析纯 化后得化合物3-(3-环丙烷基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)苯甲酸酯,产率80%:1H NMR(500MHz,DMSO)δ8.06(q,J=1.4Hz,1H),8.00–7.95(m,1H),7.59–7.54(m,1H),7.50 (m,1H),7.36–7.30(m,2H),7.07–7.00(m,2H),3.83(s,3H),3.80(s,3H),2.07(m,1H),1.03– 0.95(m,2H),0.95–0.90(m,2H)。粗产物3-(3-环丙烷基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5- 基)苯甲酸,产率82%。柱层析纯化后得化合物MF023,产率82%:1HNMR(500MHz,DMSO) δ8.51(t,J=5.3Hz,1H),8.00(s,1H),7.84(d,J=7.6Hz,1H),7.41(m,1H),7.36(d,J=7.8Hz, 1H),7.27(m,4H),7.22–7.12(m,3H),6.99(d,J=8.9Hz,2H),3.78(s,3H),3.26(m,2H),2.60(t, J=7.4Hz,2H),2.07(m,1H),1.65–1.55(m,2H),1.54–1.45(m,2H),1.05–0.95(m,2H),0.95– 0.87(m,2H)。
实施例1-24、3-(3-乙基-5-(6-甲氧基吡啶-3-基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF024)
采用与制备化合物MF001类似的方法,将4-甲氧基苯甲酸置换为6-甲氧基烟酸,将乙脒盐酸 盐置换为丙脒盐酸盐,柱层析纯化后得化合物3-(3-乙基-5-(6-甲氧基吡啶-3-基)-1H-1,2,4-三氮 唑-1-基)苯甲酸酯,产率74%:1H NMR(500MHz,DMSO)δ10.96(s,1H),8.73(d,J=2.1Hz, 1H),8.24(d,J=1.9Hz,1H),8.16(dd,J=8.7,2.5Hz,1H),7.71(dd,J=8.7,2.4Hz,1H),7.63(d, J=4.5Hz,1H),6.92(d,J=8.7Hz,1H),3.93(s,3H),3.86(s,3H),2.80–2.73(m,2H),1.05(t,J =7.3Hz,3H)。粗产物3-(3-乙基-5-(6-甲氧基吡啶-3-基)-1H-1,2,4-三氮唑-1-基)苯甲酸,产率 91%。柱层析纯化后得化合物MF024,产率75%:1H NMR(500MHz,DMSO)δ8.59(t,J=5.5 Hz,1H),8.26–8.18(m,1H),8.01–7.89(m,2H),7.70(dd,J=8.7,2.5Hz,1H),7.57(m,1H), 7.53–7.46(m,1H),7.26(m,2H),7.21–7.10(m,3H),6.84(dd,J=8.7,0.5Hz,1H),3.85(s,3H), 3.27(m,2H),2.76(q,J=7.6Hz,2H),2.59(t,J=7.4Hz,2H),1.75–1.45(m,4H),1.31(t,J=7.6 Hz,3H)。
实施例1-25、3-(3-乙基-5-(5-氟吡啶-3-基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF025)
采用与制备化合物MF001类似的方法,将4-甲氧基苯甲酸置换为5-氟烟酸,将乙脒盐酸盐置 换为丙脒盐酸盐,柱层析纯化后得化合物3-(3-乙基-5-(5-氟吡啶-3-基)-1H-1,2,4-三氮唑-1-基) 苯甲酸酯,产率79%:1H NMR(500MHz,DMSO)δ8.69(d,J=2.5Hz,1H),8.46(s,1H),8.08– 8.00(m,2H),7.80(dd,J=9.5,1.2Hz,1H),7.64(m,2H),3.86(s,3H),2.79(q,J=7.6Hz,2H), 1.33(t,J=7.6Hz,3H)。粗3-(3-乙基-5-(5-氟吡啶-3-基)-1H-1,2,4-三氮唑-1-基)苯甲酸,产率 90%。柱层析纯化后得化合物MF025,产率72%:1HNMR(500MHz,DMSO)δ8.66(d,J=2.8 Hz,1H),8.60(m,1H),8.44(t,J=1.4Hz,1H),7.98–7.91(m,2H),7.77(m,1H),7.61–7.50(m, 2H),7.26(m,2H),7.22–7.11(m,3H),3.27(m,2H),2.80(q,J=7.6Hz,2H),2.59(t,J=7.4Hz, 2H),1.65–1.47(m,4H),1.35–1.30(m,3H)。
实施例1-26、3-(1-(2,4-二甲氧基苯基)-3-乙基-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)苯甲酰胺 (MF026)
采用与制备化合物MF010类似的方法,将4-甲氧基苯肼盐酸盐置换为2,4-二甲氧基苯肼 盐酸盐,柱层析纯化后得化合物3-(1-(2,4-二甲氧基苯基)-3-乙基-1H-1,2,4-三氮唑-5-基)苯甲酸 酯,产率72%。粗产物3-(1-(2,4-二甲氧基苯基)-3-乙基-1H-1,2,4-三氮唑-5-基)苯甲酸,产率 85%。柱层析纯化后得化合物MF026,产率80%:1HNMR(500MHz,DMSO)δ8.55(m,1H), 7.83(t,J=1.7Hz,1H),7.79(d,J=7.9Hz,1H),7.47–7.39(m,2H),7.30–7.22(m,3H),7.21– 7.12(m,3H),6.64(dd,J=8.5,2.3Hz,1H),6.49(d,J=2.3Hz,1H),3.78(s,3H),3.28–3.25(m, 2H),3.24(s,3H),2.74(q,J=7.6Hz,2H),2.64–2.57(m,2H),1.64–1.47(m,4H),1.30(t,J=7.6 Hz,3H)。
实施例1-27、3-(5-(5-氯-2-甲基苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF027)
采用与制备化合物MF001类似的方法,将4-甲氧基苯甲酸置换为5-氯-2-甲基苯甲酸,将乙 脒盐酸盐置换为丙脒盐酸盐,柱层析纯化后得化合物MF027,产率84%:1H NMR(500MHz, DMSO)δ8.56(t,J=5.5Hz,1H),7.85(d,J=1.7Hz,1H),7.82(d,J=7.9Hz,1H),7.43(m,3H), 7.37–7.24(m,4H),7.22–7.13(m,3H),3.30–3.21(m,2H),2.78(m,2H),2.60(t,J=7.4Hz, 2H),1.98(s,3H),1.65–1.46(m,4H),1.32(m,3H)。
实施例1-28、3-(5-(5-氯-2-甲基苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(3-苯氧丙基)苯 甲酰胺(MF028)
采用与制备化合物MF027类似的方法,将4-苯基丁胺置换为3-苯氧基丙胺,柱层析纯化 后得化合物MF028,产率79%:1H NMR(500MHz,DMSO)δ8.67(t,J=5.5Hz,1H),7.88(d, J=1.7Hz,1H),7.84(d,J=7.8Hz,1H),7.50–7.42(m,2H),7.41(d,J=2.2Hz,1H),7.34– 7.24(m,4H),6.92(m,3H),4.02(q,J=6.4Hz,2H),3.41(m,2H),2.79(q,J=7.6Hz,2H),1.99(s, 3H),1.95(m,2H),1.32(t,J=7.6Hz,3H)。
实施例1-29、3-(3-乙基-5-(2-氟吡啶-3-基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF029)
采用与制备化合物MF001类似的方法,对甲氧基苯甲酸置换为2-氟烟酸,乙脒盐酸盐置 换为丙脒盐酸盐,柱层析纯化后得化合物MF029,产率75%:1HNMR(500MHz,DMSO)δ8.57 (m,1H),8.00(m,1H),7.92–7.78(m,2H),7.56–7.39(m,2H),7.36–7.24(m,3H),7.23–7.10 (m,4H),3.26(m,2H),2.85–2.74(m,2H),2.59(t,J=7.4Hz,2H),1.63–1.47(m,4H),1.32(t,J =7.6Hz,3H)。
实施例1-30、3-(5-(5-氯吡啶-3-基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF030)
采用与制备化合物MF001类似的方法,对甲氧基苯甲酸置换为5-氯吡啶-3-羧酸,乙脒 盐酸盐置换为丙脒盐酸盐,柱层析纯化后得化合物MF030,最后一步反应产率65%:1HNMR (500MHz,DMSO)δ8.69(d,J=2.4Hz,1H),8.60(t,J=5.6Hz,1H),8.50(d,J=1.8Hz,1H), 7.99–7.92(m,3H),7.62–7.50(m,2H),7.31–7.23(m,2H),7.22–7.11(m,3H),3.27(m,2H), 2.79(q,J=7.6Hz,2H),2.59(t,J=7.4Hz,2H),1.65–1.46(m,4H),1.33(t,J=7.6Hz,3H)。
实施例1-31、3-(3-乙基-5-(4-三氟甲氧基)苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF031)
采用与制备化合物MF001类似的方法,4-甲氧基苯甲酸置换为4-三氟甲氧基苯甲酸,乙 脒盐酸盐置换为丙脒盐酸盐,柱层析纯化后得化合物MF031,最后一步反应产率82%:1H NMR(400MHz,DMSO)δ8.58(t,J=5.5Hz,1H),7.99–7.89(m,2H),7.62–7.51(m,3H),7.47 (d,J=8.5Hz,1H),7.40(d,J=8.3Hz,2H),7.26(m,2H),7.17(m,3H),3.27(m,2H),2.77(q,J= 7.6Hz,2H),2.59(t,J=7.3Hz,2H),1.68–1.45(m,4H),1.32(t,J=7.6Hz,3H)。
实施例1-32、3-(5-(4-二氟甲氧基)苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF032)
采用与制备化合物MF001类似的方法,4-甲氧基苯甲酸置换为4-二氟甲氧基苯甲酸,乙 脒盐酸盐置换为丙脒盐酸盐,柱层析纯化后得化合物MF032,产率84%:1H NMR(400MHz, DMSO)δ8.59(t,J=5.5Hz,1H),7.94(d,J=8.1Hz,2H),7.55(m,1H),7.47(m,3H),7.26(m, 2H),7.17(m,5H),3.27(m,2H),2.76(q,J=7.6Hz,2H),2.59(t,J=7.3Hz,2H),1.57(m,4H), 1.31(t,J=7.6Hz,3H)。
实施例1-33、6-(3-乙基-1-(4-甲氧基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)吡啶甲酰 胺(MF033)
采用与制备化合物MF014类似的方法,将间苯二甲酸单甲酯置换为2,6-吡啶二羧酸单甲 酯,柱层析纯化后得化合物MF033,最后一步反应产率78%:1HNMR(400MHz,DMSO)δ8.25 (d,J=7.9Hz,1H),8.11(m,1H),7.97(d,J=7.8Hz,1H),7.38(d,J=8.8Hz,2H),7.24(d,J=7.3 Hz,2H),7.16(d,J=7.7Hz,3H),7.00(d,J=8.8Hz,2H),6.73(m,1H),3.76(s,3H),3.06(m,2H), 2.74(q,J=7.6Hz,2H),2.55(t,J=7.6Hz,2H),1.45(m,2H),1.38–1.24(m,5H)。
实施例1-34、6-(3-乙基-1-(4-羟基苯基)-1H-1,2,4-三氮唑-5-基)-N-(4-苯丁基)吡啶甲酰胺 (MF034)
取化合物MF033(912mg,2mmol),溶于4ml无水二氯甲烷中,在冰水浴下滴入1M三 溴化硼的二氯甲烷溶液(8ml),在冰水浴中反应四小时,然后加入甲醇8ml淬灭反应,再减压 蒸干溶剂,再用水和乙酸乙酯萃取,有机相合并,用无水硫酸钠干燥后蒸干,柱层析纯化得 MF034(574mg),产率65%:1H NMR(500MHz,DMSO)δ8.27(m,1H),8.12(t,J=7.8Hz,1H), 7.99(m,1H),7.30–7.25(m,4H),7.19(d,J=6.9Hz,2H),7.18–7.13(m,1H),6.91–6.85(m, 2H),6.81(m,1H),3.13(m,2H),2.77(q,J=7.6Hz,2H),2.63–2.57(m,2H),1.50(m,2H),1.41 (m,2H),1.31(t,J=7.6Hz,3H)。
实施例1-35、3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF035)
采用与制备化合物MF001类似的方法,4-甲氧基苯甲酸置换为5-甲氧基吡啶-2-羧酸,乙 脒盐酸盐置换为丙脒盐酸盐,柱层析纯化后得化合物MF035,最后一步反应产率52%:1HNMR (500MHz,DMSO)δ8.55(t,J=5.6Hz,1H),8.07(d,J=2.6Hz,1H),7.97(d,J=8.7Hz,1H), 7.93–7.82(m,2H),7.57–7.47(m,2H),7.42(m,1H),7.26(m,2H),7.22–7.13(m,3H),3.83(s, 3H),3.27(m,2H),2.75(m,2H),2.58(m,2H),1.63–1.48(m,4H),1.31(t,J=7.6Hz,3H)。
实施例1-36、3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-N-(3-苯氧丙基)苯甲酰胺 (MF036)
采用与制备化合物MF035类似的方法,4-苯基丁胺置换为3-苯氧基丙胺,柱层析纯化后 得化合物MF036,产率49%:1H NMR(500MHz,DMSO)δ8.65(t,J=5.5Hz,1H),8.08(d,J= 2.6Hz,1H),7.97(d,J=8.7Hz,1H),7.90(m,2H),7.57–7.46(m,2H),7.47–7.38(m,1H),7.32 –7.23(m,2H),6.99–6.87(m,3H),4.01(m,2H),3.84(s,2H),3.42(m,2H),2.81–2.72(m,2H), 1.99–1.94(m,2H),1.31(t,J=7.5Hz,3H)。
实施例1-37、3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-N-(4-硝基苯乙基) 苯甲酰胺(MF037)
采用与制备化合物MF035类似的方法,4-苯基丁胺置换为4-硝基苯乙胺,柱层析纯化后 得化合物MF037,产率82%:1H NMR(500MHz,DMSO)δ8.67(t,J=5.5Hz,1H),8.14(d,J= 8.7Hz,2H),8.07(d,J=2.9Hz,1H),7.98(d,J=8.7Hz,1H),7.86–7.82(m,2H),7.52(m,4H), 7.43(m,1H),3.84(s,3H),3.55(m,2H),2.99(t,J=7.0Hz,2H),2.83–2.71(m,2H),1.31(t,J= 7.6Hz,3H)。
实施例1-38、3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑-1-基)-N-(4-氟苯基)丁基)苯甲 酰胺(MF038)
采用与制备化合物MF035类似的方法,将4-苯基丁胺置换为4-对氟苯基丁胺,柱层析纯 化后得化合物MF038,产率74%:1HNMR(500MHz,DMSO)δ8.55(t,J=5.5Hz,1H),8.07 (d,J=2.9Hz,1H),7.97(d,J=8.7Hz,1H),7.87(m,2H),7.57–7.47(m,2H),7.45–7.40(m, 1H),7.22(m,2H),7.07(m,2H),3.84(s,3H),3.26(m,2H),2.75(m,2H),2.62–2.56(m,2H), 1.60–1.47(m,4H),1.35–1.31(m,3H)。
实施例1-39、N-(2-(1H-苯并咪唑-2-基)乙基)-3-(3-乙基-5-(5-甲氧基吡啶-2-基)-1H-1,2,4-三氮唑 -1-基)-苯甲酰胺(MF039)
采用与制备化合物MF035类似的方法,将4-苯基丁胺置换为2-(1H-苯并咪唑-2-基)乙胺, 柱层析纯化后得化合物MF039,产率72%:1H NMR(500MHz,DMSO)δ12.27(s,1H),8.80 (t,J=5.6Hz,2H),8.08(d,J=2.6Hz,1H),7.97(d,J=8.7Hz,1H),7.89(m,1H),7.57–7.47(m, 3H),7.45–7.38(m,2H),7.11(m,2H),3.84(s,3H),3.71(m,2H),3.08(t,J=7.3Hz,2H),2.76 (m,2H),1.31(t,J=7.6Hz,3H)。
实施例1-40、3-(3-乙基-5-(4-乙氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF040)
采用与制备化合物MF001类似的方法,将对甲氧基苯甲酸置换为对乙氧基苯甲酸,乙脒 盐酸盐置换为丙脒盐酸盐,柱层析纯化后得化合物MF040,最后一步反应产率84%:1HNMR (400MHz,DMSO)δ8.58(t,J=5.5Hz,1H),7.97–7.88(m,2H),7.55(m,1H),7.44(d,J=8.0 Hz,1H),7.34(d,J=8.8Hz,2H),7.26(m,2H),7.17(m,3H),6.91(d,J=8.8Hz,2H),4.01(q,J= 6.9Hz,2H),3.27(m,2H),2.73(q,J=7.6Hz,2H),2.59(t,J=7.3Hz,2H),1.70–1.44(m,4H), 1.30(t,J=7.2Hz,6H)。
实施例1-41、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺 (MF041)
采用与制备化合物MF001类似的方法,将乙脒盐酸盐置换为丙脒盐酸盐,柱层析纯化后 得化合物3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酸甲酯,产率80%:1H NMR (500MHz,DMSO)δ8.05(dd,J=4.9,1.6Hz,1H),7.98(s,1H),7.64(d,J=6.4Hz,2H),7.39(d, J=8.6Hz,2H),6.96(d,J=8.7Hz,2H),3.86(s,3H),3.77(s,3H),2.74(q,J=7.6Hz,2H),1.30(t, J=7.6Hz,3H)。柱层析纯化后得化合物MF041,产率86%:1H NMR(500MHz,DMSO)δ8.58 (t,J=5.6Hz,1H),7.97–7.89(m,2H),7.55(dd,J=7.8Hz,1H),7.44(d,J=7.9,Hz,1H),7.38–7.33(m,2H),7.30–7.23(m,2H),7.17(m,3H),6.97–6.90(m,2H),3.75(s,3H),3.27(m,2H), 2.74(q,J=7.6Hz,2H),2.59(t,J=7.5Hz,2H),1.59(m,2H),1.55–1.48(m,2H),1.30(t,J=7.6 Hz,3H)。
实施例1-42、3-(3-乙基-5-(4-羟基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺(MF042)
采用与制备化合物MF034类似的方法,MF033置换为MF041,用柱层析纯化,得 MF042(663mg)产率75%:1H NMR(400MHz,DMSO)δ9.95(s,1H),8.58(t,J=5.6Hz,1H), 7.91(dd,J=7.3,5.2Hz,2H),7.54(m,1H),7.42(d,J=7.9Hz,1H),7.31–7.11(m,7H),6.74(d, J=8.7Hz,2H),3.27(m,2H),2.72(q,J=7.6Hz,2H),2.59(t,J=7.4Hz,2H),1.67–1.46(m,4H), 1.29(t,J=7.6Hz,3H)。
实施例1-43、N-(2,4-二氯苯乙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺 (MF043)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(2,4-二氯苯基)乙胺,柱 层析纯化后得化合物MF043,产率75%:1HNMR(500MHz,DMSO)δ8.69(t,J=5.6Hz,1H), 7.90(d,J=7.9Hz,1H),7.86(s,1H),7.56(m,2H),7.47(d,J=8.0Hz,1H),7.35(m,2H),7.31(m, 2H),6.95(d,J=8.8Hz,2H),3.77(s,3H),3.53–3.45(m,2H),2.94(t,J=6.9Hz,2H),2.74(q,J =7.6Hz,2H),1.30(t,J=7.6Hz,3H)。
实施例1-44、N-(4-溴苯乙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺 (MF044)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(4-溴苯基)乙胺,柱层析 纯化后得化合物MF044,产率76%:1HNMR(500MHz,DMSO)δ8.69(t,J=5.6Hz,1H),7.90 (d,J=7.9Hz,1H),7.86(s,1H),7.56(m,2H),7.47(d,J=8.0Hz,1H),7.35(m,2H),7.31(m,2H), 6.95(m,2H),3.77(s,3H),3.53–3.45(m,2H),2.94(t,J=6.9Hz,2H),2.74(q,J=7.6Hz,2H), 1.30(t,J=7.6Hz,3H)。
实施例1-45、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-(4-氟苯基)丁基)苯甲酰 胺(MF045)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为4-(4-氟苯基)丁胺,柱层析 纯化后得化合物MF045,产率80%:1HNMR(500MHz,DMSO)δ8.58(t,J=5.5Hz,1H),7.92 (m,2H),7.55(d,J=7.8Hz,1H),7.44(m,1H),7.39–7.33(m,2H),7.22(d,J=8.6Hz,2H),7.08 (m,2H),6.98–6.89(m,2H),3.75(s,3H),3.26(m,2H),2.74(q,J=7.6Hz,2H),2.63–2.55(m, 2H),1.64–1.45(m,4H),1.30(t,J=7.6Hz,3H)。
实施例1-46、N-(2-溴苯乙胺)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺 (MF046)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(2-溴苯基)乙胺,柱层析 纯化后得化合物MF046,产率78%:1HNMR(500MHz,DMSO)δ8.73(t,J=5.4Hz,1H),7.92 (d,J=7.8Hz,1H),7.89(s,1H),7.57(m,2H),7.49–7.43(m,1H),7.36(d,J=8.8Hz,2H),7.33– 7.24(m,2H),7.19–7.12(m,1H),6.95(d,J=8.9Hz,2H),3.76(s,3H),3.50(m,2H),2.96(t,J= 7.2Hz,2H),2.74(q,J=7.6Hz,2H),1.30(t,J=7.6Hz,3H)。
实施例1-47、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-碘苯乙胺)苯甲酰胺 (MF047)
采用与制备化合物MF041类似的方法,4-苯基丁胺置换为4-碘苯乙胺,柱层析纯化后得 化合物MF047,产率83%:1H NMR(500MHz,DMSO)δ8.66(t,J=5.5Hz,1H),7.94–7.85(m, 2H),7.67–7.59(m,2H),7.56(m,1H),7.46(m,1H),7.41–7.32(m,2H),7.03(d,J=8.3Hz,2H), 6.99–6.90(m,2H),3.77(s,3H),3.45(m,2H),2.79(d,J=7.2Hz,2H),2.74(q,J=7.6Hz,2H), 1.31(t,J=7.6Hz,3H)。
实施例1-48、N-(3-(4-氯苯基)丙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰 胺(MF048)
采用与制备化合物MF041类似的方法,4-苯基丁胺置换为4-氯苯丙胺,柱层析纯化后得 化合物MF048,产率84%:1H NMR(500MHz,DMSO)δ8.60(t,J=5.3Hz,1H),8.02–7.86(m, 2H),7.56(m,1H),7.46(d,J=7.9Hz,1H),7.34(m,4H),7.24(d,J=8.3Hz,2H),6.94(d,J=8.8 Hz,2H),3.74(s,3H),3.25(m,2H),2.74(q,J=7.6Hz,2H),2.65–2.57(m,2H),1.80(m,2H), 1.30(t,J=7.6Hz,3H)。
实施例1-49、N-(4-(4-溴苯基)丁基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰 胺(MF049)
采用与制备化合物MF041类似的方法,4-苯基丁胺置换为4-溴4-苯基丁胺,柱层析纯化 后得化合物MF049,产率79%:1H NMR(500MHz,DMSO)δ8.57(t,J=5.6Hz,1H),7.95– 7.88(m,2H),7.58–7.52(m,1H),7.47–7.41(m,3H),7.38–7.31(m,2H),7.16(d,J=8.3Hz, 2H),6.96–6.89(m,2H),3.75(s,3H),3.26(m,2H),2.74(q,J=7.6Hz,2H),2.57(t,J=7.4Hz, 2H),1.65–1.44(m,4H),1.30(t,J=7.6Hz,3H)。
实施例1-50、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-羟基苯乙基)苯甲酰胺 (MF050)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为4-(2-氨基乙基)苯酚,柱层 析纯化后得化合物MF050,产率78%:1HNMR(500MHz,DMSO)δ9.16(s,1H),8.66(t,J=5.5 Hz,1H),7.94–7.87(m,2H),7.55(m,1H),7.47–7.43(m,1H),7.39–7.33(m,2H),7.00(d,J= 8.4Hz,2H),6.97–6.91(m,2H),6.67(d,J=8.4Hz,2H),3.76(s,3H),3.40(m,2H),2.77–2.67 (m,4H),1.30(t,J=7.6Hz,3H)。
实施例1-51、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(2-(4-甲基噻唑-5-基)乙基) 苯甲酰胺(MF051)
采用与制备化合物MF041类似的方法,将苯丁基置换为2-(4-甲基噻唑-5-基)乙胺,柱层 析纯化后得化合物MF051,产率79%:1HNMR(500MHz,DMSO)δ8.77(s,1H),8.74(t,J=5.6 Hz,1H),7.92(d,J=7.9Hz,1H),7.87(m,1H),7.58(dd,J=7.8,7.8Hz,1H),7.52–7.44(m,1H), 7.38–7.32(m,2H),7.00–6.91(m,2H),3.76(s,3H),3.42(m,2H),3.00(m,2H),2.74(q,J=7.6 Hz,2H),2.28(s,3H),1.30(t,J=7.6Hz,3H)。
实施例1-52、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-甲氧基苯乙基)苯甲酰胺 (MF052)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(4-甲氧基苯基)乙胺,柱 层析纯化后得化合物MF052,产率76%:1HNMR(500MHz,DMSO)δ8.66(t,J=5.5Hz,1H), 7.91(m,2H),7.56(dd,J=7.97.8Hz,1H),7.46(d,J=8.0Hz,1H),7.36(m,2H),7.13(m,2H), 6.95(m,2H),6.83(m,2H),3.76(s,3H),3.71(s,3H),3.43(m,2H),2.75(m,4H),1.30(t,J=7.6 Hz,3H)。
实施例1-53、N-(4-氯苯乙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)苯甲酰胺 (MF053)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(4-氯苯基)乙胺,柱层析 纯化后得化合物MF053,产率78%:1HNMR(500MHz,DMSO)δ8.66(t,J=5.5Hz,1H),7.89 (m,2H),7.56(dd,J=7.8,7.8Hz,1H),7.46(m,1H),7.38–7.34(m,2H),7.31(m,2H),7.23(m, 2H),6.95(m,2H),3.76(s,3H),3.46(m,2H),2.82(t,J=7.2Hz,2H),2.77–2.68(m,2H),1.30(t, J=,7.6Hz,3H)。
实施例1-54、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-(三氟甲基)苯乙 基)-苯甲酰胺(MF054)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(4-(三氟甲基)苯基)乙胺, 柱层析纯化后得化合物MF054,产率75%:1H NMR(500MHz,DMSO)δ8.70(t,J=5.5Hz, 1H),8.02–7.94(m,1H),7.92–7.84(m,2H),7.63(d,J=8.0Hz,2H),7.59–7.51(m,1H), 7.50–7.42(m,2H),7.38–7.32(m,2H),6.99–6.92(m,2H),3.76(s,3H),3.51(m,2H),2.93 (t,J=7.1Hz,2H),2.78–2.70(m,2H),1.30(t,J=7.6Hz,3H)。
实施例1-55、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(3-(4-甲氧基苯基) 丙基)-苯甲酰胺(MF055)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为3-(4-甲氧基苯基)丙胺,柱 层析纯化后得化合物MF055,产率72%:1H NMR(500MHz,DMSO)δ8.59(t,J=5.4Hz,1H), 7.97–7.89(m,2H),7.56(m,1H),7.49–7.43(m,1H),7.39–7.31(m,2H),7.12(m,2H),6.98 –6.89(m,2H),6.86–6.81(m,2H),3.74(s,3H),3.71(s,3H),3.24(m,2H),2.74(q,J=7.6Hz, 2H),2.57–2.52(m,2H),1.84–1.70(m,2H),1.30(t,J=7.6Hz,3H)。
实施例1-56、N-(2-(苯并呋喃-2-基)乙基)-3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑 -1-基)苯甲酰胺(MF056)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(苯并呋喃-2-基)乙胺,柱 层析纯化后得化合物MF056,产率77%:1H NMR(500MHz,DMSO)δ8.79(t,J=5.6Hz,1H), 7.98–7.89(m,2H),7.80(s,1H),7.67(d,J=7.6Hz,1H),7.55(m,2H),7.47(s,1H),7.36(d,J= 8.9Hz,2H),7.32–7.27(m,1H),7.24(m,1H),7.02–6.92(m,2H),3.76(s,3H),3.57(m,2H), 2.92(t,J=7.1Hz,2H),2.74(q,J=7.6Hz,2H),1.31(t,J=7.6Hz,3H)。
实施例1-57、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(4-(甲磺酰基)苯基) 苯甲酰胺(MF057)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(4-甲磺酰基苯基)乙胺,柱层 析纯化后得化合物MF057,产率67%:1H NMR(500MHz,DMSO)δ8.73(t,J=5.5Hz,1H), 7.93–7.88(m,2H),7.86–7.80(m,2H),7.56(m,1H),7.50(d,J=8.3Hz,2H),7.46(m,1H), 7.37–7.32(m,2H),6.98–6.92(m,2H),3.76(s,3H),3.52(m,2H),3.18(s,3H),2.95(t,J=7.2 Hz,2H),2.74(q,J=7.6Hz,3H),1.30(t,J=7.6Hz,3H)。实施例1-58、3-(3-乙基-5-(4-甲氧基 苯基)-1H-1,2,4-三氮唑-1-基)-N-(3-(三氟甲基)苯基)苯甲酰胺(MF058)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(3-(三氟甲基)苯基)乙胺, 柱层析纯化后得化合物MF058,产率67%:1H NMR(500MHz,DMSO)δ8.69(t,J=5.4Hz, 1H),7.92–7.83(m,2H),7.62–7.48(m,5H),7.45(d,J=8.0Hz,1H),7.35(d,J=8.8Hz,2H), 6.94(d,J=8.8Hz,2H),3.76(s,3H),3.52(m,2H),2.94(t,J=7.0Hz,2H),2.74(q,J=7.7Hz, 3H),1.30(m,3H).
实施例1-59、3-(3-乙基-5-(4-甲氧基苯基)-1H-1,2,4-三氮唑-1-基)-N-(3-碘苯乙基)苯甲酰 胺(MF059)
采用与制备化合物MF041类似的方法,将4-苯基丁胺置换为2-(3-碘苯基)乙胺,柱层析 纯化后得化合物MF058,产率67%:1H NMR(500MHz,DMSO)δ8.68(t,J=5.5Hz,1H),7.93 –7.85(m,2H),7.62(s,1H),7.59–7.53(m,2H),7.45(m,1H),7.39–7.32(m,2H),7.23(d,J =7.7Hz,1H),7.08(m,1H),6.99–6.90(m,2H),3.76(s,3H),3.46(m,2H),2.80(t,J=7.2Hz, 2H),2.77–2.71(m,2H),1.30(m,3H)。
实施例1-60、3-(5-(4-氯-2-甲基苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(4-苯丁基)苯甲酰胺(MF060)
采用与制备化合物MF027类似的方法,5-氯-2-甲基苯甲酸置换为为4-氯-2-甲基苯甲酸, 柱层析纯化后得化合物MF060,最后一步反应产率80%:1H NMR(500MHz,DMSO)δ8.55(t, J=5.6Hz,1H),7.84(m,1H),7.81(d,J=7.9Hz,1H),7.45(m,1H),7.41(s,1H),7.32–7.23(m, 4H),7.23–7.13(m,2H),3.26(dd,J=12.6,6.7Hz,2H),2.78(m,2H),2.65–2.57(m,2H),2.07(s, 3H),1.65–1.46(m,4H),1.36–1.28(m,3H)。
实施例1-61、3-(5-(4-氯-2-甲基苯基)-3-乙基-1H-1,2,4-三氮唑-1-基)-N-(3-苯氧丙基)苯 甲酰胺(MF061)
采用与制备化合物MF060类似的方法,4-苯基丁胺置换为3-苯氧基丙胺,柱层析纯化后 得化合物MF061,产率72%:1H NMR(500MHz,DMSO)δ8.66(t,J=5.5Hz,1H),7.88(m, 1H),7.86–7.80(m,1H),7.50–7.39(m,2H),7.35–7.22(m,5H),6.99–6.88(m,3H),4.08 –3.98(m,2H),3.41(m,2H),2.78(q,J=7.6Hz,2H),2.08(s,3H),2.03–1.92(m,2H),1.37– 1.27(m,3H)。
- 还没有人留言评论。精彩留言会获得点赞!