一种提高酿酒酵母异戊二烯合成能力的方法与流程
本发明涉及一种提高酿酒酵母中异戊二烯合成能力的方法,属于生物工程领域。
背景技术:
异戊二烯是合成橡胶的重要单体,其年消耗量超过100万吨。自然界有许多植物能释放异戊二烯。异戊二烯以气体形式释放到大气中,不易收集,从而难以用于工业生产。目前异戊二烯的主要来源是C5馏分。由于石油资源不可再生和石油化工带来的环境污染问题日趋严重,以微生物作为细胞工厂合成异戊二烯已经变成一个重要的研究课题。大多数微生物都具有2-甲基赤藓醇磷酸(MEP)或甲羟戊酸(MVA)途径,可以合成异戊二烯的前体物质二甲基烯丙基焦磷酸(DMAPP)。将植物来源的异戊二烯合成基因IspS转入这些微生物中,就可以使其具备合成异戊二烯的能力。目前对生物合成异戊二烯主的研究要集中在对上游MEP和MVA途径的调控,而对于下游异戊二烯合成途径的研究鲜有报道。异戊二烯合成酶作为催化异戊二烯合成的酶,其在微生物体内的表达量和催化活性都比较低。下游异戊二烯合成途径强度太弱已经成为限制异戊二烯合成能力提高的瓶颈问题。
技术实现要素:
本发明主要目的是增强酿酒酵母合成异戊二烯的能力。
一种提高酿酒酵母合成异戊二烯能力的方法,通过酶切连接将来源于银白杨的IspS基因序列SEQ ID NO:1克隆到质粒上,转化到酿酒酵母体内,以实现在酿酒酵母中合成异戊二烯;并通过GAL4过表达增强IspS转录水平,以实现提高酿酒酵母合成异戊二烯能力。
进一步,所述IspS由SEQ ID NO.1中的基因编码,并且所述IspS氨基酸序列是序列表中SEQ ID NO.2的氨基酸序列。
进一步,所述质粒为p416xwp01质粒,在酿酒酵母中以附着型低拷贝质粒存在,筛选标记为URA3。
进一步,通过DNA同源重组,将含有GAL4表达盒的线性化质粒整合到酿酒酵母基因组上GAL1/7/10区域,敲除GAL1/7/10基因,同时增强GAL4的表达,以实现增强IspS转录水平。
进一步,所述含有GAL4表达盒的线性化质粒为含有KanMX筛选标记、GAL1/7/10同源臂序列、多克隆位点和GAL4表达盒。
进一步,所述GAL4表达盒序列如SEQ ID NO.17所示。
进一步,所述IspS基因序列为下列突变基因序列中的一个:
a.序列表中SEQ ID NO.3的核苷酸序列;
b.序列表中SEQ ID NO.5的核苷酸序列;
c.序列表中SEQ ID NO.7的核苷酸序列;
d.序列表中SEQ ID NO.9的核苷酸序列;
e.序列表中SEQ ID NO.11的核苷酸序列;
f.序列表中SEQ ID NO.13的核苷酸序列;
g.序列表中SEQ ID NO.15的核苷酸序列。
IspS由上述突变基因编码,并且,所述IspS氨基酸序列是下列氨基酸序列之一:
(1)序列表中SEQ ID NO.4的氨基酸序列;
(2)序列表中SEQ ID NO.6的氨基酸序列;
(3)序列表中SEQ ID NO.8的氨基酸序列;
(4)序列表中SEQ ID NO.10的氨基酸序列;
(5)序列表中SEQ ID NO.12的氨基酸序列;
(6)序列表中SEQ ID NO.14的氨基酸序列;
(7)序列表中SEQ ID NO.16的氨基酸序列。
其中,序列表中SEQ ID NO.4的氨基酸序列编码的异戊二烯合成酶命名为IspSM1,相对于野生型其第340位苯丙氨酸突变为亮氨酸;序列表中SEQ ID NO.6的氨基酸序列编码的异戊二烯合成酶命名为IspSM2,相对于野生型其第478位异亮氨酸突变为缬氨酸;序列表中SEQ ID NO.8的氨基酸序列编码的异戊二烯合成酶命名为IspSM3(IspSMA),相对于野生型其第570位丙氨酸突变为苏氨酸;序列表中SEQ ID NO.10的氨基酸序列编码的异戊二烯合成酶命名为IspSM4,相对于野生型其第340位苯丙氨酸突变为亮氨酸,第570位丙氨酸突变为苏氨酸;序列表中SEQ ID NO.12的氨基酸序列编码的异戊二烯合成酶命名为IspSM5,相对于野生型其第478位异亮氨酸突变为缬氨酸,第570位丙氨酸突变为苏氨酸;序列表中SEQID NO.14的氨基酸序列编码的异戊二烯合成酶命名为IspSM6,相对于野生型其第340位苯丙氨酸突变为亮氨酸,第478位异亮氨酸突变为缬氨酸,第570位丙氨酸突变为苏氨酸;序列表中SEQ ID NO.16的氨基酸序列编码的异戊二烯合成酶命名为IspSMB,相对于野生型其第340位苯丙氨酸突变为亮氨酸,第478位异亮氨酸突变为缬氨酸。
本发明所采用的技术方案,利用GAL4表达盒敲除酿酒酵母基因组中的GAL1/7/10,增强IspS表达水平。然后利用定向进化的方法提高IspS催化活性。
其中上述增强酿酒酵母合成异戊二烯能力的技术方案中,所述GAL4表达盒序列如SEQ IDNO.17所示。
上述增强酿酒酵母合成异戊二烯能力的技术方案中,GAL4表达盒在基因组上的整合,其特征在于:将GAL4表达盒以酶切连接的方式克隆到整合型质粒pLGL-△GAL1/7/10上,构建质粒pLGL-△GAL1/7/10-GAL4;将pLGL-△GAL1/7/10-GAL4线性化,通过电转化整合到酿酒酵母基因组上,涂布G418平板,筛选阳性克隆菌株。
上述增强酿酒酵母合成异戊二烯能力的技术方案中,对酿酒酵母使用的宿主菌过度积累中间代谢产物DMAPP进行定向进化。
与现有技术相比,本发明具有如下优点:
本发明以酿酒酵母为宿主,通过将银白杨的IspS基因转化至酿酒酵母中,然后过表达转录因子GAL4,增强IspS的转录水平;并建立以DMAPP细胞毒性为基础的高通量筛选方法对异戊二烯合成酶进行定向进化,获得高活性的异戊二烯合成酶突变体。结合转录因子调控和异戊二烯合成酶定向进化,强化下游异戊二烯合成途径,提高了酿酒酵母的异戊二烯合成能力。
本发明利用同源重组技术,将GAL4表达框整合到酵母基因组中GAL1/7/10区段,增强IspS转录水平。此外,利用定向进化提高IspS催化活性。二者结合起来,增强了异戊二烯合成途径的强度,提高了酿酒酵母的异戊二烯合成能力。
本发明所构建的GAL4过表达菌株,在发酵过程中IspS转录水平是出发菌株的3-7倍。
本发明通过筛选获得的突变体IspSMA和IspSMB,催化活性相比野生型有明显的提高。
本发明通过单点组合获得的突变体IspSM1、IspSM2、IspSM3、IspSM4IspSM5和IspSM6,IspSM4是最优突变体,催化活性比其他突变体及野生型高。
附图说明
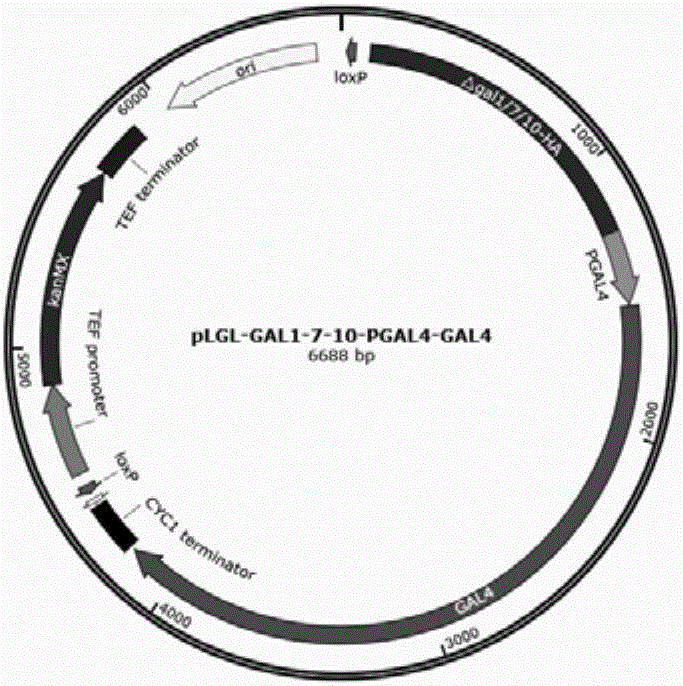
图1为pLGL-△GAL1/7/10-GAL4质粒图谱。
图2为p416xwp01质粒图谱。
图3为结合GAL4过表达和定向进化对异戊二烯产量的影响。C代表出发菌株,作为对照组;E1代表GAL4过表达菌株;E2代表在E1基础上转入最优突变体IspSM4。
具体实施方式
本发明所用质粒pLGL-△GAL1/7/10-GAL4图谱如图1所示。
本发明所用质粒p416xwp01图谱如图2所示。
本发明培养基如下:
(1)YPD培养基(1%酵母粉,2%蛋白胨,2%葡糖糖),固体培养基加入2%琼脂粉,115℃灭菌,用于酿酒酵母活化和预培养。
(2)YPD(G418)培养基(1%酵母粉,2%蛋白胨,2%葡糖糖,200μg/mL G418),固体培养基加入2%琼脂粉,115℃灭菌,用于筛选KanMX标记。
(3)LB培养基(1%氯化钠,1%胰蛋白胨,0.5%酵母粉),固体培养基加入2%琼脂粉,121℃灭菌,用于大肠杆菌活化和预培养。
(4)LB(Amp/Kan)培养基(1%氯化钠,1%胰蛋白胨,0.5%酵母粉,100μg/mL氨苄青霉素或50μg/mL卡那霉素),固体培养基加入2%琼脂粉,121℃灭菌,用于含有质粒的大肠杆菌培养。
实施例1:异戊二烯合成途径在酿酒酵母中的构建
用密码子优化软件将来源于银白杨的异戊二烯合成酶基因进行优化,并人工合成优化后的序列。用引物IspS-F(26)和IspS-R(27)将优化后的IspS克隆到p416xwp01质粒上,转入酿酒酵母中,以实现异戊二烯的合成。
实施例2:一种构建GAL4过表达菌株的方法。
用于构建GAL4过表达菌株的质粒PLGL-△GAL1/7/10-PGAL4-GAL4,其步骤如下:
以质粒PUG6为模板,用引物loxp-F1(30)和loxp-R1(31)扩增获得loxp-KanMX-loxp片段。以质粒pESC-URA质粒为模板,用引物loxp-F2(32)和loxp-R2(33)扩增获得ori片段,用引物TADH1-F2(34)和TCYC1-R2(35)扩增获得TADH1-MCS1-PGAL10-PGAL1-MCS2-TCYC1区段。将三个片段融合构建质粒PMRI-28。
以酿酒酵母BY4741基因组为模板,用引物△GAL1/7/10-UP-F1(22)和△GAL1/7/10-UP-R1(23)扩增获得GAL1/7/10区段的上游534bp,用引物△GAL1/7/10-DN-F1(24)和△GAL1/7/10-DN-R1(25)扩增获得下游671bp。两个片段有同源序列,利用重叠延伸PCR将两个片段融合获得用于敲除GAL1/7/10区段的同源臂△GAL1/7/10(1151bp)。
将△GAL1/7/10片段和克隆到质粒PMRI-28上,构建质粒PLGL-△GAL1/7/10。
以酿酒酵母BY4741基因组为模板,用引物PGAL4-F1(18)和PGAL4-R1(19)扩增获得GAL4的启动子片段,用引物GAL4-F1(20)和GAL4-R1(21)扩增获得GAL4基因片段。
将PGAL4-GAL4片段克隆到质粒PLGL-△GAL1/7/10的PGAL10-PGAL1-MCS2区段,构建质粒PLGL-△GAL1/7/10-PGAL4-GAL4。
GAL4过表达菌株的构建,具体步骤如下:
(1)用EcoRI单酶切质粒PLGL-△GAL1/7/10-PGAL4-GAL4,使其线性化。
(2)制备酿酒酵母感受态。
(3)电击转化,将线性化质粒整合到酿酒酵母基因组上,涂布G418平板。
(4)从平板上挑选出单菌落,在摇瓶中过夜培养,提取基因组,PCR验证GAL4表达盒是否整合到基因组上的GAL1/7/10区段。
(5)根据PCR验证结果,筛选出阳性克隆。
实施例3:IspS转录水平测定。
将出发菌株(C)和GAL4过表达菌株(E1)培养在在液体SS-URA培养基中。在摇瓶发酵过程中第18小时、24小时、48小时和72小时分别取2mL发酵液。
用RNA提取试剂盒(Takara)提取各个样品的总RNA。使用反转录试剂盒(Takara)去除基因组DNA并反转录获得cDNA。实验操作按试剂盒说明书进行。
以ACT1基因为内参,对IspS做实时荧光定量PCR,获得扩增曲线,记录CT值。用2-△△CT计算IspS的相对转录水平。
表1 IspS的相对转录水平
实施例4:异戊二烯产量的检测。
将出发菌株和GAL4过表达菌株培养在密封的装有液体SS-URA培养基的摇瓶中,培养24h。
采用顶空进样法,用GC-FID检测异戊二烯产量。柱温箱、进样口和检测器温度分别为80℃、180℃和180℃。结果如图3所示
实施例5:IspS阳性突变体的获得。
以p416xwp01-IspS为模板,GAL1-F(28)和qtHMG1-R1(29)为前后引物,对IspS做易错PCR反应,构建IspS突变体文库。体系中Mn2+浓度为0.1mM,用于增加突变率。
酶切p416xwp01-IspS,获得切除野生型IspS片段的质粒。
制备酿酒酵母感受态细胞,将IspS突变体文库和酶切质粒转入酿酒酵母体内。涂布SS平板。
从平板上挑取10个长得较快的单菌落。
将野生型菌株和10个突变菌株在液体SS培养基培养,24h后测量OD600,筛选出4个生长比野生型菌株快的突变菌株。
提取这4个突变菌株的质粒,并转入大肠杆菌扩增。
将质粒重新转入原宿主菌,摇瓶培养,检测异戊二烯产量。
分析结果发现两个突变菌株比野生型菌株产量高,分别命名为IspSMA和IspSMB。
对两个突变质粒IspSMA和IspSMB进行测序反应。构建单点和组合突变体,突变体如表2所示。
检测突变体异戊二烯产量,比较相对酶活(相对酶活=突变菌株产量/野生菌株产量1),筛选出最优突变体IspSM4,其相对酶活为2.5。
表2 单点组合突变体
实施例6:结合GAL4过表达和定向进化提高异戊二烯产量
将质粒p416xwp01-IspSM4转入到GAL4过表达菌株中,构建重组菌(E2)。
两个重组菌在密封的摇瓶中培养24h,检测异戊二烯产量。结果如图3所示。
- 还没有人留言评论。精彩留言会获得点赞!