一种多肟酯及其用途、以及感光性树脂组合物的制作方法
本发明涉及一种多肟酯及其光引发剂的用途、和含有该多肟酯的感光性树脂组合物及其用途。
背景技术:
:光固化技术由于其固化速度快、节能环保、无溶剂等优势,在涂料、光刻胶、油墨、电子封装材料、黏合剂等工业领域有着广泛的应用。在光固化体系中,光引发剂起着至关重要的作用,它吸收光能使液态的单体或者低聚物以及稀释剂转变成固态的交联聚合物,因而对光引发剂的研究和开发也始终占据着非常重要的位置。近年来肟酯类光引发剂作为一类新型裂解型光引发剂,因其具有相对好的感光性而被深入研发和应用,参见例如《应用聚合物科学杂志》(journalofappliedpolymerscience,2012,123,725–731;中国专利cn101508744a。再者,钱晓春等人(cn103833872a)研发出一种双肟酯类光引发剂,该引发剂在一定程度上提高了感光度和热稳定性,在不同程度上满足了光固化领域的一些应用要求,但是这类引发剂还仍然存在着光引发性能不高、稳定性差、溶解度低、在有色体系中感光度、显影性、分辨效果不好的问题,不仅降低了生产效率,而且所得产品也达不到生产精度和稳定性。因此不断开发出高感光性、高稳定性、与体系相容性好、成膜显影效果佳的光引发剂仍然是一项有重要实际意义的工作和挑战。另一方面,孙利达等人(中国专利cn102395924b)发明了以吡嗪化合物作为光聚合引发剂用于感光干膜的制作,但存在光引发效率不高的缺陷。鉴于前述所存在的技术问题和相关技术缺陷,本发明的发明人进行了深入细致研究,研发出一种含有吡嗪结构的多肟酯化合物,且将其用作光引发剂,形成为感光性树脂组合物,并且取得了非常优异的双键转化率,即非常优异的光引发效果,获得了非常优异的感光度。技术实现要素:本发明提供一种多肟酯,具有如下结构式:其中,r1和r2分别独立表示如下的2价有机基团:不取代或者被取代基取代的烷基、或者、不取代或者被取代基取代的芳基;r3和r4分别独立表示如下的1价有机基团:不取代或者被取代基取代的烷基、不取代或者被取代基取代的环烷基、不取代或者被取代基取代的氨基、不取代或者被取代基取代的芳基、或不取代或者被取代基取代的杂环基;r5和r6分别独立表示氢原子、或者不取代或者被取代基取代的芳基;或者、r5和r6相互结合与吡嗪骨架的2个碳原子一起形成环;x表示硫原子、氧原子、硒原子、氮原子、或者磷原子;m表示1~2的整数。前述烷基为c1~c15的直链烷基。前述环烷基为c3~c12的环烷基。前述芳基为c6~c20的芳基。前述杂环基选自呋喃基、喹啉基、咪唑基、吡啶基、嘧啶基、吡嗪基、吡咯基、噻吩基中的一种。前述取代基为卤素、硝基、羧基(-cooh)、或者c1~c5的直链烷基。在前述技术方案中,当x为硫原子、氧原子、硒原子时,m=1;当x为氮原子、磷原子时,m=2。r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为不取代或者被c1~c5烷硫基、c1~c5烷氧基所取代的苯环。r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为并四苯环。r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为蒽醌环。前述的多肟酯选自如下至少一种:前述多肟酯在作为光引发剂的用途。本发明还提供一种感光性树脂组合物,其含有前述任一项的多肟酯作为光引发剂。前述感光性树脂组合物还含有光聚合单体和有机溶剂。在前述感光性树脂组合物中,所述多肟酯为所述光聚合单体的0.1重量%~5重量%。本发明还提供一种前述任一项感光性树脂组合物的用途。本发明的技术效果为:通过将本发明的含有吡嗪结构的多肟酯化合物用作光引发剂,以形成为感光性树脂组合物,就能够取得非常优异的双键转化率、光引发效果、以及非常优异的感光度。附图说明图1是实施例1步骤(1)所合成的中间体产物的结构图及其在氘代氯仿溶液中的核磁氢谱谱图。图2是实施例1步骤(2)所合成的中间体产物的结构图及其在氘代氯仿溶液中的核磁氢谱谱图。图3是实施例1步骤(3)所合成的中间体产物的结构图及其在氘代氯仿溶液中的核磁氢谱谱图。图4是实施例1步骤(4)所合成的中间体产物的结构图及其在氘代氯仿溶液中的核磁氢谱谱图。图5是实施例1所合成的化合物oxe-s-q的结构图及其在氘代氯仿溶液中的核磁氢谱谱图。图6是实施例1所合成的化合物oxe-s-q的红外谱图。图7是实施例2所合成的化合物oxe-s-tpp的结构图及其在氘代氯仿溶液中的核磁氢谱谱图。图8是在实施例1的化合物oxe-s-q光引发剂和对比例1~3的各种光引发剂下,光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10中的碳碳双键转化率随曝光时间的变化图。图9是在实施例2的化合物oxe-s-tpp光引发剂和对比例1的光引发剂下,光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10中的碳碳双键转化率随曝光时间的变化图。图10是在实施例3的化合物oxe-s-pq光引发剂和对比例1的光引发剂下,光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10中的碳碳双键转化率随曝光时间的变化。具体实施方式本发明提供一种多肟酯,具有如下结构式:其中,r1和r2分别独立表示如下的2价有机基团:不取代或者被取代基取代的烷基、或者、不取代或者被取代基取代的芳基;r3和r4分别独立表示如下的1价有机基团:不取代或者被取代基取代的烷基、不取代或者被取代基取代的环烷基、不取代或者被取代基取代的氨基、不取代或者被取代基取代的芳基、或不取代或者被取代基取代的杂环基;r5和r6分别独立表示氢原子、或者不取代或者被取代基取代的芳基的1价有机基团;或者、r5和r6相互结合与吡嗪骨架的2个碳原子一起形成环;x表示硫原子、氧原子、硒原子、氮原子、或者磷原子;m表示1~2的整数;当x为硫原子、氧原子、硒原子时,m=1;当x为氮原子、磷原子时,m=2。所述烷基为c1~c15的直链烷基,例如:甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基。所述烷基较好为c1~c12的直链烷基。所述环烷基为c3~c12的环烷基,例如:环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基。所述环烷基较好为c3~c9的环烷基。所述芳基为c6~c20的芳基,例如:例如:苯基、联苯基、三联苯基、萘基、芴基、菲基、蒽基、茚基、苯并[9,10]菲基、芘基、并四苯基、屈基、荧蒽基等。较好为c6~c8的芳基,最好为苯基、萘基。所述杂环基选自呋喃基、喹啉基、咪唑基、吡啶基、嘧啶基、吡嗪基、吡咯基、噻吩基中的至少一种。较好为呋喃基、喹啉基。所述不取代或者被取代基取代的氨基:例如:氨基、被c1~c5的直链烷基取代的氨基,所述c1~c5的直链烷基例如为:甲基、乙基、丙基、丁基、戊基。例如二乙氨基。所述取代基为卤素、硝基、羧基(-cooh)、或者c1~c5的直链烷基。其中的卤素为f、cl、br、i。其中作为取代基的c1~c5的直链烷基例如为:甲基、乙基、丙基、丁基、戊基。前述的烷基、环烷基、芳基、氨基、杂环基都可被前述的取代基取代。r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为不取代或者被c1~c5烷硫基、c1~c5烷氧基所取代的苯环。所述c1~c5烷硫基为碳原子为1~5的直链烷硫基,例如:甲硫基、乙硫基、丙硫基、丁硫基、戊硫基。所述c1~c5烷氧基为甲氧基、乙氧基、丙氧基、丁氧基、戊氧基。较好为甲氧基。r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为并四苯环r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为蒽醌环。所述蒽醌环为1,2-蒽醌、1,4-蒽醌、9,10-蒽醌,较好为9,10-蒽醌。本发明的多肟酯的制备方法,包括以下步骤:第一步:在500毫升三口圆底烧瓶中,将含有被卤素y取代的r1的偶酰和含有r5和r6的二胺按照摩尔比为1:1~1:1.5溶解在50~200毫升无水醇溶剂中,通入氮气保护,搅拌,冷凝回流12~24小时,冷却至室温后,过滤,置于真空干燥箱中50~80℃下干燥4~24小时,得到中间体m1其中,r1独立表示下述烷基或芳基的2价有机基团。所述烷基:具有1~15个碳原子的直链烷基,例如:甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基;所述芳基:具有6~20个碳原子的芳基,例如:苯基、联苯基、三联苯基、萘基、芴基、菲基、蒽基、茚基、苯并[9,10]菲基、芘基、并四苯基、屈基、荧蒽基等。优选为c6~c8的芳基。所述卤素y例如为f、cl、br和i。r5和r6分别独立表示氢原子、或者不取代或者被取代基取代的芳基;或者、r5和r6相互结合与吡嗪骨架的2个碳原子一起形成环。所述芳基为前述一样。r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为不取代或者被c1~c5烷硫基、c1~c5烷氧基所取代的苯环。所述c1~c5烷硫基为碳原子为1~5的直链烷硫基,例如:甲硫基、乙硫基、丙硫基、丁硫基、戊硫基。所述c1~c5烷氧基为甲氧基、乙氧基、丙氧基、丁氧基、戊氧基。r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为并四苯环。r5和r6相互结合与吡嗪骨架的2个碳原子一起形成的环为蒽醌环,所述蒽醌环为1,2-蒽醌、1,4-蒽醌、9,10-蒽醌,较好为9,10-蒽醌。含有被前述卤素y取代的r1的偶酰:例如为4,4’-二氟二苯偶酰,4,4’-二氯二苯偶酰,4,4’-二溴二苯偶酰,草酰氟,2-氯-3',4'-二甲氧基联苯酰,1,4-二溴-2,3-丁二酮,2,5-二溴-3,4-己二酮,2,4-二氯甲基-1,2-环戊二酮,4,6-二氟-喹啉-2,3-二酮,4,7-二氟吲哚满二酮等。前述含有r5和r6的二胺:例如为邻苯二胺,1,2-二苯基-乙二胺,4-丙硫基邻苯二胺,1,2-乙二胺,4,5-二甲氧基-1,2-苯二胺,1,2-二氨基蒽醌,并四苯二胺等。前述无水醇溶剂:例如为无水乙醇等。第二步:在500毫升三口圆底烧瓶中,将第一步制得的中间体m1与具有r2基团和羟基的化合物r2-oh、或具有r2基团和巯基的化合物r2-sh、或具有r2基团和氢硒基的化合物r2-seh,按照摩尔比1:2.0~1:3.5溶解在50~200毫升有机溶剂后,搅拌,并通氮气保护,再加入2.5~4.0摩尔的碱到三口圆底烧瓶中,升高温度至120~160℃,反应12~48小时,待用。再取5~10倍前述溶剂量的去离子水放于2升烧杯中,将其加热至微沸,将前述待用的反应液缓慢倒入该沸水中,产生沉淀,搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中50~80℃烘8~24小时得到中间体m2r2独立表示烷基或芳基的2价有机基团。所述烷基:具有1~15个碳原子的直链烷基,例如:甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基;所述芳基:具有6~20个碳原子的芳基,例如:苯基、联苯基、三联苯基、萘基、芴基、菲基、蒽基、茚基、苯并[9,10]菲基、芘基、并四苯基、屈基、荧蒽基等。优选为c6~c8的芳基。前述碱:氢氧化钾,氢氧化钠等。前述有机溶剂:四氢呋喃,丁酮,环己酮,n,n-二甲基甲酰胺,n,n-二甲基乙酰胺,二甲基亚砜等。x在为硫原子、氧原子、或者硒原子时,m=1。第三步:用有机溶剂将2.0~3.6摩尔的无水三氯化铝或者三氯化锌和2.0~3.0摩尔的含r3基团的酰氯化合物溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,待用。再称量1.0~1.5摩尔的第二步所制得的中间体m2用10~30毫升的有机溶剂溶解后将其转移到恒压漏斗中逐滴加到前述待用的三口圆底烧瓶中的反应液中,0.5~2.0小时滴加完毕,撤去冰水浴,常温下继续反应6~24小时,加入等溶剂量的去离子水萃取,用无水硫酸镁干燥,抽滤并收集澄清的滤液,60~80℃下旋转蒸发除尽其中的溶剂,在真空干燥箱中50~80℃烘6~24小时,得到中间体m3r3独立表示如下的1价有机基团:不取代或者被取代基取代的烷基、不取代或者被取代基取代的环烷基、不取代或者被取代基取代的氨基、不取代或者被取代基取代的芳基或不取代、或者被取代基取代的杂环基;所述烷基为具有1~15个碳原子的直链烷基,例如:甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基;所述环烷基为c3~c12的环烷基,例如:环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基。所述不取代或者被取代基取代的氨基:例如为氨基、二乙氨基、二丁氨基。所述不取代或者被取代基取代的芳基为:具有6~20个碳原子的芳基,优选为c6~c12的芳基,例如:苯基、联苯基、三联苯基、萘基、芴基、菲基、蒽基、茚基、苯并[9,10]菲基、芘基、并四苯基、屈基、荧蒽基等。所述杂环基:选自呋喃基、喹啉基、咪唑基、吡啶基、嘧啶基、吡嗪基、吡咯基、噻吩基中的一种。所述取代基为卤素(f、cl、br和i)、硝基、羧基(-cooh)、或者c1~c5的直链烷基。其中的c1~c5的直链烷基例如为:甲基、乙基、丙基、丁基、戊基。前述含r3基团的酰氯化合物可为:乙酰氯、月桂酰氯、丁酰氯、葵酰氯、二乙氨基甲酰氯、2-呋喃甲酰氯、对硝基苯甲酰氯、环己基甲酰氯、甲烷磺酰氯、对苯二甲酰氯、苯氧乙酰氯、单酰氯乙酯、乙酰氧基乙酰氯等。前述有机溶剂:二氯甲烷,三氯甲烷,甲苯,乙酸乙酯等。第四步:将1.0摩尔第三步所制得的中间体m32.0~5.0摩尔的盐酸羟胺和2.0~6.0摩尔的乙酸钠用50~250毫升有机溶剂将其溶解在500毫升三口圆底烧瓶中,搅拌,并通氮气,升高温度至110~140℃,开始反应12~24小时。反应结束后将反应物倒入5~10倍溶剂量的去离子水中,产生沉淀,过滤,滤渣用去离子水洗涤三遍后在真空干燥箱中50-80℃烘6~24小时,得到中间体m4前述有机溶剂:四氢呋喃,丁酮,环己酮,n,n-二甲基甲酰胺,n,n-二甲基乙酰胺,二甲基亚砜等。第五步:多肟酯化合物的形成:将1摩尔的第四步所制得的中间体m4与1.0~1.3摩尔的酸酐在有机溶剂中回流12~24小时,用质量浓度为5质量%的碱溶液洗涤三遍,再用去离子水洗涤三遍,60~80℃下旋转蒸发除尽其中的溶剂,在真空干燥箱中60~80℃烘6~24小时,得到含吡嗪结构的肟酯化合物r4独立表示如下的1价有机基团:不取代或者被取代基取代的烷基、不取代或者被取代基取代的环烷基、不取代或者被取代基取代的氨基、不取代或者被取代基取代的芳基或不取代、或者被取代基取代的杂环基。所述不取代或者被取代基取代的烷基:具有1~15个碳原子的直链烷基,例如:甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基。所述环烷基为c3~c12的环烷基,例如:环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基。所述不取代或者被取代基取代的氨基:例如氨基、二乙氨基、二丁氨基。所述不取代或者被取代基取代的芳基为:具有6~20个碳原子的芳基,优选为c6~c12的芳基,例如:苯基、联苯基、三联苯基、萘基、芴基、菲基、蒽基、茚基、苯并[9,10]菲基、芘基、并四苯基、屈基、荧蒽基等。所述取代基为卤素(f、cl、br和i)、硝基、羧基、或者c1~c5的直链烷基。其中的c1~c5的直链烷基例如为:甲基、乙基、丙基、丁基、戊基。所述杂环基:选自呋喃基、喹啉基、咪唑基、吡啶基、嘧啶基、吡嗪基、吡咯基、噻吩基中的一种。前述酸酐例如可为乙酸酐,正戊酸酐,葵酸酐,对甲基磺酸酐,1,4-萘二甲酸酐,顺环己二酸酐,马来酸酐,3,4,9,10苝四酸酐,2,3-吡啶二酸酐,四甲撑马来酸酐,三氯甲烷磺酸酐,3,4,5,6-四氟邻苯二甲酸酐、偏苯三甲酸酐、苯甲酸酐、喹啉酸酐、七氟丁酸酐、4-溴-1,8-萘二甲酸酐等。前述碱:氢氧化钾,氢氧化钠等。前述有机溶剂:二氯甲烷,三氯甲烷,甲苯,乙酸乙酯,二甲苯等。前述是x在为硫原子、氧原子、或者硒原子时,m=1的制造方法。对于当x为氮原子、磷原子时,m=2的情况下的制备方法,如下所述:除了第二步有所不同外,其他步骤都如前所述。即,在第二步中,因为使用了或者所以能够形成中间体m2然后通过前述第三步~第五步骤就能够形成当x为氮原子、磷原子时,m=2的多肟酯化合物产物。其制造方法路线如下图所示,其他条件同前面所述:其中r1、r2、r3、r4、r5和r6的指代如前所述。确认化合物的结构的测定方法:在氘代氯仿溶液中的核磁氢谱谱图:先将待测样品溶于氘代氯仿溶液中,采用美国varian公司mercuryplus400mhz核磁共振谱仪,以四甲基硅烷为内标,以获得样品的核磁共振氢谱谱图。红外谱图:先将待测样品与溴化钾共混一起研磨,压制成薄片,采用thermois10型傅里叶变换红外光谱仪,采集该样品在400~4000cm-1的红外光谱谱图。前述任一项的多肟酯在光引发剂上的用途。本发明提供一种感光性树脂组合物,该组合物含有前述任一项的多肟酯作为光引发剂。所述的感光性树脂组合物,还含有光聚合单体和有机溶剂。前述光聚合单体为含c=c不饱和双键的光聚合单体,例如为:丙烯酸酯类,甲基丙烯酸酯类,烯基醚类,烯基吡咯烷酮类,烯酰胺类,烯胺类,苯乙烯类,乙酸乙烯酯类等,例如乙氧基化双酚a二丙烯酸酯、三丙烯酸三羟甲基丙酯、乙氧基化三羟甲基丙烷三丙烯酸酯、二甲基丙烯酸乙二醇酯、聚乙二醇二丙烯酸酯、聚丙二醇二丙烯酸酯、甲基丙烯酸四氢呋喃酯、甲基丙烯酸甲酯、乙氧基化甘油三丙烯酸酯、季戊四醇三丙烯酸酯、4-羟丁基乙烯基醚、甲基丙烯酸甲酯,季戊四醇三丙烯酸酯,1,6-己二醇二丙烯酸酯,苯乙烯,丙烯酰胺,烯丙胺,二烯丙基胺,n-乙烯基吡咯烷酮,乙烯基丁基醚,三乙烯基乙二醇二乙烯基醚等。所述有机溶剂:二氯甲烷、三氯甲烷、丙酮、丁酮、苯、甲苯、二甲苯、四氢呋喃、乙醇、乙酸乙酯、苯乙烯、乙醚、正己烷、乙腈等。所述感光性组合物的制造方法:在常温避光条件下,将前述多肟酯的光引发剂、前述含不饱和双键的光聚合单体以及前述有机溶剂进行搅拌,时间为4.0~8.0小时,进行完全溶解,制得感光性组合物。这些制得感光性组合物被放置在暗室内,冷藏待用。前述光聚合单体和所述多肟酯的配合比例为:所述多肟酯为所述光聚合单体的0.1重量%~5重量%。本发明还提供一种感光性树脂组合物的用途。性能评价:以含有不饱和双键的光聚合单体中的碳碳双键最终转化率(%)和光聚合速率(s-1)来反映本发明的多肟酯化合物作为光引发剂的光引发效率,以评价本发明的多肟酯化合物及其感光性树脂组合物的感光性能。碳碳双键最终转化率越大,光引发剂的光引发效率越高,光引发剂性能越好,由该光引发剂所组成的感光性树脂组合物的感光性(感光度)也越好。前述光聚合速率(s-1)是指在2分钟内碳碳双键转化的平均速率,以表述光聚合的快慢以及光聚合效率的高低。光聚合速率(s-1)越高,光引发剂的光引发效率越高,光引发剂性能越好,由该光引发剂所组成的感光性树脂组合物的感光性(感光度)也越好。碳碳双键最终转化率(%)和光聚合速率(s-1)的测定方法:将制得的感光性组合物旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明的多肟酯化合物的光引发剂来引发含不饱和双键的光聚合单体发生光聚合反应,然后采用thermois10型傅里叶变换红外光谱仪,对光聚合过程中光聚合单体在1630~1640cm-1处碳碳双键的特征峰的强度变化进行原位跟踪监测,利用数据分析软件(产品名:origin)来计算光聚合反应前后碳碳双键特征峰的面积,再通过下列公式计算出不同曝光时刻(不同曝光时间)下光聚合单体的碳碳双键的转化率。双键转化率的测定:本发明的“碳碳双键最终转化率(%)”是指:将曝光时间定为10分钟时的碳碳双键的转化率。本发明的“光聚合速率(s-1)”的定义为:在2分钟内碳碳双键转化的平均速率。测试仪器:thermois10型傅里叶变换红外光谱仪。紫外光光源:外接的sp-3紫外点光源系统。实施例下面,用实施例来进一步说明本
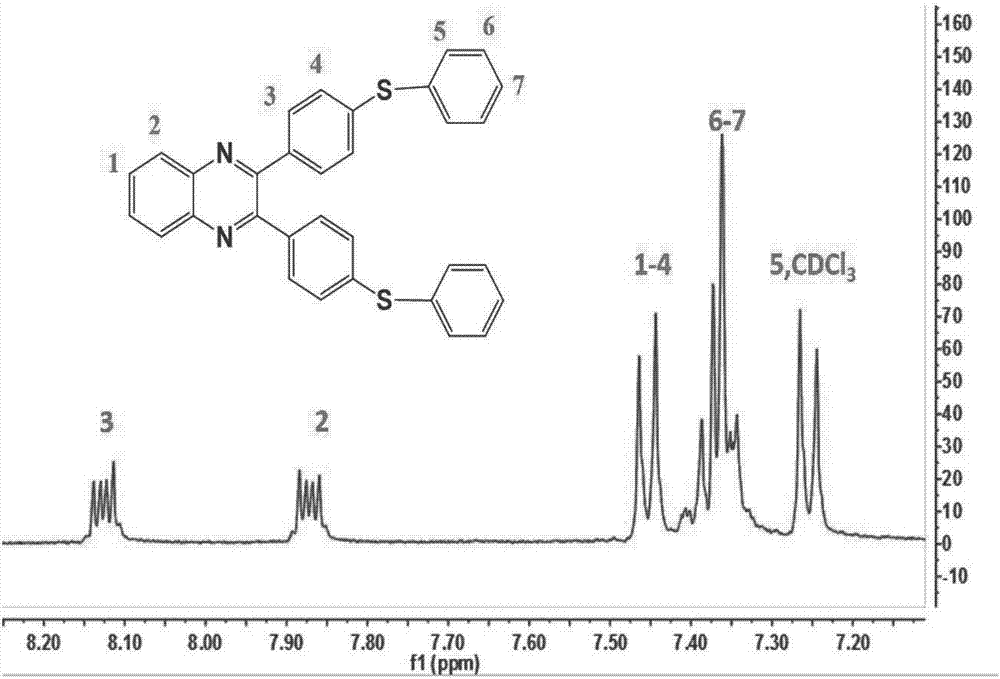
发明内容,但本发明的保护范围并不受限于这些实施例。对本领域的技术人员在不背离本发明精神和保护范围的情况下做出的其他的变化,仍包括在本发明保护范围之内。实施例1化合物oxe-s-q,其结构式如下:制备方法如下所述:(1)、在500毫升三口圆底烧瓶中,将1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的邻苯二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流24小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中50℃下干燥,得到化合物(化合物1-1);步骤(1)产物化合物1-1的结构通过核磁共振氢谱谱图得到确认,参见图1。其具体数据如下:1hnmr(cdcl3,400mhz):8.20-7.0(12h,苯环)。(2)、1摩尔所制得的化合物1-1与2.2摩尔的苯硫酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌机搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中60℃烘8小时,得到化合物(化合物1-2)。步骤(2)产物化合物1-2的结构通过核磁共振氢谱谱图得到确认。参见图2。其具体数据如下:1hnmr(cdcl3,400mhz):8.14-7.26(22h,苯环)。(3)、用二氯甲烷将2.4摩尔的无水三氯化铝和2摩尔乙酰氯溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔的所制得的化合物1-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,半小时滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物1-3)。步骤(3)产物化合物1-3的结构通过核磁共振氢谱得到确认。参见图3。其具体数据如下:1hnmr(cdcl3,400mhz):8.24-7.26(20h,苯环),2.44-2.35(6h,-c=o-ch3)。(4)、将1摩尔所制得的化合物1-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,搅拌,并通氮气,升高温度至110℃,开始反应12小时,将反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中70℃烘24小时,得到化合物(化合物1-4)。步骤(4)产物化合物1-4的结构通过核磁共振氢谱得到确认。参见图4。其具体数据如下:1hnmr(cdcl3,400mhz):11.31-11.28(2h,-c=n-oh),8.24-7.26(20h,苯环),2.3-2.24(6h,-n=c-ch3)。(5)、1摩尔所制得的化合物1-4与1.3摩尔的乙酸酐在三氯甲烷溶液中回流12小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到最终产物化合物oxe-s-q。1hnmr(cdcl3,400mhz):8.24-7.26(20h,苯环),2.44-2.35(6h,-c=o-ch3),2.3-2.24(6h,-n=c-ch3)。ft-ir(kbr):3024,2927cm-1(c-h),1760cm-1(o-c=o),1481cm-1(c-n),1082cm-1(c-s)。实施例2化合物oxe-s-tpp,其结构式如下:制备方法如下所述:(1)、1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的1,2-二苯基-乙二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流12小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中70℃下干燥,得到化合物(化合物2-1);步骤(1)产物化合物2-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.01-7.02(18h,苯环),4.81-4.76(2h,吡嗪环)。(2)、将1摩尔所制得的化合物2-1与2.2摩尔的苯硫酚溶解在150毫升n,n-二甲基甲酰胺后,搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中70℃烘8小时,得到化合物(化合物2-2)。步骤(2)产物化合物2-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.01-7.02(28h,苯环),4.81-4.76(2h,吡嗪环)。(3)、用二氯甲烷将2.4摩尔的无水三氯化锌和2摩尔乙酰氯溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔的所制得的化合物2-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,一小时滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物2-3)。步骤(3)产物化合物2-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.01-7.02(26h,苯环),4.81-4.76(2h,吡嗪环),2.44-2.35(6h,-c=o-ch3)。(4)、将所制得的1摩尔的化合物2-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开启搅拌,并通氮气,升高温度至120℃,开始反应12小时.反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中80℃烘24小时,得到化合物(化合物2-4)。步骤(4)产物化合物2-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.36-11.29(2h,-c=n-oh),8.01-7.02(26h,苯环),4.81-4.76(2h,吡嗪环),2.3-2.24(6h,-n=c-ch3)。(5)、将1摩尔所制得的化合物2-4与1.3摩尔的乙酸酐在三氯甲烷溶液中回流24小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到最终产物化合物oxe-s-tpp。1hnmr(cdcl3,400mhz):8.01-7.02(26h,苯环),4.81-4.76(2h,吡嗪环),2.44-2.35(3h,-c=o-ch3),2.3-2.24(3h,-n=c-ch3)。ft-ir(kbr):3024,2927cm-1(c-h),1760cm-1(o-c=o),1481cm-1(c-n),1082cm-1(c-s)。实施例3化合物oxe-s-pq,其结构式如下:制备方法如下所述:(1)、将1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的4-丙硫基邻苯二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流16小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中70℃下干燥,得到化合物(化合物3-1)。步骤(1)产物化合物3-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.25-7.29(11h,苯环),2.85(2h,-s-ch2),2.85(2h,-s-ch2)。(2)、将1摩尔所制得的化合物3-1与2.2摩尔的苯硫酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中70℃烘8小时,得到化合物(化合物3-2)。步骤(2)产物化合物3-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.25-7.29(21h,苯环),2.85(2h,-s-ch2),2.85(2h,-s-ch2)。(3)、用二氯甲烷将2.4摩尔的无水三氯化铝和2摩尔月桂酰氯溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔所制得的化合物3-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,一小时滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物3-3)。步骤(3)产物化合物3-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.25-7.29(21h,苯环),2.85(2h,-s-ch2),1.36-0.85(53h,-ch2-ch3)。(4)、将1摩尔所制得的化合物3-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至120℃,开始反应12小时.反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中80℃烘24小时,得到化合物(化合物3-4)。步骤(4)产物化合物3-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.42-11.32(2h,-c=n-oh),8.20-7.21(29h,苯环),2.85(2h,-s-ch2),1.39-0.89(53h,-ch2-ch3)。(5)、将1摩尔的化合物3-4与1.3摩尔的苯甲酸酐在三氯甲烷溶液中回流12小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-s-pq1hnmr(cdcl3,400mhz):8.25-7.29(29h,苯环),2.85(2h,-s-ch2),1.36-0.85(53h,-ch2-ch3)。ft-ir(kbr):3024,2927cm-1(c-h),1760cm-1(o-c=o),1481cm-1(c-n),1082cm-1(c-s)。实施例4化合物oxe-s-p,其结构式如下:制备方法如下所述:(1)、将1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的1,2-乙二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流12小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中60℃下干燥,得到化合物(化合物4-1)。步骤(1)产物化合物4-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.24-7.36(8h,苯环),4.01-3.96(4h,吡嗪环)。(2)、将所制得的1摩尔的化合物4-1与2.2摩尔的苯硫酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中65℃烘8小时,得到化合物(化合物4-2)。步骤(2)产物化合物4-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.25-7.29(18h,苯环),4.01-3.96(4h,吡嗪环)。(3)、用二氯甲烷将2.4摩尔的无水三氯化铝和2摩尔二乙氨基酰氯溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔的化合物4-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,40分钟滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物4-3)。步骤(3)产物化合物4-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.24-7.26(16h,苯环),4.01-3.96(4h,吡嗪环),2.44-2.35(3h,-c=o-ch3),2.3-2.24(4h,-n-ch2-),1.3-1.14(6h,-ch3)。(4)、将1摩尔的化合物4-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至115℃,开始反应12小时.反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中75℃烘24小时,得到化合物(化合物4-4)。步骤(4)产物化合物4-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.31-11.28(2h,-c=n-oh),8.24-7.26(16h,苯环),4.01-3.96(4h,吡嗪环),2.3-2.24(4h,-n-ch2-),1.3-1.24(6h,-ch3)。(5)、将所制得的1摩尔的化合物4-4与1.3摩尔的偏苯三甲酸酐在三氯甲烷溶液中回流13小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-s-p1hnmr(cdcl3,400mhz):11.6(2h,-cooh),8.24-7.26(24h,苯环),4.01-3.96(4h,吡嗪环),2.3-2.24(4h,-n-ch2-),1.3-1.24(6h,-ch3)。ft-ir(kbr):3207cm-1(-cooh),3024,2927cm-1(c-h),1760cm-1(o-c=o),1481cm-1(c-n),1082cm-1(c-s)。实施例5化合物oxe-s-dmq,其结构式如下:制备方法如下所述:(1)、将1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的4,5-二甲氧基-1,2-苯二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流14小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中68℃下干燥,得到化合物(化合物5-1)。步骤(1)产物化合物5-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):9.04-6.26(10h,苯环,喹喔啉环),3.83(6h,-o-ch3)。(2)、将所制得的的1摩尔的化合物5-1与2.2摩尔的苯硫酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中65℃烘8小时,得到化合物(化合物5-2);步骤(2)产物化合物5-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):9.04-6.26(20h,苯环,喹喔啉环),3.83(6h,-o-ch3)。(3)、将所制得的2.4摩尔的无水三氯化锌和2摩尔2-呋喃甲酰氯用二氯甲烷溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔的化合物5-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,50分钟滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物5-3);步骤(3)产物化合物5-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):9.04-6.26(26h,苯环,呋喃环,喹喔啉环),3.83(6h,-o-ch3)。(4)、将所制得的1摩尔的化合物5-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至115℃,开始反应12小时.反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中78℃烘24小时,得到化合物(化合物5-4);步骤(4)产物化合物5-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.51-11.38(2h,-c=n-oh),9.04-6.26(26h,苯环,呋喃环,喹喔啉环),3.83(6h,-o-ch3)。(5)、将1摩尔的化合物5-4与1.3摩尔的喹啉酸酐在三氯甲烷溶液中回流15小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-s-dmq1hnmr(cdcl3,400mhz):9.04-6.26(36h,苯环,呋喃环,喹喔啉环,喹啉环),3.83(6h,-o-ch3)。ft-ir(kbr):3067,3024,2927cm-1(c-h),1760cm-1(o-c=o),1481cm-1(c-n),1125cm-1(-o-ch3),1082cm-1(c-s)。实施例6化合物oxe-se-q,其结构式如下:制备方法如下所述:(1)、将1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的邻苯二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流20小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中55℃下干燥,得到化合物(化合物6-1)。步骤(1)产物化合物6-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.20-7.0(12h,苯环)。(2)、将所制得的1摩尔的化合物6-1与2.2摩尔的苯硒酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中65℃烘8小时,得到化合物(化合物6-2)。步骤(2)产物化合物6-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.43-7.41(22h,苯环)。(3)、将所制得的2.4摩尔的无水三氯化铝和2摩尔乙酰氯用二氯甲烷溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔的化合物6-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,55分钟滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物6-3)。步骤(3)产物化合物6-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.43-7.41(20h,苯环),2.44-2.35(6h,-c=o-ch3)。(4)、将1摩尔的化合物6-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至115℃,开始反应12小时.反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中75℃烘24小时,得到化合物(化合物6-4)。步骤(4)产物化合物6-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.32-11.27(2h,-c=n-oh),8.24-7.26(20h,苯环),2.3-2.24(6h,-n=c-ch3)。(5)、将1摩尔的化合物6-4与1.3摩尔的乙酸酐在三氯甲烷溶液中回流18小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-se-q1hnmr(cdcl3,400mhz):8.43-7.41(20h,苯环),2.44-2.35(6h,-c=o-ch3),2.3-2.24(6h,-n=c-ch3)。ft-ir(kbr):3021,2924cm-1(c-h),1758cm-1(o-c=o),1480cm-1(c-n),781cm-1(c-se)。实施例7化合物oxe-o-q,其结构式如下:制备方法如下所述:(1)、将1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的邻苯二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流22小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中65℃下干燥,得到化合物(化合物7-1)。步骤(1)产物化合物7-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.20-7.0(12h,苯环)。(2)、将所制得的1摩尔的化合物7-1与2.2摩尔的苯酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中65℃烘8小时,得到化合物(化合物7-2)。步骤(2)产物化合物7-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.14-7.26(22h,苯环)。(3)、将2.4摩尔的无水三氯化铝和2摩尔对硝基苯甲酰氯用二氯甲烷溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔的化合物7-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,58分钟滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物7-3)。步骤(3)产物化合物7-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.14-7.13(28h,苯环)。(4)、将所制得的1摩尔的化合物7-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至118℃,开始反应12小时.反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中78℃烘24小时,得到化合物(化合物7-4)。步骤(4)产物化合物7-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.31-11.28(2h,-c=n-oh),8.14-7.10(20h,苯环)。(5)、将所制得的1摩尔的化合物7-4与1.3摩尔的七氟丁酸酐在三氯甲烷溶液中回流19小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-o-q1hnmr(cdcl3,400mhz):8.14-7.03(28h,苯环)。ft-ir(kbr):3021cm-1(c-h),1740cm-1(o-c=o),1548,870cm-1(ph-no2),1300-1132cm-1(cf2-cf3),1032cm-1(c-o-ph)。实施例8化合物oxe-o-p,结构式如下:制备方法如下所述:(1)、1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的1,2-乙二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流12小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中65℃下干燥,得到化合物(化合物8-1);步骤(1)产物化合物8-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.22-7.26(8h,苯环),4.01-3.96(4h,吡嗪环)。(2)、1摩尔所制得的化合物8-1与2.2摩尔的苯酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中65℃烘8小时,得到化合物(化合物8-2)。步骤(2)产物化合物8-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.15-7.29(18h,苯环),4.01-3.96(4h,吡嗪环)。(3)、2.4摩尔的无水三氯化锌和2摩尔环己基甲酰氯用二氯甲烷溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔的化合物8-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,半小时到一小时滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物8-3)。步骤(3)产物化合物8-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.04-7.06(16h,苯环),4.04-3.96(4h,吡嗪环),2.36-14(22h,环己环)。(4)、1摩尔所制得的化合物8-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至115℃,开始反应12小时.反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中75℃烘24小时,得到化合物(化合物8-4)。步骤(4)产物化合物8-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.31-11.28(2h,-c=n-oh),8.04-7.06(16h,苯环),4.04-3.96(4h,吡嗪环),2.36-14(22h,环己环)。(5)、1摩尔所制得的化合物8-4与1.3摩尔的4-溴-1,8-萘二甲酸酐在三氯甲烷溶液中回流12到24小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到oxe-o-p1hnmr(cdcl3,400mhz):8.04-7.06(16h,苯环),4.04-3.96(4h,吡嗪环),2.36-14(22h,环己环)。ft-ir(kbr):3064,2927cm-1(c-h),1760cm-1(o-c=o),1481cm-1(c-n),1454cm-1(c-h弯曲振动,环已烷),1022cm-1(c-o)。实施例9化合物oxe-n-q,其结构式如下:制备方法如下所述:(1)1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的邻苯二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流18小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中59℃下干燥,得到化合物(化合物9-1);步骤(1)产物化合物9-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.20-7.0(12h,苯环)。(2)、将1摩尔所制得的化合物9-1与2.2摩尔的二苯胺溶解在150毫升二甲基亚砜,开动搅拌,并通氮气保护,再加入2.5摩尔的氢化钠到三口圆底烧瓶中,升高温度至120℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中60℃烘8小时,得到化合物(化合物9-2)。步骤(2)产物化合物9-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.42-7.14(32h,苯环)。(3)、2.4摩尔的无水三氯化铝和2摩尔乙酰氯用二氯甲烷溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔所制得的化合物9-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,40分钟滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物9-3)。步骤(3)产物化合物9-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.42-7.14(32h,苯环),2.44-2.35(6h,-c=o-ch3)。(4)、将1摩尔所制得的化合物9-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至110℃,开始反应12小时。反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中70℃烘24小时,得到化合物(化合物9-4)。步骤(4)产物化合物9-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.31-11.28(4h,-c=n-oh),8.42-7.14(32h,苯环),2.44-2.35(6h,-c=o-ch3)。(5)、1摩尔所制得的化合物9-4与1.3摩尔的乙酸酐在三氯甲烷溶液中回流12小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-n-q1hnmr(cdcl3,400mhz):8.42-7.14(28h,苯环),2.44-2.35(12h,-c=o-ch3),2.3-2.24(12h,-n=c-ch3)。ft-ir(kbr):3024,2927cm-1(c-h),1760cm-1(o-c=o),1515,1481cm-1(c-n),1342cm-1(c-n)。实施例10化合物oxe-p-q,其结构式如下:制备方法如下所述:(1)、将1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的邻苯二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流12小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中65℃下干燥,得到化合物(化合物10-1);步骤(1)产物化合物10-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.20-7.0(12h,苯环)。(2)、1摩尔所制得的化合物10-1与2.2摩尔的二苯基膦溶液一起溶解在150毫升四氢呋喃中,通氮气保护,开动搅拌两小时后,再升温回流反应48小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中70℃烘8小时,得到化合物(化合物10-2)。步骤(2)产物化合物10-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.47-7.24(32h,苯环)。(3)、2.4摩尔的无水三氯化铝和2摩尔乙酰氯用二氯甲烷溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔所制得的化合物10-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,50分钟滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物10-3)。步骤(3)产物化合物10-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.47-7.24(32h,苯环),2.44-2.35(6h,-c=o-ch3)。(4)、将1摩尔所制得的化合物10-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至110℃,开始反应12小时.反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中70℃烘24小时,得到化合物(化合物10-4)。步骤(4)产物化合物10-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.31-11.28(4h,-c=n-oh),8.42-7.14(32h,苯环),2.44-2.35(6h,-c=o-ch3)。(5)、将1摩尔所制得的化合物10-4与1.3摩尔的乙酸酐在三氯甲烷溶液中回流16小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-p-q1hnmr(cdcl3,400mhz):8.47-7.24(28h,苯环),2.44-2.35(12h,-c=o-ch3),2.3-2.24(12h,-n=c-ch3)。ft-ir(kbr):3024,2927cm-1(c-h),1760cm-1(o-c=o),1515,1481cm-1(c-n),1245cm-1(c-p)。实施例11化合物oxe-s-np,其结构式如下:制备方法如下所述:(1)、1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的并四苯二胺溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流12小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中50℃下干燥,得到化合物(化合物11-1);步骤(1)产物化合物11-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.24-7.26(18h,苯环)。(2)、将1摩尔所制得的化合物11-1与2.2摩尔的苯硫酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中60℃烘8小时,得到化合物(化合物11-2)。步骤(2)产物化合物11-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.42-7.14(28h,苯环)。(3)、2.4摩尔的无水三氯化铝和2摩尔乙酰氯用二氯甲烷溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔所制得的化合物11-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,一小时滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物11-3)。步骤(3)产物化合物11-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.47-7.24(28h,苯环),2.44-2.35(6h,-c=o-ch3)。(4)、将1摩尔所制得的化合物11-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至115℃,开始反应12小时。反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中75℃烘24小时,得到化合物(化合物11-4)。步骤(4)产物化合物11-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.21-11.08(2h,-c=n-oh),8.47-7.24(28h,苯环),2.44-2.35(6h,-c=o-ch3)。(5)、将1摩尔所制得的化合物11-4与1.3摩尔的乙酸酐在三氯甲烷溶液中回流12小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-s-np1hnmr(cdcl3,400mhz):8.24-7.26(20h,苯环),2.44-2.35(3h,-c=o-ch3),2.3-2.24(3h,-n=c-ch3)。ft-ir(kbr):3024,2927cm-1(c-h),1760cm-1(o-c=o),1481cm-1(c-n),1082cm-1(c-s)。实施例12化合物oxe-s-ap,其结构式如下:制备方法如下所述:(1)、将1摩尔的4,4’-二氟二苯偶酰与1.2摩尔的1,2-二氨基蒽醌溶解在无水乙醇中,通入氮气保护,搅拌,冷凝回流12小时,冷却至室温后有结晶沉淀出来,过滤,置于真空干燥箱中65℃下干燥,得到化合物(化合物12-1);步骤(1)产物化合物12-1的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.14-7.26(14h,苯环)。(2)、将1摩尔所制得的化合物12-1与2.2摩尔的苯硫酚溶解在150毫升n,n-二甲基甲酰胺后,开动搅拌,并通氮气保护,再加入2.5摩尔的氢氧化钾到三口圆底烧瓶中,升高温度至140℃,反应24小时,取1500ml去离子水,加热至微沸,将反应液缓慢倒入沸水中,有大量沉淀产生,开动搅拌过夜,抽滤,得滤渣,乙醇重结晶后置于真空干燥箱中60℃烘8小时,得到化合物(化合物12-2)。步骤(2)产物化合物12-2的结构通过核磁共振氢谱谱图得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.20-7.26(24h,苯环)。(3)、将2.4摩尔的无水三氯化铝和2摩尔乙酰氯用二氯甲烷溶解在三口圆底烧瓶中,通入氮气保护,冰水浴,搅拌,再称量1摩尔所制得的化合物12-2,用30ml二氯甲烷溶解后转移到恒压漏斗中逐渐滴加到三口圆底烧瓶中,半小时滴加完毕,撤去冰水浴,常温下继续反应10小时,加入去离子水萃取,用无水硫酸镁干燥,抽滤得到澄清的滤液,70℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中50℃烘4小时,得到化合物(化合物12-3)。步骤(3)产物化合物12-3的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):8.24-7.26(22h,苯环),2.44-2.35(6h,-c=o-ch3)。(4)、将1摩尔所制得的化合物12-3、4摩尔的盐酸羟胺和5摩尔的乙酸钠用200毫升的n,n-二甲基甲酰胺溶解在三口圆底烧瓶中,开动搅拌,并通氮气,升高温度至115℃,开始反应12小时。反应物倒入1000毫升的去离子水中,有大量沉淀产生,过滤,滤渣水洗三遍后在真空干燥箱中77℃烘24小时,得到化合物(化合物12-4)。步骤(4)产物化合物12-4的结构通过核磁共振氢谱得到确认。其具体数据如下:1hnmr(cdcl3,400mhz):11.31-11.28(4h,-c=n-oh),8.24-7.26(24h,苯环),2.44-2.35(6h,-c=o-ch3)。(5)、将1摩尔所制得的化合物12-4与1.3摩尔的乙酸酐在三氯甲烷溶液中回流12小时,用5质量%的氢氧化钠溶液洗涤三遍,再用去离子水洗涤三遍,60℃下旋转蒸发除尽里面的溶剂,在真空干燥箱中60℃烘8小时,得到化合物oxe-s-ap1hnmr(cdcl3,400mhz):8.24-7.26(22h,苯环),2.44-2.35(6h,-c=o-ch3),2.3-2.24(6h,-n=c-ch3)。ft-ir(kbr):3024,2927cm-1(c-h),1760cm-1(o-c=o),1671cm-1(蒽醌上c=o)1481cm-1(c-n),1082cm-1(c-s)。应用实施例11.感光性组合物的配制:在常温避光条件下,将98.0质量份的乙氧基化双酚a二丙烯酸酯a-bpe-10的光聚合单体、1.0质量份的前述实施例1所制得的化合物oxe-s-q的光引发剂和1.0质量份的有机溶剂二氯甲烷搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物a-1。2.测试方法如下所述:首先将感光性组合物a-1旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-q来引发光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10发生光聚合反应,然后采用thermois10型傅里叶变换红外光谱仪,对光聚合过程中光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10中在1630~1640cm-1处碳碳双键的特征峰的强度变化进行原位跟踪监测,利用数据分析软件origin来计算光聚合反应前后碳碳双键特征峰的面积,再通过公式计算不同曝光时间下光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例1的光聚合单体的碳碳双键的转化率(%)为94,光聚合速率(s-1)为0.70。应用实施例21.感光性组合物的配制:在常温避光条件下,将98.0质量份的乙氧基化双酚a二丙烯酸酯a-bpe-10的光聚合单体、1.0质量份的前述实施例2中所制得的化合物oxe-s-tpp的光引发剂和1.0质量份的有机溶剂的二氯甲烷搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-2。2.测试方法如下所述:除了将感光性组合物a-2旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-tpp来引发光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例2的光聚合单体的碳碳双键的转化率(%)为91,光聚合速率(s-1)为0.69。应用实施例31.感光性组合物的配制:在常温避光条件下,将98.0质量份的乙氧基化双酚a二丙烯酸酯a-bpe-10的光聚合单体、1.0质量份的前述实施例3中的化合物oxe-s-pq的光引发剂和1.0质量份的有机溶剂的二氯甲烷搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-3。2.测试方法如下所述:除了将感光性组合物a-3旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-pq来引发光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例3的光聚合单体的碳碳双键的转化率(%)为95,光聚合速率(s-1)为0.82。应用实施例41.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的乙氧基化三羟甲基丙烷三丙烯酸酯的光聚合单体、1.0质量份的前述实施例4所制得的化合物oxe-s-p的光引发剂和1.0质量份的有机溶剂的丁酮搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-4。2.测试方法如下所述:除了将感光性组合物a-4旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-p来引发光聚合单体乙氧基化三羟甲基丙烷三丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例4的光聚合单体的碳碳双键的转化率(%)为55,光聚合速率(s-1)为0.21。应用实施例51.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的二甲基丙烯酸乙二醇酯的光聚合单体、1.0质量份的前述实施例5所制得的化合物oxe-s-dmq的光引发剂和1.0质量份的有机溶剂的甲苯搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-5。2.测试方法如下所述:除了将感光性组合物a-5旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-dmq来引发光聚合单体二甲基丙烯酸乙二醇酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例5的光聚合单体的碳碳双键的转化率(%)为95,光聚合速率(s-1)为0.72。应用实施例61.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的聚乙二醇二丙烯酸酯的光聚合单体、1.0质量份的前述实施例6所制得的化合物oxe-se-q的光引发剂和1.0质量份的有机溶剂的四氢呋喃搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-6。2.测试方法如下所述:除了将感光性组合物a-6旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-se-q来引发光聚合单体聚乙二醇二丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例6的光聚合单体的碳碳双键的转化率(%)为96,光聚合速率(s-1)为0.74。应用实施例71.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的聚丙二醇二丙烯酸酯的光聚合单体、1.0质量份的前述实施例7所制得的化合物oxe-o-q的光引发剂和1.0质量份的有机溶剂的二氯甲烷搅拌8小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-7。2.测试方法如下所述:除了将感光性组合物a-7旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-o-q来引发光聚合单体聚丙二醇二丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例7的光聚合单体的碳碳双键的转化率(%)为97,光聚合速率(s-1)为0.75。应用实施例81.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的甲基丙烯酸四氢呋喃酯的光聚合单体、1.0质量份的前述实施例8所制得的化合物oxe-o-p的光引发剂和1.0质量份的有机溶剂的三氯甲烷搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-8。2.测试方法如下所述:除了将感光性组合物a-8旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-o-p来引发光聚合单体甲基丙烯酸四氢呋喃酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例8的光聚合单体的碳碳双键的转化率(%)为80,光聚合速率(s-1)为0.65。应用实施例91.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的甲基丙烯酸甲酯的光聚合单体、1.0质量份的前述实施例9所制得的化合物oxe-n-q的光引发剂和1.0质量份的有机溶剂的丁酮搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-9。2.测试方法如下所述:除了将感光性组合物a-9旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-n-q来引发光聚合单体甲基丙烯酸甲酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例9的光聚合单体的碳碳双键的转化率(%)为85,光聚合速率(s-1)为0.70。应用实施例101.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的1,6-己二醇二丙烯酸酯的光聚合单体、1.0质量份的前述实施例10所制得的化合物oxe-p-q的光引发剂和1.0质量份的有机溶剂的丙酮搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-10。2.测试方法如下所述:除了将感光性组合物a-10旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-p-q来引发光聚合单体1,6-己二醇二丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例10的光聚合单体的碳碳双键的转化率(%)为98,光聚合速率(s-1)为0.80。应用实施例111.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的乙氧基化甘油三丙烯酸酯的光聚合单体、1.0质量份的前述的实施例11所制得的化合物oxe-s-np光引发剂和1.0质量份的有机溶剂的甲苯搅拌6小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-11。2.测试方法如下所述:除了将感光性组合物a-11旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-np来引发光聚合单体乙氧基化甘油三丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例11的光聚合单体的碳碳双键的转化率(%)为60,光聚合速率(s-1)为0.25。应用实施例121.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的季戊四醇三丙烯酸酯的光聚合单体、1.0质量份的前述的实施例12所制得的化合物oxe-s-ap的光引发剂和1.0质量份的有机溶剂的四氢呋喃在常温避光条件下搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-12。2.测试方法如下所述:除了将感光性组合物a-12旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-ap来引发光聚合单体季戊四醇三丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例12的光聚合单体的碳碳双键的转化率(%)为50,光聚合速率(s-1)为0.19。应用实施例131.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的4-羟丁基乙烯基醚的光聚合单体、1.0质量份的前述的实施例1所制得的化合物oxe-s-q的光引发剂和1.0质量份的有机溶剂的四氢呋喃在常温避光条件下搅拌5小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-13。2.测试方法如下所述:除了将感光性组合物a-13旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-q来引发光聚合单体4-羟丁基乙烯基醚发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例13的光聚合单体的碳碳双键的转化率(%)为80,光聚合速率(s-1)为0.65。应用实施例141.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的三乙烯基乙二醇二乙烯基醚的光聚合单体、1.0质量份的前述的实施例2所制得的化合物oxe-s-tpp的光引发剂和1.0质量份的有机溶剂的三氯甲烷在常温避光条件下搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-14。2.测试方法如下所述:除了将感光性组合物a-14旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-tpp来引发光聚合单体三乙烯基乙二醇二乙烯基醚发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例14的光聚合单体的碳碳双键的转化率(%)为70,光聚合速率(s-1)为0.55。应用实施例151.感光性组合物的配制方法如下:在常温避光条件下,将98.0质量份的丙烯酰胺的光聚合单体、1.0质量份的前述实施例3所制得的化合物oxe-s-pq的光引发剂和1.0质量份的有机溶剂的丙酮在常温避光条件下搅拌4小时直至完全溶解,然后暗室冷藏,制得感光性组合物a-15。2.测试方法如下所述:除了将感光性组合物a-15旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以本发明所述的光引发剂化合物oxe-s-pq来引发光聚合单体丙烯酰胺发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。应用实施例15的光聚合单体的碳碳双键的转化率(%)为80,光聚合速率(s-1)为0.65。对比例1以无吡嗪结构的多肟酯光引发剂4,4'-二(4-(1-(乙酰氧基亚氨基)乙基)苯基巯基)苯基甲酮oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的乙氧基化双酚a二丙烯酸酯a-bpe-10的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp的光引发剂和1.0质量份的有机溶剂二氯甲烷搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-1。2.测试方法如下所述:除了将感光性组合物b-1旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp的光引发剂来引发光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例1的光聚合单体的碳碳双键的转化率(%)为75,光聚合速率(s-1)为0.59。对比例2以不具有肟酯结构的吡嗪光引发剂2,3-二(4-(4-苯基)硫苯基)喹喔啉s-q和助引发剂mbo(供氢体)为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的乙氧基化双酚a二丙烯酸酯a-bpe-10的光聚合单体、1.0质量份的不具有肟酯结构的吡嗪光引发剂s-q和助引发剂mbo(供氢体)的光引发剂和1.0质量份的有机溶剂二氯甲烷搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-2。2.测试方法如下所述:除了将感光性组合物b-2旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以光引发剂s-q和mbo助引发剂来引发光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例2的光聚合单体的碳碳双键的转化率(%)为62,光聚合速率(s-1)为0.38。对比例3以不具有肟酯结构的吡嗪光引发剂2,3-二(4-(4-苯基)硫苯基)喹喔啉s-q为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的乙氧基化双酚a二丙烯酸酯a-bpe-10的光聚合单体、1.0质量份的不具有肟酯结构的吡嗪光引发剂s-q和1.0质量份的有机溶剂二氯甲烷搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-3。2.测试方法如下所述:除了将感光性组合物b-3旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以不具有肟酯结构的吡嗪光引发剂s-q来引发光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例3的光聚合单体的碳碳双键的转化率(%)为0,光聚合速率(s-1)为0。对比例4以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的乙氧基化三羟甲基丙烷三丙烯酸酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂丁酮搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-4。2.测试方法如下所述:除了将感光性组合物b-4旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体乙氧基化三羟甲基丙烷三丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例4的光聚合单体的碳碳双键的转化率(%)为33,光聚合速率(s-1)为0.12。对比例5以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果。1.感光性组合物的配制:在常温避光条件下,将98.0质量份的二甲基丙烯酸乙二醇酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂甲苯搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-5。2.测试方法如下所述:除了将感光性组合物b-5旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体二甲基丙烯酸乙二醇酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例5的光聚合单体的碳碳双键的转化率(%)为71,光聚合速率(s-1)为0.52。对比例6以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的聚乙二醇二丙烯酸酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂四氢呋喃搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-6。2.测试方法如下所述:除了将感光性组合物b-6旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体聚乙二醇二丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能好坏。对比例6的光聚合单体的碳碳双键的转化率(%)为73,光聚合速率(s-1)为0.57。对比例7以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较含吡嗪的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的聚丙二醇二丙烯酸酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂二氯甲烷搅拌8小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-7。2.测试方法如下所述:除了将感光性组合物b-7旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体聚丙二醇二丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例7的光聚合单体的碳碳双键的转化率(%)为73,光聚合速率(s-1)为0.58。对比例8以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果。1.感光性组合物的配制:在常温避光条件下,将98.0质量份的甲基丙烯酸四氢呋喃酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂的三氯甲烷搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-8。2.测试方法如下所述:除了将感光性组合物b-8旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体甲基丙烯酸四氢呋喃酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例8的光聚合单体的碳碳双键的转化率(%)为56,光聚合速率(s-1)为0.45。对比例9以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果。1.感光性组合物的配制:在常温避光条件下,将98.0质量份的甲基丙烯酸甲酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂的丁酮搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-9。2.测试方法如下所述:除了将感光性组合物b-9旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体甲基丙烯酸甲酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例9的光聚合单体的碳碳双键的转化率(%)为62,光聚合速率(s-1)为0.56。对比例10以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的1,6-己二醇二丙烯酸酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂的丙酮搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-10。2.测试方法如下所述:除了将感光性组合物b-10旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体1,6-己二醇二丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例10的光聚合单体的碳碳双键的转化率(%)为75,光聚合速率(s-1)为0.58。对比例11以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的乙氧基化甘油三丙烯酸酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂的甲苯搅拌6小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-11。2.测试方法如下所述:除了将感光性组合物b-11旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体乙氧基化甘油三丙烯酸酯发生光聚合反应以外,其他均与应用实施例相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例11的光聚合单体的碳碳双键的转化率(%)为39,光聚合速率(s-1)为0.15。对比例12以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的季戊四醇三丙烯酸酯的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂的四氢呋喃搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-12。2.测试方法如下所述:除了将感光性组合物b-12旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体季戊四醇三丙烯酸酯发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例12的光聚合单体的碳碳双键的转化率(%)为29,光聚合速率(s-1)为0.11。对比例13以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的4-羟丁基乙烯基醚的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂四氢呋喃搅拌5小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-13。2.测试方法如下所述:除了将感光性组合物b-13旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体4-羟丁基乙烯基醚发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例13的光聚合单体的碳碳双键的转化率(%)为60,光聚合速率(s-1)为0.48。对比例14以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果:1.感光性组合物的配制:在常温避光条件下,将98.0质量份的三乙烯基乙二醇二乙烯基醚的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂的三氯甲烷搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-14。2.测试方法如下所述:除了将感光性组合物b-14旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体三乙烯基乙二醇二乙烯基醚发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例14的光聚合单体的碳碳双键的转化率(%)为43,光聚合速率(s-1)为0.39。对比例15以无吡嗪结构的多肟酯光引发剂oxe-s-bp为对照例来比较本发明的含吡嗪结构的多肟酯光引发剂的效果。1.感光性组合物的配制:在常温避光条件下,将98.0质量份的丙烯酰胺的光聚合单体、1.0质量份的无吡嗪结构的多肟酯光引发剂oxe-s-bp和1.0质量份的有机溶剂的丙酮搅拌4小时直至将其完全溶解,然后暗室冷藏,制得感光性组合物b-15。2.测试方法如下所述:除了将感光性组合物b-15旋涂在透红外硅片上,以外接的sp-3紫外点光源系统作为紫外光光源,以无吡嗪结构的多肟酯光引发剂oxe-s-bp来引发光聚合单体丙烯酰胺发生光聚合反应以外,其他均与应用实施例1相同进行测定和计算,以获得光聚合单体的碳碳双键的转化率,绘制图表来评价光引发剂引发性能。对比例15的光聚合单体的碳碳双键的转化率(%)为55,光聚合速率(s-1)为0.44。各应用实施例和对比例的感光性组合物成分表:表1性能评价:表2光引发剂性能评价图8是在实施例1的oxe-s-q化合物光引发剂和对比例1~3的各种光引发剂下,光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10中的碳碳双键转化率随曝光时间的变化图。从图8和表2中可以看出:(1)在对比例3的情况下,在没有使用供氢体mbo助光引发剂,而只使用吡嗪类化合物s-q引发剂时,双键最终转化率和光聚合速率都为0,说明没有发生光聚合反应,无光引发的性能。(2)在对比例2的情况下,在吡嗪类化合物s-q引发剂与供氢体mbo组合以作为夺氢型光引发剂时,具有一定的光引发效果,双键最终转化率为62%。(3)在对比例1的情况下,无吡嗪结构的多肟酯光引发剂oxe-s-bp具有一定的光引发效果,光聚合速率为0.59s-1,双键最终转化率为75%。(4)在本发明的实施例1中,含吡嗪结构的多肟酯光引发剂oxe-s-q具有非常好的光引发效果,光聚合速率为0.70s-1,均高于对比例1~3,且双键最终转化率为94%,都远远高于对比例1~3的双键最终转化率。即,本发明的实施例1的光引发效果高出对比例1的多肟酯的光引发剂oxe-s-bp(75%)的25.3%,光引发速率增加了18.6%。(5)本发明的实施例2中,含吡嗪结构的多肟酯光引发剂oxe-s-tpp具有非常好的光引发效果,光聚合速率为0.69s-1,均高于对比例1~3的光聚合速率,且双键最终转化率为91%,也都远远高于对比例1~3的双键最终转化率。(6)本发明的实施例3中,含吡嗪结构的多肟酯光引发剂oxe-s-pq具有非常好的光引发效果,光聚合速率为0.82s-1,均高于对比例1~3的光聚合速率,且双键最终转化率为95%,都远远高于对比例1~3的双键最终转化率。图9是在实施例2的oxe-s-tpp化合物光引发剂和对比例1的光引发剂下,光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10中的碳碳双键转化率随曝光时间的变化图。从图9可知,实施例2和对比例1都使用了相同的光聚合单体a-bpe-10,但是根据光引发剂的结构的不同,所得到的双键转化率不同,即本发明的具有吡嗪结构的多肟酯的双键转化率要高于对比例1的不具有吡嗪结构的多肟酯的光引发剂oxe-s-bp的双键转化率,即:(1)在对比例1的情况下,无吡嗪结构的多肟酯的光引发剂oxe-s-bp具有一定的光引发效果,光聚合速率为0.59s-1,双键最终转化率为75%。(2)在本发明的实施例2中,含吡嗪结构的多肟酯的光引发剂oxe-s-tpp具有非常好的光引发效果,光聚合速率为0.69s-1,高于对比例1的光聚合速率,且双键最终转化率为91%,远远高于对比例1的双键最终转化率。本发明的光引发效果高出对比例1的多肟酯的光引发剂oxe-s-bp(75%)的21.3%,光引发速率增加了16.9%。图10是在实施例3的oxe-s-pq化合物光引发剂和对比例1的光引发剂下,光聚合单体乙氧基化双酚a二丙烯酸酯a-bpe-10中的碳碳双键转化率随曝光时间的变化。从图10可知,实施例3和对比例1都使用了相同的光聚合单体a-bpe-10,但是根据光引发剂的结构的不同,所得到的双键转化率不同,即本发明的具有吡嗪结构的多肟酯的双键转化率要高于对比例1的不具有吡嗪结构的多肟酯的光引发剂oxe-s-bp的双键转化率,即:(1)在对比例1的情况下,无吡嗪结构的多肟酯的光引发剂oxe-s-bp具有一定的光引发效果,光聚合速率为0.59s-1,双键最终转化率为75%。(2)在本发明的实施例3中,含吡嗪结构的多肟酯的光引发剂oxe-s-pq具有非常好的光引发效果,光聚合速率为0.72s-1,高于对比例1的光聚合速率,且双键最终转化率为95%,远远高于对比例1的双键最终转化率。本发明的实施例3的光引发效果高出对比例1的多肟酯的光引发剂oxe-s-bp(75%)的26.7%,光引发速率增加了38.9%。根据光聚合单体官能度的不同进行如下的对比:一、单官能度的光聚合单体:表3评价项目光引发剂双键最终转化率(%)光聚合速率(s-1)a-8实施例8的oxe-o-p800.65b-8对比例8的oxe-s-bp560.45a-9实施例9的oxe-n-q850.70b-9对比例9的oxe-s-bp620.56a-13实施例1的oxe-s-q800.65b-13对比例13的oxe-s-bp600.48a-15实施例3的oxe-s-pq800.65b-15对比例15的oxe-s-bp550.44通过上述数据分析可知:在使用相同的光聚合单体时,本发明的光引发剂获得了比现有技术的无吡嗪结构的多肟酯引发剂更高的光引发效果。二、双官能度的光聚合单体:表4通过上述数据分析可知:在使用相同的光聚合单体时,本发明的光引发剂获得了比现有技术的无吡嗪结构的多肟酯引发剂等更高的光引发效果。三、三官能度的光聚合单体:表5评价项目光引发剂双键最终转化率(%)光聚合速率(s-1)a-4实施例4的oxe-s-p550.21b-4对比例4的oxe-s-bp330.12a-11实施例11的oxe-s-np600.25b-11对比例11的oxe-s-bp390.15a-12实施例12的oxe-s-ap500.19b-12对比例12的oxe-s-bp290.11a-14实施例2的oxe-s-tpp700.55b-14对比例14的oxe-s-bp430.39通过上述数据分析可知:在使用相同的光聚合单体时,本发明的光引发剂获得了比现有技术的无吡嗪结构的多肟酯引发剂等更高的光引发效果。由前述的图表及其相关数据比较可知,因本发明的多肟酯是具有吡嗪结构的特定的多肟酯,所以将其用作光引发剂时,其具有比现有技术的光引发剂更加优异的光引发作用和效率,使含不饱和双键的光聚合单体具有非常优异的双键转化率和感光度,形成为非常好的感光性树脂组合物。产业上利用的可能性本发明涉及一种多肟酯及其光引发剂的用途、和含有该多肟酯的感光性树脂组合物及其用途。本发明的化合物及其组合物能够被广泛应用在涂料、光刻胶、油墨、电子封装材料、黏合剂等工业领域,且具有非常优异的技术效果。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1