一种促进胰岛细胞分泌胰岛素的太子参均一多糖及其用途的制作方法
本发明涉及一种促进胰岛细胞分泌胰岛素的太子参均一多糖及其用途。
背景技术:
糖尿病是以持续性高血糖为主要特征的代谢性疾病。随着人们生活水平的提高、生活方式的改变、工作压力的增大,糖尿病发病率呈现明显上升趋势,成为严重威胁人类健康的疾病之一。糖尿病分为二型,1型糖尿病(type1 diabetes mellitus,T1DM)属胰岛素依赖型,2型糖尿病(type2 diabetes mellitus,T2DM)是非胰岛素依赖型,T2DM占糖尿病患者总数的90%以上,以不同程度的胰岛素分泌不足和伴胰岛素抵抗(IR)为主要致病机制。中国健康教育中心公布的“中国慢性病监测及糖尿病专题调查”结果显示,我国约有成年糖尿病患者9700万人,已成为世界第一糖尿病大国,患病率为9.7%,高于世界平均水平6.4%。
糖尿病的药物治疗,基本上是以控制血糖为主要手段,目前降糖药包括双胍类、磺脲类、胰岛素三大类。近年来,一些新型口服降糖药也开始在临床使用,如α-糖苷酶抑制剂、胰岛素增敏剂、餐时血糖调节剂等。化学降糖药在控制血糖方面疗效是非常肯定的,但也呈现出局限性和不良反应,如低血糖、乳酸中毒、长期使用后继发性失效等。糖尿病,病程长且复杂,基本上不能根治,最终导致肾病等多脏器并发症;患者往往需要长期甚至是终生用药,其副作用对人体的损害因累积而难以克服。因此开发降糖作用温和、平稳、持久、毒副作用较小的药物具有重要的意义。研究者将目光逐渐转向中医药与天然药物。
糖尿病属于中医消渴的范畴。消渴之名,首见于《黄帝内经》;东汉著名医家张仲景在《金匮要略》中将消渴分为三种类型,渴而多饮者为上消,消谷善饥者为中消,口渴、小便如膏者为下消;按现行中药新药治疗糖尿病的临床研究,糖尿病分为:阴虚热盛型、湿热困脾型、气阴两虚型、血瘀水停型和血瘀脉络型5种证型。中医治疗糖尿病注重整体调理、辨证论治,在降血糖的同时又改善脂质代谢及能量代谢紊乱、改善微循环、保护胰岛细胞功能等;积累了许多有效的方药。特别对控制糖尿病性肾病、糖尿病足、视网膜病变等并发症的发生、发展有明显优势。
益气健脾、气阴双补是中医治疗消渴病重要途径之一。太子参,系石竹科太子参属多年生草本宿根性植物异叶假繁缕Pseudostellaria heterophylla (Miq.)Pax ex Pax et Hoffm.的干燥块根。具有益气生津、补肺健脾之功效,被广泛应用到各类降糖的处方中。苗彦霞等归纳总结出了不同时期对糖尿病的中医药治疗用药规律。倪青等运用方-证、药-证关系理论,运用无尺度网络等数据挖掘方法,从中药的功效、种类、单味药的使用频数及不同药的配伍关系,探讨其T2DM合并代谢综合征的中医证候特征及用药特点。中医使用以益气养阴药物为基础,功效随病程长短呈现由养阴清热,到益气养阴、清热,再到益气活血,温阳、化湿利水的变化趋势。太子参是最常用核心药物。
发明人所在的团队,十余年来长期致力于福建柘荣产太子参的研究。采用系统溶剂提取法,以T1DM和T2DM动物模型为活性导向,对太子参抗糖尿病活性部位进行系统筛选;发现50~200kDa分子量范围的多糖,能够改善T2DM胰岛素抵抗,具有显著降血糖作用。
技术实现要素:
本发明的目的在于提供一种促进胰岛细胞分泌胰岛素的太子参均一多糖及其用途。
一种促进胰岛细胞分泌胰岛素的太子参均一多糖,其化学结构式如下:
;
其结构特征为:太子参均一多糖为酸性多糖,分子量4.8×104 Da,比旋光度[α]D25+174.5º(c 0.485,H2O);分子式由C、H、O三种元素组成,C:H:O=1:2.1:1.4;由单糖半乳糖醛酸、鼠李糖、半乳糖和阿拉伯糖组成,半乳糖糖醛酸是多糖主要的单糖组成,α-1,4-连接半乳糖醛酸构成了多糖的主链。部分半乳糖醛酸C6-OH发生甲酯化,C2和C3上的羟基部分被乙酰化,主链上存在少量鼠李糖;1,5-连接的阿拉伯糖构成支链。
所述的太子参均一多糖的制备方法,具体步骤如下:
(一)太子参抗T2DM多糖有效部位提取:
(1)取太子参干品,粉碎成粗粉,过40目筛;用8倍量的90%乙醇连续回流提取3次,每次2小时,过滤,药渣加适量蒸馏水连续回流提取3次,每次2小时,过滤合并滤液,浓缩至适量,备用;
(2)将步骤(1)所得水提取物用Sevage法除去蛋白,药液:氯仿:正丁醇=25:5:1(v:v),振摇5min,静置分层,4000r/min离心5min,收集上清液;上清液用终浓度90%乙醇沉淀,静置24h,离心5min,分离沉淀获得粗多糖,冷冻干燥备用;
(3)采用40%的乙醇沉降分级,获得分子量在50~200 kDa范围的多糖,为抗T2DM多糖活性部位(PF40);
(二)分离纯化:
取太子参抗T2DM有效部位多糖PF40,溶于H2O中,使溶液浓度为25~50mg/mL;以DEAE-Cellulose 52型层析柱,上样后,依次用H2O、0.1mol/L~1.0mol/L NaCl溶液梯度洗脱,洗脱液中多糖含量用苯酚-硫酸法检测跟踪,以高效凝胶色谱法(HPGPC)测定定多糖分子量;依上述步骤反复分离纯化,获得所述均一多糖,冷冻干燥,备用。
本发明还保护了太子参均一多糖在制备抗糖尿病药物中的应用。
本发明的有益效果在于:本发明涉及的是从中药太子参抗2型糖尿病多糖有效部位中分离得到的1个结构新颖的均一多糖的制备及其化学结构,其能促进Ins-1细胞胰岛素分泌,为将来在开发抗糖尿病药物、保健品等领域中的应用提供依据。
附图说明
图1为太子参均一多糖的IR光谱图;
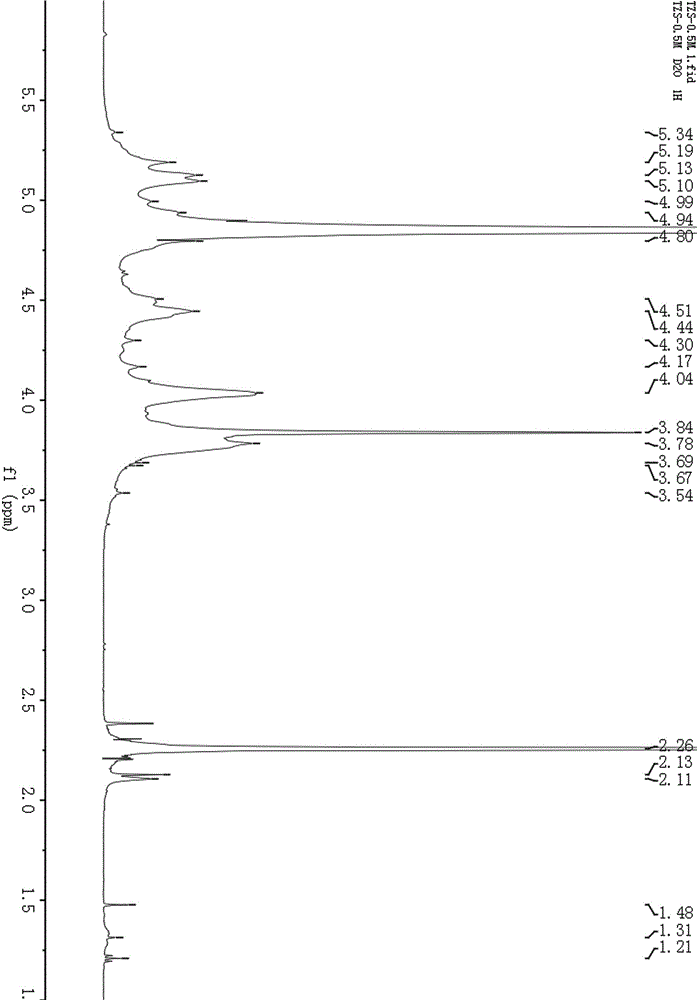
图2为太子参均一多糖的1H核磁共振光谱;
图3为太子参均一多糖的多糖核磁分析13C-NMR光谱;
图4为太子参均一多糖的H-H COSY谱;
图5为太子参均一多糖的HSQC谱;
图6为太子参均一多糖的HMBC谱。
具体实施方式
以下结合具体实施例对本发明做进一步说明,但本发明不仅仅限于这些实施例。
一、实施例
一种促进胰岛细胞分泌胰岛素的太子参均一多糖的制备方法,具体步骤如下:
(一)太子参抗T2DM多糖有效部位提取:
(1)取太子参干品,粉碎成粗粉,过40目筛;用8倍量的90%乙醇连续回流提取3次,每次2小时,过滤,药渣加适量蒸馏水连续回流提取3次,每次2小时,过滤合并滤液,浓缩至适量,备用;
(2)将步骤(1)所得水提取物用Sevage法除去蛋白,药液:氯仿:正丁醇=25:5:1(v:v),振摇5min,静置分层,4000r/min离心5min,收集上清液;上清液用终浓度90%乙醇沉淀,静置24h,离心5min,分离沉淀获得粗多糖,冷冻干燥备用;
(3)采用40%的乙醇沉降分级,获得分子量在50~200 kDa范围的多糖,为抗T2DM多糖活性部位(PF40);
(二)分离纯化:
取太子参抗T2DM有效部位多糖PF40,溶于H2O中,使溶液浓度为25~50mg/mL;以DEAE-Cellulose 52型层析柱,上样后,依次用H2O、0.1mol/L~1.0mol/L NaCl溶液梯度洗脱,洗脱液中多糖含量用苯酚-硫酸法检测跟踪,以高效凝胶色谱法(HPGPC)测定定多糖分子量;依上述步骤反复分离纯化,获得所述均一多糖,冷冻干燥,备用。
上述实施例制得的太子参均一多糖的结构式:
二、所述太子参均一多糖的化学结构表征
HPGPC测得分子量为4.8×104 Da,比旋光度[α]D25+174.5º(c 0.485,H2O);PMP柱前衍生化法测定单糖组成,均一多糖由半乳糖醛酸、鼠李糖、半乳糖和阿拉伯糖组成;元素分析多糖不含N和S元素,主要由C、H、O三种元素组成,C:H:O=1:2.1:1.4。
红外光谱(IR)显示了典型的多糖类吸收特征峰,在3426.69、2930.25、1418.51、1021.35cm-1的强吸收峰,分别来自于羟基-OH、C-H、环外C-O及糖环内C-O的伸缩震动;1745.20cm-1 出现羧基吸收峰,源于糖醛酸的羧基,结合单糖组成分析,推断所述均一多糖为酸性多糖,见图1。
根据1H核磁共振光谱(如图2所示)和多糖核磁分析13C-NMR光谱(如图3所示),δ176.50ppm和172.18ppm 两组信号来源于α-半乳糖醛酸的6位碳(C6),当部分半乳糖醛酸C6-OH发生甲酯化时,C6 的化学位移值向低场迁移;根据核磁规律 δ 54 pmm 附近有一组信号,δ 176.50ppm 信号应归属于C6发生甲酯的半乳糖醛酸,172.18ppm信号归属于未发生甲酯的半乳糖醛酸,而δ54.11ppm信号归于CH3O;半乳糖醛酸C2和C3上的羟基容易被乙酰化,所以δ21.38ppm信号归属于CH3CO。
根据信号强度及糖醛酸多糖NMR解析规律,δ100.29ppm异头碳信号信来源于α-1,4连接半乳糖醛酸的C1;δ108.11ppm 和62.38ppm信号分别归属于阿拉伯糖的C1和C5,而δ18.04ppm微弱的信号是来源于鼠李糖的C6。根据 H-H COSY谱(如图4所示)和HSQC谱(如图5所示)及α-1,4连接半乳糖醛酸相关文献,α-1,4连接半乳糖醛酸其他C和H信号归属如表1。HSQC中δ100.29ppm异头碳信号与δ5.10ppm异头H有相关信号,说明δ5.10ppm为α-1,4连接半乳糖醛酸的异头H1的信号。HMBC(如图6所示)有清晰的半乳糖醛酸C4和H1相关信号。因此,半乳糖糖醛酸是多糖主要的单糖组成,1,4-连接半乳糖醛酸构成了多糖的主链。
表1 均一多糖主链13C和1H谱化学位移
三、药理学实验(太子参均一多糖对Ins-1细胞分泌胰岛素的影响)
1. 细胞培养及操作流程
大鼠胰岛瘤细胞INS-1细胞,常规培养于含10%胎牛血清的RPMI 1640培养基中,另含100U/mL青霉素、100mg/mL链霉素、1 mM丙酮酸钠、2 mM L-谷氨酰胺和50µM β-巯基乙醇。细胞培养于37℃、5%CO2孵箱中培养。细胞隔天换液,四天传一代。
培养液更换:新接种的INS-1 24h后贴壁,贴壁前细胞透亮,体积较小、折光性强,贴壁后细胞的触角伸出呈现不规则的多角形。培养液使用前需37℃水浴中加热,一般隔天换液一次。
细胞传代:细胞贴别后生长很快,3-4天后细胞融合度可达80%以上,此时需要将细胞传代。舍弃原有的培养液,37℃ PBS冲洗2次;加入0.25% Tripsin-EDTA消化液1mL,置于37℃静止消化l-2min;加RPMI-1640培养液反复吹打,形成单细胞悬液,按1:2-1:3传代,于37℃、5%CO2培养箱中培养。
细胞冻存:选择生长状态良好,融合程度近80-90%的细胞。显微镜下观察,形态饱满、细胞轮廓清楚,高倍镜下见明显细胞核形态。加0.25% Tripsin-EDTA消化,吹打好的单细胞悬液于1000 rpm离心3-5min。细胞冻存于1.8ml的冻存管内。加10% DMSO和90% FBS配制的冻存液,拧紧管盖,在冻存管上做好标记,包括细胞代号及冻存日期。冰箱冷藏室(4℃ 30min)→低温冰箱(-20℃ 1h)→低温冰箱(-80℃ 过夜)→液氮。
细胞复苏:取出一支冻存的INS-1细胞,在37℃水浴中不断摇动细胞冻存管,冻存液需要在1min内完全融化。溶化后,管口用75%酒精棉球擦拭消毒,冻存液吸入离心管中,加10mL培养液吹打混匀,800rpm离心5min离心去掉DMSO。重悬细胞后,接种于培养瓶中,每瓶加培养液5 mL,吹打混匀,置于37℃ 5%CO2培养箱中。
2.试剂的配制
准确称取12mg太子参均一多糖溶于10mL培养液中,浓度为1200mg/L,用培养液稀释成所需浓度100、200、400、500、600 mg/L。
格列齐特溶液的配制:称取格列齐特32.34mg加入二甲基亚矾(DMSO)10mL溶解,即为1×10-2mol/L的格列齐特;取其100µL溶于9.9mL的RPMI 1640培养液中,即得1×10-4mol/L格列齐特溶液;取其10mL溶于9mL的RPMI 1640培养基中,即得1×10-5 mol/L格列齐特溶液。配好的溶液4℃冰箱避光储存。
无糖KRBH buffer配制:逐一称取各组分,依次溶解于800 ml无菌水中,磁力搅拌助溶,调整液体PH值为7.35,补足总体积至1L,过滤除菌,4℃冰箱分装保存。
3. 不同时间、不同浓度太子参均一多糖对Ins-1细胞胰岛素分泌的影响
取对数生长期的细胞,消化后计数,调整细胞密度至1×105个/mL,接种于24孔板。24 h后细胞贴壁,按如下分组给药干预。
1)空白组:给予RPMI-1640培养液。
2)PF40太子参多糖作用组:用RPMI-1640培养液配制,浓度为0、100、200、300、400、500、600 mg/L。
3)阳性药物格列齐特组:浓度为10-5 mol/L。
多糖与细胞共同孵育后,在12h、24h、48h、72h吸弃上清,以37℃预热的PBS洗3遍。加入预热的含3.3 mM 葡萄糖的KRBH缓冲液平衡1 h,弃上清。加入含16.7 mM 葡萄糖的KRBH缓冲液37℃培养2 h,取上清4℃ 1000rpm离心5 min,上清-80℃保存,用于放射性免疫分析法检测胰岛素,见表2。
4. 结果
表2 不同时间、不同浓度太子参均一多糖对Ins-1 细胞分泌胰岛素的影响
5. 结 论
INS-1细胞源于最初辐射诱导的肿瘤,后来通过在2-巯基乙醇(2-mercaptoethanol,2-ME)培养液中生成肿瘤物质。这些细胞表现出胰岛β细胞的许多重要特性,包括相对较高的胰岛素含量和对生理浓度葡萄糖刺激的反应能力,因此被广泛用于研究胰岛素分泌机制。
与对照组比较,经不同浓度太子参均一多糖处理12、24及48 h后均可显著提高Ins-1细胞的胰岛素分泌量,且具有剂量及时间依赖性。400mg/L太子参多糖,干预48 h后对Ins-1细胞的刺激作用最强,分泌的胰岛素最多。随培养时间的延长,胰岛素释放量降低,至72 h,Ins-1细胞胰岛素释放出现失代偿,但是促进Ins-1细胞分泌胰岛素的作用并不显著。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!