一种提取葡萄溃疡病菌菌丝RNA的方法与流程
本发明属于分子生物学领域,主要涉及一种应用改良的Trizol法高效提取真菌总RNA的方法。
背景技术:
葡萄(Vitis vinifera L.)一直是全世界最重要的水果之一,占全球水果种植面积的10%以上,不仅可以鲜食还可以酿酒、制干和制汁等加工。截至2013年底,我国葡萄栽培面积已达到71.46万hm2,葡萄产量1155万吨,自2010年后一直位居世界葡萄产量的首位。
葡萄病害是影响葡萄产量和品质的最重要因素之一,据统计,危害我国葡萄生产的病害有40余种,根据其危害部位,葡萄病害可以分为葡萄叶部病害、果实病害、枝蔓病害和根系病害。由葡萄座腔病菌(Botryosphaeriaceae)引起的葡萄溃疡病(Botryosphaeria dieback)是葡萄上存在的主要枝干病害之一,在世界上主要的葡萄栽培区域均有分布。葡萄座腔病菌是一类世界性分布的真菌,寄主范围十分广泛,不仅能侵染葡萄属寄主还能侵染栎属、苹果属、梨属等寄主。通常认为,这种病害主要通过自然孔口或修剪伤口进行侵染,造成葡萄果梗干枯、果实干缩或掉粒、枝干溃疡、树势减弱等症状,严重时会导致植株整株死亡。
目前近年来对葡萄溃疡病的研究主要集中在病原真菌类群的分子遗传多样性上,对葡萄溃疡病的发生机理还不明晰。传统的研究手段已不能满足目前葡萄溃疡病相关研究的需求。功能基因组学和分子生物学的快速发展,将极大地促进葡萄溃疡病菌与宿主葡萄的互作研究,而所有这些研究的基础是获得高质量的真菌菌丝RNA。提取的总RNA的质量对下游实验如反转录、实时定量PCR、RNA-Seq以及cDNA文库构建等的成败至关重要,如果总RNA中残留蛋白会使后续试验中的RNA极易降解;同时多糖类物质可以和RNA共沉淀,降低RNA的得率。
利用现有技术对葡萄溃疡病菌丝提取RNA,多糖等杂质非常多,提取质量不佳,不能直接用于下游实验,要经过大量的纯化的过程,耗费资金和精力。
技术实现要素:
本发明的目的是提供一种提取产物纯度高、产量高的提取葡萄溃疡病菌菌丝RNA的方法。
本发明所提供的一种提取葡萄溃疡病菌菌丝RNA的方法,包括下述步骤:
1)研钵和研棒预先用液氮冷却,取出液氮中保存的葡萄溃疡病菌菌丝,液氮中磨成粉末;
2)将粉末转入预冷的离心管中,以每90-110mg粉末加1mLTrizol抽提液的比例加入Trizol抽提液,摇动使其混匀,室温下放置10-15min;
3)加入抽提液体积的1/5的氯仿,剧烈震荡,室温放置3-5min,于4℃12000g,离心15-20min;
4)取上清液于一新的离心管中,加入上清液体积的1/2的异丙醇和上清液体积的1/2的沉淀缓冲液,颠倒混匀;室温放置10-12min,于4℃13000g离心10-15min;所述沉淀缓冲液为含1.2-1.5mol/L NaCl和0.5-0.8mol/L柠檬酸二钠盐·15H2O的溶液。
5)弃去上清液,加1mL体积百分浓度为70%-75%的乙醇溶液清洗RNA沉淀块,于4℃12000g离心5-10min;
6)弃去上清液,重复步骤5);
7)弃乙醇,开盖室温放置2-5min,或真空干燥,使乙醇完全挥发;获得的沉淀即RNA产物。
更进一步的,所述方法中,还包括葡萄溃疡病菌菌丝的制备,所述葡萄溃疡病菌菌丝的制备方法包括:
1)菌株准备:以无菌接种环或牙签挑取方式,将保存的纯化菌株接种于固体PDA培养基平板上,25-28℃培养10-12小时备用;
2)菌丝悬液准备:将步骤1)得到的菌丝用PDA培养基洗脱后,转移到液体PDA培养基中,25-28℃120rpm(转)摇培10-12小时;
3)菌丝收集:将步骤2)得到的菌丝用单层miracloth滤布(Merck)过滤,挤压去除培养液后,将菌丝置于锡纸中液氮速冻。
优选的,所述步骤4)中,所述沉淀缓冲液为含1.2mol/L NaCl和0.8mol/L柠檬酸二钠盐·15H2O的溶液;上清液、异丙醇和沉淀缓冲液的体积比为2:1:1。
本发明在常规Trizol法提取真菌菌丝RNA的基础上,改良了葡萄座腔病菌菌丝准备及收集方式,并改良了RNA乙醇沉淀的方式,提取的RNA具有纯度高、产量高的优点,可以直接用于下游的分子生物学实验。
附图说明
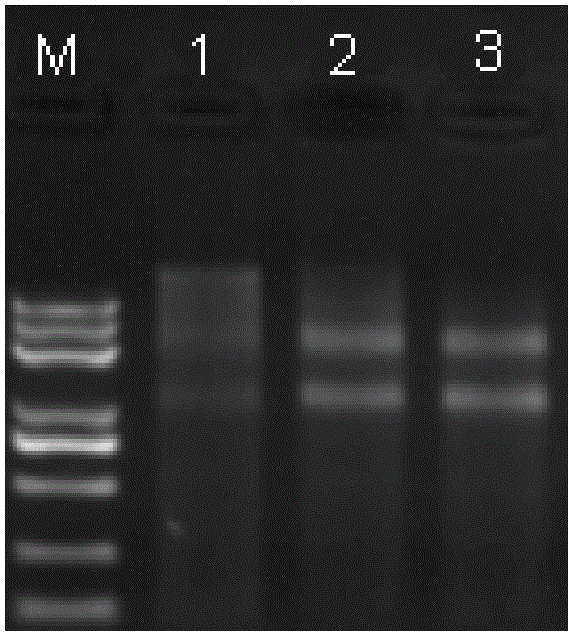
图1为本发明提供实施例1的方法(泳道2和3)及对比例(泳道1)提取的总RNA琼脂糖凝胶电泳照片。
图2为本发明提供实施例2的方法(图中A)及对比例(图中B)提取的总RNA琼脂糖凝胶电泳照片。
图3为本发明提供方法提取的总RNA经RT-PCR扩增的电泳照片。
具体实施方式
实施例1、提取葡萄溃疡病菌菌丝RNA的方法
耗材:金属钥匙、研钵和研棒用0.1N的NaOH浸泡1小时后,用蒸馏水洗净,160℃高温灭菌6小时;RNase-free灭菌吸头及1.5mL离心管(Axygen)。
试剂:Trizol(Qiagen);氯仿;异丙醇;75%乙醇(DEPC处理水配制);沉淀缓冲液(含1.2mol/L NaCl和0.8mol/L柠檬酸二钠盐·15H2O的溶液);RNase-free水;
菌株:野生型葡萄溃疡病菌菌株CSS-01s,由本实验室保存(刘爱芬,张鑫,张玮,等.葡萄溃疡病菌转化子致病力快速评价体系的建立[J].植物保护,2013,2:021)。
1)菌株准备:以无菌接种环或牙签挑取方式,将保存的纯化菌株接种于固体PDA培养基平板上,28℃过夜培养备用;
2)菌丝悬液准备:将步骤1)得到的菌丝用PDA培养基洗脱后,转移到100mL液体PDA培养基中,28℃120rpm摇培过夜;
3)菌丝收集:将步骤2)得到的菌丝用单层miracloth滤布(Merck)过滤,挤压去除培养液后,将菌丝置于锡纸中液氮速冻。
4)研钵和研棒预先用液氮冷却,取出液氮中保存的菌丝,液氮中磨成粉末;
5)将粉末转入预冷的1.5mL离心管中,已约100mg组织比1mL Trizol的比例加入Trizol抽提液(含苯酚、8-羟基喹啉、异硫氰酸胍、β-巯基乙醇,购自Qiagen公司),摇动使其混匀,室温下放置5min;
6)加入200μL的氯仿,剧烈震荡,室温放置2min,于4℃12000rpm离心15min;
7)分别取400μL上清液于3个新的离心管中,1号管加入300μL异丙醇和100μL沉淀缓冲液;2号管加入100μL异丙醇和300μL沉淀缓冲液;3号管加入200μL异丙醇和200μL沉淀缓冲液颠倒混匀;沉淀缓冲液为含1.2mol/L NaCl和0.8mol/L柠檬酸二钠盐·15H2O的溶液。
8)室温放置10min,于4℃13000rpm离心10min;弃去上清液,加1mL75%乙醇清洗RNA沉淀块,于4℃12000rpm离心5min;
9)弃去上清液,重复步骤8);
10)弃乙醇,开盖室温放置10min,或真空干燥,使乙醇完全挥发;
11)加50-100μL RNase-free水,用手指轻轻震荡,使沉淀彻底溶解,取2μL电泳检测及用紫外分光光度计测定RNA的OD260/OD280,并定量。
实施例1和对比例的结果比较:
上述实施例1和对比例的紫外分光光度计检测结果如表1所示。
表1紫外分光光度计检测结果
从表1中可以看出,采用改良方法(步骤7的编号2和3)提取的葡萄座腔病菌的RNA浓度高,OD260/OD280在2.00-2.04之间,OD260/OD230在1.95-1.95之间;而编号1得到的RNA浓度较低,质量较差。
图1是RNA跑胶结果。注:图1泳道1,2,3表示采用上述方法提取的葡萄座腔病菌RNA上样量均为500ng;M代表DNA Marker5000。
以上结果表明,在步骤7中以上清液:异丙醇:沉淀缓冲液=2:1:1的比例添加时,得到的RNA质量最好。
实施例2、
耗材:金属钥匙、研钵和研棒用0.1N的NaOH浸泡1小时后,用蒸馏水洗净,160℃高温灭菌6小时;RNase-free灭菌吸头及1.5mL离心管(Axygen)。
试剂:Trizol(Qiagen);氯仿;异丙醇;75%乙醇(DEPC处理水配制);沉淀缓冲液(含1.2mol/L NaCl和0.8mol/L柠檬酸二钠盐·15H2O的溶液);RNase-free水;
菌株:野生型葡萄溃疡病菌菌株CSS-01s,由本实验室保存(刘爱芬,张鑫,张玮,等.葡萄溃疡病菌转化子致病力快速评价体系的建立[J].植物保护,2013,2:021)。
1)菌株准备:以无菌接种环或牙签挑取方式,将保存的纯化菌株接种于固体PDA培养基平板上,28℃过夜培养备用;
2)菌丝悬液准备:将步骤1)得到的菌丝用PDA培养基洗脱后,转移到100mL液体PDA培养基中,28℃120rpm摇培过夜;
3)菌丝收集:将步骤2)得到的菌丝用单层miracloth滤布(Merck)过滤,挤压去除培养液后,将菌丝置于锡纸中液氮速冻。
4)研钵和研棒预先用液氮冷却,取出液氮中保存的菌丝,液氮中磨成粉末;
5)将粉末转入预冷的1.5mL离心管中,在离心管中加入100mg菌丝粉末和1mL Trizol抽提液,摇动使其混匀,室温下放置5min;Trizol抽提液:含苯酚、8-羟基喹啉、异硫氰酸胍、β-巯基乙醇,购自Qiagen公司。
6)在离心管中加入200μL的氯仿,剧烈震荡,室温放置2min,于4℃12000g离心15min;
7)取500μL上清液于一新的离心管中,加入250μL异丙醇和250μL沉淀缓冲液,颠倒混匀;室温放置10min,于4℃13000g离心10min;沉淀缓冲液:含1.2mol/L NaCl和0.8mol/L柠檬酸二钠盐·15H2O的溶液。
8)弃去上清液,加1mL 75%乙醇清洗RNA沉淀块,于4℃12000g离心5min;
9)弃去上清液,重复步骤8);
10)弃乙醇,开盖室温放置10min,或真空干燥,使乙醇完全挥发;
11)加50-100μL RNase-free水,用手指轻轻震荡,使沉淀彻底溶解,取2μL电泳检测及用紫外分光光度计测定RNA的OD260/OD280,并定量。
对比例、
耗材:金属钥匙、研钵和研棒用0.1N的NaOH浸泡1小时后,用蒸馏水洗净,160℃高温灭菌6小时;RNase-free灭菌吸头及1.5mL离心管(Axygen)。
试剂:Trizol(Qiagen);氯仿;异丙醇;75%乙醇(DEPC处理水配制);RNase-free水;
1)菌株准备:以无菌接种环或牙签挑取方式,将保存的纯化菌株接种于固体PDA培养基平板上,28℃过夜培养备用;
2)菌丝悬液准备:将步骤1)得到的菌丝用PDA培养基洗脱后,转移到100mL液体PDA培养基中,28℃120rpm摇培过夜;
3)菌丝收集:将步骤2)得到的菌丝用于4℃12000g离心5min,弃上清,将菌丝置于锡纸中液氮速冻。
4)研钵和研棒预先用液氮冷却,取出液氮中保存的菌丝,液氮中磨成粉末;
5)将粉末转入预冷的1.5mL离心管中,在离心管中加入100mg组织粉末和1mL Trizol抽提液(含苯酚、8-羟基喹啉、异硫氰酸胍、β-巯基乙醇,购自Qiagen公司),摇动使其混匀,室温下放置5min;
6)加入200μL的氯仿,剧烈震荡,室温放置2min,于4℃12000g离心15min;
7)取500μL上清液于一新的离心管中,加入500μL异丙醇,颠倒混匀;-20℃冰箱放置15min,于4℃12000g离心10min;
8)弃去上清液,加1mL 75%乙醇清洗RNA沉淀块,于4℃12000rpm离心5min;
9)弃去上清液,重复步骤8);
10)弃乙醇,开盖室温放置10min,或真空干燥,使乙醇完全挥发;
11)加50-100μL RNase-free水,用手指轻轻震荡,使沉淀彻底溶解,取2μL电泳检测及用紫外分光光度计测定RNA的OD260/OD280,并定量。
实施例2和对比例的结果比较:
上述实施例2和对比例的紫外分光光度计检测结果如表2所示。
表2紫外分光光度计检测结果
从表1中可以看出,采用改良方法(编号1和2)提取的葡萄座腔病菌的RNA浓度高,OD260/OD280在2.00-2.01之间,OD260/OD230在1.9-1.95之间;而对照方法(编号3和4)得到的RNA浓度较低,质量较差。以上结果表明改良方法提取出的RNA纯度高,无蛋白和多糖类等物质的污染。
从图2中可以看出,采用改良方法RNA的三条带型清晰明亮,且28S/18S亮度在2.0左右,且从两个样本中提取的RNA质量基本一致,表明此方法稳定、重复性较高,总量≥10μg能够满足转录组文库构建要求。注:图2中A中的泳道1,2表示采用改良方法提取的葡萄座腔病菌RNA,泳道图2中B中3,4表示采用对照方法提取的葡萄座腔病菌RNA上样量均为500ng;M代表DNA Marker5000。
将上述实施例2提取的葡萄座腔病菌RNA反转录得到cDNA。以cDNA为模板,用BrActinF(5′-TCTTCGCTCGAGAAGTCGTA-3′)和BrActinR(5′-ACAATGGAAGGTCCGCTCTC-3′)组成的引物对进行PCR扩增(靶序列约500bp),经28个扩增循环10μL点样所得条带亮度较为一致(图3),表明该方法提取的RNA可用于葡萄座腔病菌基因功能表达实验。注:泳道1,2表示PCR模板是采用本发明方法实施例2提取的葡萄座腔病菌RNA反转录得到的cDNA;泳道3表示PCR模板是葡萄座腔病菌基因组DNA;M代表DNA Marker2000。
以上说明对本发明而言只是说明性的,而非限制性的,本领域普通技术人员理解,在不脱离所附权利要求所限定的精神和范围的情况下,可做出许多修改、变化或等效,但都将落入本发明的保护范围内。
序列表
<110> 北京市农林科学院
<120> 一种提取葡萄溃疡病菌菌丝RNA的方法
<130> WHOI1160074
<160> 2
<210> 1
<211> 20
<212> DNA
<213>人工序列
<400> 1
tcttcgctcg agaagtcgta 20
<210> 2
<211> 1455
<212> DNA
<213>人工序列
<400> 1
acaatggaag gtccgctctc 20
- 还没有人留言评论。精彩留言会获得点赞!