一种用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法与流程
本发明涉及一种用于提高微生物次级代谢产物中大环内酯类化合物产量的发酵方法,具体涉及一种用于提高粘细菌中大环内脂类次级代谢产物(具有临床药用价值的埃博霉素和粘球菌素)产量的发酵方法,属于抗生素药物发酵技术领域。
背景技术:
粘细菌(Myxobacteria)是原核生物中一类具有复杂多细胞行为特征的革兰氏阴性细菌类群,能够代谢产生种类丰富、结构新颖、作用机制独特的次级代谢产物,包括聚酮类、大环类、芳香类、多烯类、肽类化合物等等。是继放线菌之后又一个重要的、有巨大应用潜力的药源微生物新类群,在新药研发中具有独特的优势(Gerth,et al.,2003;Weissman and Müller,2010)。其中,16元环的埃博霉素(Epothilone)(式1)和28元环的粘球菌素(Myxovirescin)(式2)是粘细菌来源的2例具有临床应用价值的大环内酯类化合物。
埃博霉素是由粘细菌中的纤维堆囊菌(Sorangium cellulosum)代谢产生的具有和紫杉醇相似的促微管聚合活性的16元大环内脂类化合物。与紫杉醇相比,埃博霉素具有分子结构简单,水溶性好;其噻唑环结构与微管作用更加紧密;抗肿瘤谱广泛;对多重耐药和耐紫杉醇的肿瘤细胞表现出更高的抗肿瘤活性(Kowalski et al.,1997;Goodin et al.,2004;Nettles et al.,2004)。不仅如此,由于埃博霉素可以由微生物代谢产生,通过发酵即可大规模制备,无须像紫杉醇那样通过砍伐杉树或者复杂的化学合成途径来获取,因此埃博霉素被公认为是紫杉醇的更新替代品。粘球菌素是黄色粘球菌(Myxococcus xanthus)中报道的一类28元大环内酯内酰胺类化合物。已有文献表明,粘球菌素对多数革兰氏阴性菌和少数革兰氏阳性菌均具有很好的杀菌活性,是一类抗菌谱较为宽广的快速杀菌剂(Gerth et al.,1982;Onishi et al.,1984;Content et al.,2003)。其在大肠杆菌中的作用靶点是lspA基因编码的二型信号肽酶,属于二型信号肽酶抑制剂,可以抑制细胞内含有LspA剪切位点的脂蛋白前体的加工(Xiao et al.,2012)。作为一类结构较为独特、作用靶点较为新颖的广谱抗生素,粘球菌素具有潜在的广阔应用前景。
然而,目前埃博霉素和粘球菌素在其各自本源菌株中的发酵产量较低。而且,埃博霉素的本源菌株——纤维堆囊菌的代时较长、遗传操作体系难以构建,不利于工业生产。科研工作者们尝试将埃博霉素在异源菌中(例如Streptomyces coelicolor、Escherichia coli、Myxococcus xanthus等)进行发酵,但每升发酵液中埃博霉素的产量仅为1~170μg(Tang et al.,2000;Julien and Shah,2002;Mutka et al.,2006)。这在一定程度上限制了其后续的研究与应用。随着全球市场对抗肿瘤和抗生素类药物需求的不但增长,迫切需要对埃博霉素和粘球菌素的发酵技术进行改进,以促进其产量的提高。
参考文献:
Content,S.,Dutton,C.J.,&Roberts,L.(2003).Myxovirescin analogues via macrocyclic ring–closing metathesis.Bioorganic&medicinal chemistry letters,13(3),321-325.
Gerth,K.,Irschik,H.,Reichenbach,H.,&Trowitzsch,W.(1982).The myxovirescins,a family of antibiotics from Myxococcus virescens(Myxobacterales).The Journal of antibiotics,35(11),1454-1459.
Gerth,K.,Pradella,S.,Perlova,O.,Beyer,S.,&Müller,R.(2003).Myxobacteria:proficient producers of novel natural products with various biological activities—past and future biotechnological aspects with the focus on the genus Sorangium.Journal of biotechnology,106(2),233-253.
Goodin,S.,Kane,M.P.,&Rubin,E.H.(2004).Epothilones:mechanism of action and biologic activity.Journal of clinical oncology,22(10),2015-2025.
Julien,B.,&Shah,S.(2002).Heterologous expression of epothilone biosynthetic genes in Myxococcus xanthus.Antimicrobial agents and chemotherapy,46(9),2772-2778.
Kowalski,R.J.,Giannakakou,P.,&Hamel,E.(1997).Activities of the microtubule-stabilizing agents epothilones A and B with purified tubulin and in cells resistant to paclitaxelJournal of Biological Chemistry,272(4),2534-2541.
Mutka,S.C.,Carney,J.R.,Liu,Y.,&Kennedy,J.(2006).Heterologous production of epothilone C and D in Escherichia coli.Biochemistry,45(4),1321-1330.
Nettles,J.H.,Li,H.,Cornett,B.,Krahn,J.M.,Snyder,J.P.,&Downing,K.H.(2004).The binding mode of epothilone A onα,β-tubulin by electron crystallography.Science,305(5685),866-869.
Onishi,N.,Izaki,K.,&Takahashi,H.(1984).A macrocyclic antibiotic M-230B produced by Myxococcus xanthus.Isolation and characterization.The Journal of antibiotics,37(1),13-19.
Tang,L.,Shah,S.,Chung,L.,Carney,J.,Katz,L.,Khosla,C.,&Julien,B.(2000).Cloning and heterologous expression of the epothilone gene cluster.Science,287(5453),640-642.
Xiao,Y.,Gerth,K.,Müller,R.,&Wall,D.(2012).Myxobacterium-produced antibiotic TA(myxovirescin)inhibits type II signal peptidase.Antimicrobial agents and chemotherapy,56(4),2014-2021.
Weissman,K.J.,&Müller,R.(2010).Myxobacterial secondary metabolites:bioactivities and modes-of-action.Natural product reports,27(9),1276-1295.
技术实现要素:
针对现有发酵水平的不足,本发明要解决的问题是提供一种用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法,实现快速提高埃博霉素和粘球菌素的发酵水平、降低生产成本的目的。
本发明所述用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法,其中所述大环内脂类次级代谢产物是指埃博霉素和粘球菌素,该方法是通过在粘细菌发酵中向液体发酵培养基中适时加入添加剂的方式来改善发酵培养基的组分,以实现埃博霉素和粘球菌素发酵水平的快速提高;
其特征在于:
所述粘细菌选能同时代谢产生埃博霉素和粘球菌素的黄色粘球菌(Myxococcus xanthus)ZE9菌株;
上述菌株是通过转座随机插入的方法将纤维堆囊菌中埃博霉素的合成基因簇整合到黄色粘球菌模式菌株的基因组上获得。
所述添加剂为菜籽油、橄榄油、花生油、玉米油、芥末油、亚麻油、豆油、葵花籽油、葡萄籽油、调和油、油酸甲酯、亚油酸甲酯中的任意一种或其任意重量比例的混合物;
所述向液体发酵培养基中加入添加剂的时间是发酵后36±4小时;
所述液体发酵培养基简称为CYE液体培养基,其组成及含量为酪蛋白胨10g,酵母浸提物5g,MgSO4·7H2O 1g,100mM MOPS溶液100ml,蒸馏水1000ml,pH值为7.5;菌株培养涉及的固体培养基简称为CYE固体培养基,其组成及含量为:酪蛋白胨10g,酵母浸提物5g,MgSO4·7H2O 1g,100mM MOPS溶液100ml,琼脂粉15g,蒸馏水1000ml,pH值为7.5。
所述粘细菌发酵中,发酵培养基中加入用于吸附发酵液中的大环内脂类次级代谢产物的灭菌吸附树脂。
上述用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法中:所述添加剂优选为菜籽油、花生油、油酸甲酯、亚油酸甲酯中的任意一种;所述向液体发酵培养基中加入添加剂的时间优选是发酵后36小时;所述粘细菌发酵中,用于吸附发酵液中的大环内脂类次级代谢产物的灭菌吸附树脂优选为大孔吸附型树脂XAD-16。
上述用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法中:能明显提升埃博霉素和粘球菌素发酵水平的添加剂用量优选是终浓度为5μl/ml的花生油或/和终浓度为10μl/ml的油酸甲酯。
上述用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法中:能明显提升埃博霉素发酵水平的添加剂用量优选是终浓度为5μl/ml的菜籽油或/和终浓度为10μl/ml的亚油酸甲酯。
上述用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法中:能明显提升埃埃博霉素A发酵水平的添加剂用量是终浓度为5μl/ml的的亚油酸甲酯;能明显提升埃埃博霉素B发酵水平的添加剂用量是终浓度为20μl/ml的的亚油酸甲酯。
上述用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法中:能明显提升粘球菌素发酵水平的添加剂用量优选是终浓度为15μl/ml的油酸甲酯。
具体的,本发明所述用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法实施步骤及检测方法如下:
(1)CYE培养基的配制方法为:酪蛋白胨10g,酵母浸提物5g,MgSO4·7H2O 1g,100mM MOPS溶液100ml,蒸馏水1000ml,使用KOH调节培养基的pH值至7.5。如需配制CYE固体培养基,需向其中加入琼脂粉15g。121℃灭菌30min后冷却至室温。
(2)取-80℃条件下保存的黄色粘球菌ZE9菌株菌液20μl,滴加到CYE固体培养基上进行划线操作,将划线后的固体平板倒置,在30℃条件下培养至有明显的黄色菌落出现。
(3)将接种铲在酒精灯的火焰上反复灼烧并冷却至室温,刮取黄色粘球菌ZE9菌株,接种到装有50ml CYE液体培养基的300ml锥形瓶中。
(4)在30℃,200rpm的条件下振荡培养24h,至对数中前期。
(5)用CYE液体培养基调整菌体浓度至1×108cfu/ml,按2%接种量将上述黄色粘球菌ZE9菌液转接到100ml CYE液体发酵培养基中,同时按照发酵体积2%的比例在每瓶发酵培养基中加入事先已经高温灭菌的大孔吸附树脂。在30℃,200rpm的条件下振荡培养进行发酵。
(6)培养36小时后,添加不同的脂肪酸类化合物作为添加剂。在30℃,200rpm的条件下振荡培养,继续发酵7天。以不添加油酸甲酯的CYE培养基作为对照组。每组实验设置4个平行。所述的添加剂为菜籽油、橄榄油、花生油、玉米油、芥末油、亚麻油、豆油、葵花籽油、葡萄籽油、调和油、油酸甲酯、亚油酸甲酯。
(7)用80目的筛网过滤发酵液,回收后的树脂用无菌去离子水冲洗,自然晾干后转入10ml离心管中并向其中加入3ml甲醇过夜浸提。
(8)将上述(7)中的浸提液用有机滤膜(直径13mm,孔径0.22μm)进行过滤,转移至HPLC样品瓶中进行检测。
(9)发酵液中埃博霉素和粘球菌素的含量采用HPLC进行检测,方法如下:
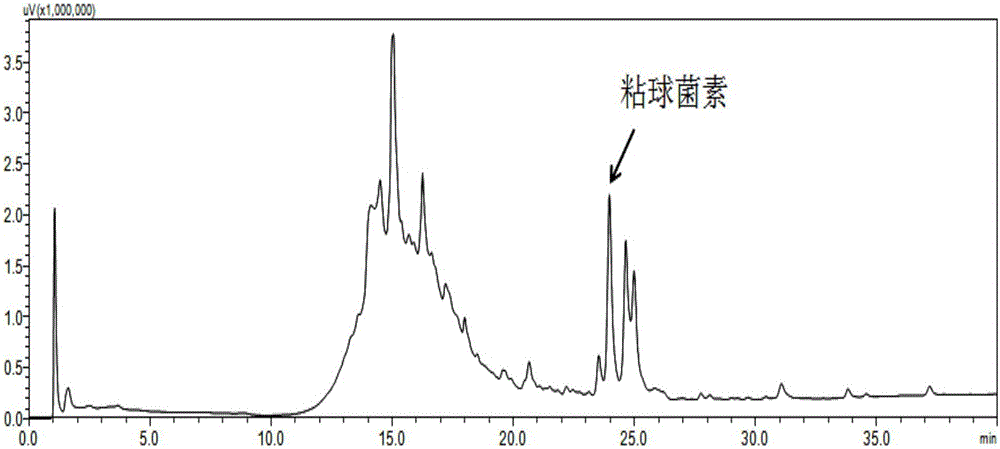
检测埃博霉素的色谱柱为Hypersil GOLD SAX C18column(5μm,4.6×250mm,Thermo Scientific),检测条件如下:进样量20μl;流动相流速:1.0mL/min;流动相A为水,流动相B为甲醇,采用60%B相等浓度梯度检测25min,检测波长为249nm。(图1)
检测粘球菌素的色谱柱为XTerra MS C18column(5μm,2.1×100mm,Waters,US),检测条件如下:进样量20μl;流动相流速:0.3mL/min;流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的乙腈溶液,采用多阶梯度洗脱的方法,即0-2min流动相B浓度为5%;2-10min流动相B浓度由5%上升到50%;10-27min流动相B浓度由50%上升到95%;27-40min流动相B的浓度维持在95%,检测波长为239nm。(图2)
(10)根据检测到信号峰的峰面积与埃博霉素和粘球菌素含量的关系曲线计算其各自的发酵产量,实验结果取平均值并计算误差。
结果如下表所示。
表1不同添加剂对埃博霉素发酵的影响
表2不同添加剂对粘球菌素发酵的影响
从上述结果可以看出,不同种类的添加剂均不同程度的提高了埃博霉素和粘球菌素的发酵水平。其中,终浓度为5μl/ml的花生油和终浓度为10μl/ml的油酸甲酯均能提升埃博霉素和粘球菌素的发酵水平;终浓度为5μl/ml的菜籽油和终浓度为10μl/ml的亚油酸甲酯对埃博霉素的发酵产量提升最为明显。该结果表明通过向液体发酵培养基中添加本发明所述的油脂类化合物,能够有效提高埃博霉素和粘球菌素的发酵产量。
本发明提供的一种用于提高粘细菌中大环内脂类次级代谢产物产量的发酵方法,实现了快速提高埃博霉素和粘球菌素的发酵水平、降低生产成本的目的。该方法简单、高效,无需增加额外的设备与人力,能够大幅度提高埃博霉素和粘球菌素的产量,极为适合工业化生产。
附图说明
图1.使用HPLC检测黄色粘球菌发酵液中的埃博霉素。
图2.使用HPLC检测黄色粘球菌发酵液中的粘球菌素。
具体实施方式
下面结合具体实例对本发明提供的发酵添加剂进行详细描述和说明。所描述的实例仅仅是本发明内容的一部分实例,不是全部实例。其内容是对本发明的解释而非用于限定本发明的保护范围。
实施例1:黄色粘球菌(Myxococcus xanthus)ZE9菌株的构建
(1)选用的黄色粘球菌和纤维堆囊菌均购买自德国菌种保藏中心(DSMZ,https://www.dsmz.de/home.html)。
(2)提取纤维堆囊菌的基因组,向10μg的基因组中加入0.5U的Sau3A I进行酶切,利用琼脂糖凝胶电泳进行分析确定30~50kb目的片段,将待回收片段放入V型槽电洗脱装置中,100V电洗脱1.5h,利用苯酚/氯仿/异戊醇抽提,乙醇沉淀洗脱除盐,回收纯化目的DNA样品备用。
(3)利用Xba l和BamH 1对粘粒DNA进行酶切处理,利用DNA连接酶将酶切处理后的粘粒DNA与(2)中的DNA片段进行连接,连接产物转染大肠杆菌构建粘粒文库,利用含有氨苄青霉素的筛选平板从中筛选阳性克隆。
(4)根据文献中已经报道的埃博霉素合成基因簇信息,选取其中3段不同区段设计巢式PCR引物对进行PCR测序验证。
(5)将测序验证正确的粘粒用DraI酶切,连同构建的含有埃博霉素基因簇上下游同源臂的质粒一起以电转化的方式转入大肠杆菌GB2005red(购买自Gene Bridges)中,同时进行两轮Red-ET重组,在添加10%蔗糖(或2-DOG)+Apra(或Tet)+LB固体平板上筛选双交换阳性克隆,提取质粒进行酶切分析和测序验证。
(6)刮取黄色粘球菌菌体转接于50ml CYE液体培养基中,30℃,200rpm培养18~24h;离心回收菌体,用6ml无菌水洗涤2次。
(7)加入2ml无菌水悬浮菌体细胞,向其中加入50~100ng测序验证正确的重组质粒,混匀,用Electroporator电转化仪以1250V电击;转至装有2ml CYE培养基的10ml离心管中,200rpm,30℃修复培养4~6h;取修复培养后的菌液平铺于含有筛选抗生素的CYE固体平板上培养6~7天。
(8)利用菌落PCR扩增特定的基因片段并测序分析,从中筛选阳性克隆,将筛选到的阳性克隆菌株命名为黄色粘球菌ZE9菌株。
实施例2:添加不同浓度的油酸甲酯对埃博霉素和粘球菌素发酵产量的影响
(1)取黄色粘球菌ZE9菌株在CYE固体平板上进行活化培养,在30℃条件下倒置培养至有明显的黄色菌落出现。
(2)用无菌的接种铲刮取活化后的ZE9菌株到50ml CYE液体培养基中,在30℃、200rpm的条件下振荡培养24h,至对数中前期。
(3)检测黄色粘球菌ZE9菌液在600nm条件下的吸光度值,调整菌体浓度至1×108cfu/ml,按2%接种量将上述黄色粘球菌ZE9菌液转接到100ml CYE液体发酵培养基中,在30℃,200rpm的条件下振荡培养进行发酵。
(4)培养36小时后,分别向液体发酵培养基中添加不同浓度的油酸甲酯(终浓度分别为0、5、10、15μl/ml),按照2%的比例在每瓶发酵培养基中加入事先已经高温灭菌的树脂。在30℃,200rpm的条件下振荡培养,继续发酵7天。每组实验设置4个平行。
(5)回收树脂并用无菌去离子水冲洗,洗去表面残留的菌体。树脂自然晾干后转入10ml离心管中,加入3ml甲醇过夜浸提。
(6)回收的浸提液用有机滤膜(直径13mm,孔径0.22μm)进行过滤,然后转移至HPLC样品瓶中进行检测。
实验结果如表3所示。
表3添加不同浓度的油酸甲酯对埃博霉素和粘球菌素发酵产量的影响。
从表3中的数据可以看出:在不添加油酸甲酯的情况下,发酵液中埃博霉素A、B和粘球菌素的产量分别是0.149±0.01mg/L、1.34±0.22mg/L和1.13±0.19mg/L。当向发酵培养基中添加了油酸甲酯后,埃博霉素和粘球菌素的发酵产量得到了不同程度的提高。当油酸甲酯的终浓度达到10μl/ml时,发酵液中的埃博霉素的发酵产量达到最高,埃博霉素A和B分别提高了67.72倍和4.37倍。但是,当油酸甲酯的终浓度进一步提高到15μl/ml时,埃博霉素的发酵产量有所下降,相比于终浓度为10μl/ml时下降了22.75%。相反,当油酸甲酯的终浓度达到15μl/ml时,发酵液中的粘球菌素的发酵产量可高达7.78±2.77mg/L,提高了5.88倍。
实施例3:油酸甲酯不同添加时间对埃博霉素发酵产量的影响
根据实施例2中的结果,选取向发酵培养基中添加油酸甲酯的终浓度为10μl/ml,按照实施例2中的方法,考察在发酵的不同阶段添加油酸甲酯对埃博霉素发酵产量的影响。
实验结果如表4所示。
表4油酸甲酯同一浓度不同添加时间对埃博霉素发酵产量的影响
从表4可以看出,在不同发酵时间里添加终浓度为10μl/ml油酸甲酯可以不同程度的提高埃博霉素的发酵产量。当发酵36小时的时候添加终浓度为10μl/ml的油酸甲酯,发酵液中埃博霉素的产量最高,过早或过晚添加都会降低埃博霉素的发酵产量。
实施例4:添加不同浓度的亚油酸甲酯对埃博霉素发酵产量的影响
按照实施例2中的方法,考察添加不同浓度的亚油酸甲酯对埃博霉素发酵产量的影响。
实验结果如表5所示。
表5添加不同浓度的亚油酸甲酯对埃博霉素发酵产量的影响。
从表5我们可以看出,亚油酸甲酯的添加能提高埃博霉素产量的提高,但是不同浓度的添加量对埃博霉素A和B的影响不同。当添加终浓度为5μl/ml的亚油酸甲酯时埃博霉素A的产量达到最高18.29±5.56mg/L。当添加终浓度为20μl/ml的亚油酸甲酯时埃博霉素B的产量达到最高18.35±7.61mg/L。
- 还没有人留言评论。精彩留言会获得点赞!