一种废糖蜜原料下固定化酵母细胞发酵生产乙醇的方法与流程
本发明属于生物发酵技术领域,具体涉及到一种用于不需进行任何预处理的糖蜜原料中发酵的新型固定化酵母细胞。
背景技术:
乙醇作为一种重要的工业原料,广泛用于食品、化工、医药、染料、国防等领域。同时,它还是一种可再生的清洁能源,作为燃料其燃烧值达到26900kJ/kg。
糖蜜作为制糖产业的副产物之一,因其主要成分为糖类,为提高废糖蜜生物质资源的利用,将糖蜜作为碳源用于发酵过程已得到了广泛的研究。除此之外,糖蜜中还含有较高的矿物质离子Na+、K+、Mg2+、Ca2+、Cl-等,还含有少量的蛋白质以及硝酸盐、酰胺类等物质,可以作为部分无机盐离子和氮源提供给细胞生长。但是,发现当乙醇的发酵生产以废糖蜜为碳源时,由于糖蜜中还含有其他有机酸,胶体,灰分等成分会严重影响游离细胞的活性,使得乙醇产率不高,为了达到更好的生产效果需要在糖蜜利用之前进行酸碱等过程的预处理,这就增加了生产的成本。
乙醇的发酵生产存在严重的产物抑制现象,当发酵液中乙醇浓度达到5%(v/v)时,就开始出现产物抑制现象,而固定化细胞因为其具有可连续发酵,细胞成活率高,降低产物抑制和消耗等优点,所以在发酵领域得到了广泛的应用。目前细胞固定化的方法大致分为共价法、交联法、吸附法和包埋法,其中凝胶包埋法是应用最广泛的细胞固定化方法,常用的载体有聚丙烯酰胺凝胶,海藻酸钠,海藻酸钙,琼脂糖,凝胶等。董江青等利用甘蔗块作为酵母固定化的材料,在以废糖蜜为碳源的发酵液中乙醇平均体积分数比游离酵母菌发酵提高了0.76%,但是其糖蜜经过了硫酸铵和浓硫酸的预处理。Anuchit Rattanapan等利用一种丝茧作为固定化酵母的材料,在糖蜜中发酵得到的乙醇产量是游离菌的11.5%,最高乙醇浓度达到了52.8g/L。专利CN 102787143 A介绍了一种利用海藻酸锰凝胶代替海藻酸钙来固定树干毕赤酵母的方法,其方法提高了细胞耐磷酸盐的能力,使用寿命增长,但其发酵过程用的是葡萄糖培养基。
技术实现要素:
本发明提供了一种新型的固定化酵母细胞的方法,可以用于不经任何预处理的糖蜜体系下乙醇的发酵生产,并且固定化细胞发酵的乙醇产量明显高于游离菌发酵的乙醇产量,菌体使用寿命增长,糖醇转化率相对提高。
本发明采用的技术方案为:
一种废糖蜜原料下固定化酵母细胞发酵生产乙醇的方法,包括如下步骤:
1)酵母细胞的固定化:将酵母细胞培养后稀释制成菌悬液,与固定化载体均匀混合制备得到固定化酵母细胞,所述固定化载体为海藻酸钠(SA)、聚乙二醇(PEG),与活性炭的混合液;
2)将步骤1)制备得到的固定化酵母细胞进行增值培养,然后移入发酵培养基中,以废糖蜜为碳源发酵生产乙醇。
所述菌悬液与固定化载体的体积比可以在1:(2.5~5)之间,优选为1:4。
所述固定化载体为2-6%(w/w)的海藻酸钠,4-8%(w/w)的聚乙二醇,0.5-2%(w/w)活性炭的混合液。进一步优选固定化载体为3-5%(w/w)的海藻酸钠,5-7%(w/w)的聚乙二醇,0.5-1.5%(w/w)活性炭的混合液,溶剂为水。
更进一步地,优选为聚乙二醇含量为6%(w/w),海藻酸钠含量为4%(w/w),活性炭含量为1%(w/w)。
所述菌悬液中菌体浓度可以为5×108-7×108个/mL。
步骤2)所述增值培养的培养基为:糖蜜(以糖蜜中所含葡萄糖的量来计算,相当于50g/L葡萄糖含量的糖蜜),CaCl2 0.058-0.062g/L,(NH4)2SO4 1.98-2.02g/L,(NH4)2HPO40.98-1.02g/L,MgSO4 0.098-0.102g/L,酵母粉0.5-1.5%,pH 4.5-5.0。
步骤2)所述发酵培养基为:糖蜜(以糖蜜中所含葡萄糖的量来计算,相当于葡萄糖含量为180-220g/L的糖蜜量),CaCl2 0.098-0.102g/L,KCl 0.098-0.102g/L,(NH4)2SO49.98-10.02g/L,(NH4)2HPO44.98-5.02g/L,MgSO4 0.098-0.102g/L,酵母粉0.1-1%,PH 4.5-5.0。
步骤2)中增值培养在28-32℃,180-220r/min条件下增值培养18-24小时。
步骤2)中发酵温度为28-32℃,转速70-100rpm,发酵时间为40-80h。
将固定化好的酵母细胞用无菌水洗涤3~4次后,进行增值培养,然后转发酵培养基。发酵的容器为一升的发酵罐,发酵液体积与增值固定化菌的体积比可以为6:1-8:1之间。
所述的酵母细胞的固定化方法具体为:将试管斜面上的菌株接种到种子培养基中,在30℃,200r/min条件下培养20小时,6000转离心1min收集菌体,用无菌生理盐水洗涤菌体3-5次,用无菌水将菌体稀释大约5倍制成(5~7)×108个/mL的菌悬液,然后与无菌的复合固定化载体均匀混合,菌悬液与固定化载体的体积比为1:4,室温下用注射器成滴注入到无菌的5%(w/w)的CaCl2溶液中,边滴边搅拌,滴完后20±2℃下水浴搅拌2h,放置4℃冰箱平衡12h。将平衡过的菌体用无菌水洗涤2-3次,置于增值培养基中,30℃,200r/min条件下增值培养20小时。
所述的复合固定化载体优选为4%(w/w)的海藻酸钠(SA),6%(w/w)的聚乙二醇(PEG),1%(w/w)活性炭的混合液。在以原糖蜜为碳源的发酵液体系中SA/PEG/活性炭复合载体固定化的细胞在发酵90小时时未发现有载体破损,在发酵58小时时乙醇浓度可以达到68g/L。
载体损失率是以体积比来计算的,以未出现任何裂痕的固定化细胞的积相当于水的体积来计算。
本发明中所述的糖蜜可以是甜菜糖蜜,甘蔗糖蜜,玉米糖蜜等,在发酵时只需对该糖蜜进行稀释处理,以降低其黏度,便于量取。
本发明中所述的酵母细胞可以为酿酒酵母,毕赤酵母等产酒型酵母。
本发明利用的固定化载体和固定化方法使酿酒酵母细胞在糖蜜不经任何处理的情况下提高了糖蜜乙醇发酵的乙醇抑制浓度,使得乙醇浓度达7%(v/v)时才开始出现抑制现象,发酵液中最高乙醇浓度可以达到68g/L,而Anuchit Rattanapan报道的用甘蔗渣固定化的酵母细胞发酵的乙醇最高浓度为52.8g/L,并且其糖蜜原料经过酸碱预处理过。对于未经任何预处理的糖蜜乙醇发酵至今还未见报道。该固定化载体和固定化方法不但提高了乙醇的产量,还实现了废弃生物质资源糖蜜的低成本利用,对固定化细胞用于其他产品的糖蜜发酵生产具有借鉴意义。
有益效果:本发明采用海藻酸钠(SA)/聚乙二醇(PEG)/活性炭复合载体固定化酵母细胞,使其更适合在未经任何预处理的糖蜜体系下进行发酵,并提高了发酵液中乙醇的浓度,与普通的海藻酸钠固定化方法相比提高了乙醇产量,降低了载体损失率,在发酵58h乙醇浓度最高可以达到68g/L,在分批发酵90h未出现载体破损,在连续发酵近400h时,其产乙醇能力未出现下降。固定化细胞操作简单,成本低廉,并为糖蜜体系下的固定化细胞发酵提供了很好的借鉴方法。
附图说明
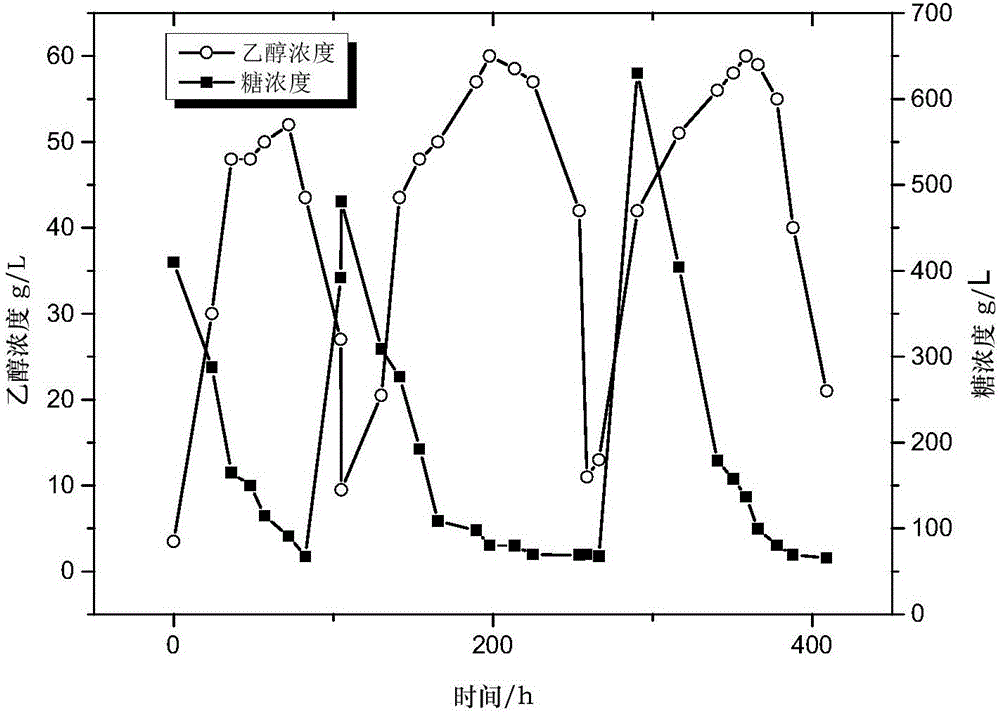
图1:游离菌细胞与固定化细胞糖蜜乙醇发酵情况;
图2:固定化载体在糖蜜乙醇发酵体系下的重复使用性;
图3:固定化载体在糖蜜乙醇发酵体系下的菌体浓度。
具体实施方式
下面结合实施例对本发明做进一步说明,本发明所涉及的主题保护范围并非仅限于这些实施例。
实施例中酿酒酵母(Saccharomyces cerevisiae)编号S.NJL-2001是从糖蜜乙醇发酵液中筛选得到的。保藏于国家微生物典型保藏中心保藏编号为CCTCC AY 2016001。
实施例中用的糖蜜为甘蔗糖蜜购于广西南宁。该糖蜜的含水量为23.52%,总糖43.5%(其中葡萄糖3.69%,果糖8.91%,蔗糖30.9%),灰分7.21%,总氮1.34%,胶体15.92%,其他8.51%,所述百分比为质量百分比。
实施例1酵母细胞的固定化
种子培养基3瓶(250mL锥形瓶,装液量120mL):糖蜜50g/L(以糖蜜中所含葡萄糖的量来计算),CaCl2 0.022g,(NH4)2SO4 0.72g,(NH4)2HPO4 0.36g,MgSO4 0.036g,酵母粉1.8g,H2O270mL,糖蜜需单独灭菌后再与其他已灭菌的培养基成分混合。
复合固定化载体的制备:6%(w/w)PEG和4%(w/w)SA和1%(w/w)活性炭的混合液300mL(300mL混合液中18克的PEG,12g的SA,3g的活性炭);5%(w/w)的CaCl2溶液300mL,分别于121℃下,灭菌15min。
将试管斜面上的菌株接种到种子培养基中,在30℃,200r/min条件下培养20小时,6000转离心1min收集菌体,用无菌生理盐水洗涤菌体3-5次,用无菌水将菌体稀释5倍制成7×108个/mL的菌悬液,然后与灭过菌的复合固定化载体均匀混合,菌悬液与固定化载体的体积比为1:4,室温下用注射器成滴注入到无菌的5%(w/w)的CaCl2溶液中,边滴边搅拌,滴完后20±2℃下水浴搅拌2h,然后放置4℃冰箱平衡12h,得到直径大约2-3毫米的黑色球状固定化酵母细胞颗粒。
实施例2复合固定化载体的优化实验
为了找出最佳的固定化条件,通过三因素三水平的正交试验对固定化材料海藻酸钠(SA)、聚乙二醇(PEG)、活性炭的浓度进行了优化,并假定各因素之间没有相互作用。
实验按照实施例1,对酵母细胞进行固定化后于30℃下200rpm的摇床进行增殖培养,按照固定化细胞体积与发酵液体积为1:7的比例进行糖蜜乙醇发酵实验,其中发酵液体积750ml,温度30℃,转速80rpm,氨水调节PH5.0,通气,记录发酵液中可以达到的最高乙醇浓度。
表1:因素水平表
表2:各因素水平实验结果及分析
经过三因素三水平的优化实验发现,当实验组合为A2B2C3,即SA含量为4%(w/w),活性炭含量为1%(w/w),PEG含量为6%(w/w)进行固定化酵母细胞时可以得到最高的乙醇浓度为68g/L,并且实验结果发现海藻酸钠的浓度对固定化细胞糖蜜发酵生产乙醇的影响最大,活性炭的浓度影响最小。
实施例3游离菌发酵与不同固定化载体发酵的对照实验
实验按照实施例1的方法将酵母细胞固定化后,同时于30℃下200rpm的摇床进行增值培养,并以游离菌的种子培养为对照实验,增值培养20h后以固定化细胞体积与发酵液体积比为1:7的比例转发酵培养基,游离菌以相同的菌量接种到发酵培养基中。其中发酵液体积750ml,温度30℃,转速80rpm,氨水调节PH5.0,通气,且每隔一定时间取样,测量乙醇的生产情况和糖的消耗情况,这里的糖是以总的还原糖计的。实验结果如图1和表3。
表3游离细胞与固定化细胞糖蜜乙醇发酵
与游离细胞糖蜜乙醇发酵相比,普通的固定化细胞方法海藻酸钠固定化细胞降低了发酵液中乙醇的抑制浓度,使得乙醇产量提高了66.7%,糖醇转化率提高了47%。但是受糖蜜复杂成分的影响,海藻酸钠固定化细胞在发酵大约90小时时大约有17%的载体出现了不同程度的裂痕。但是,当利用海藻酸钠/聚乙二醇/活性炭复合固定化载体进行糖蜜乙醇发酵时,与普通的海藻酸钠固定化细胞相比乙醇的产量不但提高了16%,糖醇转化率也提高了近80%。关键是,在发酵相同时间下,海藻酸钠/聚乙二醇/活性炭复合固定化载体并没出现破损情况,这对糖蜜体系下的发酵是非常有利的。
实施例4SA/PEG/活性炭复合固定化载体固定化细胞糖蜜体系发酵与模拟糖蜜体系发酵的对比。
实验按照实施例1的方法将酵母细胞固定化后,同时于30℃下200rpm的摇床进行增值培养,并以游离菌的种子培养为对照实验,增值培养20h后以固定化细胞体积与发酵液体积比为1:7的比例分别接种到糖蜜体系的发酵系统和模拟糖蜜体系的发酵系统,这里的模拟糖蜜体系是根据糖蜜中所含蔗糖,葡萄糖,果糖的比例来配置的。发酵液体积为750ml,发酵温度30℃,转速80rpm,PH=5.0氨水调节,通气,实验结果发现,在发酵大约108小时结束时,糖蜜体系下发酵的固定化载体几乎没有破裂,而模拟糖蜜体系下的固定化载体有的破损,有的出现了裂痕,载体损失率达30%以上,这是因为未经任何前期处理糖蜜中含有Ca2+,Mg2+等有利于固定化载体的固化,而活性炭的加入有利于这些盐离子被吸附在固定化载体表面,从而增强了固定化细胞的强度,除此之外,活性炭本身就可以增加载体的机械强度;另一方面,聚乙二醇具有润滑的作用从而减少了在搅拌过程中载体与载体之间以及载体与罐体之间的摩擦力,进一步降低了固定化载体的损失率。
实施例5糖蜜体系下载体的重复性实验
实验按照实施例1的方法将酵母细胞固定化后,同时于30℃下200rpm的摇床进行增值培养,并以游离菌的种子培养为对照实验,增值培养20h后以固定化细胞体积与发酵液体积比为1:7的比例转发酵培养基。其中发酵液体积750ml,温度30℃,转速80rpm,氨水调节PH5.0,通气。当乙醇的浓度出现明显的降低时,更换新的发酵液,进行第二次发酵。实验一共进行了三次发酵,发酵总时长约为390h,每隔一定时间取样测量其乙醇的量和还原糖的浓度,并计算最终发酵结束时载体的损失率,实验的乙醇生产曲线图和还原糖的消耗曲线如图2和图3所示。
从图中可以看出,在发酵时间达到大约300h固定化载体开始出现严重破损,由发酵罐中菌体的OD曲线看出,此时发酵罐中游离菌的浓度明显增大,这是由于载体破损使大量菌体游离出来导致的。在发酵达到390h,结束发酵时,发现固定化载体的损失率约为30%,由发酵罐中乙醇的浓度曲线知道菌体产乙醇的能力一直都保持在较高的水平,糖耗也保持在一个较稳定的状态。
- 还没有人留言评论。精彩留言会获得点赞!