增强植物抗逆性的ABA类似物的制作方法
本发明涉及植物学领域,具体地,涉及增强植物抗逆性的ABA类似物及其制法和用途。
背景技术:
脱落酸(Abscisic Acid,ABA)是平衡植物内源激素和有关生长活性物质代谢的关键因子,具有促进植物平衡吸收水、肥和协调体内代谢的能力,可有效调控植物的根/冠和营养生长与生殖生长,对提高农作物的品质、产量具有重要作用。通过施用ABA,在提高农产品品质等许多方面有着重要的生理活性作用和应用价值。此外,外源ABA能引起叶片气孔的迅速关闭,抑制蒸腾作用,可用于花的保鲜,或在作物幼苗移植栽培的运输过程中防止萎蔫。ABA还能控制花芽分化,调节花期,在花卉园艺上有很大的应用价值。
ABA可以改善作物在低温、干旱、春寒、盐渍等不良生长环境中的生长。因此,ABA具有广泛应用,可用于草坪、农田、园林,尤其是可用于西部地区等缺水地区,对于发展中国农业产业具有重大意义。
然而,天然活性的(+)-ABA不稳定且人工合成难度较大,生产成本很高。因此,ABA一直未被广泛应用于农业生产,各国科学家都在开发天然ABA的替代物。
目前虽然已经开发了一些ABA的替代物,然而这些替代物的活性尚不能令人满意,农业生产上的应用价值低。此外,一些替代物的环境友好性较差。
因此,本领域迫切需要开发环境友好的且可有效提高植物抗逆性的化合物。
技术实现要素:
本发明的目的是提供一种环境友好的且可有效提高植物抗逆性的化合物及其制法和用途。
本发明的第一方面提供了一种式I化合物、或其盐、或其光学异构体、或其外消旋体、或其溶剂化物、或其前体,
式中,
R1为H、卤素、C1-C3烷基、或C1-C3卤代烷基;
R2为H、卤素、C1-C3烷基、或C1-C3卤代烷基;
R3为H、卤素、C1-C3烷基、或C1-C3卤代烷基;
R4为H、卤素、C1-C3烷基、或C1-C3卤代烷基;
R5为卤素、C1-C3烷基、C1-C3卤代烷基或SF5;
R6为C1-C7烷基、C2-C7链烯基、C2-C7链炔基、C3-C7环烷基、或-R8-O-R10,其中,R8为C1-C2亚烷基而R10为H、C1-C3烷基;
X为CR9、NR7、O、或S,其中R9选自下组:H、卤素、C1-C3烷基、C2-C3链烯基、C2-C3链炔基、C1-C3卤代烷基、或其组合;R7为无,或选自下组:H、卤素、C1-C3烷基、C2-C3链烯基、C2-C3链炔基、C1-C3卤代烷基、或其组合;
表示单键或双键;
附加条件是,当X为CR9且R9为H时,为双键。
在另一优选例中,当X为CR9时,R1、R2、R3、R4不全部为H。
在另一优选例中,当X为CR9时,R1、R2、R3、R4中有1-4个为卤素。
在另一优选例中,当R9选自下组:H、卤素、C1-C3烷基、C2-C3链烯基、C2-C3链炔基、C1-C3卤代烷基、或其组合时,为双键。
在另一优选例中,当R7为无时,为双键。
在另一优选例中,当R7选自下组:H、卤素、C1-C3烷基、C2-C3链烯基、C2-C3链炔基、C1-C3卤代烷基、或其组合时,为单键。
在另一优选例中,所述的化合物具有式Ia结构:
式中,R1-R6、R9的定义如上所述。
在另一优选例中,所述的化合物具有式Ib结构:
式中,R1-R7、的定义如上所述。
在另一优选例中,所述的化合物具有式Ic结构:
式中,R1-R6的定义如上所述。
在另一优选例中,所述的化合物具有式Id结构:
式中,R1-R6的定义如上所述。
在另一优选例中,R1、R2、R3、R4全为H。
在另一优选例中,R1、R2、R3、R4中有1、2、3或4个为卤素。
在另一优选例中,所述的卤素包括F、Cl、Br或I。
在另一优选例中,所述的卤素为F。
在另一优选例中,R1、R2、R3、R4中有4个为F。
在另一优选例中,R5为甲基、Cl、三氟甲基、或SF5。
在另一优选例中,R5为甲基。
在另一优选例中,R6为C3烷基、C3链烯基、或C3链炔基。
在另一优选例中,R6为正丙基。
在另一优选例中,R7为H、C3烷基、C3链烯基、或C3链炔基。
在另一优选例中,R7为H、或正丙基。
在另一优选例中,所述的化合物选自下组:
本发明第二方面提供了一种式I化合物、或其盐、或其光学异构体、或其外消旋体、或其溶剂化物、或其前体的用途,用于制备农用制剂或组合物,所述农用制剂或组合物用于(i)增强植物抗逆性;(ii)制备ABA受体的激动剂;和/或(iii)制备种子萌发抑制剂。
在另一优选例中,所述的激动剂促进ABA受体PYL蛋白与PP2C蛋白磷酸酶的相互作用。
在另一优选例中,所述农用制剂或组合物用于一种或多种以下用途:
(i)促进ABA受体PYL蛋白与PP2C蛋白磷酸酶的相互作用;
(ii)减弱叶片的蒸腾作用;
(iii)抑制种子萌发。
在另一优选例中,所述抗逆性为ABA相关的非生物胁迫抗逆性。
在另一优选例中,所述抗逆性选自下组:抗旱性、耐冷性、耐盐碱、耐渗透压、耐热性、或其组合。
在另一优选例中,所述植物为含有PYR/PYL家族ABA受体的植物。
在另一优选例中,所述植物包括苔藓、蕨类、裸子植物、单子叶植物和双子叶植物。
在另一优选例中,所述的植物包括农业植物、园艺植物、林业植物。
在另一优选例中,所述的植物包括木本植物、草本植物。
在另一优选例中,所述的植物包括完整的植株、器官(如根、茎、叶、枝、花、果实、种子)、组织(如愈伤组织)、或细胞。
在另一优选例中,所述的植物选自下组:禾本科、菊科、百合科、十字花科、蔷薇科、豆科、茶科、梧桐科、松科、胡桃科、胡椒科、木兰科、杜鹃花科、猕猴桃科、葡萄科、秋海棠科、凤梨科、银杏科、八角茴香科、姜科、石榴科、夹竹桃科、小檗科、芸香科、茄科、柏科、冬青科、棕榈科植物、或其组合。
在另一优选例中,所述植物选自下组:拟南芥、烟草、棉花、生菜、水稻、小麦、玉米、花生、高粱、燕麦、黑麦、甘蔗、大豆、马铃薯、荞麦、胡椒、葡萄、梨、苹果、香蕉、人参、番茄、辣椒、茄子、花椰菜、大白菜、油菜、黄瓜、西瓜、洋葱、向日葵、百合、玫瑰、菊花、牡丹、康乃馨、樟树、梧桐、松树、或其组合。
本发明第三方面提供了一种农用制剂,所述农用制剂包括:
(i)本发明第一方面所述的式I化合物、或其盐、或其光学异构体、或其外消旋体、或其溶剂化物、或其前体;和
(ii)农业上可接受的载体。
在另一优选例中,组分(i)在农用制剂中的含量为0.1-1000μM,较佳地,1-200μM,更佳地,5-100μM。
在另一优选例中,所述农用制剂中,含有0.0001-99wt%,较佳地0.1-90wt%的组分(i),以农用制剂的总重量计。
在另一优选例中,所述农用制剂还包括额外的抗旱剂(如抗旱种衣剂、抗旱保水剂、或抗旱喷洒剂)或其他农用活性成分。
在另一优选例中,所述的农用活性成分选自下组:杀真菌剂、除草剂、杀虫剂、杀线虫剂、杀昆虫剂、植物激活剂、增效剂、植物生长调节剂、杀螨剂。
在另一优选例中,所述农用制剂还包括表面活性剂(如阳离子型、阴离子型、两性、或非离子型表面活性剂)。
在另一优选例中,所述农用制剂的剂型选自下组:溶液剂、乳剂、混悬剂、粉剂、泡沫剂、糊剂、颗粒剂、气雾剂、或其组合。
本发明第四方面提供了一种增强植物抗逆性的方法,给所述植物施用本发明第一方面所述的式I化合物、或其盐、或其光学异构体、或其外消旋体、或其溶剂化物、或其前体或施用本发明第三方面所述的农用制剂。
在另一优选例中,所述施用选自下组:喷洒或灌溉。
在另一优选例中,所述施用的剂量为2-100g/公顷,较佳地,4-80g/公顷,更佳地,6-60g/公顷。
在另一优选例中,所述施用的剂量为1-5000微克/株,较佳地,10-2500微克/株,更佳地,20-1000微克/株。
本发明第五方面提供了一种式I化合物或其盐的制法,包括步骤:
(a)在惰性溶剂中,将化合物I-S1与化合物I-S2进行反应,从而形成式I化合物;
上述各式中,R1、R2、R3、R4、R5、R6、X、如本发明第一方面所定义。
在另一优选例中,所述惰性溶剂选自下组;N,N-二甲基甲酰胺(DMF)、二氯甲烷(DCM)、乙腈(ACN)、或其组合。
在另一优选例中,所述反应在缚酸剂存在下进行。
在另一优选例中,所述缚酸剂选自下组:碳酸钾(K2CO3)、三乙胺(Et3N)、吡啶(Py)、或其组合。
在另一优选例中,所述反应温度为0-150℃(或回流温度),较佳地,10-60℃,更佳地,20-40℃。
在另一优选例中,所述反应时间为0.1-72小时,更佳地,1-24小时,更佳地,4-12小时。
在另一优选例中,在式I-S1中,X为O,且为单键。
在另一优选例中,所述化合物I-S2由如下方法制备:
在惰性溶剂中,将化合物I-SS1与硫脲反应,从而形成化合物I-S2;
上述各式中,R1、R2、R3、R4、R5如本发明第一方面所定义,X2为离去基团(如Cl、Br或I)。
在另一优选例中,所述惰性溶剂选自下组;乙醇、乙腈、四氢呋喃、或其组合。
在另一优选例中,所述反应在酸条件下进行。
在另一优选例中,所述酸选自下组:盐酸、氢溴酸、或其组合。
在另一优选例中,所述反应温度为0-150℃(或回流温度),较佳地,10-50℃,更佳地,15-25℃。
在另一优选例中,所述反应时间为0.1-72小时,更佳地,1-24小时,更佳地,2-12小时。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1显示本发明的化合物0428(a)、1022B(b)和NC0F4(c)可以结合拟南芥PYL2受体-HAB1复合物,进而抑制蛋白磷酸酶HAB1的活性。且在更低浓度下,化合物0428、1022B和NC0F4(c)抑制效果显著优于ABA。
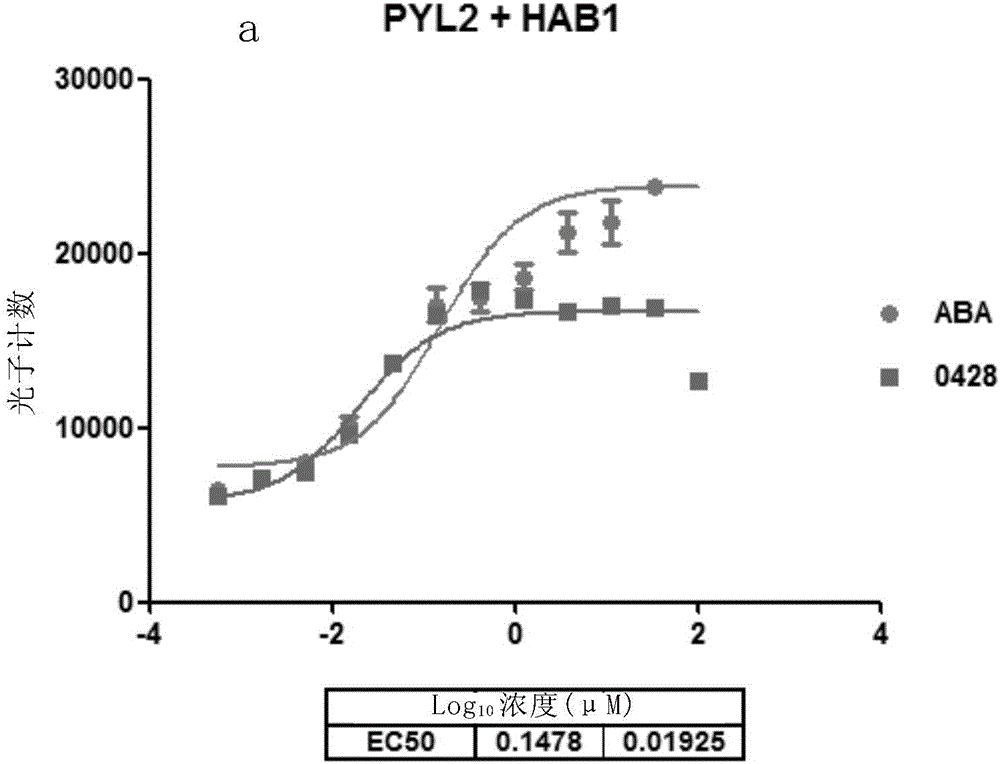
图2显示了本发明的化合物0428(a)、1022B(b)和NC0F4(c)及ABA的拟南芥PYL2或PYR1受体激动剂的剂量响应曲线。化合物0428、1022B和NC0F4(c)均可分别促进蛋白磷酸酶HAB1与拟南芥PYL2或PYR1受体的相互作用,且该作用存在剂量依赖效应。
图3显示了用10μM本发明化合物1022B处理6小时后,野生型拟南芥体内受ABA诱导的胁迫相关基因的转录水平变化。DMSO和同浓度ABA处理分别为阴性和阳性对照组。结果显示本发明化合物1022B诱导的4个胁迫相关基因转录水平均高于ABA。
图4a和4b分别显示了ABA(a)或本发明化合物(如化合物0428)(b)与PYL2-HAB1复合体口袋结构内多个氨基酸残基相互作用的二维结构。图中显示了水分子、氮原子、氧原子和卤素原子,虚线代表氢键,其上的数字则表示两个原子/分子之间的距离(单位是埃,)。结果显示,与ABA类似,本发明的化合物0428与PYL2口袋结构内的氨基酸残基形成多个氢键,不同的是这些氢键的形成并不需要水分子介导,这有助于化合物0428与PYL2-HAB1复合体的结合更加紧密。
图5显示了本发明化合物0428处理显著降低了拟南芥叶面的蒸腾速率,导致叶面温度升高。5μM ABA和、2μM和/1μM化合物0428处理后,叶面温度较DMSO处理显著增加,且叶面温度随浓度增高而增高,表明化合物0428对于叶面蒸腾作用的抑制效应存在浓度依赖效应。
图6显示了拟南芥土壤干旱实验结果。短日照环境中生长3周的野生型拟南芥植物(Col-0)停止浇水并喷施5μM ABA或本发明化合物0428。图片显示的分别是首次喷施化合物当天和14天后的植物生长状况,喷施DMSO溶液的植物作为负对照。结果显示喷施化合物0428的植物长势优于对照组和喷施ABA的植物。
图7显示本发明的化合物(如化合物0428)及ABA的大豆GmPYL6和水稻OsPYL2受体激动剂剂量响应曲线。化合物0428可以促进拟南芥蛋白磷酸酶HAB1与大豆GmPYL6或水稻OsPYL2的相互作用,且该相互作用存在剂量依赖效应。
图8a和图8b分别显示了大豆和玉米的土壤干旱实验结果。选取小喇叭口期的玉米和3组3叶期的大豆植株,在开始干旱后的第一天和第二天喷施本发明的化合物(如化合物0428),照片显示了玉米干旱处理四天和大豆干旱处理九天后的整体生长状况。实验中化合物0428的浓度为50μM。经化合物0428处理的玉米和大豆的长势要显著优于对照组。
图9显示2μM浓度下,化合物0428和ABA对于Col-0和pyr1;pyl1;pyl4三突变体种子萌发的影响。每个培养皿的左半边播种Col-0,右半边播种pyr1;pyl1;pyl4三突变体。照片为pyr1;pyl1;pyl4三突变体种子萌发7天后(播种9天后)所拍摄的。DMSO处理为对照组。结果显示0428化合物可以抑制Col-0种子的萌发,但对pyr1;pyl1;pyl4三突变体种子的萌发抑制作用显著减弱,这表明0428化合物对于拟南芥种子萌发的抑制是通过ABA受体介导的而非毒性作用。
具体实施方式
本发明人经过广泛而深入的研究,首次开发了一类具有高脱落酸(ABA)活性的ABA替代物(本发明化合物)。本发明化合物具有明显高于现有ABA类似物的活性,能够显著增强植物的多种抗逆性(如抗旱、耐冷等)。此外,本发明化合物制法简便,且具有优异的环境友好性和作用迅速等优点,因此,具有广泛的应用前景。在此基础上完成了本发明。
实验表明,本发明化合物不仅活性优于脱落酸(Abscisic Acid,ABA),而且可结合于多个不同PYL受体,可显著增强各种不同植物的抗逆性。
基团定义
如本文所用,术语“取代或未取代的”指所述基团可以是未取代的,或者所述基团中的H被一个或多个(如1-10个,较佳地1-5个,更佳地1-3个,最佳地,1-2个)取代基所取代。
如本文所用,所述的“取代”或“取代的”指所述基团具有一个或多个(较佳地1-6个,更佳地1-3个)选自下组的取代基:卤素、羟基、-NH2、硝基、-CN、C1-C4烷基、C1-C4卤代烷基、C1-C4烷氧基、C3-C6环烷基、C1-C3羧基、C2-C4链烯基、C2-C4炔基。
如本文所用,术语“C1-C7烷基”是指具有1-7个碳原子的直链或支链烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C1-C7烷基。
如本文所用,术语“C2-C7链烯基”指具有2-7个碳原子的直链或支链的烯基,例如乙烯基、烯丙基、1-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C2-C7链烯基。
如本文所用,术语“C2-C7链炔基”是指具有2-7个碳原子的直链或支链的炔基,例如乙炔基、丙炔基、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C2-C7链炔基。
如本文所用,术语“C1-C3烷基”是指具有1-3个碳原子的直链或支链烷基,例如甲基、乙基、正丙基、异丙基、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C1-C3烷基。
如本文所用,术语“C2-C3链烯基”指具有2-3个碳原子的直链或支链的烯基,例如乙烯基、烯丙基、1-丙烯基、异丙烯基或类似基团。在未特别指出的时候,该术语包括取代或未取代的C2-C3链烯基。
如本文所用,术语“C2-C3链炔基”是指具有2-3个碳原子的直链或支链的炔基,例如乙炔基、丙炔基、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C2-C3链炔基。
如本文所用,术语“C3-C7环烷基”指具有3-7个碳原子的环状烷基,例如环丙基、环丁基、环戊基、环己基、环庚基、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C3-C7环烷基。
如本文所用,术语“C1-C3卤代烷基”是指氢被1个或1个以上的卤素取代的具有1-3个碳原子的直链或支链烷基,例如,卤代甲基、卤代乙基、卤代丙基、卤代异丙基、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C1-C3卤代烷基。
如本文所用,术语“C1-C2亚烷基”是指具有1-2个碳原子的二价烃基,如,亚甲基、亚乙基、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C1-C2亚烷基。
如本文所用,术语“C1-C4烷氧基”是指具有“(C1-C4烷基)-O-结构的基团,例如,CH3-O-、C2H5-O-、C3H7-O-、(CH3)2CH-O-、nC4H9-O-、tC4H9-O-、或类似基团。在未特别指出的时候,该术语包括取代或未取代的C1-C4烷氧基。
如本文所用,术语“卤素”是指氟、氯、溴、或碘,优选氟和氯。
如本文所用,术语“卤代的”指被相同或不同的一个或多个上述卤原子取代的基团,可以部分卤代或全部卤代,例如三氟甲基、五氟乙基、七氟异丙基、或类似基团。
本发明的化合物可以含有一个或多个不对称中心,并因此以消旋体、外消旋混合物、单一对映体、非对映异构体化合物和单一非对映体的形式出现。可以存在的不对称中心,取决于分子上各种取代基的性质。每个这种不对称中心将独立地产生两个旋光异构体,并且所有可能的旋光异构体和非对映体混合物和纯或部分纯的化合物包括在本发明的范围之内。本发明包括化合物的所有异构形式。
式I化合物及其制备方法
如本文所用,术语“本发明化合物”、“本发明ABA替代物”、“式I化合物”可互换使用,均指具有式I所示结构的化合物。此外,所述术语还包括式I化合物的盐、光学异构体、外消旋体、溶剂化物(如水合物)、和/或前体,
其中,R1、R2、R3、R4、R5、R6、X、的定义如前所述。
下面更具体地描述本发明式I化合物的制备方法,但这些具体方法不对本发明构成任何限制。本发明化合物还可以任选将在本说明书中描述的或本领域已知的各种合成方法组合起来而方便的制得,这样的组合可由本发明所属领域的技术人员容易的进行。通常,在本发明的制备方法中,各反应大多在惰性溶剂中,在0℃至150℃(或回流温度)(较佳地,10-60℃,或20-40℃)下,反应一段时间(如0.1-72小时,较佳地2-20小时)。
如本文所用,室温是指约20-30℃。
较佳地,本发明式I化合物可以通过以下方案及实施例中所述的示例性方法以及本领域技术人员所用的相关公开文献操作完成。
典型地,本发明的式Ia、Ib、Ic和/或Id化合物的制备方法可包括(但不限于)如下流程。
方案I(以X=O,R6=丙基,且为单键为例)
(1)制备6-氨基-1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮:
在步骤1中,在惰性溶剂(如N,N-二甲基甲酰胺)中,首先将式I-1化合物与尿素在一定温度(如100-150℃)下进行反应一段时间,形成式I-2化合物。
步骤2:在碱(如氢化钠、碳酸钾、碳酸铯)存在下,在惰性溶剂(如N,N-二甲基甲酰胺)中,式I-2化合物与碘丙烷在一定温度(如10-50℃)下进行反应一段时间,形成式I-3化合物。
步骤3:在酸(如硫酸)存在下,式I-3化合物与硝酸钾在一定温度(如0—25℃)下进行反应一段时间,形成式I-4化合物。
步骤4:在惰性溶剂(如甲醇)中,以钯碳作催化剂,在一定温度(如20-40℃)下,将式I-4化合物进行还原反应,形成式I-5化合物。
(2)制备4-甲基卤代苄磺酰氯:
步骤4:在惰性溶剂(如乙醇、乙腈)中,式I-SS1化合物(如4-甲基苄溴或4-甲基苄氯)与硫脲反应,形成反应产物。然后,在酸(如浓盐酸)存在下,在惰性溶剂(如乙腈)中,将所述反应产物和亚氯酸钠在一定温度(如15-25℃)下进行反应一段时间,形成式I-S2化合物。
(3)制备式Ia化合物
步骤5:在惰性溶剂(如DMF)中,在缚酸剂(如碳酸钾)存在下,式I-5化合物与式I-SS2化合物在一定温度(如20-50℃)下进行反应一段时间,从而得到式Ia化合物。
方案I中,X2为离去基团,为氯、溴、碘。其它各取代基和基团如说明书中所定义。
农用制剂
可将本发明的活性物质(式I化合物、或其盐、或其光学异构体、或其外消旋体、或其溶剂化物、或其前体)以常规的方法制备成农用制剂,例如溶液剂、乳剂、混悬剂、粉剂、泡沫剂、糊剂、颗粒剂、气雾剂、用活性物质浸渍的天然的和合成的材料、在多聚物中的微胶囊、用于种子的包衣剂。
这些制剂可用已知的方法生产,例如,将活性化合物与扩充剂混合,这些扩充剂就是液体的或液化气的或固体的稀释剂或载体,并可任意选用表面活性剂即乳化剂和/或分散剂和/或泡沫形成剂。例如在用水作扩充剂时,有机溶剂也可用作助剂。
用液体溶剂作稀释剂或载体时,基本上是合适的,如:芳香烃类,例如二甲苯,甲苯或烷基萘;氯化的芳香或氯化的脂肪烃类,例如氯苯,氯乙烯或二氯甲烷;脂肪烃类,例如环己烷或石蜡,例如矿物油馏分;醇类,例如乙醇或乙二醇以及它们的醚和脂类;酮类,例如丙酮,甲乙酮,甲基异丁基酮或环已酮;或不常用的极性溶剂,例如二甲基甲酰胺和二甲基亚砜,以及水。
就液化气的稀释剂或载体说,指的是在常温常压下将成为气体的液体,例如气溶胶推进剂,如卤化的烃类以及丁烷,丙烷,氮气和二氧化碳。
固体载体可用研磨的天然矿物质,例如高岭土,粘土,滑石,石英,活性白土,蒙脱土,或硅藻土,和研磨合成的矿物质,例如高度分散的硅酸,氧化铝和硅酸盐。供颗粒用的固体载体是碾碎的和分级的天然锆石,例如方解石,大理石,浮石,海泡石和白云石,以及无机和有机粗粉合成的颗粒,和有机材料例如锯木屑,椰子壳,玉米棒子和烟草梗的颗粒等。
非离子的和阴离子的乳化列可用作乳化剂和/或泡沫形成剂。例如聚氧乙烯-脂肪酸酯类,聚氧乙烯-脂肪醇醚类,例如烷芳基聚乙二醇醚类,烷基磺酸酯类,烷基硫酸酯类,芳基磺酸酯类以及白蛋白水解产物。分散剂包括,例如木质素亚硫酸盐废液和甲基纤维素。
在制剂中可以用粘合剂,例如羧甲基纤维素和以粉末,颗粒或乳液形式的天然和合成的多聚物,例如阿拉伯胶,聚乙烯基醇和聚乙烯醋酸酯。
可以用着色剂例如无机染料,如氧化铁,氧化钻和普鲁士蓝;有机染料,如有机染料,如偶氮染料或金属钛菁染料;和用痕量营养剂,如铁,猛,硼,铜,钴,铝和锌的盐等。
在本发明中,所述“农用制剂”通常是农用植物生长调节剂,其含有式I化合物或其盐、其光学异构体、外消旋体、溶剂化物或前体作为增强植物抗逆性(如抗旱性)的活性成分;以及农业上可接受的载体。
如本文所用,所述“农业上可接受的载体”是用于将本发明的式I化合物或其盐、光学异构体、外消旋体、溶剂化物或前体传送给植物的农药学上可接受的溶剂、悬浮剂或赋形剂。载体可以是液体或固体。适用于本发明的农业上可接受的载体选自下组:水、缓冲液、DMSO、表面活性剂如Tween-20、或其组合。任何本领域技术人员已知的农业上可接受的载体均可用于本发明中。
本发明的农用制剂可与其他抗旱剂制成一种混合物存在于它们的商品制剂中或从这些制剂制备的使用剂型中,这些其他的抗旱剂包括(并不限于):抗旱种衣剂、抗旱保水剂、或抗旱喷洒剂等。
此外,本发明的农用制剂也可与增效剂制成一种混合物存在于它们的商品制剂中或从这些制剂制备的使用剂型中,这些增效剂是提高活性化合物作用的化合物,由于活性化合物本身有活性,也可不必加增效剂。
本发明所述的农用制剂的剂型可以是多种多样的,只要能够使活性成分有效地到达植物体内的剂型都是可以的,从易于制备和施用的立场看,优选的农用制剂是一种喷雾剂或溶液制剂。
本发明所述的农用制剂通常含有占所述农用制剂总重量的0.0001-99wt%,较佳地0.1-90wt%的本发明化合物。商品制剂或使用剂型中的本发明化合物的浓度可在广阔的范围内变动。商品制剂或使用剂型中的本发明化合物的浓度可从0.0000001-100%(g/v),最好在0.0001与1%(g/v)之间。
增强植物抗逆性的方法
本发明提供了一种增强植物抗逆性(如抗旱性、耐冷性)的方法,包括步骤:给植物施用式I化合物或其盐、其光学异构体、外消旋体、溶剂化物或前体、或其相应的的农用制剂。
施用可采用已知的各种方法,例如,通过在植物叶片、繁殖材料上喷洒、喷雾、喷粉或播撒该化合物或含有该化合物的农用制剂,或以其他方式使植物接触该化合物或含有该化合物的农用制剂,如果是种子,则通过涂布、包裹或以其他方式处理种子。另一种在种植前直接处理植物或种子的方法,还可将本发明的农用制剂引入土壤或其他待播种种子的培养基。在一些实施方案中,还可以使用载体,所述载体可以是如上所述的固态、液态。
在一优选实施方式中,还可以通过喷洒(如飞机喷洒)或灌溉将该化合物或含有该化合物的农用制剂递送给所述植物。
本发明的主要优点包括:
首次开发了一类具有高脱落酸(ABA)活性的ABA替代物(本发明化合物)。本发明化合物具有明显高于现有ABA类似物的活性,能够显著增强植物的多种抗逆性(如抗旱、耐冷等)。此外,本发明化合物制法简便,且具有优异的环境友好性,因此,具有广泛的应用前景。在此基础上完成了本发明。
实验表明,本发明化合物(如化合物0428、1022B、NC0F4等)可结合于多个不同PYL受体,活性优于或与脱落酸(Abscisic Acid,ABA)相当,可显著增强各种不同植物的抗逆性。
(1)本发明首次合成了一系列的天然脱落酸(Abscisic Acid,ABA)的高活性的替代化合物。本发明的化合物能够显著增强植物多种抗逆性(如抗旱、耐冷)。并且,光学异构体或外消旋体的本发明化合物均具有高活性。
(2)本发明化合物的活性显著优于脱落酸(Abscisic Acid,ABA)以及现有的ABA类似物。
(3)本发明的化合物对于多个PYR/PYL受体蛋白与PP2C蛋白磷酸酶HAB1的相互作用均有促进作用。
(4)本发明化合物的合成方法简单、成本低廉。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
除非另有说明,否则本发明实施例中所用的材料和试剂均为市售产品。
ABA购自A.G.Scientific公司。
材料和通用方法
材料
实验中使用的模式植物均为常规的或市售的品种,其中拟南芥(Arabidopsis thaliana)包括:哥伦比亚(Col-0)生态型,基于Col-0生态型的ABA合成突变体aba2-1和基于Col-0生态型的PYL受体三缺失突变体(pyr1;pyl1;pyl4)。大豆品种为邯夏10号,玉米品种为掖单13号。
本发明所述的各化合物(如0428、1022B、NC0F4等)见各实施例。
植物生长
拟南芥生长温度为22℃,生长在植物生长培养基上的植物的光周期为长日照(24小时光照),生长在土壤中的植物(如叶面蒸腾实验和土壤干旱实验)的光周期为短日照(8小时光照/16小时黑暗),光强为75μmol·m–2·s–1。
大豆生长温度为26℃,光周期为14小时光照/10小时黑暗。玉米的生长温度为27℃,光周期为11小时光照/13小时黑暗,光强均为400μmol·m-2·s-1。
如无特殊指明,实验中使用的植物生长培养基均为含1%(w/v)蔗糖和0.6%(w/v)琼脂的1/2MS(Murashige and Skoog)固体培养基(购自Phyto Technology Labotories公司)。
基因表达分析
取全植株或叶子,用常规方法进行RNA抽提、经逆转录后进行荧光定量PCR。每种处理取3个生物学重复并进行两次实验重复,ACT7基因被用作内参。
蛋白表达纯化
带6×His和SUMO双标签序列的拟南芥基因PYL2(氨基酸序列14-188)和带Biotin标签序列的拟南芥基因HAB1(氨基酸序列172-511)的重组质粒的构建方法详见“A gate-latch-lock mechanism for hormone signalling by abscisic acid receptors”(Nature,Vol 462,2009),带6×His和SUMO双标签序列的PYR1以及大豆GmPYL6和水稻OsPYL2的重组质粒的构建方法与拟南芥PYL2相同。
将上述重组质粒转入感受态细胞大肠杆菌BL21(DE3)(购自NEB公司),接种到含有Amp抗性的200ml LB液体培养基(购自OXOID公司),37℃200rpm培养过夜;按1:50-1:100接种至2L含有Amp抗性的LB液体培养基中进行扩大培养,37℃200rpm培养3-4小时,16℃低温培养至OD600=0.8-1.0左右。带6×His和SUMO双标签序列的PYR1/PYL2/GmPYL6/OsPYL2的重组质粒用100μM IPTG诱导过夜,而带Biotin标签序列的HAB1重组质粒要用100μM IPTG和40μM biotin同时进行诱导。
将诱导16小时后的菌液在低速大容量离心机中离心收集菌体,4℃以4000rpm转速离心20min。每2L菌液用50ml提取缓冲液(含20mM Tris,pH 8.0,200mM NaCl和10%(v/v)甘油)重悬菌体,然后在4℃进行1000Pa压力破碎3-5次。破碎后的细胞进行超速离心,16000rpm离心30min,重复2次,收集上清液过亲和层析柱。
对于带6×His和SUMO双标签序列的PYR1/PYL2/GmPYL6/OsPYL2蛋白,选择50ml亲和层析Ni柱(50ml Ni-NTA column,购自GE公司);先用10%缓冲液B(含20mM Tris,pH 8.0,200mM NaCl,500mM imidazole和10%甘油)平衡600ml,再用200ml 50%缓冲液B洗脱,最后用100ml 100%缓冲液B洗脱;用于晶体解析的蛋白与ulp1酶以1000:1的摩尔比混合进行酶切透析过夜;酶切后的蛋白再过一次亲和层析Ni柱;收集液用洗脱溶液(含25mM Tris,pH 8.0,200mM ammonium acetate,1mM dithiotreitol和1mM EDTA)过HiLoad 26/60Superdex200凝胶过滤柱(购自GE公司)进一步分离纯化蛋白。
对于带Biotin标签序列的HAB1蛋白,过50ml MBP亲和层析柱(购自GE公司);先用10%缓冲液C(含20mM Tris,pH 8.0,200mM NaCl,10mM Maltose和10%甘油)平衡600ml,再用200ml 50%缓冲液C洗脱,最后用100ml 100%缓冲液C洗脱;收集液用洗脱溶液(含20mM Tris,pH 8.0,200mM NaCl和10%甘油)过HiLoad 26/60 Superdex200凝胶过滤柱进一步分离纯化蛋白。
蛋白晶体解析
结晶前,将酶切去除标签后的拟南芥PYL2和HAB1蛋白与(+)-ABA或化合物0428按1:1:5的摩尔比混合,浓缩到6mg/ml用于点晶体。采用悬滴法进行点晶体;用于结晶的孔缓冲液(well buffer)包含0.2M酒石酸钠(Di-sodium tartrate)和20%PEG 3350。一天后可看到晶体出现,约3-4天可长到100-120μm。晶体用X射线衍射并收集衍射数据,再根据相关PYR/PYL受体结构模型来解析复合物结构。
AlphaScreen实验
采用AlphaScreen试剂盒(购自Perkin Elmer),方法如下:150μl实验体系中含1:10稀释的10×buffer(50mM MOPS,pH 7.4,50mM NaF,50mM CHAPS,0.1mg/ml bovine serum albumin),各100nM带Biotin标签序列的HAB1和带6×His和SUMO双标签序列的PYR1/PYL2/GmPYL6/OsPYL2蛋白,相应浓度的(+)-ABA/0428/1022B/NC0F4,5μg/ml供体珠(donor beads)和受体珠(acceptor beads)(购自Perkin Elmer),室温下避光孵育1.5小时后,置于Envision Plate Reader(购自Perkin Elmer)中按设定的AlphaScreen程序进行读数。
HAB1磷酸酶活性检测
反应体系中含50mM咪唑,pH 7.2,5mM MgCl2,0.1%β-巯基乙醇,0.5μg·ml-1BSA,100nM带Biotin标签序列的HAB1蛋白,500nM带6×His-SUMO双标签序列的PYL2受体蛋白及相应浓度的(+)-ABA/0428/1022B/NC0F4,室温孵育30分钟,随后加入含11个氨基酸的磷酸化多肽作为底物继续反应30分钟,该磷酸化多肽为SnRK2.6蛋白激酶的170-180位氨基酸,其中175位的磷酸化丝氨酸(序列为HSQPKpSTVGTP,购自金斯瑞)为已知的HAB1脱磷酸化靶位点。30分钟后加入显色试剂(购自BioVision),用酶标仪(购自Molecular Device)读取650nm波长的吸收值。
种子萌发和土壤干旱实验
(1)种子萌发
以本发明的化合物0428为例。拟南芥Col-0生态型和PYL受体三缺失突变体(pyr1;pyl1;pyl4)的种子用NaClO消毒后置于4℃春化3天,然后播种在含2μM(+)-ABA/本发明化合物0428或0.05%DMSO(对照)的1/2MS固体培养基上。每个6cm直径的培养基上同时播种两个株系,每个株系播种15-20粒种子,每种化合物设4个重复。培养基置于22℃长日照培养,9天后拍照。
(2)植物叶面蒸腾实验
拟南芥叶面蒸腾实验使用ABA合成突变体aba2-1。在环境胁迫条件下,该突变体中的内源ABA含量并不增加,仅为同样条件下野生型拟南芥Col-0中的1/40,因此使用该突变体可以排除内源ABA对于蒸腾实验的影响。持续浇水三周后的植物一次性喷施含0.05%Tween-20和相应浓度的DMSO(对照)/(+)-ABA/化合物0428,使用量为1.2ml/盆,喷施前和喷施后每天在相同时间段使用FLIR A655sc红外热像仪成像。
(3)土壤干旱实验
拟南芥Col-0生态型种子用NaClO消毒后置于4℃春化3天后播种在1/2MS固体培养基上,生长6天后选取长势良好且大小一致的幼苗移入装满土的8×7×6cm3的花盆中。每个花盆装有相同重量的土并移入相同数目的植物(六株)以减少实验误差,所有的花盆均置于22℃短日照培养,两周后停止浇水进行干旱处理,期间每周向叶面喷洒一次含0.05%Tween-20和5μM的(+)-ABA/0428或0.05%Tween-20和0.05%DMSO(对照)的溶液,喷施量为2ml溶液/盆,干旱过程中每天变换花盆位置以减少环境因素引起的误差,整个干旱期间总计喷施两次溶液,两周后拍照记录。
大豆和玉米的土壤干旱实验与拟南芥类似,每盆只包含一株植物。所有的大豆植株均在26℃长日照培养,3组3叶后停止浇水,选择长势一致的植株进行干旱处理;玉米则在小喇叭口期停止浇水进行干旱处理。开始干旱的第一天和第二天各向叶面喷洒一次含0.05%Tween-20和50μM(+)-0428或0.05%Tween-20和0.05%DMSO(对照)的溶液,喷施量为4ml/盆,同时变换花盆位置。大豆在干旱9天后,玉米在干旱4天后复水,第二天拍照。
实施例1化合物0428的制备
1.1制备1,4-二氢-2H-3,1-苯并噁嗪-2-酮
将3.0克2-氨基苯甲醇和1.6克尿素加入到80毫升DMF中,升温到150℃,反应12小时;加入饱和氯化钠溶液淬灭反应,加入乙酸乙酯萃取反应三次。合并有机相,用饱和氯化钠水溶液和2N盐酸洗涤除去未反应的2-氨基苯甲醇和尿素,在加入无水硫酸钠干燥有机相。减压蒸干得到3.0克1,4-二氢-2H-3,1-苯并噁嗪-2-酮。HPLC检测纯度为92%,无需进一步纯化直接进行下一步,收率为83%。1HNMR(400MHz,DMSO-d6):δ5.27(s,2H),6.85-7.27(m,4H),10.15(s,1H)ppm。
1.2制备1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮
将2.0克1,4-二氢-2H-3,1-苯并噁嗪-2-酮加入到80毫升N,N-二甲基甲酰胺中,在冰水浴下搅拌分批加入1.05当量氢化钠,加完搅拌0.5小时;滴加1.05当量的碘丙烷,撤去冰水浴,反应12小时;加入饱和氯化铵溶液淬灭反应,加入乙酸乙酯萃取反应。合并有机相,用饱和氯化钠水溶液洗涤,在加入无水硫酸钠干燥有机相。减压蒸去溶剂和过量的碘丙烷,得到2.2克油状1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮。HPLC检测纯度为92%,无需进一步纯化直接进行下一步,收率为88%。
1.3制备6-硝基-1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮
在冰水浴下将20毫升硫酸加入到盛有2克1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮烧瓶中,并剧烈搅拌0.5h;用滴液漏斗缓慢滴加1.1当量的硝酸钾硫酸溶液,维持冰水浴温度并反应1-2小时;倾倒反应液到冰水中搅拌0.5h。过滤并用大量的水洗涤滤饼。红外灯下干燥。用乙醇对粗品进行重结晶。得1.8克6-硝基-1-丙基1,4-二氢-2H-3,1-苯并噁嗪-2-酮,收率为77%。1HNMR(400MHz,DMSO-d6):δ0.93(t,3H),1.63(m,2H),3.85(t,2H),5.39(s,2H),7.37(m,1H),8.22(m,2H)ppm。
1.4制备6-氨基-1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮
将1.8克6-硝基-1-丙基1,4-二氢-2H-3,1-苯并噁嗪-2-酮加入到甲醇中,再加入钯碳作为催化剂。反应体系用氢气置换三次。室温搅拌8小时。反应液通过加入硅藻土的玻璃砂漏斗,滤去固体。浓缩滤液得1.4克6-氨基-1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮.未进一步纯化直接进行下一步,粗收率为90%。
1.5制备2,3,5,6-四氟-4-甲基苄磺酰氯
取1.0克2,3,5,6-四氟-4-甲基氯苄和1当量的硫脲溶于40毫升乙醇中,然后慢慢加热至回流。反应4-6h后浓缩反应液,得白色固体。加入10毫升乙腈和4毫升浓盐酸。控制温度5-10℃下,在剧烈搅拌下分批加入2.25克亚氯酸钠。在15-20℃下反应8-16小时。加入水来终止反应。乙酸乙酯萃取三次。浓缩萃取液得2,3,5,6-四氟-4-甲基苄磺酰氯。未进一步纯化直接进行下一步。
1.6制备化合物0428
将1.0克6-氨基-1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮和1.2当量的2,3,5,6-四氟-4-甲基苄磺酰氯加入到20毫升DMF中,再加入3当量碳酸钾为缚酸剂。使反应保持在室温搅拌12-16小时。反应结束加入冰水,乙酸乙酯萃取。无水硫酸钠干燥。浓缩有机相。粗品用硅胶柱层析得1.5克化合物0428,收率为70%。
1HNMR(400MHz,DMSO-d6):δ0.92(t,3H),1.60(m,2H),2.27(s,3H),3.77(t,2H),4.60(s,2H),5.17(s,2H),7.10-7.18(m,3H),10.19(s,1H)ppm。
实施例2化合物1022B的制备
2.1制备1-丙基-2(1H)-喹啉酮
将4.0克2-羟基喹啉加入到100毫升DMF中,在冰水浴下搅拌,分批加入1.1当量氢化钠,加完保温搅拌0.5小时;滴加1.1当量的碘丙烷,撤去冰水浴,反应12小时;加入饱和氯化铵溶液淬灭反应,乙酸乙酯萃取反应。合并有机相,用饱和氯化钠水溶液洗涤,加入无水硫酸钠干燥有机相。减压蒸去溶剂和过量的碘丙烷,得到油状粗品。通过硅胶层析柱分离,得到无色油状液体1-丙基-2(1H)-喹啉酮3.3克,收率为62%。1HNMR(400MHz,DMSO-d6):δ0.95(t,3H),1.62(m,2H),4.18(t,2H),6.63(d,1H),7.25(t,1H),7.60(m,2H),7.72(d,1H),7.90(d,1H)ppm。
2.2制备6-硝基-1-丙基-2(1H)-喹啉酮
在冰水浴下将40毫升硫酸加入到装有2.0克1-丙基-2(1H)-喹啉酮的烧瓶中,并剧烈搅拌0.5小时;用滴液漏斗缓慢滴加15毫升1.1当量的硝酸钾硫酸溶液,维持冰水浴温度并反应1-2小时;倾倒反应液到冰水中搅拌0.5小时。过滤并用大量的水洗涤滤饼。红外灯下干燥。用乙醇对粗品进行重结晶。得1.7克6-硝基-1-丙基-2(1H)-喹啉酮,收率为72%。1HNMR(400MHz,DMSO-d6):δ0.95(t,3H),1.63(m,2H),4.24(t,2H),6.76(d,1H),7.76(d,1H),8.12(d,1H),8.35(d,1H),8.71(s,1H)ppm。
2.3制备6-氨基-1-丙基-2(1H)-喹啉酮
将1.7克6-硝基-1-丙基-2(1H)-喹啉酮加入到80毫升甲醇中,再加入钯碳作为催化剂。反应体系用氢气置换三次。室温搅拌2小时。反应液通过加入硅藻土的玻璃砂漏斗,滤去固体。浓缩滤液得1.4克6-氨基-1-丙基-2(1H)-喹啉酮。粗品无需进一步纯化,收率为90%。1HNMR(400MHz,DMSO-d6):δ0.92(t,3H),1.60(m,2H),4.08(t,2H),5.08(s,2H),6.46(d,1H),6.79(s,1H),6.94(d,1H),7.29(d,1H),7.66(d,1H)ppm。
2.4制备对甲基卤代苄磺酰氯
取1.0克对甲基苄溴与1当量的硫脲加入到40毫升乙醇中,然后慢慢加热至回流,溶液转为澄清。反应4-6小时后浓缩反应液,得白色固体。加入10毫升乙腈和4毫升浓盐酸。控制温度在5-10℃,剧烈搅拌下分批加入2.25克的亚氯酸钠。在15-20℃下反应8-16小时。加水来终止反应。乙酸乙酯萃取三次。浓缩萃取液得对甲基苄磺酰氯。粗品未经纯化直接用于下一步。
2.5制备化合物1022B
将1.0克6-氨基-1-丙基-2(1H)-喹啉酮和1.2当量的对甲基苄磺酰氯加入到20毫升DMF中,再加入3当量碳酸钾为缚酸剂。使反应在室温搅拌12-16小时。结束后加入冰水,乙酸乙酯萃取三次,合并有机相并用无水硫酸钠干燥。浓缩有机相,粗品用硅胶柱层析得1.3克化合物1022B,收率为70%。
1HNMR(400MHz,DMSO-d6):δ0.95(t,3H),1.62(m,2H),2.27(s,3H),4.18(t,2H),4.42(s,2H),6.60(d,1H),7.12-7.17(m,4H),7.40(d,1H),7.45(s,1H),7.55(d,1H),7.83(d,1H)ppm;13CNMR(100MHz,DMSO-d6)δ11.53,20.99,21.54,43.35,57.34,116.08,119.20,121.17,122.14,124.01,126.89,129.46,131.34,133.02,135.97,138.12,139.45,161.12ppm。
实施例3化合物NC0F4的制备
3.1制备2-氨甲基-4-硝基苯胺
将5.0克2-氰基-4-硝基苯胺加入到200毫升干燥四氢呋喃中,在冰水浴下搅拌滴加3.5当量硼烷四氢呋喃溶液,加毕,室温搅拌过夜;缓慢滴加入饱和氯化铵溶液淬灭反应,加入二氯甲烷萃取混合液。合并有机相,用饱和氯化钠水溶液洗涤,在加入无水硫酸钠干燥有机相。减压蒸去溶剂和过量的碘丙烷,得到4.2克2-氨甲基-4-硝基苯胺,收率83%。1HNMR(400MHz,DMSO-d6):δ8.05(d,1H),7.88(dd,1H),6.70-6.59(m,3H),3.63(s,2H)ppm。
3.2制备6-硝基-3,4-二氢喹唑啉-2(1H)-酮
将4.5克2-氨甲基-4-硝基苯胺加入到250毫升干燥四氢呋喃中,搅拌下加入1.5当量CDI。加毕,升温至回流并搅拌过夜;减压蒸去四氢呋喃,加入水和二氯甲烷萃取混合液。合并有机相,用饱和氯化钠水溶液洗涤,在加入无水硫酸钠干燥有机相。得到6-硝基-3,4-二氢喹唑啉-2(1H)-酮,收率74%。1HNMR(400MHz,DMSO-d6):δ9.78(s,1H),8.07(s,1H),8.04(m,1H),7.17(d,1H),6.93(d,1H),4.43(s,2H)ppm。
3.3制备1-丙基-6-硝基-3,4-二氢喹唑啉-2(1H)-酮
合成方法同实施例1.2,只是用6-硝基-3,4-二氢喹唑啉-2(1H)-酮代替1,4-二氢-2H-3,1-苯并噁嗪-2-酮。粗品未经进一步纯化,直接进行下一步,粗收率为56%。
3.4制备1-丙基-6-氨基-3,4-二氢喹唑啉-2(1H)-酮
合成方法同实施例1.4,只是用1-丙基-6-硝基-3,4-二氢喹唑啉-2(1H)-酮替代6-硝基-1-丙基1,4-二氢-2H-3,1-苯并噁嗪-2-酮。粗品未经进一步纯化,粗收率为87%。
3.5制备NC0F4
合成方法同实施例1.6,只是用1-丙基-6-氨基-3,4-二氢喹唑啉-2(1H)-酮代替6-氨基-1-丙基-1,4-二氢-2H-3,1-苯并噁嗪-2-酮。1HNMR(400MHz,DMSO-d6):δ10.0(s,1H),7.06-6.90(m,4H,),4.56(s,2H),4.20(s,2H),3.69(s,2H),2.24(s,3H),1.52(m,2H),0.89(t,3H)ppm。
实施例4化合物0428/1022B/NC0F4体外实验的活性测试
体外生化实验表明,本发明的化合物0428、1022B和NC0F4作为高效的PYL受体激动剂,与多个PYL受体具有高亲和性的结合能力,同时促进PYL受体结合并抑制PP2C蛋白磷酸酶活性。
4.1 PP2C蛋白磷酸酶活性测试
结果如图1a-1c所示。以SnRK2.6磷酸化多肽为底物的HAB1蛋白磷酸酶活性实验表明,化合物0428、1022B和NC0F4均可促进PYL2受体可与PP2C蛋白磷酸酶(HAB1)结合,从而抑制HAB1对于SnRK2.6磷酸化多肽的去磷酸化作用,且在低浓度下效果显著优于同浓度的ABA。
4.2 AlphaScreen实验
用AlphaScreen技术检测化合物0428、1022B和NC0F4对于PYL受体和PP2C蛋白磷酸酶(HAB1)结合的促进能力。
实验结果表明,对于拟南芥PYL2和HAB1,化合物0428和1022B均具有显著优于ABA的PYL受体亲和性和结合能力,化合物0428的EC50值只有ABA的约1/8,1022B的EC50值则比ABA低1个数量级,且PYL2受体与HAB1的结合能力存在化合物0428和1022B的剂量依赖效应(图2a,2b)。对于拟南芥PYR1和HAB1,化合物NC0F4具有显著优于ABA的PYL受体亲和性和结合能力,EC50值只有ABA的约1/11,且PYR1受体与HAB1的结合能力存在化合物NC0F4的剂量依赖效应(图2c)。
此外,使用大豆GmPYL6(拟南芥PYL2的同源基因)和水稻OsPYL2(拟南芥PYL2的同源基因)与拟南芥AtHAB1的实验表明,化合物0428与大豆GmPYL6蛋白和水稻OsPYL2蛋白同样具有显著高于ABA的亲和性(图7)。
上述结果表明,化合物0428和1022B是一系列比ABA等现有化合物更为高效的PYL受体激动剂。
并且,当体外测试的本发明其他化合物的浓度区间为0.01-100μM时,本发明的其他化合物均表现出显著的PYR/PYL受体亲和性。
实施例5化合物0428的抗旱活性测试
5.1拟南芥叶面蒸腾作用
本实验中,利用红外摄像机观察记录叶面的温度变化,从而反映出植物的蒸腾作用强弱。蒸腾作用越强的植物,叶面温度越低。
拟南芥叶面蒸腾实验结果如图5所示。5μM/2μM/1μM 0428化合物喷施拟南芥一天后,叶面温度均高于DMSO对照组,意味着化合物处理的植物蒸腾作用减弱,且0428化合物对于蒸腾作用的抑制存在剂量效应。
5.2拟南芥和作物(如大豆、玉米)的抗旱性
移入土中两周的拟南芥停止浇水进行干旱处理,期间每周向叶面喷洒一次含0.05%Tween-20和5μM的(+)-ABA/0428或0.05%Tween-20和0.05%DMSO(对照)的溶液,喷施量为2ml溶液/盆,两周后拍照记录。如图6所示,由于浓度过低,喷施5μM(+)-ABA的植物长势与喷施DMSO的对照组无异,但喷施5μM 0428的拟南芥长势明显优于喷施DMSO的对照组和喷施5μM(+)-ABA的植物。
选取相同大小的3组3叶期大豆或小喇叭口期玉米植株进行土壤干旱实验,开始干旱后连续两天每天喷施一次含50μM的0428化合物或0.05%DMSO(对照)的水溶液,溶液中同样添加了0.1%(v/v)的表面活性剂Tween-20。玉米和大豆分别经过四天和九天的干旱处理后复水,喷施50μM的化合物0428的大豆(图8a)和玉米(图8b)在复水后的长势均明显优于喷施DMSO的对照组。
实施例6化合物1022B可诱导ABA响应的胁迫相关基因的表达
本发明人分析了外源添加化合物1022B对于植物基因表达的影响。
基因表达分析的结果表明,化合物1022B可诱导ABA响应的胁迫相关基因的表达,且表达水平大多可以达到或高于相同浓度的外源ABA所诱导的表达水平(图3)。10μM的化合物1022B处理后,10天大的野生型拟南芥(Col-0)苗期植株中,4个已知的受ABA诱导的与环境胁迫相关基因(COR15a,COR47,RAB18和RD29b)的表达量显著增加,显著超过10μM ABA处理相同时间后的水平。
结果表明,化合物1022B对于多数环境胁迫相关基因的诱导效果要显著优于ABA。
实施例7 PYL2-0428-HAB1复合物的结构
采用通用方法中所述的蛋白晶体解析方法,检测了本发明化合物0428所形成的PYL2-0428-HAB1复合物晶体结构。复合物晶体分辨率为2.4埃,对照为ABA,两种复合物晶体的二维结构局部示意图如图4a和图4b所示。
从图4a和图4b看出,0428存在于PYL2的口袋结构中。ABA结构上的四个氧原子可通过多个水分子与PYL2口袋结构以及HAB1的多个氨基酸残基形成氢键。化合物0428磺酰氨基团上的氧原子和氮原子以及喹啉环上的氧原子同样可以形成氢键,此外,对二甲苯上的卤素取代基(氟原子)还可与PYL2口袋结构内的氨基酸残基形成氢键,进一步增强化合物0428与PYL2受体的亲和性。
实施例8化合物0428对拟南芥种子萌发的抑制效果
结果如图9所示。播种9天后,2μM化合物0428和ABA同样能够抑制Col-0生态型种子的萌发,而无法抑制PYR/PYL三突变体pyr1;pyl1;pyl4种子的萌发。
结果表明,0428化合物的萌发抑制效应是因为其激活了植物内在的ABA信号通路,而非对植物种子产生了毒性,其对Col-0生态型种子萌发的抑制效果显著优于DMSO溶剂对照组。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!