调控自身增殖的轮状病毒编码的小RNA分子的制作方法
本发明涉及生物医药领域,尤其是一种一种由病毒自身编码的小RNA分子。
背景技术:
轮状病毒属于呼肠孤病毒属,是一种无包膜的二十面体形状病毒。基因组不连续,由11个节段(Segment)的双链RNA组成,编码6种结构蛋白(VP1-4, 6, 7)和6种非结构蛋白(NSP1-6)。轮状病毒非结构蛋白中大小为175aa的NSP4是一个具有多重功能的内质网跨膜糖蛋白,最早作为肠毒素被发现。结构研究较为清楚,由3个疏水区(H1-H3)和两个甘露糖糖基化位点等组成。其中,H1(8-18aa),H3(55-69aa和47-92aa),卷曲螺旋区域(coiled-coil domain)及可变区(flexible region)的多个氨基酸位点的功能已被研究,H2区的功能还未知。NSP4在轮状病毒的复制,转录和形态发生上起到重要调控作用,能够与VP6相互作用,作为双层病毒颗粒(DLP)的细胞内受体;作为孔道形成蛋白,通过与细胞内Ca2+感应器STIM1相互作用,释放细胞内储存的Ca2+,稳定三层病毒颗粒(TLPs)的外层结构;能够在病毒池表面形成帽子结构,与自噬相关。除了以上三方面的功能可能还有其他的调控功能未被研究。在轮状病毒的6个结构蛋白(VP1-4, 6, 7)中,大小为98KDa的VP3作为RNA 加帽酶,由于其结构未知,在病毒感染过程中的作用及机制被了解的最少。通过序列比对和结构预测,RV的VP3在结构上类似于蓝舌病毒(Bluetongue virus,BTV)的VP4蛋白,在功能上能够作为轮状病毒转录本的加帽酶,防止病毒RNA被宿主RNA sensor识别;直接通过裂解OAS/RNase L通路中的2-5A来阻断该通路进行免疫逃逸。但其作为轮状病毒复制机制中的重要组成成分,功能还不完全清楚。
病毒在宿主细胞中的复制是结构蛋白和非结构蛋白共同协作与宿主细胞相互作用的复杂过程,在进化过程中,病毒形成了一整套利用宿主细胞代谢机制促进自身增殖的策略。MicroRNA(miRNAs)是一类长度约为22个碱基的非编码小RNA,它们通过抑制翻译和导致mRNA降解两种方式在转录后水平调控真核生物三分之一以上基因的表达,参与了细胞的分化发育、增殖、凋亡和代谢等几乎所有生物过程。同时miRNAs也在多种疾病,如癌症、心脏病和病毒性肝炎等中扮演着重要的作用,能够调控从发育到癌症发生的各个细胞过程,具有非常重要的生物学功能。研究表明,除真核细胞外,病毒也能通过调节宿主细胞的microRNA和自身编码microRNA来对自身的感染和增殖进行调控,包括病毒的复制,持续性感染及宿主免疫逃逸等。病毒编码的miRNAs(vmiRNAs)的相对分子质量小,免疫原性较小,不会刺激机体产生免疫反应,半衰期长且进化速度要比蛋白质快得多,能通过进化调节自身从而靶向新的基因或通过降低宿主某些关键基因的表达创造有利于病毒复制的环境,对病毒增殖意义重大。对于病毒而言,其编码的miRNAs不仅能参与病毒蛋白表达,基因组复制,病毒颗粒组装等自身基因表达的调节,而且也能直接靶向调控宿主基因的表达,以利于自身的潜伏生存和逃避宿主免疫系统对其的清除。因此,研究病毒编码的miRNAs及其在与宿主细胞相互作用中的调控功能具有非常重要的理论意义和应用价值。
病毒 miRNAs的研究已经成为生命科学特别是RNA研究领域的一个重要方向,它揭示了非编码区提供给机体的一种新的重要调节机制。小RNA深度测序技术为发现病毒编码的miRNAs提供了可能,越来越多的vmiRNAs被发现,但vmiRNAs的作用机制还有待研究。轮状病毒属于呼肠孤病毒属,是一种双链RNA病毒。到目前为止,还未有轮状病毒是否编码miRNAs的报道。
技术实现要素:
本发明的目的在于发现一种调控轮状病毒增殖的由病毒自身编码的小RNA分子 RV-vsRNA1755。
本发明公开了一种调控自身增殖的轮状病毒编码小RNA分子,命名为 RV-vsRNA1755,其特征在于其核苷酸序列为:5‘ATTCAGGATCCTGGAATGGCG3’;
RV-VSRNA1755分子的序列位于NSP4基因的114aa-115aa区域,即卷曲螺旋区域(coiled-coil region)。
RV-VSRNA1755分子对轮状病毒增殖起调控作用;小RNA分子RV-VSRNA1755靶定轮状病毒VP3基因调控病毒增殖,RV-VSRNA1755能够明显调控VP3的表达,VP3基因的功能主要是在轮状病毒增殖过程中,具有加帽酶的功能,该小RNA分子能够通过靶定结合轮状病毒VP3基因,调控轮状病毒本身基因组的RNA转录加帽过程,形成反馈环,调控自身病毒增殖速度,保护宿主以免宿主细胞死亡无法支持病毒继续增殖。轮状病毒编码的小RNA研究能够进一步了解轮状病毒与宿主细胞之间相互调控关系,为寻找特异性针对轮状病毒感染的药物提供可能途径,为将来以RV-VSRNA1755分子为轮状病毒治疗靶点的药物筛选提供了理论依据。
附图说明
图1:RV-VSRNA1755结构及序列分析
图2:RV-VSRNA1755序列比对分析
图3不同细胞感染ZTR-68株后RV-VSRNA1755的检测
图4不同细胞感染Wa株后RV-VSRNA1755的检测
图5不同G型RV感染MA104细胞后RV-VSRNA1755表达水平检测
图6不同感染时间和感染剂量RV-VSRNA1755表达水平检测
图7 qRT-PCR检测RV-VSRNA1755上调和下调
图8 qRT-PCR检测RV-VSRNA1755上调和下调后轮状病毒NSP3和VP7的基因转录
图9上调和下调RV-VSRNA1755分子后轮状病毒免疫荧光检测结果(A)下调RV-VSRNA1755后RV荧光检测;(B)上调RV-VSRNA1755后RV荧光检测;(C)对照MA104细胞RV荧光检测;(D)下调RV-VSRNA1755后DAPI检测;(E)上调RV-VSRNA1755后DAPI检测;(F)对照MA104细胞DAPI检测;
图10蚀斑检测RV-VSRNA1755上下调后的子代病毒滴度
图11:miRanda软件预测RV-VSRNA1755分子靶定轮状病毒基因预测结果
图12:RV-VSRNA1755与VP3双荧光素酶检测结果((*P<0.05))
图13:MA104细胞中上调RV-VSRNA1755后,VP3转录水平检测(*P<0.01)
具体实施方式
实施例1、轮状病毒感染过程中的小RNA测序分析
将分离的野生型轮状病毒ZTR-68(保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏编号:CGMCC No.5265)感染敏感细胞MA104细胞后做小RNA深度测序分析,对轮状病毒感染过程中的microRNAs表达谱进行研究,发现有40个microRNAs在轮状病毒感染后表达水平发生改变。经过与多个数据库(miRBase database,Rfam database和GeneBank database等)比对及RT-PCR验证后发现,差异表达的40个microRNAs中有四个microRNA分子是未知功能的新的小RNA分子。其中表达差异水平最大的miRNA分子为RV-VSRNA1755,前体颈环结构和序列已被预测(图1),但其在轮状病毒感染过程中的作用及功能还不清楚。在未感染RV的MA104细胞中未检测到RV-VSRNA1755的表达,测序拷贝数为0,但在RV感染的MA104细胞中,RV-VSRNA1755的测序拷贝数高达800 多。通过qRT-PCR验证RV-VSRNA1755在感染轮状病毒的MA104细胞中的表达水平,结果显示四个新的小RNA分子中,RV-VSRNA1755的表达水平依然为最高(图1)。根据预测的RV-VSRNA1755前体序列设计引物,通过RT-CPR在轮状病毒感染的MA104细胞中克隆前体片段,克隆产物经过测序后与预测相符,相似度达96%。说明RV-VSRNA1755是由前体序列编码而来的,非RNA干扰的降解产物。
小RNA分子RV-VSRNA1755序列比对分析,将RV-VSRNA1755分子的成熟序列在Nucleotide BLAST数据库中进行比对,发现该小分子均来自于不同G型轮状病毒的NSP4基因,说明RV-VSRNA1755由轮状病毒编码而不是MA104细胞编码(图2)。通过与NSP4基因的序列比对,发现RV-VSRNA1755分子的序列位于NSP4基因的114aa-115aa区域,即卷曲螺旋区域(coiled-coil region)(图2)
实施例2、RV-VSRNA1755分子在不同毒株(野毒株和实验室株)感染不同宿主细胞后表达水平检测及其时效性表达
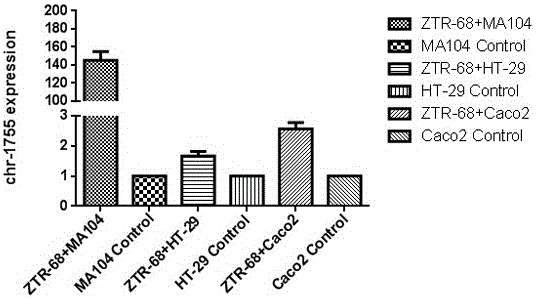
将分离的野毒株ZTR-68株和实验室株Wa株分别感染MA104细胞、HT-29细胞及Caco2细胞后,检测RV-VSRNA1755的表达,该小分子均出现了不同水平的上调(图3,图4)。野毒株和实验室株在感染MA104细胞后与其他宿主细胞相比表达水平最高(图3,图4)。我们选择实验室保存的5种G型的轮状病毒毒株感染MA104细胞后也检测到了RV-VSRNA1755不同程度的上调表达,说明RV-VSRNA1755分子的产生不只是针对G1型,在其他基因型的病毒中同样存在该调控分子(图5)。使用同一感染剂量,RV-VSRNA1755分子随感染时间,表达水平发生变化,表现为感染24h后最高,36h开始降低(图6A)。在同一感染时间点(16h),RV-VSRNA1755分子的表达随病毒感染剂量增加表达不断上调(图6B)。
实施例3、RV-VSRNA1755分子在轮状病毒增殖中的作用研究
合成针对RV-VSRNA1755分子的inhibitor和mimics,分别转染宿主细胞(MA104细胞),转染24h后感染轮状病毒。经过qRT-PCR实验验证,与对照MA104细胞相比, RV-VSRNA1755的表达水平出现了明显的上调和下调(图7)。分别于RV感染后16h后提取细胞内病毒RNA,通过real-time PCR检测轮状病毒基因组NSP3和VP7的转录情况。NSP3结果显示,相同时间点下调1755组比上调1755组NSP3的拷贝数增加要快,上调1755组对病毒增殖起到抑制作用(图8A)。VP7结果显示与对照感染组相比,上调RV-VSRNA1755分子时,RV的基因组RNA转录差异不大,但下调RV-VSRNA1755分子时,RV的基因组RNA转录明显上调(图8B);RV感染细胞16h后,通过免疫荧光检测轮状病毒蛋白的表达情况,结果显示与对照相比,上调RV-VSRNA1755后,病毒的蛋白合成不受影响,下调RV-VSRNA1755后,病毒的蛋白合成增加(图9)。收集RV病毒感染后72h病毒上清,在上调RV-VSRNA1755和下调RV-VSRNA1755的MA104细胞中盲传三代,收集病毒。通过蚀斑法检测RV-VSRNA1755上调和下调后收获的病毒滴度,结果显示,与对照细胞子代病毒相比,上调RV-VSRNA1755后,RV子代病毒的增殖与对照差异不大,但下调RV-VSRNA1755后,RV子代病毒的滴度增加(图10);
在确定了RV-VSRNA1755分子对轮状病毒增殖的调控作用后,我们通过miRanda软件预测RV-VSRNA1755分子靶定在轮状病毒ZTR-68株的VP3基因(图11),通过双荧光素酶报告系统检测了RV-VSRNA1755和靶蛋白VP3之间的存在调控作用:我们将靶基因VP3的靶定序列(NC)及突变序列(VP3 Mut)克隆至荧光素酶表达质粒,与RV-VSRNA1755分子的mimics及对照microRNA序列共转染HEK293细胞,通过荧光素酶检测试剂盒检测荧光素酶活性的相对变化情况来鉴定RV-VSRNA1755分子对该靶基因是否有调控作用,结果显示RV-VSRNA1755能够明显调控VP3的表达(图12)。
体外合成了靶基因VP3的核酸序列,与RV-VSRNA1755 mimics共转染HEK293细胞,分不同时间段取样,在确定RV-VSRNA1755上调的情况下,通过qRT-PCR检测VP3的转录情况,结果显示VP3的转录受到抑制(图13)。
5‘ATTCAGGATCCTGGAATGGCG3’
- 还没有人留言评论。精彩留言会获得点赞!