胶质母细胞瘤中同时敲除EGFRwt和EGFRvIII的方法与流程
本发明涉及DNA重组技术,更具体地是一种胶质母细胞瘤中同时敲除EGFRwt和EGFRvIII的方法。
背景技术:
胶质瘤是人颅内最常见的原发肿瘤,胶质母细胞瘤是其最恶性的一种,尽管使用先进的技术手术治疗和放化疗,胶质母细胞瘤的平均生存期仍保持在14个月左右,治疗胶质母细胞瘤是一个世界难题。患胶质母细胞瘤的患者,40-60%具有EGFR扩增,约25%伴有EGFR的III型突变(EGFRvIII),这两种情况都使EGFR活性增强,增强肿瘤的恶性程度和降低患者的预后。目前,针对EGFR扩增和突变体治疗的EGFR单克隆抗体(mAb)和小分子抑制剂(TKI)在肺癌中取得了成功,但是因为血脑屏障的存在,mAb和TKI不能到达胶质母细胞瘤,并且许多mAb和TKI并不能针对EGFRvIII起作用。
CRISPR/CAS9(Clustered Regularly Interspaced Short Palindromic Repeats/Cas9)是一种新兴的并日趋成熟的基因编辑技术。使用一段序列特异性向导RNA分子(sgRNA)引导核酸内切酶(Cas9)到靶点处,从而完成基因组的编辑。切开的DNA可以通过非同源末端链接(NHEJ)的方式修复DNA损伤,从而形成开放读码框的改变,影响基因的转录与翻译。
对于以EGFR扩增和EGFRvIII突变的胶质母细胞瘤来说,阻断或抑制EGFR wt/vIII的表达是治疗该型肿瘤的有效手段,但是如何同时针对EGFR wt/vIII的表达进行阻断和抑制是摆在眼前的难题。
技术实现要素:
本发明为了解决现有的技术手段无法同时阻断或抑制EGFRwt和EGFRvIII的表达的问题,所提出一种胶质母细胞瘤中同时敲除EGFRwt和EGFRvIII的方法。
本发明是按照以下技术方案实现的。
一种在胶质母细胞瘤中基于CRISPR/Cas9系统同时靶向敲除EGFRwt和EGFRvIII的sgRNA,所述sgRNA的基因序列如Seq ID NO.1所示。
所述sgRNA在EGFR基因的靶向位点位于EGFR基因的第17号外显子上,是表达EGFR跨膜区的基因序列。
所述sgRNA指导的CRISPR/Cas9系统在治疗胶质母细胞瘤的新型药物中的应用。
一种胶质母细胞瘤中同时敲除EGFRwt和EGFRvIII的方法:包括以下步骤:
A. Cas9和sgRNA慢病毒设计和包装:将权利要求1所述sgRNA序列使用GV371质粒连接;将含有表达sgRNA或Cas9的质粒的转染体系混合物采用瞬时共转染法转入 293T 高表达细胞系而产生重组慢病毒;最后重组慢病毒分泌到培养基中进行培养而得到大量载体慢病毒;
B.CRISPR/Cas9靶向EGFRwt/vIII抑制胶质瘤细胞:将合成好的Cas9病毒以感染复数为1加入U87胶质瘤细胞,用含10%FBS的DMEM培养,嘌呤霉素筛选5-7天后,加入EGFR sgRNA病毒,5-7天后收集细胞,western blot检测EGFR及下游基因表达,提取DNA进行EGFR基因测序,并行CCK8细胞增殖试验。
本发明获得了如下有益效果。
本发明有效的解决了现有的技术手段无法同时阻断或抑制EGFRwt和EGFRvIII的表达的问题。使用本发明所述方法可同时稳定的敲除EGFRwt和EGFRvIII两个基因,敲除后可有效的抑制肿瘤发生发展。本发明所述sgRNA有望在治疗EGFR扩增和EGFRvIII突变型胶质母细胞瘤的新型药物中得到应用。
附图说明
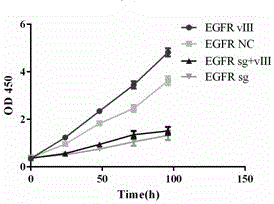
图1是本发明敲除EGFRwt/vIII后U87细胞增殖图;
图2是本发明敲除EGFRwt/vIII后LN229细胞增殖图;
图3是本发明敲除EGFR后基因编辑区的基因测序图;
图4是本发明敲除EGFR后EGFRwt/vIII及其下游基因蛋白变化图;
图5是本发明敲除EGFR后小鼠体内实验图。
具体实施方式
下面结合附图及实施例对本发明作进一步描述。
1.Cas9和sgRNA慢病毒设计和包装
Cas9质粒从addgene购买,EGFR sgRNA根据EGFR序列(NM_005228)从http://crispr.mit.edu/设计,取打分最高的序列,位于第17号染色体:AGATCCCGTCCATCGCCACT,将sgRNA序列使用GV371质粒连接。
细胞准备:
1)弃去旧培养液,加入5 ml灭菌 PBS溶液,轻轻晃动,洗涤细胞生长面,然后弃去PBS溶液。
2)用2 ml 胰蛋白酶(Gibco ,Thermo Fisher Scientific,USA)消化对数生长期的293T细胞(ATCC)。
3)以含10%血清的培养基调整细胞密度为5×106 细胞/10ml,重新接种于100 mm细胞培养皿中,37℃,5% CO2继续培养,转染前细胞密度80%左右。
质粒转染:
1)转染前 2 h 将细胞培养基更换为 Opti-MEM (Gibco ,Thermo Fisher Scientific,USA)培养基。
2)取20µl表达sgRNA或Cas9的质粒和25µl Lenti-Easy Packaging Mix(ViraPower,Thermo Fisher Scientific,USA),与相应体积(1455µl)的Opti-MEM混合均匀,总体积为1.5 ml,在室温下温育5分钟。
3)将Lipofectamine 2000(Gibco ,Thermo Fisher Scientific,USA)试剂轻柔摇匀,取60μl Lipofectamine 2000与1440µl的Opti-MEM混合均匀,总体积为1.5 ml,在室温下温育5分钟。
4)把稀释后的包装体系与稀释后的 Lipofectamine2000进行混合,轻轻地颠倒混匀(共3ml),不要振荡。在室温下温育20分钟,以便形成 DNA与Lipofectamine 2000 稀释液的转染复合物。
5)将转染体系混合物转移至293T细胞的培养液中,混匀,于37℃, 5% CO2细胞培养箱中培养。
6)培养8h后倒去含有转染混和物的培养基,每盘细胞加入10 ml的 PBS液,轻轻洗涤残余的转染混和物,然后倒去。
7)每盘细胞中加入含10%血清的 DMEM 细胞培养基 12ml,于37℃、5% CO2培养箱内继续培养48小时。
病毒上清收集:
1)转染后 48~72h,收集细胞上清液,并根据细胞生长状况适当补充新鲜细胞培养基(10% FBS,DMEM)。
2)将收集的细胞上清液1500rpm 离心5分钟,并用 0.22µm 的过滤膜(Millipore,USA)过滤,分装并于-70℃以下储存。
2.CRISPR/Cas9靶向EGFRwt/vIII抑制胶质瘤细胞
将合成好的Cas9病毒以感染复数(MOI)为1加入U87胶质瘤细胞,细胞数量大约为10-15万,含10%FBS(Hyclone)的DMEM(Gibco)培养,嘌呤霉素筛选5-7天后,加入EGFR sgRNA病毒,5-7天后收集细胞,western blot检测EGFR及下游基因表达,提取DNA进行EGFR基因测序,并行CCK8(Dojindo Laboratories, Kumamoto, Japan)细胞增殖试验。
Western blot具体方法:使用蛋白质提取试剂盒提取细胞中总蛋白,使用聚丙烯酰胺凝胶电泳,以GAPDH(抗GAPDH抗体,Millipore)为内参,检测EGFR(抗EGFR抗体:cell signaling technology)及其下游的基因表达。使用invitrogen公司DNA提取试剂盒,提取基因组DNA,将DNA产物进行PCR扩增,引物序列为:前导GGAAACGTTGCCTTAGAAGC,反向GCTTTGTGGACATTGAAGGG。反应条件为95℃ 5 min,95℃ 30 s,53℃ 45 s,72℃30 s,从第二步开始循环39次。琼脂糖凝胶电泳分离PCR产物,将目的条带回收。再用invitrogen公司DNA提纯试剂盒将DNA提纯,送测序公司测序。
CCK8试验:将U87 EGFRwt/vIII和LN229 EGFRwt/vIII使用CRISPR/Cas9技术敲除(knockout,KO)细胞分别种入96孔板,每孔3000细胞,在0,24,48,72,96小时分别在100ml DMEM培养基中加入10ul CCK8,培养2小时后,用酶标仪检测细胞吸光度,试验结果参见图1、图2 。
3.体外实验
以胶质瘤中U87和LN229细胞(ATCC)为例,EGFRvIII细胞先用表达EGFRvIII的慢病毒(3ul)转染并用puromycin筛选成为稳定表达的细胞系。分别分为四个组,空白病毒对照组(阴性空白对照病毒3ul)、共转Cas9和sgRNA组(表达Cas9和sgRNA慢病毒各3ul)、EGFRvIII组(不含表达Cas9和sgRNA慢病毒)、共转EGFRvIII(含表达Cas9和sgRNA慢病毒各3ul)。按照病毒的滴度以及培养皿中细胞的密度加入相应量的Cas9病毒,稳定表达5-7天后,加入相应量的sgRNA,在培养箱中培养5-7天,待基因剪切、修复、再次表达后,收集细胞DNA,蛋白,通过基因测序(图3)和western blot(图4)的方法,确认EGFR基因被编辑,并且EGFR蛋白表达下调,进而影响EGFR下游蛋白活性。细胞增殖试验也证明了敲除EGFR或EGFRvIII有效的抑制体外肿瘤细胞增殖活性。
4. 小鼠颅内原位模型的建立
(1)取U87EGFR和U87EGFR KO胶质母细胞瘤细胞经 0.125%胰酶消化,1000rpm×10 分钟常温离心去上清,以 PBS 离心洗涤 2 次;(2)计算细胞数;调整细胞浓度至 2×108/ml,将细胞悬浮于无血清 DMEM 培养液中,制成细胞悬液。(3)将待试验小鼠称重,用 5%的水合氯醛腹腔注射麻醉(剂量:0.001ml/g)。(4)常规酒精消毒头部皮肤,沿头部正中线偏右 3mm 并与两耳连线垂直切开头部皮肤,暴露颅骨,取对侧眼、耳连线交点偏右 2mm 处,细针钻透颅骨,将小鼠用立体定向仪三角架固定。(5)量程为 5μl 的微样进样器吸取 3μl 细胞悬液(约含 5×105细胞)后置于立体定向仪(STOELTING CO.620 WHEAT LANE,USA)上,沿钻孔处进针 3mm,后退 1mm,后启动立体定向仪缓慢注入细胞悬液。(6)注射完毕后,将皮肤切口缝合,并消毒创面,小鼠放回笼中。
结果判定:体外成像技术:颅内肿瘤模型成瘤一周后,每周一次从每组中随机抽取三只小鼠,5%的水合氯醛腹腔注射麻醉后,1×荧光素酶底物200ul腹腔注射,反应十分钟后,荧光成像仪检测荧光强度(参见图5a)。生存分析:从颅内成瘤模型形成后,每日观察小鼠的生长状态,并记录小鼠的生存时间(参见图5b)。免疫组化:将处死的小鼠大脑取出,PBS清洗后放入4%多聚甲醛中固定24小时,蜡块包埋并切10um片,分别行HE染色和抗EGFR免疫组化染色(参见图5c)。
SEQUENCE LISTING
<110> 天津医科大学总医院
<120> 胶质母细胞瘤中同时敲除EGFRwt和EGFRvIII的方法
<130> 1
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> RNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<220>
<221> sgRNA
<222> (1)..(20)
<400> 1
agatcccgtc catcgccact 20
SEQUENCE LISTING
<110> 天津医科大学总医院
<120> 胶质母细胞瘤中同时敲除EGFRwt和EGFRvIII的方法
<130> 1
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> RNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<220>
<221> sgRNA
<222> (1)..(20)
<400> 1
agatcccgtc catcgccact 20
- 还没有人留言评论。精彩留言会获得点赞!