荧光定量RT‑PCR检测促甲状腺激素受体基因mRNA表达的试剂盒及其使用方法与流程
本发明涉及基因检测领域,特别涉及一种荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒及其使用方法。
背景技术:
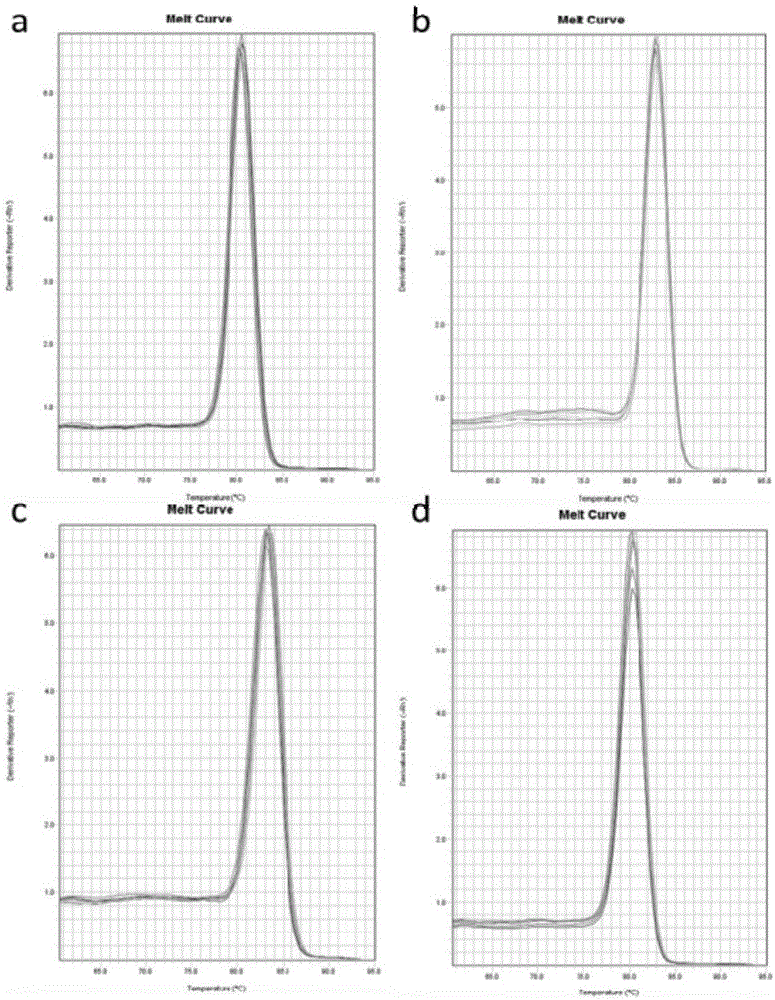
:甲状腺结节在临床上很常见,其中多数为良性结节,少数为恶性结节,二者早期临床表现相似,但治疗方法及预后并不相同,因此鉴别甲状腺结节良恶性质至关重要。尽管临床上可采用高分辨率超声、扫描、CT、MRI、甲状腺细针穿刺细胞学检查(FNAC)等来评估结节的良恶性质,但依然存在一定的局限性,造成了一些患者进行不必要的手术治疗。由于甲状腺癌细胞可以分泌、表达一些甲状腺特异性抗原,因此,近年国外一些学者致力于在组织或外周血中寻找甲状腺癌的分子标志物,关注热点包括DNA甲基化物、BRAF基因、甲状腺球蛋白(Tg)mRNA、促甲状腺素激素受体(TSHR)mRNA和甲状腺过氧化物酶(TPO)mRNA等,国内近年也有外周血TgmRNA表达的报道,但离临床实际应用尚有距离。甲状腺癌是最常见的头颈部内分泌肿瘤,分为分化型甲状腺癌(DTC)和未分化甲状腺癌(ATC)。分化型甲状腺癌(DTC)是其主要病理学类型,占甲状腺癌的绝大多数,主要包括甲状腺乳头状癌(PTC)和甲状腺滤泡癌(FTC)。其中,PTC占85%,FTC占10%。DTC属低度恶性肿瘤,侵袭性弱,进展较缓慢,预后良好,10年生存率达80-95%,但存在一定的复发及转移的风险,有报道称,约20%-40%的DTC患者术后会发生复发和转移。因此,需要长期随访以监测病情变化。目前,随访的手段包括血清甲状腺球蛋白(thyroglobulin,Tg)检测、1311全身显像(wholebodyscan,WBS)、18F-FDGPET显像。Tg检测法,经过甲状腺全切及放射性531I治疗后,甲状腺球蛋白抗体(anti-thyroglobulinantibodies,TgAb)为阴性的情况下,血清Tg对检测甲状腺癌是否复发具有较高的敏感性和特异性。然而10%正常人存在TgAb,同时20%40%的甲状腺癌患者存在TgAb抗体,TgAb抗体的存在干扰了Tg的测量,导致Tg检测的敏感性及特异性下降。且在抑制性促甲状腺激素(TSH)的条件下,Tg的敏感性下降到40%左右,存在假阴性。WBS方法也因为各种因素常常会出现假阴性。停用甲状腺激素,在TSH刺激条件下,可以提髙血清Tg和WBS诊断的敏感性,但是这样可能会刺激DTC病灶的生长。18F-FDGPET显像在诊断DTC复发及转移灶方面的诊断率由于感染、炎性病变及其他部位的非特异性摄取等因素的影响存在一定的假阳性率,且PET/CT检查费用较高,不能作为常规随访手段。鉴于以上鉴别甲状腺结节良恶性质的方法以及患者术后随访手段均存在一定的局限性,甲状腺癌分子标志物的探查及研究越来越广泛。目前,己检测到34种甲状腺癌分子标志物,绝大多数的分子标志物检测是基于外科病理组织标本,还有一部分是基于细针穿刺组织学检查(FNAB),材料不易得到且有创。甲状腺球蛋白(Tg)和促甲状腺激素受体(TSHR)均与甲状腺细胞生长、发育、成熟、衰老、变异及功能有密切关系。虽然,血清Tg测定是公认的监测DTC复发的敏感手段之一,但由于TgAb的存在,干扰了对Tg的测定结果,从而影响了对结果的正确判断。人TSHR由于获取困难和技术原因目前尚没有建立真正的测定方法。生物的生长、发育、衰老和病变通常是由基因在不同阶段和部位的差异表达决定的。基因表达差异最终表现为蛋白质合成的差异,并在一定程度上决定了细胞的激活、增殖、分化、病变和凋亡。定量分析mRNA,是了解机体生长发育调控和病变机理的—个重要方面。TgmRNA及TSHRmRNA是基于基因水平的检测,只需少量外周血即可,取材方便,其检测既可消除TgAb的不利干扰,又可绕开TSHR的技术难点。利用实时荧光定量PCR(RT-PCR)技术测量外周血TgmRNA及TSHRmRNA相对表达量的技术对模板要求较高,对引物设计要求较高,且TSHRmRNA相对表达量的检测特异度不高。技术实现要素:有鉴于此,本发明旨在提供一种荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒及其使用方法,该试剂盒利用Taqman-qPCR法,对外周血及肿瘤组织等样品中是否存在TSHR-mRNA的表达及表达水平进行检测。为达到上述目的,本发明的技术方案是这样实现的:本发明提供了一种荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒,包括用于扩增促甲状腺激素受体mRNA反转录cDNA的引物、用于促甲状腺激素受体mRNA反转录cDNA检测的探针:1)所述的用于扩增促甲状腺激素受体mRNA反转录cDNA的引物为下列组合中的一种:组合a)上游引物为TSHR_F1、下游引物为TSHR_R1;组合b)上游引物为TSHR_F2、下游引物为TSHR_R2;组合c)上游引物为TSHR_F3、下游引物为TSHR_R3;组合d)上游引物为TSHR_F4、下游引物为TSHR_R4;2)所述的用于促甲状腺激素受体mRNA反转录cDNA检测的探针序列为TSHR_P1、TSHR_P2中的一种。进一步的,荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒,还包括内标、内标引物、检测内标的探针。进一步的,荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒中的内标序列为SEQIDNO:1所示的序列。进一步的,荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒中的内标引物,上游引物为GAPDH_F1、GAPDH_F2和GAPDH_F3中的一种,下游引物为GAPDH_R1、GAPDH_R2和GAPDH_R3中的一种;所述的检测内标的探针为GAPDH_P1、GAPDH_P2中的一种。进一步的,荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒中的内标引物,上游引物为GAPDH_F4,下游引物为GAPDH_R4;所述的检测内标的探针为GAPDH_P3。进一步的,荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒还包括阳性对照品,所述的阳性对照品的序列为SEQIDNO:2。进一步的,荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒还包括特异性反转录引物,所述特异性反转录引物序列为RT1-RT8。进一步的,荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒中所述的用于促甲状腺激素受体mRNA反转录cDNA检测的探针具有荧光标记,其荧光标记5’端为FAM、HEX、ROX和JOE中的一种,3’端为TAMRA、BHQ和Elipse中的一种。本发明的另一目的在于提出一种荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒的使用方法:为达到上述目的,本发明的技术方案是这样实现的:一种荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒的使用方法:1)提取肿瘤组织或者血液RNA后,对提取的RNA进行逆转录,在逆转录的过程中加入特异性反转录引物RT1-RT8;反转录反应条件为:42℃孵育30-50分钟,85℃孵育5分钟;荧光定量检测反应条件为:95℃5分钟、95℃20秒、60℃40秒,40循环收集荧光信号;2)逆转录后得到cDNA,以获得的cDNA为模板进行促甲状腺激素受体基因mRNA的表达:a)利用扩增促甲状腺激素受体mRNA反转录cDNA的引物和促甲状腺激素受体mRNA反转录cDNA检测的探针检测受检样本中促甲状腺激素受体基因mRNA的表达,利用阳性对照品作为对照以排除假阴性结果;b)以内标GAPDH引物和内标探针检测相同受检样品中GAPDH的表达,同时检测内标为对照以排除假阴性结果。相对于现有技术,本发明具有以下优势:本发明所述的试剂盒利用Taqman-qPCR法,对外周血、肿瘤组织等样品中是否存在TSHR-mRNA的表达及表达水平进行检测,具有灵敏度高、准确性高、检出率高和特异性的优点,还配有内标和阳性对照品,可以有效消除假阳性和假阴性结果,抗干扰能力强,检测快速经济,对患者创伤小,产品稳定性高的特点。附图说明构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:图1为引物特异性分析;图2为探针筛选TSHR表达检测结果;图3为引物及探针特异性TSHR表达检测结果;图4为内标、内标引物、检测内标探针TSHR样本检测结果;图5为阳性对照品TSHR检测结果;图6为特异性反转录引物TSHR检测结果;图7为样本检测结果;具体实施方式需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本发明。实施例1本实施例为扩增促甲状腺激素受体mRNA反转录cDNA的引物及探针的设计筛选。根据TSHR基因mRNA的表达、剪切以及转录组水平其他相似序列,控制引物长度和序列,以增加引物特异性,据此以TSHR基因CCDS(GenBank序列号CCDS9872.1)全长序列为模板,设计六对引物。六对引物分别与总mRNA序列进行比对,验证了六对引物的扩增特异性。然后通过具体实验进一步验证引物的扩增效率以及特异性:以甲状腺癌组织提取的总mRNA反转录获得的DNA样本为模板,分别利用六对引物进行SYBRGreen-qPCR扩增,扩增条件为:95℃10分钟;(95℃15秒,60℃1分钟)50循环;通过扩增曲线验证各对引物扩增效率,通过熔解曲线验证各对引物的扩增特异性。最终筛选出具有良好扩增特异性的引物对组合,结果如附图1引物特异性分析图所示:分别为a)上游引物为TSHR_F1、下游引物为TSHR_R1;组合b)上游引物为TSHR_F2、下游引物为TSHR_R2;组合c)上游引物为TSHR_F3、下游引物为TSHR_R3;组合d)上游引物为TSHR_F4、下游引物为TSHR_R4。以筛选出的四对扩增引物的扩增产物为模板,设计三条TaqMan探针。以不同浓度的阳性对照品为模板,用引物组合a)-d)进行qPCR扩增验证三条探针检测效率,扩增条件为:95℃5分钟(95℃20秒,60℃40秒),50循环检测信号。通过扩增曲线最终筛选出探针TSHR_P1、TSHR_P2具有较好的检测效率。结果如附图2引物及探针筛选TSHR表达检测结果所示:本发明探针序列的设计考虑到探针与转录组其他序列可能产生的错配以及和现有TSHR检测引物、内标引物可能产生的错配等因素,通过设计以增加其有效性和特异性。实施例2本实施例为用于扩增促甲状腺激素受体mRNA反转录cDNA的引物及探针的特异性测试,在本实施例中的试剂盒仅包括用于扩增促甲状腺激素受体mRNA反转录cDNA的引物及探针,以必要的试剂。1、操作过程1)样本制备将抽取的5毫升EDTA抗凝的新鲜外周血经红细胞裂解液处理去除红细胞后,进行总RNA提取。2)逆转录反应取一定量的总RNA于等温扩增反应液中进行逆转录反应获得DNA样本。3)TSHR基因表达量的检测以逆转录获得的DNA样本为模板,利用TSHR检测的引物和探针,通过qPCR法检测TSHR的表达量。2、检测结果以qPCR检测的TSHR的扩增曲线为最终的检测结果。不同检测样本浓度(检测样本),PBMC和NTC。共检测不同浓度样本4例,PBMC和阴性对照NTC。PBMC信号较弱,Ct值为36.9,而阴性对照NTC未检出信号。如表1引物及探针特异性TSHR样本检测,附图3引物及探针特异性TSHR表达检测结果所示,检测样本1-4的Ct值从23.4-29.2。表1引物及探针特异性TSHR样本检测3、结果分析1)TSHR检测引物和探针能够有效检测不同浓度TSHR的样本。2)以正常人血液提取的PBMC为模板以及未加扩增模板时,未检测到明显荧光信号,说明检测引物和探针具有较好的特异性。实施例3本实施例为内标、内标引物、检测内标探针的设计筛选。检测试剂盒最终判定TSHR表达量相对高低,通过与内标(GAPDH)扩增为参比,并以Ct来判定,Ct=Ct(GAPDH)—Ct(TSHR)。GAPDH为反应模板起始量的常用内参,及时检测样本含有相近含量的TSHR,但经过GAPDH换算后,单位样本量中TSHR表达是不同的,如表2内标、内标引物、检测内标探针TSHR样本检测及附图4内标、内标引物、检测内标探针TSHR样本检测结果所示。因此,内标可以有效量化两份来源不同的检测样本,使的不同来源的受检样本中TSHR表达量具有可比性。以内标GAPDH引物和探针检测相同受检样品中GAPDH的表达,对受检样本起到量化的作用;与此同时检测内控标准品,作为对照以排除操作失误和仪器故障,排除假阴性结果。表2内标、内标引物、检测内标探针TSHR样本检测实施例4本实施为阳性对照品技术效果描述。当检测试剂盒中某一成分失效,或操作失误忘记加入某一检测成分(如反转录引物、检测引物、反应液等),或检测条件设定错误,或检测仪器温控故障等。若无阳性对照品,则样本的样本检测结果为阴性;而在对检测样本以及阳性对照品的平行检测实验中,阳性对照品的阴性检测结果可以说明样本的假阴性检测结果。如表3不同样本中TSHR基因表达检测、附图5阳性对照品TSHR检测结果所示,样品9-16均未检测到明显的荧光信号,因此仅以荧光信号无法判定可能原因,但加入阳性对照品后则能够排除配样或者仪器故障等原因引起的阴性结果。表3不同样本中TSHR基因表达检测实施例5本实施例为特异性反转录引物技术效果描述。特异性反转录引物RT1-RT8能够更加有针对的反转录TSHR的mRNA,因此能够提高本试剂盒的检测灵敏度。对七份1×106个正常人外周血单个核细胞(PBMC)中混入10个甲状腺肿瘤细胞的样本进行mRNA的提取,命名为模板1-7。其中,模板1-6除了正常进行反转录体系外,加入特异性反转录引物RT1-RT8;模板7进行常规总mRNA的反转录获取DNA样本,未加入特异性反转录引物;模板8为正常人血液PBMC样本,作为阴性对照,反转录是同时加入特异性逆转录引物;NTC为灭菌超纯水。通过TSHR检测扩增引物对TSHR_F1/TSHR_R1、检测探针TSHR_P1,分别对两份DNA样本进行qPCR扩增检测。表4反转录cDNA如表4反转录cDNA、附图6特异性反转录引物TSHR检测结果所示,qPCR扩增曲线显示,加入特异性反转录引物RT1-RT8的样本能够检测出TSHR基因产物(模板1-6),未加入特异性反转录引物RT1-RT8的样本检测TSHR信号较弱(模板7)。而PBMC(模板8)即使加入特异性引物也未能检测出有效Ct信号。由此可见,特异性反转录引物RT1-RT8能够增加TSHR基因的检测灵敏度。实施例6本实施例为试剂盒的使用方法。1、标本的制备50毫升离心管中加入30毫升红细胞裂解液,将EDTA抗凝的5毫升新鲜外周血倒入红细胞裂解液中,室温放置5至10分钟,待液体变为红色透明状态后于400G转速下离心10分钟。弃去上清液,留下白细胞沉淀物,向离心管中加入5毫升PBS重悬沉淀,400G转速离心5分钟。弃上清,向细胞沉淀中加入1毫升BufferRLT(康为世纪,目录号CW0538S)重悬细胞沉淀。2、总RNA提取血液RNA提取选用康为世纪血液RNA提取试剂盒(目录号CW0538S)。1)将上述BufferRLT重悬的液体转移至已装入收集管的过滤柱(SpinColumnsFL)中,12000rpm(~13400g)离心2分钟,收集滤液,弃掉过滤柱。若一次不能加完溶液,可分多次转入,多次收集滤液;2)向滤液中加入1倍体积的70%乙醇(无RNase水配制),混匀;3)将上述溶液全部加入到已装入收集管的吸附柱(SpinColumnsRM)中,12000rpm离心15秒,倒掉收集管中废液,将吸附柱重新放回收集管中;若一次不能加完溶液,可分多次转入;4)向吸附柱中加入350μlBufferRW1,12000rpm离心1分钟,弃废液,将吸附柱重新放回收集管中;5)配制DNaseI混合液:取52μlRNase-FreeWater,向其中加入8μl10×ReactionBuffer和20μlDNaseI(1U/μl),混匀,配制成终体积为80μl的反应液;6)向吸附柱中直接加入80μlDNaseI混合液,20-30℃孵育15分钟;7)向吸附柱中加入350μlBufferRW1,12,000rpm离心1分钟,弃废液,将吸附柱重新放回收集管中;8)向吸附柱中加入500μlBufferRW2(使用前检查是否已加入无水乙醇),12,000rpm离心15秒,倒掉收集管中的废液,将吸附柱重新放回收集管中;9)重复步骤8;10)12,000rpm离心2分钟,倒掉收集管中的废液;将吸附柱置于室温数分钟,以彻底晾干;11)将吸附柱置于一个新的RNase-Free的1.5ml离心管(自备)中,向吸附柱的中间部位加入30-50μlRNase-FreeWater,室温放置1分钟,12,000rpm离心1分钟,收集RNA溶液,-70℃保存RNA,防止降解。3、RT-PCR1)取1μl上述步骤获取的RNA为模板,冰上配制以下反应体系,总体积为20μl。(等温扩增反应液:康为世纪目录号:uperRTcDNASynthesisKit货号CW0741M)反应体系:试剂加入体积RNA模板1ng-5μg等温扩增反应液10μlTSHR特异反转录引物RT1-RT80.5μlOligod(T)1μl无RNase超纯水补齐至20μl2)涡旋震荡混匀,短暂离心,使管壁上的溶液手机到管底。3)42℃孵育30-50分钟,85℃孵育5分钟。反应结束后,短暂离心,置于冰上冷却。4)上述获取的逆转录产物进行qPCR检测TSHR表达,冰上配制以下反应体系,总体积为20μl。检测扩增反应缓冲液康为试剂UltraSYBRMixture(LowROX)CW2601MTSHR检测反应体系:试剂加入体积反转录产物模板10ngTSHR检测上游引物1μlTSHR检测下游引物1μlTSHR检测探针0.5μl检测扩增反应缓冲液10μl超纯水补齐至20μlGAPDH检测反应体系:TSHR检测探针:5’-FAM-TCTGCTGGCTCTCCTGGGCA-TAMRA-3’GAPDH检测探针:5’-FAM-ACCTTGCCCACAGCCTTGGC-TAMRA-3’反应条件:955分钟;(9520秒,6040秒)40循环检测信号5)内标检测试剂加入体积内标质控品5ngGAPDH检测上游引物1μlGAPDH检测下游引物1μlGAPDH检测探针0.5μl检测扩增反应缓冲液10μl超纯水补齐至20μlGAPDH检测探针:5’-FAM-ACCTTGCCCACAGCCTTGGC-TAMRA-3’反应条件:955分钟;(9520秒,6040秒)40循环检测信号6)阳性对照品检测试剂加入体积阳性质控品5ngTSHR或GAPDH检测上游引物1μlTSHR或GAPDH检测下游引物1μlTSHR或GAPDH检测探针0.5μl检测扩增反应缓冲液10μl超纯水补齐至20μlTSHR检测探针:5’-FAM-TCTGCTGGCTCTCCTGGGCA-TAMRA-3’反应条件:955分钟;(9520秒,6040秒)40循环检测信号4、结果分析1)RNA提取、质检与获得cDNA表5RNA和cDNA浓度测定经过Nanodrop2000测定不同肿瘤样本中提取的RNA以及反转录浓度如表5所示,浓度和OD260/280比值符合条件能够进行下游检测。2)临床样本检测表6不同样本检测TSHR表达TSHR表达以Ct来判定,Ct=Ct(GAPDH)—Ct(TSHR)。如表6、附图7样本检测结果所示对于TSHR阳性质控品检测,THSR引物和探针能够检测Ct值约为15;对于GAPDH阳性质控品的检测,GAPDH引物和探针能够检测,Ct值约为15。通过甲状腺癌患者肿瘤组织和血液样本(肿瘤组织1,肿瘤组织2,血液样本1和血液样本2)的检测,待检样本Ct均显著高于阴性对照PBMC1和PBMC2。实施例7本实施例为一系列试剂盒产品对样品进行检测的效果数据。其中内标均为SEQIDNO:2所示序列,阳性对照均为SEQIDNO:1所示序列,特异性反转录引物为RT1-RT8。制备肿瘤组织、血液样本以及阴性对照品(PBMC)各20份标准品,利用不同组合构成的试剂盒产品进行检测,从检测准确率,特异性和稳定性方面进行验证,如表7所示。表7系列试剂盒检测效果以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。SEQUENCELISTING<110>河北德路通生物科技有限公司<120>荧光定量RT-PCR检测促甲状腺激素受体基因mRNA表达的试剂盒及其使用方法<160>31<170>PatentInversion3.3<210>1<211>203<212>DNA<213>内标序列<400>1actgtggatggcccctccgggaaactgtggcgtgatggccgcggggctctccagaacatc60atccctgcctctactggcgctgccaaggctgtgggcaaggtcatccctgagctgaacggg120aagctcactggcatggccttccgtgtccccactgccaacgtgtcagtggtggacctgacc180tgccgtctagaaaaacctgccaa203<210>2<211>240<212>DNA<213>阳性对照品<400>2gttcctgagaattgtggtgtggttcgttagtctgctggctctcctgggcaatgtctttgt60cctgcttattctcctcaccagccactacagcatggggatgtacctgctcctcatcgcctc120tgtagacctctacactcactctgagtactacaaccatgccatcgactggcagacaggccc180tgggtgcaacacggctggtttcttcactgtctttgcaagcgagttatcggtgtatacgct240<210>3<211>20<212>DNA<213>TSHR_F1<400>3gctcctcatcgcctctgtag20<210>4<211>21<212>DNA<213>TSHR_F2<400>4tcctcatcgcctctgtagacc21<210>5<211>20<212>DNA<213>TSHR_F3<400>5gggatgtacctgctcctcat20<210>6<211>20<212>DNA<213>TSHR_F4<400>6gagaattgtggtgtggttcg20<210>7<211>20<212>DNA<213>TSHR_R1<400>7tacaccgataactcgcttgc20<210>8<211>20<212>DNA<213>TSHR_R2<400>8ggctggtgaggagaataagc20<210>9<211>21<212>DNA<213>TSHR_R3<400>9cagtgaagaaaccagccgtgt21<210>10<211>20<212>DNA<213>TSHR_R4<400>10agtgaagaaaccagccgtgt20<210>11<211>20<212>DNA<213>TSHR_P1<400>11tctgctggctctcctgggca20<210>12<211>20<212>DNA<213>TSHR_P2<400>12tgttgcacccagggcctgtc20<210>13<211>20<212>DNA<213>GAPDH_F1<400>13atcatccctgcctctactgg20<210>14<211>18<212>DNA<213>GAPDH_F2<400>14tccctgcctctactggcg18<210>15<211>20<212>DNA<213>GAPDH_F3<400>15tggtatcgtggaaggactca20<210>16<211>20<212>DNA<213>GAPDH_F4<400>16tcaagaaggtggtgaagcag20<210>17<211>20<212>DNA<213>GAPDH_R1<400>17gtcaggtccaccactgacac20<210>18<211>18<212>DNA<213>GAPDH_R2<400>18gcagtggggacacggaag18<210>19<211>20<212>DNA<213>GAPDH_R3<400>19ccagtagaggcagggatgat20<210>20<211>20<212>DNA<213>GAPDH_R4<400>20cgctgttgaagtcagaggag20<210>21<211>20<212>DNA<213>GAPDH_P1<400>21accttgcccacagccttggc20<210>22<211>20<212>DNA<213>GAPDH_P2<400>22acgccacagtttcccggagg20<210>23<211>20<212>DNA<213>GAPDH_P3<400>23cctcaagggcatcctgggct20<210>24<211>18<212>DNA<213>RT1<400>24ccaggcgcatggcgaagg18<210>25<211>19<212>DNA<213>RT2<400>25gctacttattcccaccaaa19<210>26<211>15<212>DNA<213>RT3<400>26gaagcagggcgagaa15<210>27<211>25<212>DNA<213>RT4<400>27gctcctcatcgcctctgtagacctc25<210>28<211>18<212>DNA<213>RT5<400>28cgatgacgaaggcaacta18<210>29<211>21<212>DNA<213>RT6<400>29cagcagcagacgatgacgaag21<210>30<211>16<212>DNA<213>RT7<400>30accctgcctcatctcg16<210>31<211>16<212>DNA<213>RT8<400>31tggattggcacaggag16当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1