从多能干细胞分化巨噬细胞的制作方法
相关申请的交叉引用
本申请要求2015年1月16日提交的新加坡申请第10201500366v号的优先权,其内容以引用的方式全部并入本文中以用于所有目的。
本发明涉及从干细胞分化巨噬细胞。具体来说,本发明涉及一种用于从干细胞分化原始巨噬细胞的无血清、无饲养层细胞且无胚状体的方法。
背景技术:
巨噬细胞是单核吞噬细胞,其在体内稳态和免疫力中起关键作用,但也造成广泛范围的病理且因此代表关键的治疗标靶。然而,在对于从人多能干细胞分化原始巨噬细胞的深入研究中,其体内稳态以及其在组织特异性情形中的指定活性目前是缺乏的。
根据单核吞噬细胞系统(mps)概念,组织常驻型巨噬细胞的稳态依赖于血液单核细胞的恒定募集。然而,虽然单核细胞在病理环境和炎症中明确产生巨噬细胞,但是最新证据显示(1)单核细胞在稳态下和在某些类型的炎症中并不显著产生特定的组织巨噬细胞,和(2)一些成人组织巨噬细胞例如脑小胶质细胞是衍生自被称作原始巨噬细胞的胚胎原始前体,其在出生前就植根在组织中并且通过自我更新在成人体内自我维持。
基于这个证据,需要对体外巨噬细胞的胚胎原始起源进行重述以便设计出靶向单核细胞和巨噬细胞的新颖临床策略。在这方面,用于人细胞的造血分化的绝大多数的现有方法都利用使用基质层的共培养,或胚状体(eb)。许多这些方案依赖于使用不明确的牛血清补充剂。这些条件将固有水平的可变性引入到人细胞的造血分化方案中,这会影响再现性和产率。因此,需要提供一种造血分化方法,其克服或至少改善以上描述的一或多个缺点,从而重述体外巨噬细胞的胚胎起源。
技术实现要素:
在一方面,提供了一种用于从干细胞培养类原始巨噬细胞的方法,其中所述方法包括:
(a)将所述干细胞与包括gsk3抑制剂的无血清培养基接触并孵育以诱导所述干细胞分化成中胚层谱系的细胞;
(b)将所述中胚层谱系的细胞与包括dkk1的培养基接触并孵育以使所述中胚层谱系的细胞分化成造血细胞谱系的细胞;
(c)使所述造血细胞谱系的细胞成熟;
(d)将所述造血细胞谱系的成熟细胞与包括m-csf的培养基接触并孵育以促使所述造血细胞分化成类原始巨噬细胞。
在一方面,提供了一种用于如本文所定义的方法中的试剂盒,其包括gsk3抑制剂和dkk1以及使用说明书。
在一方面,提供了一种通过本文所述的方法获得的类原始巨噬细胞。
在一方面,提供了本文所述的类原始巨噬细胞用于开发体外疾病模型的用途,其中所述疾病是神经变性疾病、代谢疾病、呼吸系统疾病、心血管疾病、结缔组织疾病、癌症或炎性疾病。
在一方面,提供了本文所述的小胶质细胞用于开发体外疾病模型的用途,其中所述疾病是神经变性疾病。
在一方面,提供了本文所述的类原始巨噬细胞用于筛选供治疗疾病用的化合物的用途,其中所述疾病是神经变性疾病或代谢疾病。
在一方面,提供了本文所述的小胶质细胞用于筛选供治疗疾病用的化合物的用途,其中所述疾病是神经变性疾病。
在一方面,提供了本文所述的类原始巨噬细胞用于制造用在伤口愈合和组织再生中的药物的用途。
在一方面,提供了本文所述的类原始巨噬细胞用于将载运分子(cargomolecule)递送到组织中的用途,其中所述载运分子是免疫调节性细胞因子或趋化因子,或活化前药的酶。
在一方面,提供了一种用于从鼠干细胞培养类原始巨噬细胞的方法,其中所述方法包括:
(a)将所述干细胞与包括fgf2和bmp4的无血清培养基接触并孵育以诱导所述干细胞分化成中胚层谱系的细胞;
(b)将所述中胚层谱系的细胞与包括fgf2、bmp4、激活素a(activina)和vegf的培养基接触并孵育以使所述中胚层谱系的细胞分化成造血细胞谱系的细胞;
(c)使所述造血细胞谱系的细胞成熟;
(d)将所述造血细胞谱系的成熟细胞与包括m-csf的培养基接触并孵育以促使所述造血细胞分化成类原始巨噬细胞。
附图说明
当结合非限制性实施例和附图考虑时,参考具体实施方式将更好地理解本发明,其中:
图1显示本发明方法的流程图。
图2显示用于添加本发明方法中所用的生长因子的时间表。
图3显示从a)h1es细胞、b)患者来源的wtipsc和c)患者来源的突变型ipsc分化的巨噬细胞的流式细胞术分析:依次对细胞的fsc/ssc谱、然后活细胞(dapi-)、然后造血细胞(cd45+)且然后单峰(ssc-a和ssc-w门)设门。显示常见巨噬细胞标志物的表达谱:cd14、hla-dr、cd11b和cd163。从h1es细胞、患者来源的wtipsc和患者来源的突变型ipsc分化的巨噬细胞是cd14+、hla-dr+,且大多数是cd163+和cd11b+。(ssc=侧向散射:侧向散射测量与激光路径成90度的散射光并测量细胞的粒度;fsc=前向散射:前向散射测量在激光路径方向上的散射光并测量细胞的大小;dapi(4',6-二脒基-2-苯基吲哚二盐酸盐):cd45:全造血细胞标志物;hla-dr:巨噬细胞和树突状细胞标志物,由人白细胞抗原复合物编码的mhcii类细胞表面受体;cd14:分化抗原簇14,巨噬细胞标志物;cd11b:整合素αm(itgam),巨噬细胞标志物;cd163:分化抗原簇163,血红蛋白-结合珠蛋白复合物的高亲和力清道夫受体,巨噬细胞标志物)。
图4显示暴露于荧光标记的乳胶粒或淀粉样aβ肽的第12天分选的ipsc来源的原始巨噬细胞的吞噬试验的结果。iba-1=离子钙结合衔接分子1(小胶质细胞和巨噬细胞标志物);cx3cr1=fractalkine受体;dic=微分干涉相差。
图5显示在培养7天后,从ipsc来源的原始巨噬细胞于神经元上的共培养物获得的结果的显微镜图像。tuj1=神经元特异性iii类β-微管蛋白标志物;iba1=离子钙结合衔接分子1(小胶质细胞和巨噬细胞标志物);hoechst=荧光染料,其标记dna且然后标记细胞核。图像右上角的数字(*60和*100)指示显微镜的放大倍数。
图6显示在共培养的不同天数(7、16和21),从ipsc来源的原始巨噬细胞于ipsc来源的神经元(相同ipsc来源)上的共培养物获得的结果的显微镜图像。
图7显示对csf2ar-ko小鼠(cd45.2)模型鼻内移植鼠ipsc来源的原始巨噬细胞以测试其功能的策略的图解。
图8显示以下三项的流式细胞术分析:a)野生型(wt)小鼠肺(8个月大);b)csf2ar-ko小鼠肺(9个月大),其中没有显示肺泡巨噬细胞(分化缺陷);和c)csf2ar-ko小鼠肺(1.5个月大)+阳性对照(冷冻ipsc巨噬细胞)。
图9显示用ipsc
图10显示鼠ipsc来源的原始巨噬细胞能够嫁接到肺中超过8周并得到肺泡巨噬细胞的标志物(siglecf)。
图11显示鼠ipsc来源的原始巨噬细胞(cx3cr1-gfp+)可嫁接到肺中超过8周并吞噬表面活性物质相关蛋白b(spb)。
图12显示从csf2ar-ko小鼠(ko)和用ipsc来源的原始巨噬细胞移植的csf2ar-ko小鼠(ko-移植)收集的支气管肺泡灌洗液的浑浊度。灌洗液的光密度在600nm下测量。
图13显示从野生型小鼠(wt)、csf2ar-ko小鼠(ko)和用ipsc来源的原始巨噬细胞移植的csf2ar-ko小鼠(ko-移植)收集的支气管肺泡灌洗液的浑浊度。灌洗液的光密度在600nm下测量。
具体实施方式
在第一方面,本发明涉及一种从干细胞培养类原始巨噬细胞的方法。所述方法包括:(a)将所述干细胞与包括gsk3抑制剂的无血清培养基接触并孵育以诱导所述干细胞分化成中胚层谱系的细胞;(b)将所述中胚层谱系的细胞与包括dkk1的培养基接触并孵育以使所述中胚层谱系的细胞分化成造血细胞谱系的细胞;(c)使所述造血细胞谱系的细胞成熟;和(d)将所述造血细胞谱系的成熟细胞与包括m-csf的培养基接触并孵育以促使所述造血细胞分化成类原始巨噬细胞。
干细胞可选自胚胎干细胞(esc)和诱导性多能干细胞(ipsc)。在一个实施方案中,干细胞可以是人h1胚胎干细胞(esc)。在另一个实施方案中,干细胞可以是人诱导性多能干细胞(ipsc)。
gsk3抑制剂可选自6-溴靛玉红-3′-肟(bio)、chir-99021、sb216763、chir-98014、tws119、im-12、1-氮杂坎帕罗酮(azakenpaullone)、ar-a014418、sb415286、azd1080、azd2858、靛玉红、a1070722、tcs2002、tideglusib或其任何衍生物。
在一些实施方案中,干细胞可以在步骤(a)之前的至少24小时,以小于1个小集落/cm2的密度接种到涂布有matrigel的6孔板上。
干细胞可以用包括80%dmem/f12、20%knockout血清替代物、l-谷氨酰胺、非必需氨基酸、β-巯基乙醇和fgf-2的培养基孵育(步骤(a))。在一些实施方案中,干细胞可以在所述培养基中孵育约1天。
在另一个实施方案中,干细胞可以在步骤(a)中与包括1-20ng/ml的bmp4、5-100ng/ml的vegf、0-50ng/ml的fgf-2和0-10μm的chir99021的分化培养基接触。分化培养基可以是获自invitrogen的
在另一个实施方案中,细胞另外在步骤(a)中与1-20ng/ml的bmp4和5-100ng/ml的vegf接触。
在另一个实施方案中,细胞在约5%的氧浓度下用所述培养基孵育约2天。
细胞可以在步骤(b)中与包括5-100ng/ml的vegf、0-50ng/ml的fgf-2、0-250ng/ml的scf、0-500ng/mldkk1、0-50ng/ml的il-6和0-50ng/ml的il-3的分化培养基接触。细胞可以在约5%的氧浓度下用所述培养基孵育约3天。
在一些实施方案中,细胞可以在步骤(c)中通过与包括0-50ng/ml的fgf-2、0-250ng/ml的scf、0-50ng/ml的il-3和0-50ng/ml的il-6的分化培养基接触而成熟。细胞可以在常氧条件下用所述培养基孵育约7天。本文所用的术语“常氧条件”是指培养基中的氧浓度水平可以是约20%的条件。
细胞可以在步骤(d)中与包括0-100ng/mlm-csf的分化培养基接触并孵育。细胞可以在常氧条件下用所述培养基孵育至少6天。
在一个实施方案中,本文所述的方法在6孔培养板中培养21天至25天期间可以产生大于1×106/孔的类原始巨噬细胞产率。如所属领域中将会了解的,巨噬细胞的产率可取决于本文所述方法中所应用的细胞的起源。
在另一个实施方案中,所述方法可另外包括使用facs分选法或磁选法分离所述类原始巨噬细胞。
本文还提供了一种根据本文所述方法使用的试剂盒,其包括gsk3抑制剂和dkk1以及使用说明书。
本文还提供了一种通过本文所述的方法获得的类原始巨噬细胞。类原始巨噬细胞可以随后分化成小胶质细胞、肺泡巨噬细胞、库普弗细胞(kupffercell)、郎格罕细胞(langerhanscell)或其他组织巨噬细胞。术语“其他组织的巨噬细胞”是指可在包括但不限于肾组织、胰腺组织、脂肪组织、肝组织或结缔组织的任何组织类型中发现的巨噬细胞。
本文还提供了本文所述的类原始巨噬细胞用于开发体外疾病模型的用途,其中所述疾病是神经变性疾病、代谢疾病、呼吸系统疾病、心血管疾病、结缔组织疾病、癌症或炎性疾病。在一个实施方案中,所述疾病是神经变性疾病。
在一些实施方案中,提供了本文所述的类原始巨噬细胞用于筛选供治疗疾病用的化合物的用途,其中所述疾病是神经变性疾病或代谢疾病。
在一些实施方案中,所述疾病是神经变性疾病。在一些实施方案中,神经变性疾病可以是阿尔茨海默病、亨廷顿舞蹈病或雷特综合征(rettsyndrome)。在一些实施方案中,代谢疾病可以是肥胖症或糖尿病。在一些实施方案中,呼吸系统疾病可以是肺泡蛋白沉着症。在一些实施方案中,心血管疾病可以是动脉粥样硬化。在一些实施方案中,结缔组织疾病可以是纤维化。在一些实施方案中,炎性疾病可以是关节炎、类风湿性关节炎、实验性自身免疫性脑脊髓炎、多发性硬化或炎性肠病以及皮肤炎性疾病例如异位性皮炎、牛皮癣。
还提供了本文所述的类原始巨噬细胞用于伤口愈合和组织再生的用途。
还提供了本文所述的类原始巨噬细胞用于将载运分子递送到组织中的用途,其中所述载运分子是免疫调节性细胞因子或趋化因子,或活化前药的酶。
还提供了一种用于从鼠干细胞培养类原始巨噬细胞的方法,其中所述方法包括:(a)将所述干细胞与包括fgf2和bmp4的无血清培养基接触并孵育以诱导所述干细胞分化成中胚层谱系的细胞;(b)将所述中胚层谱系的细胞与包括fgf2、bmp4、激活素a和vegf的培养基接触并孵育以使所述中胚层谱系的细胞分化成造血细胞谱系的细胞;(c)使所述造血细胞谱系的细胞成熟;(d)将所述造血细胞谱系的成熟细胞与包括m-csf的培养基接触并孵育以促使所述造血细胞分化成类原始巨噬细胞。
鼠干细胞可选自小鼠胚胎干细胞(esc)和小鼠诱导性多能干细胞(ipsc)。
本文中说明性地描述的本发明可以在不存在本文未具体公开的任何一或多个要素、一或多个限制的情况下适当地实施。因此,举例来说,术语“包含”、“包括”、“含有”等应被广义地且不受限制地解读。另外,本文使用的术语和表达已经作为描述性且不构成限制的术语使用,并且在此类术语和表达的使用中不意图排除所显示和所描述特征或其部分的任何等效物,但是应认识到各种修改在要求保护的本发明的范围内都是可能的。因此,应理解虽然已经通过优选实施方案和任选特征明确公开了本发明,但是本文公开的在其中体现的本发明的修改和变化可以由所属领域技术人员实施,并且此类修改和变化被视为处于本发明的范围内。
在本文中已经广泛且一般性地描述了本发明。属于类属公开内的每一个更窄物种和亚属分组也形成本发明的部分。这包括本发明的类属描述,附带条件或负面限制是从该类属中去除任何主题,而不论本文中是否具体叙述了切除的材料。
其他实施方案处于以下权利要求和非限制性实施例中。此外,当用马库什群组(markushgroup)描述本发明的特征或方面时,所属领域技术人员将认识到,因而也用马库什群组的任何单独成员或成员子群描述本发明。
实验部分
将参考具体实施例更详细地进一步描述本发明的非限制性实施例(包括最佳模式)和比较实施例,所述具体实施例不应以任何方式被解释为限制本发明的范围。
实施例1
小鼠多能干细胞分化成原始巨噬细胞
如果mesc/mipsc在mef上扩增,那么在分化开始之前通过在涂布有明胶的6孔板上传代1-2次耗尽mef。
在第0天,将集落离解并以175,000-200,000个细胞/ml再悬浮于补充有5ng/mlhfgf2和5ng/mlhbmp4的无血清分化培养基(以下配方)中。将这些分配到非附着板中以形成胚状体(eb)。
48小时后,汇集eb并用tryple(优选)或胰蛋白酶离解。
eb然后以175,000个细胞/ml在补充有5ng/mlhfgf2、2ng/mlhbmp4、2ng/ml人激活素a、5ng/mlhvegf的无血清分化培养基中再聚集。
另外48小时后,将eb离解并针对flk-1+细胞分选。
分选后的细胞然后以500,000个细胞/ml在补充有5ng/mlvegf、300ng/mldkk1、100ng/mlm-csf的无血清分化培养基中再聚集。细胞悬浮液然后分配到非贴壁培养孔中以形成eb。
另外48小时后(整个分化的d6),将eb离解并再悬浮于补充有100ng/mlscf、10ng/mlil-3、100ng/mlm-csf的stemprosfm完全培养基(以下配方)中。细胞然后接种到涂布有明胶的组织培养板上。
类原始巨噬细胞应当从分化的d8开始出现并且在分化的d13-14附近达到峰值。典型地在d10-11附近分选或收获细胞。细胞传代不是必需的,但应注意截至d8时悬浮液中有很多细胞。收集悬浮液和贴壁部分两者以用于分选。
无血清分化培养基:
75%imdm/25%f12
0.5×n2补充物
0.5×b27补充物(无视黄酸)
1×pen/strep(青霉素/链霉素)
0.05%bsa
2mml-谷氨酰胺
0.5mm抗坏血酸
4.5×10-4m1-硫代甘油
stemprosfm完全培养基:
stempro-34sfm(invitrogen)
1×pen/strep(青霉素/链霉素)
2mml-谷氨酰胺
200μg/ml转铁蛋白
0.5mm抗坏血酸
4.5×10-4m1-硫代甘油
实施例2
人多能干细胞分化成原始巨噬细胞
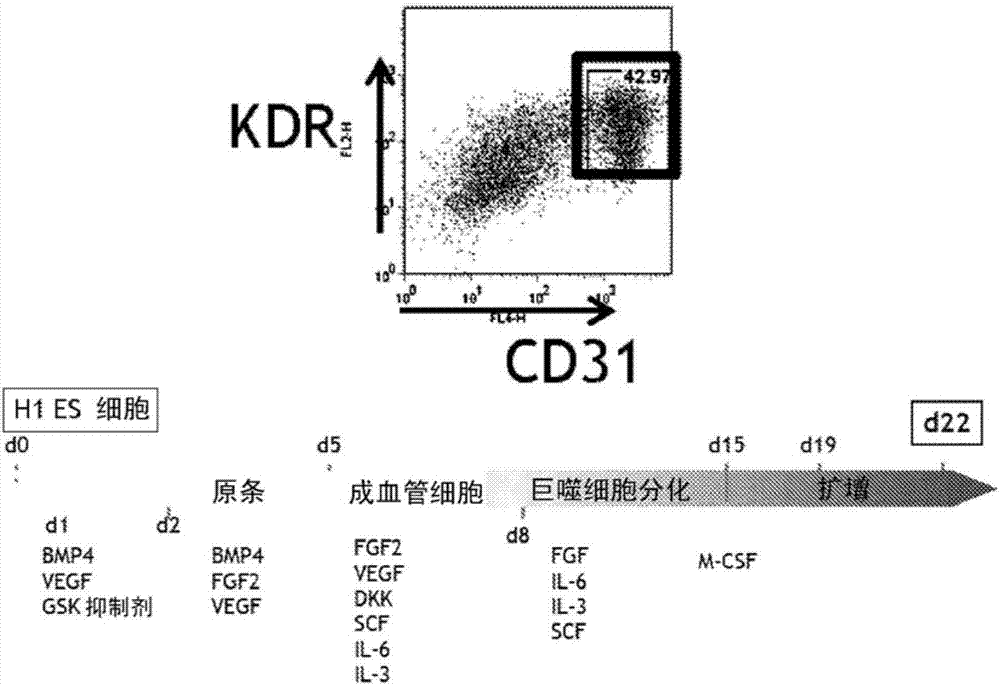
分化策略可以分成4个阶段:原条/中胚层诱导、造血特化、造血细胞成熟和最终端髓扩增。每个阶段的实验细节在图1和图2说明且描述如下:
阶段0:将es或ips细胞在涂布有matrigel的板上在cf1mef调节培养基中维持。培养基配方由80%dmem/f12、20%knockout血清替代物、l-谷氨酰胺、非必需氨基酸、β-巯基乙醇和6ng/mlfgf-2组成,且培养基每天更换。细胞每隔5-6天通过胶原酶iv处理和用细胞刮棒轻轻分离来传代。在分化开始前24小时,将细胞以极低密度(<1个小集落/cm2)接种到涂布有matrigel的6孔板上并附着过夜。
阶段1(原条/中胚层诱导):在这个初始阶段,用bmp4和gsk3抑制剂处理细胞以促进特化成后部原条(posteriorprimitivestreak),这在胚胎发生期间产生中胚层。还添加vegf以促进造血中胚层的发育。细胞也维持在低氧条件(5%o2)下。
阶段2(造血特化):大约4-5天后,可以观察到具有kdr和cd31高表达的细胞的子集。这个群体含有成血管细胞,它是造血细胞和内皮细胞的双潜能前体。调整此时的诱导混合液以扩增成血管细胞,并且进一步使其朝向造血谱系特化。此时添加scf和fgf-2以促进细胞存活和增殖。添加il-3、il-6和vegf以促进造血分化,并添加dkk1以抑制红系分化(且可能驱动巨噬细胞分化)。细胞在低氧条件下维持到第8天,随后在常氧条件下培养。
阶段3(造血细胞成熟):在这个阶段,更充分地驱动造血细胞朝向巨噬细胞谱系。此时不再需要dkk和vegf,因此将其从混合液中去除。
阶段4(端髓扩增):去除除m-csf外的所有细胞因子,发现m-csf可经由通过csf1-受体的信号传导促进原始巨噬细胞的增殖。
早在分化的第18天就可以在群体中观察到表达经典表面标志物的巨噬细胞,并且我们发现在分化的第21-25天的细胞流式分选导致良好的产率和生活力。具体来说,常见巨噬细胞标志物(cd14、hla-dr、cd11b和cd163)的表达谱,在关于从h1es细胞、患者来源的wtipsc和患者来源的突变型ipsc分化的巨噬细胞的图3中显示。
分化培养基1(dm1)
含有补充物和1×青霉素/链霉素的stempro34(invitrogen)
2mm谷氨酰胺
1×脱铁转铁蛋白(apo-transferrin)
4×10-4m硫代甘油(mtg)
50μg/ml抗坏血酸(aa)
分化培养基2(dm2)
含有1×青霉素/链霉素的imdm75%/ham’sf-1225%
0.5×b27补充物(无视黄酸)
0.5×n2补充物
2mm谷氨酰胺
4×10-4m硫代甘油
50μg/ml抗坏血酸
程序
第0天:用含有bmp4(5ng/ml)、vegf(50ng/ml)、chir99021(2μm)的dm1更换扩增培养基。在5%o2中培养。
第2天:用含有bmp4(5ng/ml)、vegf(50ng/ml)、fgf-2(20ng/ml)的dm1更换培养基。在5%o2中培养。
第4天:用含有vegf(15ng/ml)、fgf-2(5ng/ml)的dm1更换培养基。在5%o2中培养。
第6天:用含有vegf(10ng/ml)、fgf-2(10ng/ml)、scf(50ng/ml)、dkk1(30ng/ml)、il-6(10ng/ml)、il-3(20ng/ml)的dm1更换培养基。在5%o2中培养。
第8天、第10天:用含有vegf(10ng/ml)、fgf-2(10ng/ml)、scf(50ng/ml)、dkk1(30ng/ml)、il-6(10ng/ml)、il-3(20ng/ml)的dm1更换培养基。将细胞恢复到常氧条件(20%o2)。
第12天、第14天:用含有fgf-2(10ng/ml)、scf(50ng/ml)、il-6(10ng/ml)、il-3(20ng/ml)的dm1更换培养基。
第16天、第18天、第20天:用含有mcsf(50ng/ml)的dm2更换培养基。
技术备忘表
推荐6孔板中的3ml培养基/孔的体积。
从第6天开始,观察悬浮液中的细胞。为了避免损失造血细胞,将上清液离心并将得到的细胞沉淀再悬浮于少量新鲜培养基中,随后添加回其原始孔中。
dm1应每隔5-7天新鲜制备并在4℃储存以降低生物活性的损失。
dm2可以在使用前预先制备(无aa和mtg)并作为等分试样冷冻。aa和mtg可以添加到解冻的等分试样中并在4℃储存长达一周。
这种方法有许多独特且有利的特征,包括其模拟胚胎卵黄囊中的原始造血。与晚些时候需要血清补充且需要和基质细胞例如op9共培养的竞争性技术相比,这种方法完全不含血清和饲养层。此外,不需要离解步骤且不存在胚状体形成阶段。事实上,分化发生在2d贴壁培养中而不是整个过程中。所述方法也已经在h1细胞和其他ipsc细胞系上得到了验证并且是可规模化的,从而产生高产率的原始巨噬细胞(6孔板中>1×106/孔)。gsk抑制剂的添加推动朝向原条的初始特化,而dkk的添加则抑制红系分化。
实施例3
人ipsc来源的原始巨噬细胞的分化
用第12天分选的ipsc来源的原始巨噬细胞(cd163+cd11b+hla-dr+iba-1+cx3cr1+cd14+)进行吞噬试验,其中已经从患者来源的wtipsc分化了巨噬细胞且表达谱是cd45+cd11b+和cd163+。具体来说,将第12天分选的ipsc来源的原始巨噬细胞暴露于荧光标记的乳胶粒或淀粉样aβ肽,以便评估其作为巨噬细胞和小胶质细胞进行吞噬的能力。
如图4所示,支持了所述ipsc来源的原始巨噬细胞作为巨噬细胞和小胶质细胞进行吞噬的能力。这是很重要的,因为淀粉样β(aβ或abeta)肽作为阿尔茨海默病患者的脑中所发现的淀粉样斑块的主要组分至关重要地参与到阿尔茨海默病中。
程序
用于分析巨噬细胞吞噬能力的方法使用亨廷顿舞蹈症人ipsc(hd33i)来源的原始巨噬细胞的对照细胞系,将其用含有10%fcs的imdm重构,接种(5.0×104个细胞/孔)到24孔板上,并在37℃在空气中在完全潮湿的5%co2气氛中静置。
然后将细胞用乳胶粒(1:100,000)孵育24小时,用pbs洗涤三次,用4%pfa固定,并用激光共聚焦显微镜分析。
通过参照细胞形态(微分干涉相差)和核(dapi,1:10,000)来分析被吞噬的乳胶粒。
实施例4
人ipsc来源的神经元和巨噬细胞共培养
将从本文所述的方法获得的ipsc来源的原始巨噬细胞与神经元共培养。
如图5和图6所示,共培养导致ipsc来源的原始巨噬细胞分化成iba1+小胶质细胞,其具有体内成人小胶质细胞所特有的分枝形态。
这些结果显示ipsc来源的原始巨噬细胞具有分化成小胶质细胞的能力。
程序
采用本文所述的分化方法从人ipsc(hd33i)诱导神经元。将百分之八十(80%)融合率的ipsc用dmem/f12洗涤两次并用accutase离解成单细胞。用神经元前体细胞(npc)+培养基再悬浮细胞并将其接种到涂布有matrigel的6孔板上。为了诱导npc,每天更换npc+培养基,持续7天。npc然后在含有10μmrock抑制剂的npc-培养基中以1:3稀释率分离到涂布有matrigel的6孔板上,随后用补充有egf(20ng/ml)和bfgf(20ng/ml)的npc-培养基传代几次以进行调节。为了终末分化成神经元,用accutase将融合npc离解成单细胞,用神经元分化培养基再悬浮,并接种(5.0×104个细胞/孔)到24孔板中的涂布有聚-l-鸟氨酸和层粘蛋白的盖玻片上。
实施例5
csf2ar-ko小鼠肺移植
使用肺泡蛋白沉着症的csf2ar-ko小鼠(cd45.2)小鼠模型测试ipsc来源的原始巨噬细胞的作用。
如图7所示,鼠ipsc来源的原始巨噬细胞的移植拯救并缓解了小鼠模型的肺泡蛋白沉着症。
通过流式细胞术分析来自以下小鼠的肺的细胞悬浮液:未经处理的野生型小鼠(8a,阳性对照),未经处理的小鼠模型csf2ar-ko(8b,阴性对照),和添加有ipsc巨噬细胞的细胞悬浮液中的小鼠模型csf2ar-ko,作为技术对照(8c),并通过显现已知的巨噬细胞标志物检测肺泡巨噬细胞的存在或不存在。
在这方面,图8a、8b和8c中的圆圈区域显示肺泡巨噬细胞的存在或不存在,其中肺泡巨噬细胞在图8a中存在但在图8b和8c中不存在。图8a、8b和8c证明在鼻内移植离体来源的巨噬细胞之前,csf2ar-ko小鼠缺乏肺泡巨噬细胞。
此外,在另一个实验中,csf2ar-ko小鼠接受1000kipsccx3cr1-gfp巨噬细胞的鼻内移植,并通过流式细胞术分析肺的细胞悬浮液。如图9和图10所示,鼠ipsc来源的原始巨噬细胞(ipsc来源的巨噬细胞是f4/80和cx3cr1-gfp且得到siglec-f表达)嫁接到肺中超过42天并得到肺泡巨噬细胞的标志物(siglecf),同时维持特异性标志物例如cd11b的表达。具体来说,图9中的虚线圆圈代表野生型小鼠中存在的内源肺泡巨噬细胞的预期群体。
鼠ipsc来源的原始巨噬细胞也显示嫁接到肺中超过8周并得到肺泡巨噬细胞的标志物(siglecf)并分布到整个肺中(图10)。
鼠ipsc来源的原始巨噬细胞(cx3cr1-gfp+)也显示嫁接到肺中超过8周,并吞噬因为不存在内源功能肺泡巨噬细胞而积累的表面活性物质相关蛋白b(spb)(参见图10和图11)。因此,在经过移植的肺中的spb积累减少,且通过elisa灌洗法测量的支气管肺泡的浑浊度降低(图12和图13)。如将要了解的,针对csf2ar-ko小鼠(cd45.2)小鼠模型显示的作用和结果是表明所述疾病因为用ipsc来源的原始巨噬细胞治疗而被清除的证据。
- 还没有人留言评论。精彩留言会获得点赞!