改进的用于测试的培养方法和装置与流程
相关申请
本申请要求于2015年5月8日提交的美国临时申请no.62/158,583的优先权,其通过引用在此整体并入。
本发明的技术领域一般地涉及细胞培养装置。更具体地,本发明涉及通过提供独特的几何结构来改善体外研究细胞与细胞相互作用之能力的方法和装置,所述几何结构可用于降低供料干预次数、提高细胞密度、允许由细胞分泌的产物建立梯度、研究生物体的移动性和/或改善评估t细胞找到和/或杀伤癌细胞之能力的能力。
背景技术:
目前用于培养和/或评估以高密度存在的细胞的静态体外细胞培养装置不能够允许在没有频繁更换培养基以向细胞提供营养物的情况下的长期培养过程。这具有频繁地改变多种细胞分泌信号浓度的不利影响。
现有装置的设计多么不利的一个实例可见于t细胞治疗领域,其中期望了解细胞毒性t细胞如何可迁移至肿瘤型环境,攻击癌细胞并持续攻击。目前,典型的体外方法是将癌细胞接种到常规多孔板中,在此它们下沉(gravitate)至一些形式的三维基质,所述基质旨在允许癌细胞以高密度生长。然后将可杀伤该癌细胞类型的t细胞放入多孔板中,在此可评估它们消灭癌细胞的能力。各孔中存在的大量细胞给各孔中非常少量的培养基带来了很大的代谢需求。为了满足该需求,必须频繁地更换培养基。当这发生时,参与杀伤过程的重要细胞信号通过新鲜培养基的添加被除去和/或稀释。因此,频繁地改变培养条件并可影响实验结果。此外,随着癌细胞的量迅速扩增,足够频繁地更换培养基以满足其代谢需求的能力完全丧失,将实验的持续时间限制为仅几天。
避免该问题的常见方法是使用重症联合免疫缺陷(severecombinedimmunodeficient,scid)小鼠。为了进行评估,在小鼠内引入或诱导癌细胞。随后,将t细胞引入小鼠中。细胞的营养需求由小鼠支持,与使用常规体外工具相比,可进行长得多的时间,并且避免了体外装置固有的细胞条件的频繁改变。然而,小鼠的使用是高度受控的,并且小鼠间的变异性难以预测。
本文中公开的某些实施方案通过产生可整合多个新特征的装置提供了更高效的细胞培养装置和方法,其克服了现有装置和方法的限制。
发明概述
已经发现,对于长期培养和/或当期望培养物中细胞或物质的迁移时,具有独特几何结构的体外装置可提供对现有装置的优秀替代方案。新的静态装置及使用方法不需要培养基混合装置、培养基灌注装置或气体泵送装置来工作。
本文中公开的某些实施方案提供了改善的细胞培养环境,其允许细胞(例如癌细胞)以高密度生长而无需与现有高密度静态细胞培养装置一样频繁地补充营养物。例如当期望研究t细胞攻击癌细胞并持续该工作的能力时,通过在不中断该过程以补充营养物的情况下允许该过程持续比现有技术状态下的装置所允许的长得多的时间,这可以是有益的。通过较不频繁地中断该过程以为培养物供料(包括完全不中断的可能性),在评估结果时考虑更少的变量。
本文中公开的某些实施方案描述了相对于现有静态细胞培养装置改进的几何结构,其允许装置内的物质和/或细胞在整个装置内迁移。可改变这种几何结构以控制培养基内的组分在隔室之间行进的路径和装置内的细胞在隔室之间行进的路径。通过改变几何结构和材料以提高营养物和氧供给,可实现任何包含细胞之过程的长期研究。
这样的一些实施方案可用于评估细胞在长期基础上发出信号、应答于信号和/或迁移至信号源的能力。例如,以高密度培养的癌细胞可变成趋化因子信号的来源,信号可以移动通过隔室的迷宫(maze)并最终到达装置内的t细胞,引起t细胞通过移动通过该迷宫以找到来源来进行应答。一旦t细胞发现癌细胞是来源,它们可启动杀伤癌细胞并持续该工作。可适当地构造几何结构以允许这样的过程进行而不被供料或培养基内的物理力(其可通过移动装置造成)中断。也可构造装置以允许可视化地监测该过程。
这样的一些实施方案可允许经遗传改造的t细胞找到癌症靶标、杀伤癌症靶标并持续杀伤癌症靶标的能力。装置几何结构可允许将具有不同的待比较的经遗传改造特征的t细胞群进行比较。其可允许评估遗传t细胞可与不同类型的癌细胞反应得如何。其还可允许评估天然t细胞与肿瘤相关抗原反应得如何。
这样的一些实施方案可改变目标物质在隔室之间迁移的能力,可改变其迁移的路径并且可打开或关闭其迁移的路径。
本文中公开的某些实施方案提供了可整合多个新特征的更高效的细胞培养装置。代表性特征可包括使用透气材料(gaspermeablematerial)和超过常规装置的培养基体积,以及隔室,其可有利于具有降低的培养环境破坏的高密度培养物的长期研究,研究目标项目(包括例如趋化因子的物质)之迁移、追踪细胞移动和监测细胞与细胞相互作用的能力。
附图简述
图1示出了被构造成允许长期培养的一个实施方案的截面图,其可以有益于多种细胞培养应用,包括研究t细胞杀伤癌细胞并持续该工作的能力。
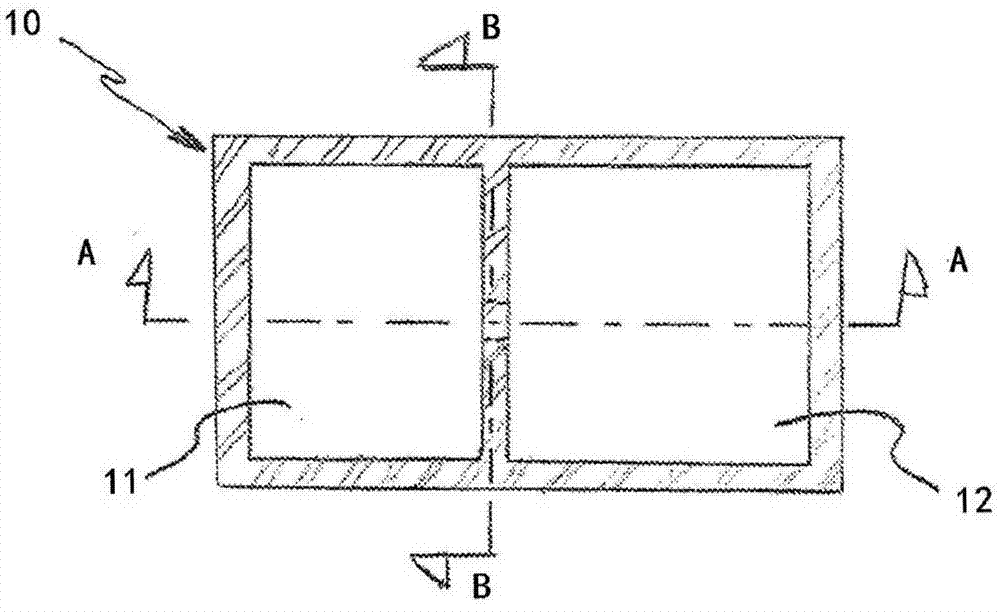
图2a、图2b和图2c示出了包含两个隔室的隔室化装置的多个视图。
图3a、图3b和图3c示出了可如何使用先前在图2a、图2b和图2c中描述并示出的隔室化装置的实例。
图4示出了具有三个隔室的隔室化装置的顶视图。
图5a、图5b和图5c各自示出了本发明的六隔室装置的替代构造的透视图。
图6示出了本发明的包含饼形(pieshaped)隔室的圆形构造。
图7示出了本发明的包含饼形隔室的圆形构造。
图8示出了被细分成不对称隔室的隔室化装置的一个实施方案。
图9示出了可用于使隔室至隔室的培养基移动最小化的通道的一种构造。
图10示出了如何可用于使隔室至隔室的培养基移动最小化的通道的另一种构造。
图11示出了通道如何可以是任何形状并且可从隔室壁取出特定应用所期望的任何量的材料。
图12示出了scid小鼠中和原型中通过在28天时间中生物发光信号逐渐提高表示的癌细胞增殖的代表性实例。图12b比较了原型与scid小鼠与algimatrixtm3d培养系统板的癌细胞生长。
图13示出了在常规algimatrixtm3d培养系统板中培养的癌细胞快速耗尽其营养供给并在第7天死亡。
图14示出了scid小鼠中cart细胞的施用如何导致维持两周时间的肿瘤信号降低,并且示出了当将cart细胞直接添加至本发明的测试原型时如何看到相同的抗肿瘤作用。
图15示出了现在本发明可允许在整个装置中建立趋化因子梯度。
图16示出了数据表明本发明可用于区分第一代与第二代cart细胞。
发明详述
图1示出了本发明的一个实施方案的截面图,其描绘了不整合培养基混合装置、培养基灌注装置或气体泵送装置并且可用于以高密度培养癌细胞以及研究t细胞杀伤癌细胞并持续该工作的能力的装置。癌细胞1存在于静态细胞培养装置2的底部。顶部未示出,但可以像与多孔板常规关联的盖一样简单,或者可以是更复杂的,包括封闭和构造成用于自动进入。培养基3存在于癌细胞培养装置2内。装置的底部4由透气材料(优选硅酮)构成。可对隔室底部上细胞接触的表面进行修饰(例如通过纹理化)以允许癌细胞以高密度状态存在,以便模拟肿瘤。表面纹理可采取沟槽、口袋、粗糙化区域等形式。实质上,对于每平方厘米的占地面积(footprint),相对于具有光滑表面的装置,当底部表面不光滑时可增大癌细胞可接触的表面积并有利于增多每平方厘米隔室底部的细胞。还可使用基质用于以高密度或更天然的物理构造培养细胞。基质通常用于以通常被称为的三维培养来培养细胞。基质可附接于底部表面,但不需附接于底部表面。基质材料可由技术人员已知允许细胞以这样的状态被培养的任何材料组成:其允许细胞以紧密接触存在和/或整合到基质内,所述基质包括天然或合成材料,例如algimatrixtm、胶原、纤连蛋白、塑料、烧结陶瓷是许多可用选择。当底部是透气的时,这样的材料应在允许细胞以紧密接触存在(例如当使用癌细胞来模拟肿瘤时)与允许氧到达细胞之间取得平衡。因此,优选地,基质不是固体物质。
该实施方案克服了传统体外培养装置(例如algimatrixtm3d培养系统24-孔板(gibco目录号12684-023))的限制。通过经由透气底部提供优异的氧合作用并提供大的培养基体积,可将t细胞添加至装置并且可进行其癌症杀伤能力的长期评估。通过允许培养基体积与底部占地面积比值超过algimatrixtm3d培养系统24-孔板,装置可运行更长的持续时间并具有如将示出的许多优点。底部的占地面积通过如同底面是光滑的那样计算底部的表面积来确定,从而避免了包括纹理、生长基质或增大表面积的其他形式。优选地,培养基体积与底部占地面积比值超过algimatrixtm3d培养系统24-孔板。因此,在该优选实施方案中,培养基体积与底部占地面积比值为2、3、4、5、6、7、8、9、10、11、12、13、14、15或其间的任意数值。底部优选由硅酮构成。为了改善评估装置内的细胞活性的能力(特别是通过荧光检测),至少壁应着色。底部也可优选地着色,或者壁和底部二者均可着色。
图2a示出了包含两个隔室的隔室化装置10的顶视图。为了清楚起见,移除了顶部。虽然每个隔室的边界显示为正方形,但是它们可以是任何形状并且每个隔室不需具有相同的形状或表面积。如图2b最佳示出的,其为图2a的截面图a-a,通道14连接隔室11与相邻隔室12。在该描述中,隔室显示具有顶部13。顶部13可与传统多孔板的顶部相似。隔室的底部可以是不透气的或透气的。如果是透气的,则材料应优选是不透液性的。通过使每个隔室的底部15是透气的,顶部13不需要允许用于向隔室进行气体输送的间隙并且可被密封于装置以使污染风险最小化。在图2b的描述中,顶部13显示以与常规多孔板的顶部相似的方式升高。可使用脚(feet)5来升高隔室的底部。这可用于多于一个目的。例如,如果期望通过底部(例如通过使用倒置显微镜)评估隔室的内容物,则脚可以防止底部刮擦或以其他方式降低其有利于此类评估的能力。如果期望使用透气材料用于一个或更多个隔室的底部,则脚可以升高底部以有利于环境气体非强制地与透气材料接触的能力。如果是透气的,则底部应与环境气体接触,所述气体不需要泵送或以其他方式以强制运动来与透气材料接触。鼓励技术人员回顾美国专利9,255,243(其通过引用在此整体并入)以更多地了解将透气材料保持在水平面中同时允许环境气体被动地、非强制地与该材料接触接触的技术。图2c示出了图2a的截面b-b。在该描述中,通道14是将相邻隔室11和12分开的壁中的开口。通道14可以是允许一个隔室的内容物与另一隔室连通的任何开口。
图3a、图3b和图3c示出了可如何使用先前在图2a、图2b和图2c中描述并示出的隔室化装置10的实例。该装置构造允许评估t细胞识别趋化因子梯度、跟随梯度、找到癌细胞、启动癌细胞杀伤并持续该工作的能力。如图3a中所示,癌细胞16存在于隔室11中,且t细胞18存在于隔室12中。箭头20示出了当癌细胞16分泌的趋化因子从较高浓度区域行进到较低浓度区域时其移动通过通道14的方向。图3b的箭头22示出了当t细胞18寻找趋化因子的来源,从较低趋化因子浓度的区域向较高趋化因子浓度的区域移动时t细胞18迁移通过通道14的方向。图3c示出了t细胞18在寻找癌细胞16中如何已经迁移到隔室11中。为了清楚起见,未示出培养基的存在。该装置构造允许评估t细胞识别趋化因子梯度、跟随梯度、找到癌细胞、启动癌细胞杀伤并持续该工作的能力。
对于特定应用,可使用很多种设计特征来改变装置的性能并对其进行优化。实例可帮助解释可如何改变设计特征以使装置的性能很好地适用于特定应用。一个这样的实例是装置的使用者试图评估t细胞找到并杀伤癌细胞的能力的应用。在该应用中,装置的一个重要方面是每个隔室的底部的几何结构。在癌细胞存在的隔室中,其优选地生长至高密度以模拟肿瘤。在癌细胞不存在的装置区域中,设计目标应是产生不妨碍t细胞迁移至癌细胞位置的环境。因此,t细胞将迁移穿过的表面应是平坦而无纹理的。具有均匀和规则的一致性且不具有易察觉的突起、团块或缺口的光滑的表面光洁度是优选的。塑料工程师协会(societyofplasticengineers,spe)表面光洁度2号的表面光洁度是更优选的,且spe表面光洁度1号是最优选的。还优选的是当装置用于使细胞不得不向上行进的可能性或细胞向下下沉的可能性最小化时,细胞迁移穿过的表面通常是水平的。这些条件中的任一种均可误导研究人员认为t细胞移动得比当表面是水平时它们实际上的移动更快或更慢。目的是为了使t细胞通过趋化因子刺激而移动,从而可针对其向癌细胞移动并找到癌细胞的能力对它们进行评估。因此,设计目的是使可作用以使t细胞移动至癌细胞或降低t细胞迁移至癌细胞之能力的不期望的力最小化。技术人员应知晓,产生完全水平的表面是不可能的,但是与传统多孔板或可商购的
每个隔室的底部可由用于细胞培养装置的任何材料制成,并且不需是透气的。这样的材料包括例如在传统多孔板中常见厚度的聚苯乙烯。然而,我们已经发现在底部使用透气材料可产生如将进一步描述的优点。这样的材料可以是膜(membrane)、薄膜(film)或用于透气细胞培养装置的任何材料,例如硅酮、氟乙烯聚丙烯、聚烯烃、聚苯乙烯和乙烯乙酸乙烯酯共聚物。本领域技术人员将认识到应基于多种特性来选择透气材料,所述特性包括透气性、湿蒸气透过率、改变以用于期望的细胞与细胞相互作用的能力、光学透明度(opticalclarity)、物理强度等。存在描述已经成功用于细胞培养的透气材料的类型的很多种信息。硅酮是优选的选择。其具有优异的透氧性(oxygenpermeability),可允许光学观察,不易被刺破,通常不使细胞与其结合并且可容易地被制造成很多种适用于本发明的形状。
壁的高度可决定允许在装置中存在多少培养基。添加培养基提供了更大的基质来源和更大的废物池。通过提高壁高度和提高隔室中可存在的培养基的体积,其可具有降低供料频率的效果,从而降低培养基中的溶质和物质浓度的变化。其还可具有提高每平方厘米装置占地面积存在的细胞数目的效果。
可期望使用多于两个隔室。图4示出了具有三个隔室的隔室化装置的顶视图。为了清楚起见,未示出与隔室边界和隔室之间通道无关的材料。该构造可用于评估不同t细胞群识别多种类型的癌症的能力。例如,来自一种类型癌症的癌细胞可存在于隔室化装置23的隔室24中。特定的t细胞群可存在于隔室25中,且不同的t细胞群可存在于隔室26中。当癌细胞分泌趋化因子信号时,可观察到最能够应答并迁移至癌细胞的t细胞类型。这样的评价可以是有用的,例如当评价各自已经通过遗传改造赋予了不同特征的t细胞群时。利用该构造,最快迁移至癌细胞的经遗传改造的t细胞群可有助于评估经遗传改造的特征预期在体内作用得如何。还可评估杀伤能力。
优选地,以向其提供相同几何结构和材料的思路产生隔室25和隔室26,从而使得t细胞应答中的任何差异可归因于t细胞而不是隔室内的几何结构或材料类型。因此,在隔室25和隔室26之间相同的几何结构和材料是优选的。关键特征是在隔室之间的通道的构造。应建议技术人员,在隔室之间不必仅一个通道。在该描述中,为了清楚起见示出了仅一个通道。优选地,隔室25与隔室24之间的通道被构造成具有与隔室26与隔室24之间通道相同的几何结构。在设计通道时重要的考虑是以与隔室24相同的关系设置它们。例如,在图4中,通道27在将隔室25与隔室24分开的壁的中央,且通道28在将隔室26与隔室24分开的壁的中央。假设癌细胞和t细胞均匀地分布在整个其各自的隔室中,这有助于确保趋化因子信号以大约相同的时间和大约相同的信号浓度到达t细胞。
图4所示的几何结构的替代应用是将t细胞放置在隔室24中,然后将两种不同类型的癌细胞放置在隔室25和隔室26中。在该构造中,可评价t细胞的对不同癌症类型的应答和移动。当评估由识别多于一种肿瘤相关抗原的t细胞构成的t细胞群识别不同类型的肿瘤(如癌细胞群)的能力时,这样的应用可以是特别有益的。另外,对于本文中的任何实施方案,当评估癌症识别和杀伤能力时,可使用实际肿瘤碎片替代癌细胞。
可使用任何数量的隔室,可包括一个、两个、三个、四个、五个、六个和更多个。如先前所述,隔室形状不限于正方形或矩形。图5a、图5b和图5c各自示出了本发明的六隔室装置的替代构造的透视图。多个隔室之间的通道可以以多种样式构造以允许迁移性物质和/或微生物(例如趋化因子和/或细胞)在隔室之间行进。对于所示的每种构造,箭头29表示当迁移在隔室30中开始并在箭头29的箭头终止的地方结束时的迁移路径。为了集中于通道的位置可在隔室中产生多种路径的点,在图5a、图5b和图5c中未示出具体的通道几何结构。相对于其他路径,一些路径可使在移动装置时培养基的动量最小化,从而使在装置操作期间通过液体移动将信号从隔室运送至隔室的可能性最小化。在该描述中,在一些点上,每个箭头采取一个或更多个转弯。因此,当产生具有预期为细胞分泌信号的来源的一个孔和预期包含应答于细胞分泌信号来源的细胞的一个孔的装置构造时,那些特定孔之间的通道优选不全部完全地对齐。优选地,信号路径具有至少一个转弯(如例如图5a中所示),更优选多于一个转弯(如例如图5b中所示),并且甚至更优选在不是信号的来源或信号的最终目的地的每个隔室产生转弯(如例如图5c中所示)。
图6示出了本发明的包含饼形隔室的圆形构造。为了清楚起见,仅示出了隔室和通道的轮廓。在隔室化装置32内,隔室33通过通道37与隔室34连接,隔室34通过通道36与隔室35连接,且隔室35通过通道38与隔室33连接。在该构造中,每个隔室通过通道与其相邻隔室接触。
图7示出了本发明的包含饼形隔室的圆形构造。为了清楚起见,仅示出了隔室和通道的轮廓。在隔室化装置40内,隔室41、隔室42和隔室43都通过通道44连接。在其中认为有利地具有通过仅一个通道连接的多于两个隔室的情况下,这是示出这如何可以实现的一个举例说明性实施方案。
图8示出了被细分成不对称隔室的隔室化装置的一个实施方案。隔室化装置46包含隔室47、隔室48、以及隔室49、以及隔室50。通道51、通道52、通道53允许物质在隔室49与隔室50之间输送。通道相对于装置的中心点的位置改变并且可在不增大装置占地面积大小的情况下延长迁移路径。
分离隔室的通道的形状、数量和取向可影响性能。其设计应在允许装置的内容物内的元素从隔室行进至隔室与使推动这样的元素从隔室至隔室的物理力最小化的需要之间取得平衡。例如,如果正在监测t细胞找到癌细胞的能力,则移动装置以监测这样的事件的特定动作应不促进该事件。应注意,隔室之间的通道的数量不需限制为仅一个。可使用一个、两个、三个、四个、五个、六个或任意数目的通道。孔之间的通道的设计也可以影响t细胞迁移。例如,如果将装置从流罩(flowhood)转移至培养箱,则应使培养基通过通道从一个隔室移动至下一个的能力最小化,以防止培养基的动量将t细胞从一个隔室携带至另一隔室或将癌细胞从一个隔室携带至另一隔室。这可以以多种方式来实现。
图9示出了可用于使隔室至隔室的培养基移动最小化的通道的一种构造。通道56的壁58和壁59不切割出通过隔室壁55的垂直路径。在另一方面,通道57的壁60和壁61切割出通过隔室壁55的垂直路径。虽然可使用任一通道,但是在这种情况下可使用通道56以产生对装置操作期间的培养基动量的抵抗。
图10示出了可用于使从隔室至隔室的培养基移动最小化的通道的另一种构造。通道63不切割出通过隔室壁62的垂直路径。相反地,通道63在隔室壁62内包括两个直角转弯。鼓励技术人员认识到可使用通道中的至少一个任意角度的转弯来限制动量的力驱动物质通过隔室壁。
图11示出了通道如何可以是任何形状以及可以从隔室壁取出特定应用所期望的任何量的材料。例如,通道65具有矩形,通道67具有顶部为圆形的矩形形状,且通道68具有三角形形状。通道66是在隔室壁69中形成完全断开的狭缝。隔室壁69与底部70配合。当隔室壁与底部模塑成一件时,模塑完全断开隔室壁的狭缝可以是有利的。然后,第二部件可附接于隔室壁以阻挡狭缝的任何期望的部分。在这种情况下,隔室壁会包含具有开口的第一壁和限制开口的壁部件。第一开口的大小会通过壁部件减小。鼓励技术人员认识到在给定的隔室壁中可使用多于一个通道,并且当这样做时,每个通道可具有不同的形状和/或尺寸和/或截面面积以适应任何给定的应用。
通道不需永久打开。其可包含阻止来自隔室的内容物穿过壁的闭合件(closure)。当期望允许隔室的内容物穿过通道时,可打开闭合件。
对于包括期望监测物质或项目的荧光的实验,制造隔室的壁和/或底部使得其不是光学透明的可提供益处。如果由塑料制成,则应在材料中包含着色剂。壁和底部的材料的选择也要考虑。在一个优选的制造方法中,壁和底部由硅酮制成。在一个更优选的制造方法中,在该过程期间将壁和底部注塑(injectionmolded)并使其邻接。当应用可包括监测荧光标记物时,在硅酮中使用着色剂可以是有益的。将硅酮底部模塑在着色的隔室壁上也可以是可行的。因此,硅酮底部可以是光学透明的而壁是着色的。
将参考以下非限制性实施例来进一步描述本发明。
实施例1
当与常用的常规体外装置相比以及当与scid小鼠相比时,新装置对癌细胞研究提供了益处。
进行评价以确定本发明的隔室化装置是否可优于通常用来培养癌细胞的标准体外工具的方式维持癌细胞。评价还与在scid小鼠中体内培养癌细胞进行了比较。
制造了隔室化装置的一个实施方案的原型。其中放置癌细胞的装置具有表面积为12cm2的正方形底部,其由厚度为0.008至0.012英寸的硅酮构成。隔室壁的高度允许培养基以5cm的高度存在并且培养基存在于底部正上方。
为了证实该新方法可支持长期肿瘤生长,将原型与通常用于癌细胞研究的algimatrixtm3d培养系统24-孔板(gibco目录号12684-023)和scid小鼠进行比较。为了开始比较,algimatrixtm3d培养系统24-孔板的六个孔中的每一个接收1×106个capan-1癌细胞。约24小时后,在癌细胞移植到algimatrixtm生物支架中后,取出三个支架并分别分配至三个原型中的每一个。因此,现在每个原型都具有一个移植有癌细胞的algimatrixtm生物支架。每个原型接收60ml培养基,并且algimatrixtm3d培养系统板的剩余三个孔中的每一个以每孔2ml的量接收完全新鲜培养基。使二十只scid小鼠(n=20)各自接收1×106个capan-1癌细胞。通过生物发光成像监测癌细胞生长。图12示出了scid小鼠中和原型中通过在28天时间中生物发光信号逐渐提高表示的癌细胞增殖的代表性实例。图12还比较了原型与scid小鼠与algimatrixtm3d培养系统板的癌细胞生长。原型中的癌细胞增殖与在scid小鼠中观察到的类似。应注意,原型中的三个原型重复类似,如通过对数标度图中所示的小误差线指示的,而scid小鼠中的癌细胞增殖高度可变。如预期的以及如图13中所示的,在常规algimatrixtm3d培养系统板中培养的癌细胞快速耗尽其营养供给并在第7天死亡。
实施例2
新装置具有评估延长的抗肿瘤作用的能力。
为了确定在本发明中是否可以以与在scid小鼠中达到的相似的灵敏度和特异性测量经遗传改造以包括嵌合抗原受体(chimericantigenreceptor,cart)细胞的t细胞的抗肿瘤作用,向实施例1中构造的三个原型移植1×106个capan1癌细胞。向xxscid小鼠也移植1×106个capan-1癌细胞。在移植后,将20×106个cart细胞添加至每个原型并注射到每只scid小鼠中。如图14的左侧图中所示,scid小鼠中的cart细胞施用导致肿瘤信号降低,其维持两周时间,表明输注的cart细胞杀伤capan-1癌细胞,并因此能够产生抗肿瘤作用。图14的右侧图示出了当将cart细胞直接添加至原型时如何看到了相同的抗肿瘤作用。这示出了新原型如何可成为scid小鼠的合适代用品,从而使研究人员更频繁地依赖于使用体外装置而不是scid小鼠。
实施例3
本发明可允许在整个装置中建立趋化因子梯度。
原型测试装置构造成具有六个隔室。每个隔室具有表面积为12cm2的正方形底部。壁允许培养基以5cm的高度存在于每个隔室的底部正上方。隔室以与传统六孔板相似的样式被布置成三个隔室长×两个隔室。隔室的多个相邻壁之间的小通道开口允许趋化因子在隔室之间移动。开口为约2mm×2mm并且在所连接的隔室之间的壁中央的基部。图15的顶部图示出了表示通过隔室之间的通道产生的预期梯度路径的箭头。实质上,设计是一种迷宫样式,旨在允许装置移动(例如,进入培养箱)而不造成趋化因子梯度的破坏。为了测试新设计是否支持梯度的产生,装置的一个隔室(在图15中指示为孔#1)掺加24ug重组mcp1。接下来,在24小时、48小时和72小时时在孔1至6中测定趋化因子浓度。图15的底部图示出了指定时间点不同孔中mcp1的浓度。如所预期的,随着时间推移,孔1中mcp1水平逐渐降低,并且在沿着通道所允许的路径上的隔室中以提高的方式变得可检出。例如,在图15中指示为#2(24小时)、#3(48小时)和#4(72小时)的隔室显示出提高量的mcp1,在72小时时可清楚地看到梯度。这表明本发明可支持产生趋化因子梯度并且表明装置可用于产生将会到达位于远端孔中的t细胞的趋化因子梯度。然后可针对其应答评估在该远端孔中的t细胞。
实施例4
数据表明本发明可用于区分第一代与第二代cart细胞。
使用实施例3的原型设计来评价靶向胰腺癌细胞的能力。每个孔中存在60ml培养基。结果示于图16中。在两个原型中的每一个的隔室6中建立发光capan-1癌细胞的培养物。将第一代cart细胞放入一个原型的1号隔室中。将第二代cart细胞放入在另一个原型的1号隔室中。在这两个原型中,cart细胞跟随由capan-1癌细胞表达的趋化因子梯度(迁移数据未示出)并到达capan-1癌细胞。最初,第一代和第二代cart变体二者均表现出降低癌细胞发光的能力,表明它们同样有效地杀伤capan-1癌细胞,并且表现为在约第12天癌细胞几乎被消除。然而,此后,第二代cart细胞开始表现出显著更好的持久性并且能够继续抗肿瘤活性,而第一代cart细胞失去了其癌杀伤能力并且癌细胞能够恢复。重要的是注意到,利用常规体外装置,由于两个重要原因而不能区分这些cart世代。首先,常规体外装置不允许迁移,并且必须用与癌细胞在相同隔室中的t细胞开始实验。其次,如先前所述,由于没有足够的营养物用于细胞存活,常规体外装置不能维持培养超过两天(参见图13)。因此,不能足够长时间监测t细胞对癌细胞的攻击以检测随时间推移的杀伤能力的关键差异。使用常规方法,科学工作者可能仅能通过使用scid小鼠了解该差异,从而浪费了时间和金钱而获得通过本发明可快速且廉价地获得的关键知识。应注意,实施例还示出了透气材料的使用如何可允许在至少长达28天内消除培养基更换。在实施例3中进行的实验的情况下,由于装置中存在足够的培养基(即,每隔室60ml的6个隔室=360ml),所以没有培养基更换。
鼓励技术人员认识到,对于在短距离上的细胞迁移的非常短期的实验,产生不依赖于使用透气材料或更大培养基体积的装置可更具成本效益。在这种情况下,具有至少两个隔室的装置应构造成具有隔室之间的通道以允许信号和细胞从隔室运行至隔室。然而,如实施例4所示,使用透气材料可允许在至少长达28天内消除培养基更换。
本领域技术人员将认识到,在不脱离本公开内容的精神的情况下可以对其进行大量修改。因此,其不旨在将本发明的范围限制于所示和所述的实施方案。相反,本发明的范围将由所附权利要求书及其等价形式来解释。本文中引用的各出版物、专利、专利申请和参考文献通过引用在此整体并入本文。
- 还没有人留言评论。精彩留言会获得点赞!