提高比活的α‑淀粉酶BasAmy突变体及其编码基因和应用的制作方法
本发明涉及基因工程领域,具体涉及提高比活的α-淀粉酶basamy突变体及其编码基因和应用。
背景技术:
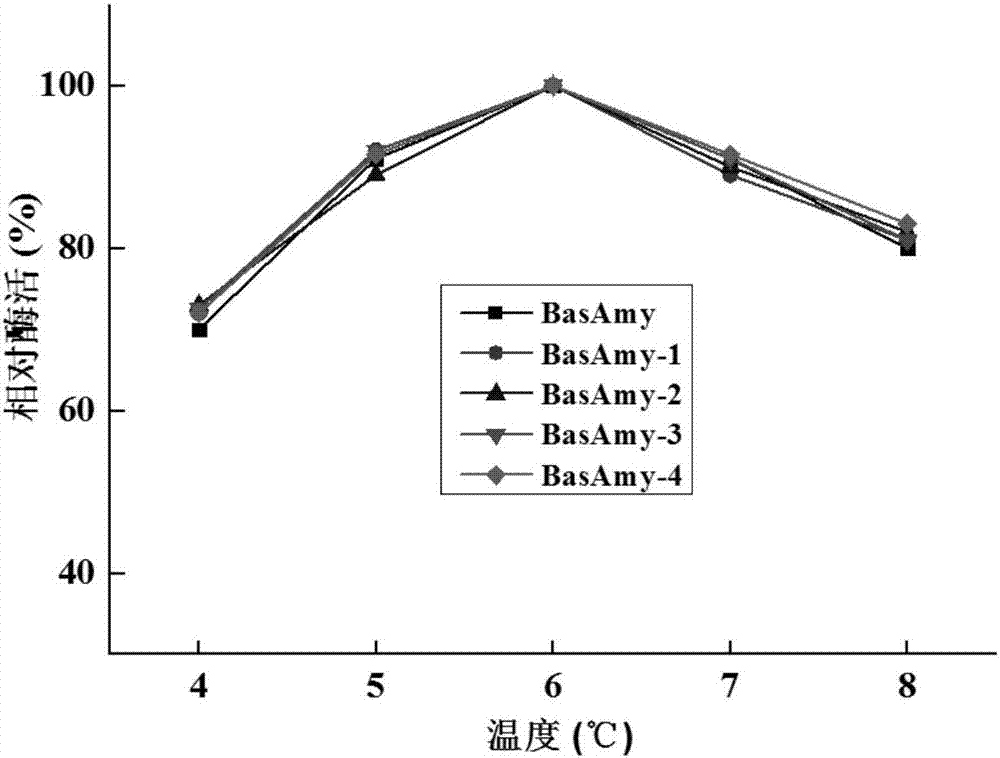
:α-淀粉酶是一种十分重要的酶制剂,能够从淀粉分子内部随机切开α-1,4糖苷键生成糊精和还原糖。α-淀粉酶广泛应用于食品工业、酿造、发酵和纺织品工业。α-淀粉酶分布十分广泛,遍及微生物至高等植物。相对于其他来源的α-淀粉酶,微生物来源的α-淀粉酶作用温度广,ph值范围广,生产成本低,因此微生物来源的α-淀粉酶被广泛的应用于各个工业领域。作为微生物α-淀粉酶中最重要的一类,芽孢杆菌α-淀粉酶是目前研究和应用最为广泛。沙漠芽胞杆菌(bacillussonorensis)α-淀粉酶简称basamy,是一种中温α-淀粉酶,其作用ph广,适用于食品、造纸、饲料等工业领域。相对于其他芽孢杆菌α-淀粉酶,basamy比活低,生产成本高,限制了其在食品、造纸、饲料等工业领域的应用。因此,提高basamy的比活,降低其生产成本,是basamy工业化应用急需解决的问题。技术实现要素:本发明对来源于索诺拉沙漠芽胞杆菌的α-淀粉酶basamy进行分子改造,从而提高basamy的比活,降低生产成本,为α-淀粉酶basamy的工业化应用奠定基础。本发明的目的是提供提高比活的α-淀粉酶basamy突变体。本发明的再一目的是提供提高比活的α-淀粉酶basamy突变体的编码基因。索诺拉沙漠芽胞杆菌的α-淀粉酶basamy的核苷酸序列和氨基酸序列分别如seqidno.1和seqidno.6所示。本发明采用定点饱和突变的方法对seqidno.6所示的α-淀粉酶basamy的第29位、第267位、第270位、第275位和第350位进行分子改造,经过高通量筛选确定了第29位、第267位、第270位、第275位和第350位这5个位点的最优突变氨基酸。其中29位由l突变为a最好,267位则是s突变为q,270位则是s突变为p,275位则是a突变为y,350位则是d突变为g。同时采用易错pcr技术对seqidno.1所示的α-淀粉酶basamy的核苷酸序列进行改造,从而获得一系列的突变位点。经过高通量筛选获得了6个有效突变体分别为a112r,l269f,k274s,q278s,s279q和l412c。在上述有效突变位点的基础上,分别一一进行组合,最终得到了四个提高比活的bsamy突变体分别命名为basamy-1、basamy-2、basamy-3和basamy-4。这四个突变体的相对比活分别是basamy的130%,160%,180%和125%。basamy-1、basamy-2、basamy-3和basamy-4突变体的核苷酸序列如seqidno.2到seqidno.5所示,氨基酸序列如seqidno.7到seqidno.10所示。其中basamy-1包含的突变位点为l29a,a112r,s267q,k274s,q278s,s279q,d356g和l412c。其中basamy-2包含的突变位点为l29a,l269f,s270p,a275y,q278s,s279q,d356g和l412c。其中basamy-3包含的突变位点为l29a,a112r,l269f,k274s,a275y,q278s,s279q和l412c。其中basamy-4包含的突变位点为s267q,l269f,s270p,k274s,a275y,q278s,s279q和l412c。本发明通过蛋白理性改造和高通量筛选技术对索诺拉沙漠芽胞杆菌的α-淀粉酶basamy进行分子改造,得到了四个比活提高的突变体。为索诺拉沙漠芽胞杆菌的α-淀粉酶的工业化应用奠定基础。附图说明图1原始α-淀粉酶和突变体basamy-1至basamy-4的最适反应ph图2原始α-淀粉酶和突变体basamy-1至basamy-4的ph稳定性图3原始α-淀粉酶和突变体basamy-1至basamy-4的最适反应温度图4原始α-淀粉酶和突变体basamy-1至basamy-4的热稳定性具体实施方式以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行;所述试剂和生物材料,如无特殊说明,均可从商业途径获得。实验材料和试剂:1、菌株与载体索诺拉沙漠芽胞杆菌(bacillussonorensis)的α-淀粉酶购自中国工业微生物菌种保藏管理中心,菌种编号为10848、大肠杆菌菌株topl0、毕赤酵母x33、载体ppiczαa,载体pgapzαa,zeocin购自invitrogen公司。2、酶与试剂盒q5高保真taq酶mix购自neb公司,质粒提取,胶纯化,限制性内切酶、试剂盒购自上海生工公司。3、培养基大肠杆菌培养基为lb(1%蛋白胨,0.5%酵母提取物,1%nacl,ph7.0)。lbz为lb培养基加25ug/mlzeocin。酵母培养基为ypd(1%酵母提取物,2%蛋白胨,2%葡萄糖)。酵母筛选培养基为ypdz(ypd+100mg/lzeocin)。酵母诱导培养基bmgy(i%酵母提取物、2%蛋白胨、1.34%ynb、0.00004%biotin、1%甘油(v/v))和bmmy(除以0.5%甲醇代替甘油,其余成份相与bmgy相同)。实施例1、索诺拉沙漠芽胞杆菌(bacillussonorensis)的α-淀粉酶的克隆将索诺拉沙漠芽胞杆菌接入lb培养基,培养24小时后,提取其基因组dna。根据已报道索诺拉沙漠芽胞杆菌α-淀粉酶的序列(genebank:aofm01000005.1)设计两条引物(r:5'-ctgaattcatggtttacaaatgcaaacgg-3'和f:5'-cttctagactatcgttggacataaatcga-3')用于扩增索诺拉沙漠芽胞杆菌α-淀粉酶基因。将扩增的pcr产物纯化回收,分别连接到表达载体ppiczαa和ppgapzαa,得到表达载体ppiczαa-basamy和pgapzαa-basamy。实施例2、理性定点突变以上述ppiczαa-basamy为模板,以表中的引物进行pcr扩增,具体地扩增反应体系如下:q5高保真taq酶mix23ul对应突变体引物1ul对应突变体引物1ulppiczαa-basamy(20ng)2ul加水至50ul反应程序如下:琼脂糖电泳检测pcr扩增结果,纯化回收pcr产物。用限制性内切酶dpni将原始质粒分解,将分解完的产物才用热激法转入大肠杆菌top10,通过菌液pcr验证重组转化子,提取验证正确的转化子的质粒进行测序,从而确定相应的突变体。将测序正确的突变体,用saci线性化,转入毕赤酵母x33。实施例3、高通量筛选高比活突变菌株将实施例2中的酵母重组转化子用牙签逐个挑至24孔板,每个孔中加入1ml含有bmgy培养基,30℃,220rpm培养24h左右,离心去上清。再分别加入1.6mlbmmy培养基进行诱导培养。培养24h后,离心取上清,将上述上清液分别取出200μl至96孔板,进行α-淀粉酶酶活测定。α-淀粉酶酶活检测参照中华人民共和国国家标准《gb/t24401-2009》进行测定。经过高通量筛选得到5个有效突变位点分别为l29a,s267q,s270p,a275y和d350g。这5个突变体的相对比活如表1所示。表1原始α-淀粉酶和突变体α-淀粉酶相对比活编号相对比活(%)原始α-淀粉酶100l29a115s267q120s270p125a275y119d350g128实施例4、易错pcr非理性改造以上述pgapzαa-basamy为模板,进行易错pcr随机突变扩增,具体地扩增方法是:第一轮扩增:以载体启动子引物aox5-f和aox3-r为引物进行pcr扩增,反应体系如下:反应程序如下:回收第一轮pcr产物,去1μl稀释50-100倍用作第二轮pcr的模板;第二,第三轮易错pcr以α-淀粉酶特异性引物r及f替代引物aox5-f和aox3-r为反应引物,重复pcr反应。取第二、三轮的产物用xbai和ecori进行双酶切,连接至pgapzαa载体上的ecori和xbai位点之间。连接产物转化x33,在ypdz平板培养筛选突变菌株。经过高通量筛选获得了6个有效突变体分别为a112r,l269f,k274s,q278s,s279q和l412c。这6个突变体的相对比活如表2所示。表2原始α-淀粉酶和突变体α-淀粉酶相对比活编号相对比活(%)原始α-淀粉酶100a112r121l269f130k274s126q278s131s279q123l412c125实施例5、组合突变进行组合突变,通过实验最终得到4个组合突变分别命名为basamy-1、basamy-2、basamy-3、basamy-4。其中basamy-1包含的突变位点为l29a,a112r,s267q,k274s,q278s,s279q,d356g和l412c。其中basamy-2包含的突变位点为l29a,l269f,s270p,a275y,q278s,s279q,d356g和l412c。其中basamy-3包含的突变位点为l29a,a112r,l269f,k274s,a275y,q278s,s279q和l412c。其中basamy-4包含的突变位点为s267q,l269f,s270p,k274s,a275y,q278s,s279q和l412c。实施例6、原始α-淀粉酶及α-淀粉酶突变体的比活分析分别将原始α-淀粉酶和突变体α-淀粉酶进行纯化,纯化方法为镍柱纯化。将纯化好的α-淀粉酶和突变体α-淀粉酶分别测定相应的酶活并计算出比活。以突变体比活除以原始α-淀粉酶比活,来计算突变体的相对比活。最终basamy-1,basamy-2,basamy-3和basamy-4的相对比活分别为130%,160%,180%和125%。实施例7、原始α-淀粉酶及突变体basamy-1,basamy-2,basamy-3和basamy-4的最适反应ph及ph稳定性参照国标方法测定原始α-淀粉酶basamy及突变体basamy-1,basamy-2,basamy-3和basamy-4的最适反应ph。basamy及突变体basamy-1,basamy-2,basamy-3和basamy-4的最适反应ph如图1所示。由图1可知,突变体basamy-1,basamy-2,basamy-3和basamy-4的最适ph值几乎和baamy一样,均为6.0。将basamy及突变体basamy-1,basamy-2,basamy-3和basamy-4分别在ph4-8条件下室温处理2小时,然后参照国标的方法测定酶活,结果如图2所示。由图2可知突变体basamy-1、basamy-2、basamy-3和basamy-4的ph稳定性与basamy一致。实施例8、原始α-淀粉酶及突变体basamy-1,basamy-2,basamy-3和basamy-4的最适反应温度及热稳定性参照国标方法测定basamy及突变体basamy-1,basamy-2,basamy-3和basamy-4的最适反应温度,结果如图3所示。由图3可知,basamy及突变体basamy-1,basamy-2,basamy-3和basamy-4的最适反应温度均为60℃。将basamy及突变体basamy-1,basamy-2,basamy-3和basamy-4分别在50℃-90℃条件下水浴处理30分钟,然后参照国标的方法测定酶活,结果如图4所示。由图4可知,突变体basamy-1,basamy-2,basamy-3和basamy-4的热稳定性与basamy一致。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1