一种肝素前体硫酸化修饰酶的表达方法与流程
一种肝素前体硫酸化修饰酶的表达方法,该方法涉及生物
技术领域:
,具体涉及新的核苷酸序列、原核表达系统的构建和制备方法。
背景技术:
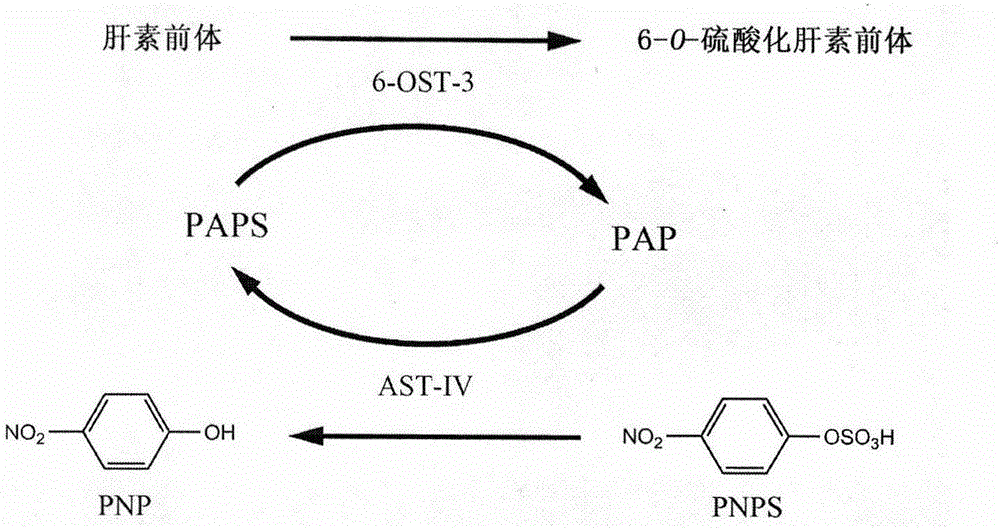
:硫酸乙酰肝素(Heparansulfate,HS)是一种多硫酸化多糖,它广泛存在于细胞表面及细胞外基质,参与了多种生物反应过程,如胚胎发育过程、凝血过程、病毒感染过程等等。研究发现,硫酸乙酰肝素具有多种生物活性,包括抗凝血、抗肿瘤、抗病毒等等,且其生物功能与多糖上修饰的硫酸基团密切相关。目前,肝素寡糖主要通过化学合成的方法进行制备。但是对于合成五糖以上分子量的肝素,单独使用化学合成十分困难。酶具有专一性和高效性,且其反应条件温和,不会对大分子的底物的结构造成变化,因此可用于大分子肝素的合成修饰过程。在硫酸乙酰肝素的生物合成过程中,首先合成的是由葡萄糖醛酸和乙酰氨基葡萄糖交替连接形成的主糖链,即肝素前体,然后进行修饰反应获得具有生物活性的肝素。共有六种酶参与了多糖链的修饰反应:N-硫酸基转移酶(N-sulfotransferase)、C5异构酶(C5epimerase)、2-O-硫酸基转移酶(2-O-sulfotransferase,2-OST)、3-O-硫酸基转移酶(3-O-sulfotransferase,3-OST)和6-O-硫酸基转移酶(6-O-sulfotransferase,6-OST),分别对肝素前体糖链的不同位点进行修饰。本发明通过分析小鼠的6-OST-3的催化活性区间蛋白的氨基酸序列,得到相应的经密码子优化的新双链核苷酸序列(6-ost-3),利用大肠杆菌原核表达系统,表达并制备了6-OST-3的催化活性区间蛋白,其作为工具酶对于大分子肝素的修饰合成具有重要意义。技术实现要素:本发明的目的是使用对实验条件要求较低的原核表达系统,表达小鼠的6-OST-3的催化活性区间蛋白,获得可溶性表达的酶蛋白以用于肝素的修饰合成反应。一种肝素前体硫酸化修饰酶的表达方法,包括下列步骤:(1)人工合成两端带有NdeI和XhoI酶切位点的6-ost-3序列,经双酶切后插入表达质粒pET-28a的NdeI/XhoI的位点,获得表达质粒pET-28a/6-ost-3。(2)将表达质粒pET-28a/6-ost-3转化入大肠杆菌BL21感受态中,获得重组工程菌。(3)将工程菌接种至LB培养基中过夜震荡培养作为种子液,再将种子液以1%的接种量接种至LB发酵培养基中,当菌液吸光度至0.4-0.6时加入IPTG在20℃诱导10-12h,离心收集菌体。(4)菌体重悬于pH7.4的磷酸缓冲液,加入溶菌酶破碎细胞,离心收集上清。(5)溶菌上清经镍柱纯化,获得6-OST-3酶蛋臼溶液。本发明利用大肠杆菌原核表达系统,在胞内可溶性表达了6-OST-3酶蛋白,并利用镍柱纯化获得酶溶液,具有方法简单、成本低廉的优点。经BCA法测量,酶蛋白溶液中蛋臼含量为2.44mg/mL。经测定,其酶活力为1.53U/mg。附图说明图1为BCA法蛋白含量测定的标准曲线图图2为酶活性测定中的酶反应体系说明图图3为酶活性测定中产物PNP的标准曲线图具体实施方式现结合实施例,对本发明作详细阐述。实施例1:(1)重组质粒的构建:人工合成两端带有NdeI和XhoI酶切位点的6-ost-3序列,经双酶切后插入表达质粒pET-28a的NdeI/XhoI的位点,获得表达质粒pET-28a/6-ost-3。(2)工程菌的构建:将表达质粒pET-28a/6-ost-3转化入大肠杆菌BL21感受态中,经卡那霉素抗性平板筛选,获得重组工程菌。(3)工程菌的诱导表达:将工程菌接种至LB培养基中37℃震荡培养过夜作为种子液,取1mL种子液接种至100mL的LB发酵培养基中37℃震荡培养,当菌液吸光度至0.6时加入IPTG在20℃诱导10h,8000rpm离心10min收集菌体。(4)菌体破碎:将步骤(3)所收集的菌体重悬于4mL含有500mM的NaCl、20mM磷酸三钠的pH7.4的磷酸缓冲溶液中,加入终浓度为1mg/mL的溶菌酶于4℃放置过夜,12000rpm离心15min收集上清。(5)镍柱纯化:将步骤(4)中所得的溶菌上清上样至镍柱,以含10mM咪唑的磷酸缓冲溶液作为清洗缓冲液,以含100mM咪唑的磷酸缓冲溶液作为洗脱缓冲液,收集洗脱液组分并用磷酸缓冲液透析去除咪唑,最后得到酶溶液。实施例2:(1)重组质粒的构建:人工合成两端带有NdeI和XhoI酶切位点的6-ost-3序列,经双酶切后插入表达质粒pET-28a的NdeI/XhoI的位点,获得表达质粒pET-28a/6-ost-3。(2)工程菌的构建:将表达质粒pET-28a/6-ost-3转化入大肠杆菌BL21感受态中,经卡那霉素抗性平板筛选,获得重组工程菌。(3)工程菌的诱导表达:将工程菌接种至LB培养基中37℃震荡培养过夜作为种子液,取1mL种子液接种至100mL的LB发酵培养基中37℃震荡培养,当菌液吸光度至0.4时加入终浓度为0.8mmol/L的IPTG在20℃诱导12h,8000rpm离心10min收集菌体。(4)菌体破碎:将步骤(3)所收集的菌体重悬于4mL含有500mM的NaCl、20mM磷酸三钠的pH7.4的磷酸缓冲溶液中,加入终浓度为1mg/mL的溶菌酶于4℃放置过夜,12000rpm离心15min收集上清。(5)镍柱纯化:将步骤(4)中所得的溶菌上清上样至镍柱,以含10mM咪唑的磷酸缓冲溶液作为清洗缓冲液,以含100mM咪唑的磷酸缓冲溶液作为洗脱缓冲液,收集洗脱液组分并用磷酸缓冲液透析去除咪唑,最后得到酶溶液。实施例3:(1)重组质粒的构建:人工合成两端带有NdeI和XhoI酶切位点的6-ost-3序列,经双酶切后插入表达质粒pET-28a的NdeI/XhoI的位点,获得表达质粒pET-28a/6-ost-3。(2)工程菌的构建:将表达质粒pET-28a/6-ost-3转化入大肠杆菌BL21感受态中,经卡那霉素抗性平板筛选,获得重组工程菌。(3)工程菌的诱导表达:将工程菌接种至LB培养基中37℃震荡培养过夜作为种子液,取1mL种子液接种至100mL的LB发酵培养基中37℃震荡培养,当菌液吸光度至0.6时加入终浓度为1.0mmol/L的IPTG在20℃诱导12h,8000rpm离心10min收集菌体。(4)菌体破碎:将步骤(3)所收集的菌体重悬于4mL含有500mM的NaCl、20mM磷酸三钠的pH7.4的磷酸缓冲溶液中,加入终浓度为1mg/mL的溶菌酶于4℃放置过夜,12000rpm离心15min收集上清。(5)镍柱纯化:将步骤(4)中所得的溶菌上清上样至镍柱,以含10mM咪唑的磷酸缓冲溶液作为清洗缓冲液,以含100mM咪唑的磷酸缓冲溶液作为洗脱缓冲液,收集洗脱液组分并用磷酸缓冲液透析去除咪唑,最后得到酶溶液。实施例4:蛋白含量测定:BCA法测定,标准曲线结果如下表样品名称01234567蛋白浓度(mg/mL)00.0250.050.10.20.30.40.5A5620.0970.1270.1540.2030.3110.4160.5190.597样品稀释10倍后测定,其吸光度为0.352,经计算蛋白含量为2.44mg/mL。实施例5:酶活测定:酶反应系统如图2。设置空白对照管和测试管,在两管中分别加入1mL的MES缓冲溶液(50mmol/LMES,1mmol/LMgCl2,1mmol/LMnCl2),再加入终浓度为40μmol/L的PAP溶液、终浓度为1mmol/L的PNPS溶液和终浓度为1μg/ml的AST-IV酶溶液,在30℃震荡反应20min。然后同时加入终浓度为1mg/mL的肝素前体溶液,在测试管内加入终浓度为0.1μg/ml的6-OST-3酶溶液,在30℃条件下反应30min后于100℃水浴10min终止反应,12000rpm离心15min,取上清于测定400nm处紫外吸收。6-OST-3酶活力单位(U)定义为:在上述条件下,加入6-OST-3后每分钟比空白管催化生成1μmolPNP所需要的酶量为一个活力单位。PNP标准曲线结果如下表pnp(μmol)00.511.522.5A4000.0470.0580.0780.1010.1230.14经测定,对照管及测定管吸光度分别为0.157和0.174,经计算,6-OST-3的比酶活为1.53U/mg。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1