一种利用淡水微藻生产含神经酸微藻油脂的生产方法与流程
本发明涉及微藻规模化生产,具体的说是一种利用淡水微藻生产含神经酸微藻油脂的生产方法。
背景技术:
神经酸(nervonic acid,NA)又名鲨鱼酸,化学名为顺-15-二十四碳烯酸,是一种长链不饱和脂肪酸,分子式C24H48O2,最早发现于哺乳动物的神经组织。神经酸在神经组织和脑组织中含量较高,主要以鞘糖脂和鞘磷脂的形式存在于人体大脑白质中,是生物膜的重要组成成分。人体自身很难合成神经酸,只能依靠体外摄取来补充。神经酸是大脑神经纤维和神经细胞的核心天然成分。神经酸缺失将会引起脑中风后遗症、老年痴呆、脑瘫、脑萎缩、记忆力减退、失眠健忘等脑疾病。神经酸可以延缓脑衰老,修复疏通神经纤维,进而激活神经细胞,恢复大脑对四肢、语言、记忆、面部的支配功能,缓解脑中风引起的偏瘫、四肢麻木、言语不清等后遗症。
神经酸主要来源于深海鱼油、植物油以及人工合成。目前,随着许多限制性使用动物产品法规的逐步建立,来自于动物油脂的天然神经酸资源受到极大限制。植物神经酸油脂则受到植物生长的季节和气候的影响,导致产量不稳定,而且副产品芥酸(C22:1)的含量很高,不利于人体健康,大量摄入芥酸,会在心肌脂肪积聚,导致心肌纤维化。而人工合成神经酸存在合成率低,副产品多的缺点。
微藻是单细胞的低等藻类,在自然界中广泛存在。随着藻种资源的不断开发,利用微藻进行高附加值产品的生产已经初具规模。目前国内外利用微藻进行生产蛋白质,二十碳五烯酸(EPA),二十二碳六烯酸(DHA),类胡萝卜素,虾青素等高值产品已经大量投放市场。国际上已形成利用螺旋藻、小球藻、杜氏盐藻、雨生红球藻和三角褐指藻等藻株从人工培养到下游产品的产业链。
技术实现要素:
本发明目的在于提供一种利用淡水微藻生产含神经酸微藻油脂的生产方法。
为实现上述目的,本发明采用的技术方案为:
一种利用淡水微藻生产含神经酸微藻油脂的生产方法,利用淡水微藻通过两步法进行培养,培养后通过絮凝-板框压榨方法收集微藻生物质,而后进一步通过乙醇亚临界萃取法提取含神经酸的微藻油脂。
所述淡水微藻为Mychonastes afer HSO-3-1,其保藏编号是CGMCC No.4654(参见申请号为201110119480.X申请案中记载)。
所述两步法培养是将OD750值达到2.0的淡水微藻依次经袋式光反应器和螺旋管式光反应器进行培养。
将所述OD750值达到2.0的指数生长期的淡水微藻藻种M.afer HSO-3-1接种于含BG-11培养基的柱式光反应器中,按1:10(v/v)的比例接种,通气培养,CO2浓度为2%,培养温度为25±1℃。
将所述OD750值达到2.0的淡水微藻接种于含培养液1的袋式光反应器中,按1:10(v/v)的比例接种,向反应器中通入含1-2%CO2的空气,通气比为1:0.05,室温下培养(20-30℃),经自然光照下培养6-8天,继而转入含培养液2的螺旋管中继续培养,,培养过程中以潜水泵推动藻液循环,通入含1-2%CO2的空气,通气比为1:0.05;培养温度控制在24-32℃,光照强度,白天为自然光照,夜间补充光照,光照强度为400μmol·photons·m-2·s-1,培养6天;
上述培养液1为BG-11,其中的氮源为硝酸钠(1.5g/L)或尿素(0.53g/L);
培养液2为1/4N BG-11,其中的氮源分别为硝酸钠(0.375g/L)或尿素(0.13g/L)。
将上述两步法培养后的微藻液经絮凝处理,收集絮凝处理后的沉淀,沉淀藻泥通过板框压榨机去除藻泥中的水分,所得到的块状藻泥通过阳光曝晒进一步除去水分,最后得到含水量10-15%的藻块;其中,絮凝剂为磷酸氢二钾和氯化钙,两者加入微藻液的终浓度均为藻液质量的0.5‰,等量依次加入到藻液中,絮凝体系中再加入碳酸氢钠,碳酸氢钠的加入量为体系质量的0.05‰。
上述絮凝过程中产生的上清液,经过滤后回收利用。
所述经絮凝处理获得藻块经粉碎后置于反应釜中,加入10-12倍体积于藻粉质量的乙醇,混合均匀,密闭条件下经亚临界萃取,获得粗藻油,粗藻油再经纯化即为含神经酸的中性脂(C24:1)。
所述亚临界萃取是在密闭反应釜内于1.4MPa,温度为90℃下反应50分钟,冷却后的混合液经离心后取上清液,上清液经浓缩,获得粗藻油,粗藻油溶于过量正己烷,再加入硅胶,通过吸附处理得含神经酸的中性脂。
与现有技术相比,本发明专利具有以下优势:
本发明利用微藻生产含神经酸微藻油脂,其采用两步法培养产神经酸的微藻Mychonastes afer HSO-3-1,在第一阶段的高氮环境中生产微藻生物质,在第二阶段的低氮和高光环境下诱导微藻细胞积累油脂,以尿素代替硝酸钠作为氮源可以大幅降低生产成本。与单阶段批次培养相比,两步法可以充分利用光照,缩短培养时间。
采用本发明方法获得较高产率的油脂,尤其是在室外规模化培养条件下,本发明的微藻油脂含量最高为34.6%(油脂占细胞干重),培养周期12-14天,油脂含量和培养周期均较优。
本发明在培养过程中利用磷酸氢二钾和氯化钙作为絮凝剂收集微藻生物质,能够有效的沉淀微藻细胞,降低能耗,同时可以避免重金属污染。
使用对环境友好的乙醇亚临界萃取法提取含神经酸微藻油脂,无污染,无有害有机溶剂残留,乙醇可以重复回收利用,有助于降低生产成本。
本发明在培养过程中获得经济价值高的副产品,产神经酸微藻藻株经两步法培养12-14天后,除了神经酸含量达到油脂含量的8.49%外,其它不饱和脂肪酸组成丰富,经济价值较高的亚麻酸(C18:3)也达到细胞内油脂含量的10.09%,可显著提高经济效益。
附图说明
图1为本发明实施例提的两步法规模化培养微藻的工艺流程图。
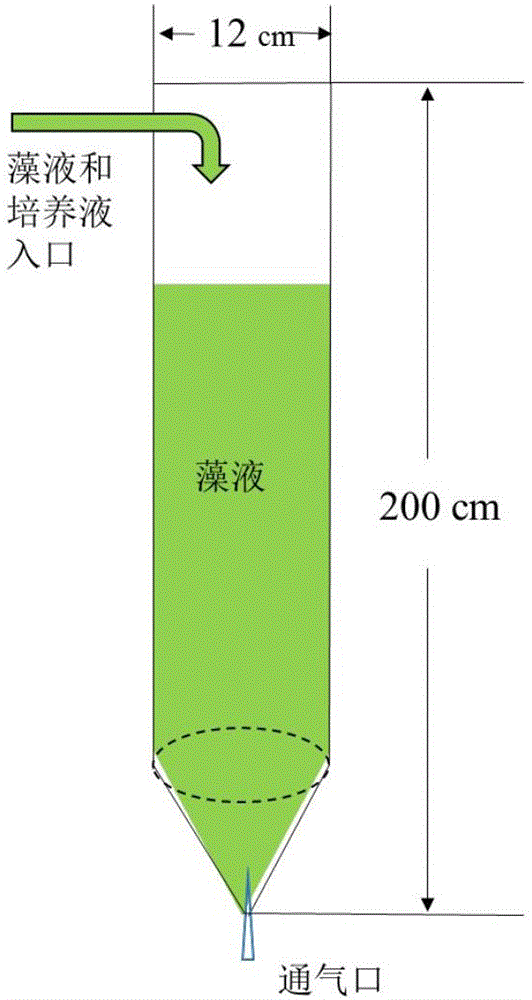
图2为本发明实施例提的袋式光反应器示意图。
图3为本发明实施例提的螺旋管式光反应器示意图。
图4为本发明实施例提的袋式光反应器中的Mychonastes afer HSO-3-1藻株的生物量与油脂含量图。
图5为本发明实施例提的螺旋管式光反应器中的Mychonastes afer HSO-3-1藻株的生物量与油脂含量图。
图6为本发明实施例提的不同培养阶段下的Mychonastes afer HSO-3-1油脂的脂肪酸组成图。
图7为本发明实施例提的Mychonastes afer HSO-3-1干燥藻块中油脂脂肪酸组成的气相色谱分析报告图。
具体实施方式
根据下列实施例,可以更好的理解本发明专利。实施例中,所描述的物料配比、工艺条件及其结果仅用于说明本发明,而不应当限制权利要求书中所详细描述的本发明的范围。
本发明公开上述藻株在规模化培养过程的不同生长阶段和不同培养基成分下的生长状况、油脂含量和神经酸含量。该生产工艺可以提高上述藻株的神经酸产率,同时生产具有较高价值的其它多不饱和脂肪酸,是一种环保、成本低廉的生产高附加值生物活性产品的生产技术。
本发明利用两步法规模化培养产神经酸的微藻藻株M.afer HSO-3-1生产神经酸,在获得神经酸的同时,还可以获得经济价值高的多不饱和脂肪酸和藻蛋白,尤其是一种生态友好、成本低廉的生产神经酸和微藻生物质的生产技术。
其可工业化室外规模化两步法培养技,培养过程中利用无污染的絮凝剂采收微藻生物质,并使用对环境友好的乙醇亚临界萃取法提取含神经酸的微藻油脂。
下述实施例中袋式光反应器和螺旋管式光反应器的规格:
培养单元1-袋式光反应器:φ12cm×200cm,容积为20L,塑料材质(图2);培养单元2-螺旋管光反应器:直管φ12cm×200cm,弯管φ12cm×100cm,亚克力材质,整套螺旋管式光反应器由20根直管、18根弯管组成,直管与弯管之间以法兰密闭连接,容积为600L,容积为600L(图3)。
实施例:
1)Mychonastes afer HSO-3-1种子液的培养
在实验室无菌条件下,从试管斜面培养基中将上述Mychonastes afer HSO-3-1转接至含(100mL BG-11(NaNO3 1500mg/L;K2HPO4 40mg/L;MgSO4·7H2O 75mg/L;CaCl2·2H2O 36mg/L;柠檬酸6mg/L;柠檬酸铁铵6mg/L;Na2EDTA1mg/L;NaCO3 20mg/L;H3BO3 2.86mg/L;MnCl2·4H2O 1.81mg/L;ZnSO4·7H2O 0.222mg/L;NaMoO4·2H2O 0.39mg/L;CuSO4·5H2O 0.079mg/L;Co(NO3)2·6H2O 0.049mg/L,pH 7.4)液体培养基的三角瓶中培养,50-100μmol·photons·m-2·s-1光照、20-25℃下培养7~10天,OD750达到2.0,以10%的接种量(体积比)接种至含有1000ml灭菌BG-11培养液的柱式光反应器中;然后在连续光照的条件下培养,光照强度为100~200μmol·photons·m-2·s-1,室温(24~30℃)下培养7~9天至指数生长期末期,获得M.afer HSO-3-1藻液的初始藻液,OD750值达到2.0-2.5。
2)Mychonastes afer HSO-3-1在袋式光反应器中生产微藻生物质
将上述获得的初始藻液,接种于培养单元1-袋式光反应器中,其中含10L的BG-11培养液,培养过程中以过滤后的自来水作为水源,氮源为硝酸钠(1.5g/L)或尿素(0.53g/L),其它营养盐的终浓度同步骤1)中所述液体培养基,而后接种OD750为0.2的藻液,自然光照,光照强度为200-700μmol·photons·m-2·s-1,温度为20-30℃,并通入含1-2%CO2的空气,通气比为1:0.05(体积比),通气培养6-8天后,收集藻细胞。氮源为硝酸钠(1.5g/L)时,生物量达到0.67g/L;以尿素(0.53g/L)为氮源时,生物量为0.66g/L(图4)。
经离心后获得的藻渣,经冷冻干燥24小时后获得干藻粉,而后采用氯仿-甲醇(2:1,v:v)方法提取干藻粉中的油脂:
具体,80-100mg藻粉使用6ml的氯仿-甲醇混合液在30℃下180rpm振荡过夜,离心后取上清液,再添加甲醇和水混合,使混合液中氯仿、甲醇、水的体积比为10:10:9,离心分层,取下层有机相(氯仿层)转移至事先称重的试管中,使用氮吹仪去除氯仿,残留的油脂经干燥后称重,计算油脂含量。氮源为硝酸钠(1.5g/L)时,油脂含量达到细胞干重的23.49%;以尿素(0.53g/L)为氮源时,油脂含量达到细胞干重的24.04%(图4)。
适量微藻油脂加入到2.5ml浓度为2.5%的硫酸-甲醇(v:v)溶液中,85℃下静置2.5h,每半小时振荡一次,使微藻油脂中的脂肪酸支链完全甲酯化。所得到的脂肪酸甲酯成分的分析采用气相色谱法(Varian 450-GC,美国),色谱检测条件如下:使用CP-WAX58毛细管柱(25m×0.25mm),进样量为1μl,分流比为1:30。升温程序:100℃保持2min,以10℃/min升至250℃,保持3min。进样器温度为:250℃,检测器温度为280℃。以面积归一法得到各脂肪酸组分的相对含量,脂肪酸标准品为Sigma公司产品。分析结果神经酸(C24:1)含量达到细胞内油脂含量的1.81%(图6)。
3)在螺旋管式反应器中诱导Mychonastes afer HSO-3-1生产含神经酸微藻油脂
将步骤2)获得的M.afer HSO-3-1藻液转入培养单元2-螺旋管式光反应器中继续培养,培养液为1/4N BG-11,其中的氮源分别为硝酸钠(0.375g/L)或尿素(浓度0.13g/L),培养周期为6天,白天为自然光照,夜间补充光照,光照强度为400μmol·photons·m-2·s-1,形成连续光照诱导微藻产生油脂,培养过程中以潜水泵推动藻液循环,通入含1-2%CO2的空气,通气比为1:0.05。培养过程中的温度控制在24-32℃。氮源为硝酸钠(0.375g/L)时,生物量达到1.57g/L,油脂含量达到细胞干重的34.4%;以尿素(0.53g/L)为氮源时,生物量为1.68g/L,油脂含量达到细胞干重的30.1%(图6)。
根据上述步骤2)的方法分析上述藻株在螺旋管式光反应器中培养6天后的油脂含量(图5)和脂肪酸组成(图6),氮源为硝酸钠(0.375g/L)时,油脂含量达到细胞干重的34.2%;以尿素(0.13g/L)为氮源时,油脂含量达到细胞干重的34.63%(图5)。神经酸(C24:1)含量达到细胞内油脂含量的2.45%。
4)絮凝法收集Mychonastes afer HSO-3-1生物质:絮凝剂为磷酸氢二钾和氯化钙,它们的终浓度分别为藻液质量的0.5‰,将絮凝剂依次加入到藻液中,搅拌均匀,进一步在藻液中加入0.05‰(质量比)的碳酸氢钠后,可以加速微藻的沉降速度,静置至少4小时后回收上层清液,过滤后回收利用,下层藻泥通过板框压榨机进一步去除藻泥中的水分,所得到的块状湿藻泥通过阳光曝晒干燥,2-3天后得到干燥的藻块,含水量10-15%。
5)Mychonastes afer HSO-3-1含神经酸微藻油脂的规模化提取工艺对上述步骤4)得到的Mychonastes afer HSO-3-1干藻粉,使用乙醇亚临界萃取法提取其生物质中的油脂。
具体:上述干燥藻块粉碎成粉末状后置于反应釜中再加入乙醇混合均匀,其中,10份体积的乙醇与1份质量的藻粉混合均匀后,密闭反应釜,反应釜压力保持在1.4MPa,温度为90℃,反应时间为50分钟。冷却后的混合液经离心后取上清液,通过旋蒸仪去掉有机溶剂,得到粗藻油。粗藻油溶于正己烷,加入硅胶,通过吸附作用去除粗藻油中的色素和磷脂等极性脂成分,得到含神经酸的中性脂。根据步骤2)中的方法分析中性脂的脂肪酸组成,神经酸(C24:1)含量达到细胞内油脂含量的8.49%,亚麻酸(C18:3)含量达到油脂含量的10.09%(图6),气相色图谱如图7。
- 还没有人留言评论。精彩留言会获得点赞!