一种鼠李糖乳杆菌胞外多糖的制备及用途的制作方法
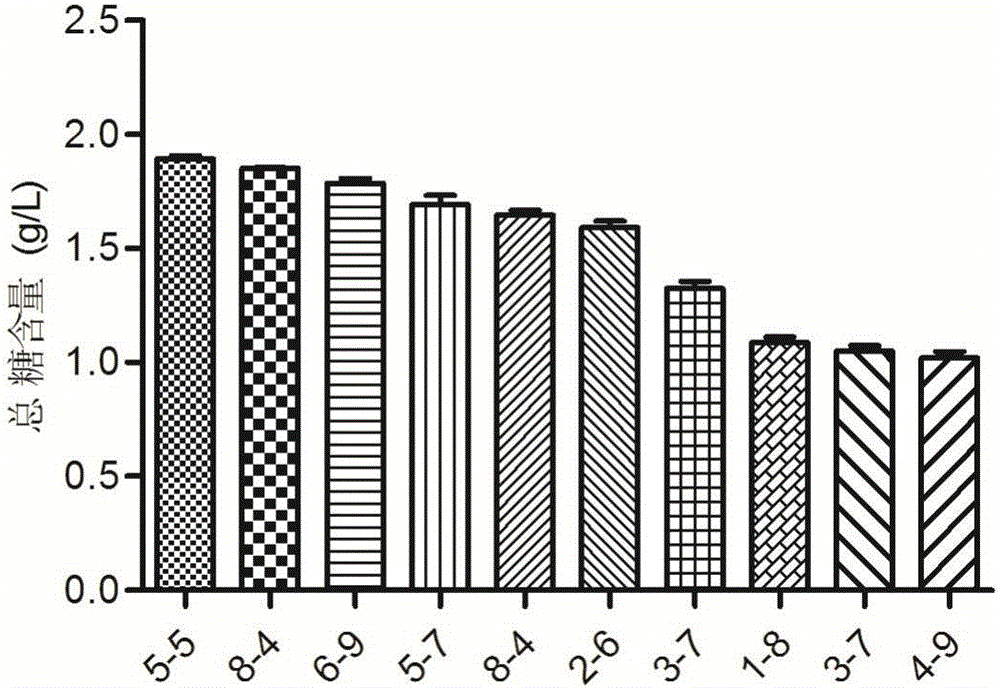
本发明涉及微生物学中的多糖药物技术领域,具体涉及到一种微生物胞外多糖,尤其是涉及一种鼠李糖乳杆菌来源的胞外多糖的制备及用途。
背景技术:
多糖一直以来是生命有机体不可或缺的组成部分,是高等植物、动物细胞膜及微生物细胞壁的重要构成。近年来随着膜化学功能研究、免疫物质的化学研究及新药物资源的研究开发,以及对多糖的探索不断深入,发现多糖不仅结构复杂,而且显示出多种多样的生物活性,如免疫调节、抗炎、抗肿瘤、抗衰老以及抗菌等。
乳酸菌胞外多糖是乳酸菌在生长代谢过程中分泌到细胞壁外的一类大分子糖类化合物,有的依附于微生物细胞壁形成荚膜,称为荚膜多糖;有的则进入培养基形成粘液,称为粘液多糖,他们都是微生物适应环境的代谢产物。近年来研究发现,乳酸菌来源的胞外多糖是食品级多糖的良好来源,不仅对乳制品的质构和风味有重要影响,而且作为增稠剂、稳定剂、乳化剂、胶凝剂及保湿剂广泛应用于各种食品中。研究表明,乳酸菌胞外多糖还具有抗肿瘤、降血清胆固醇、增强人体免疫力等多种生理功能,因此将其开发成功能性食品或药品具有广阔的应用前景。自然界产胞外多糖的乳酸菌来源十分广泛,如乳制品、发酵食品、动物肠道等。高产胞外多糖的乳酸菌菌种通常为产粘菌株,如乳酸乳杆菌(Lactobacillus lactis),鼠李糖乳杆菌(Lactobacilus rhamnosus),乳酸链球菌(Streptococcus lactis)等。但发酵乳的粘度及质构与多糖的产量并非有直接的相关,而与多糖的分子量、链的长度、分支度以及单糖组成等有关。根据单糖组成的种类不同,乳酸菌胞外多糖可分为两大类:同型多糖和异型多糖。仅有同一种单糖聚合形成的即为同型多糖,乳酸菌胞外多糖中的同型多糖组成单糖主要为葡萄糖或果糖。而根据糖苷键类型不同,可分为四种:(1)葡聚糖(Dextrans):葡萄糖残基通过α-1,6-糖苷键连接而成,在C3上连有不同程度的分支,而在C2和C4上很少有分支;(2)β-葡聚糖(β-glucans):葡萄糖残基通过β-1,3-糖苷键连接而成;(3)果聚糖(Fructans):果糖残基通过β-2,6-糖苷键或者β-2,1-糖苷键连接而成;(4)变聚糖(Mutans):葡萄糖残基通过α-1,3-糖苷键连接而成直链多糖(直链中糖苷键含量>50%),含有少量的α-1,6分支;(5)其他种类的多聚糖。
技术实现要素:
本发明中的鼠李糖乳杆菌CGMCC No.13497,是从8种市售酸奶中依据菌落拉丝法和胞外总糖产量筛选获得,代号为ZLW-1。菌株的分类名称:鼠李糖乳杆菌Lactobacilus rhamnosus,保藏编号为:CGMCC No.13497,保藏日期:2016年12年26日,保藏单位为:中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为:北京市朝阳区北辰西路1号院3号。
通过菌落拉丝法结合胞外总糖产量筛选到的一株产胞外多糖的鼠李糖乳杆菌CGMCC No.13497,通过16S rDNA序列鉴定得知该菌株属于鼠李糖乳杆菌亚种。
本发明还公开了一种鼠李糖乳杆菌胞外多糖,其由本发明的鼠李糖乳杆菌菌株CGMCC No.13497发酵而得。优选的方法为:将本发明的鼠李糖乳杆菌菌株CGMCC No.13497在脱脂乳培养基中37℃静置恒温培养,培养上清液经初步分离得到粗多糖,粗多糖经过DEAE-52离子交换层析和Sephacryl S-300凝胶层析的方法纯化,即得。更有选的方法为:将鼠李糖乳杆菌CGMCC No.13497在脱脂乳培养基中37℃恒温静置培养18-24h,培养液经离心除菌体获得上清液,上清液经Sevag法除蛋白,3-5倍体积乙醇沉淀,真空冷冻干燥后获得粗多糖;所述粗多糖经过DEAE-52离子交换层析纯化,流动相为1mol/L NaCl,流速为SV=1/120;洗脱组分经截留分子量为5000Da的超滤膜进行超滤,浓缩4倍体积后再经过Sephacryl S-300凝胶层析纯化,流动相为双蒸水,流速为SV=1/500;洗脱组分经截留分子量为7000Da的透析袋流水透析36-48h,透析截留液经真空冷冻干燥,即得。
该菌株在2L的脱脂乳培养基中进行恒温静置培养,最终粗多糖产量可达到2.9g/L。培养后的粗多糖经DEAE-52阴离子交换层析和Sephacryl S-300凝胶层析的方法纯化后得到一种纯度为95.3%的水溶性胞外多糖组分(Extracellular polysaccharide,EPS),其分子量为1.4×105Da。体内外实验表明,本发明鼠李糖乳杆菌胞外多糖EPS具有促进巨噬细胞增殖,治疗结肠炎的作用,在作为免疫增强剂,抗炎药物方面具有广阔的应用价值。
体外巨噬细胞增殖实验表明,本发明的鼠李糖乳杆菌胞外多糖EPS具有促进巨噬细胞增殖的活性。所述的巨噬细胞为鼠源巨噬细胞RAW 264.7细胞。
体内抗溃疡性结肠炎实验表明,本发明的鼠李糖乳杆菌胞外多糖EPS能够明显减缓溃疡性结肠炎的炎症反应,显著降低了TNBS诱导的结肠炎小鼠的疾病活动指数,同时对TNBS诱导的结肠炎具有良好的治疗作用。
本发明的鼠李糖乳杆菌胞外多糖EPS还可用于制备具有抗炎效果的口服或注射制剂,也可用于制备具有免疫增强功能的保健品。
本发明的鼠李糖乳杆菌胞外多糖EPS优选用下列方法制备:将鼠李糖乳杆菌CGMCC No.13497在脱脂乳培养基中37℃恒温静置培养18-24h,培养液经离心除菌体获得上清液,上清液经Sevag法除蛋白,3-5倍体积乙醇沉淀,真空冷冻干燥后获得粗多糖;粗多糖经过DEAE-52离子交换层析(Φ2.6cm×30cm,BV=120mL)分离,流动相为1mol/L NaCl,流速为SV=1/120;洗脱组分经截留分子量为5000Da的超滤膜进行超滤,浓缩4倍体积后在经过Sephacryl S-300凝胶层析(Φ1.6cm×80cm,BV=120mL)纯化,流动相为双蒸水,流速为SV=1/500,洗脱组分经截留分子量为7000Da的透析袋流水透析36-48h,透析截留液经真空冷冻干燥后获得精品糖EPS。
下面是本发明多糖的药效学试验及结果:
一、体外巨噬细胞增殖实验
采用CCK-8检测方法。将体外培养的巨噬细胞RAW 264.7,经细胞计数及稀释后得到5×106个/mL的细胞悬液,于96孔板中每孔加100μL巨噬细胞悬液,于37℃、5%CO2细胞培养箱中培养6h至巨噬细胞贴壁后,每孔加入20μL的EPS(终浓度为50、100、200、400μg/mL),同时设定control组(加20μL的生理盐水),每组设定3个复孔,培养24h后,吸取并弃掉上清,每孔加入100μL CCK-8溶液(DMEM:CCK-8=10:1),继续培养1.5h后,于450nm波长处用酶标仪测定吸光值。结果见附图6。
由图6可以看出,采用CCK-8方法检测加入的EPS 24h后RAW 264.7细胞的生长状况。EPS对RAW 264.7细胞生长具有明显的刺激增殖作用,且具有剂量依赖性,活细胞数量明显多于阴性对照的空白组。而400μg/mL的EPS加药组的巨噬细胞数量为空白对照组的1.78倍。实验结果表明,EPS作用下RAW 264.7巨噬细胞增殖效果十分明显。
二、体内抗溃疡性结肠炎实验
1.大鼠结肠炎模型的建立
将SD大鼠用300mg/kg剂量的水合氯醛麻醉,之后将三硝基苯磺酸(TNBS)溶解于40%的乙醇中,注射于小鼠结肠部位,后将小鼠倒置30s,确保TNBS充分吸收。
2.TNBS诱导结肠炎小鼠的疾病指数变化
取体重为180-200g的SD大鼠随机分成4组,每组10只,用无菌水溶解鼠李糖乳杆菌胞外多糖EPS制成EPS溶液(20mg/kg)。组别设置为TNBS模型组,空白组,TNBS+EPS组,TNBS+SASP组,每组10只动物。在连续给药期间,空白组和模型组每天给药生理盐水,EPS组每天给药EPS。SASP组每天给药SASP(100mg/kg),各组连续给药14天。每天记录大鼠体重和粪便稀疏程度,并且计算大鼠疾病活动指数。疾病活动指数按照下表计算。绘制疾病活动指数-时间变化曲线。结果如附图7所示。
疾病指数
由图7可以看出,在EPS给药之后,大鼠体内溃疡性结肠炎的症状得到明显缓解,疾病活动指数呈明显下降的趋势。相比于模型组,EPS给药组最终的疾病活动指数下降了3.1倍,结果表明本发明鼠李糖乳杆菌胞外多糖EPS对TNBS诱导的大鼠结肠炎具有一个显著的治疗作用。
附图说明
图1是本发明中筛选的十株乳酸菌的多糖产量
图2是鼠李糖乳杆菌CGMCC No.13497在发酵过程中的多糖积累和生物量变化
图3是粗多糖在DEAE-52阴离子交换柱上的洗脱曲线
图4是粗多糖在Sephacryl S-300凝胶层析柱上的洗脱曲线
图5是鼠李糖乳杆菌胞外多糖EPS的HPLC图谱
图6是鼠李糖乳杆菌胞外多糖EPS对巨噬细胞增殖的倍数变化
图7是鼠李糖乳杆菌胞外多糖EPS对大鼠的疾病活动指数变化
具体实施方式
实施例1
一、产糖菌株的筛选和鉴定
1.酸奶样品预处理
菌株分离样品为8种市售酸奶。取酸奶液体样品5mL加含有50mL 0.1%无菌蛋白胨水的锥形瓶中,振荡后静置20min,4℃保存备用。
2.菌落拉丝法初筛
取液体样品2mL于20mL 0.1%无菌蛋白胨水中振荡混匀,梯度稀释105倍,取100μL涂布于MRS平板培养基,37℃恒温倒置培养72h,挑取总计156个粘稠且有明显拉丝的单菌落转接至MRS斜面培养基,37℃恒温培养48h,4℃保存备用。
3.菌种镜检
从斜面挑取少量菌体至载玻片上进行涂片、革兰染色,然后在显微镜下观察菌体形态。选取镜检形态大小规则均一,没有杂菌的菌株进行复筛。
4.菌株复筛
将从平板上得到的分离株接种到MRS液体培养基中培养24h,再按3%的接种量接种到50mL MRS摇瓶培养基中,在37℃恒温培养箱中静置培养18h。取20mL培养液,沸水浴加热10min,冷却到室温,10000×g离心10min,取上清液薄膜浓缩至5mL,加入1mL Servag试剂,4℃静置过夜。10000×g离心10min后取上清液,用双蒸水定容至10mL后,苯酚硫酸法测定总糖的含量,DNS法测定还原糖含量。而溶液中的多糖含量=总糖含量-还原糖含量。根据多糖产量结合拉丝性能,选取10株拉丝现象明显,总糖含量相对较高的菌株进行进一步研究。菌株筛选结果见图1。
由图1可以看出,对产胞外多糖菌株使用的拉丝法进行初筛时,根据各菌株的拉丝特征我们将八种市售酸奶的稀释液涂布于MRS平板上,筛选出156株具有明显拉丝现象的菌株,继而通过革兰染色确定156株菌均为革兰阳性菌。而将平板上分离的156株菌转接至MRS液体培养基中培养后,取18h发酵液煮沸灭活,Sevag法除蛋白,醇沉透析,双蒸水定容后通过苯酚硫酸法测定总糖含量,DNS法测定还原糖含量,从而计算出多糖的产量。附图1中列出了多糖产量相对较多的十个菌株,而菌株5-5、8-4以及6-19相比其他菌株的多糖产量较高,同时结合拉丝性能,我们选取这三株菌进行接下来的实验研究。
5.菌种16S rDNA鉴定
菌种鉴定通过16S rDNA序列分析完成。挑取菌株5-5斜面培养物适量,加至5mL MRS液体培养基中,37℃培养过夜,取2mL菌液,5000×g离心5min,弃上清液,在沉淀中加入300μL细胞裂解液,加入10μL蛋白酶K,56℃水浴1h。100℃沸水浴加热10min后,12000×g离心10min,取上清液进行PCR反应。引物由南京金斯瑞生物科技有限公司合成。引物序列如下:
上游引物:5'-CGGCTACCTTGTTACGACTT-3'
下游引物:5'-AGAGTTTGATCCTGGCTCAG-3'
PCR产物纯化后送交南京金斯瑞生物科技有限公司进行测序。测得菌株5-5的16S rDNA序列。测序结果用BLAST程序与美国国立生物技术信息中心数据库中已报道的细菌16S rDNA进行比对,结果表明,菌株5-5的16S rDNA序列与鼠李糖乳杆菌亚种Lactobacilus rhamnosus strain HFI-K2的同源性为99.7%。
由以上鉴定结果可得,鼠李糖乳杆菌CGMCC No.13497为鼠李糖乳杆菌亚种(Lactobacilus rhamnosus),该菌已于2016年12月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏号:CGMCC No.13497。
实施例2
鼠李糖乳杆菌胞外多糖的发酵制备
1.鼠李糖乳杆菌CGMCC No.13497在2L发酵瓶中发酵培养
(1)种子培养基的配制
MRS液体培养基:蛋白胨10g/L,牛肉膏10g/L,酵母提取物5g/L,K2HPO4 2g/L,柠檬酸二铵2g/L,乙酸钠5g/L,葡萄糖20g/L,吐温80 1mL/L,MgSO4·7H2O 0.58g/L,MnSO4·4H2O 0.25g/L,调节pH至6.4。MRS斜面培养基:在MRS固体培养基基础上添加1.8%琼脂。
(2)种子液的培养
将实验所需的菌株从-20℃保藏的甘油管中接种至MRS斜面,置于37℃培养箱中培养24h后,用接种环挑取少许接种至5ml MRS液体培养基,置于37℃培养箱中培养16h后,转接至50mL MRS液体培养基,置于37℃培养箱中培养16h后,4℃保存备用。
(3)发酵培养基的配制
将2L脱脂牛奶倒入3L发酵瓶中,纱布塞封口,于105℃,20min进行高压蒸汽灭菌,冷却后置于常温备用。
(4)2L脱乳培养基发酵培养
将MRS液体脂培养基中16h种子培养物以5%接种量接种至2L脱脂乳培养基中。置于恒温培养箱中37℃培养24h。每隔2h取样3mL测定生物量、总糖含量以及还原糖含量。生物量通过干湿重法测定。多糖含量=总糖含量-还原糖含量。总糖含量通过苯酚硫酸法测定,还原糖含量通过DNS法测定。
结果见图2.由图2可以看出,在发酵过程中多糖在不断积累,在8h之后积累速率明显加快,在18h之后产量趋于稳定,最终达到2.9g/L;生物量在4h-12h内迅速上升,在12h之后趋于稳定,在20h时达到最大值2.8g/L。结果表明在鼠李糖乳杆菌CGMCC No.13497规模发酵时,将发酵总时间控制在18h能够获得较高产量的胞外多糖,保证后续分离纯化和药理活性实验过程有足够的粗多糖来源基础。与此同时鼠李糖乳杆菌CGMCC No.13497在2L发酵瓶发酵获得的胞外多糖产量较其他乳酸菌相对较高,因此本发明中鼠李糖乳杆菌CGMCC No.13497是一株良好的多糖生产菌种,有潜在的工业规模化生产和应用价值。
2、鼠李糖乳杆菌胞外粗多糖的提取
(1)纯化试剂的配制
Sevag试剂:氯仿与正丁醇以4∶1的体积比混合。
(2)发酵产物中粗多糖的提取
将2L发酵液100℃煮沸5min,灭活残余菌体。之后将2L灭活菌体的发酵液于10000×g离心10min,去除沉淀取上清液;将上清液薄膜浓缩至500mL,加入1/5倍体积Sevag试剂,于摇床中200rpm震荡20min;Sevag试剂反应后于5000×g离心,去除沉淀,收集上清,重复三次。之后进行乙醇沉淀,将95%乙醇和上清液置于4℃冷却30min,加入3-5倍体积95%的乙醇,充分搅拌后(此过程应伴随多糖称絮状沉淀析出),4℃静置过夜。之后倒去上层乙醇,将沉淀用蒸馏水充分搅拌溶解,进行真空冷冻干燥后获得干燥后的淡黄色粉末状粗多糖。
3、鼠李糖乳杆菌胞外精多糖的制备
(1)粗多糖溶液配制
称取粗多糖1g溶解于10mL双蒸水中充分溶解,配成100mg/mL的水溶液,于冷冻离心机8000×g离心10min后,取上清液即为100mg/mL粗多糖水溶液。
(2)DEAE-52阴离子交换层析
将粗多糖水溶液上样至平衡好的DEAE-52阴离子交换柱(Φ2.6cm×30cm,BV=120mL)。用5倍柱体积双蒸水冲洗离子交换柱,流速为SV=1/240(0.5mL/min),再用2倍柱体积1mol/L的NaCl溶液洗脱,流速为SV=1/120(1mL/min)。利用自动分部收集器收集,每管收集5mL,用苯酚硫酸法逐管测定总糖含量,作出洗脱曲线,合并收集相同组分,得到NaCl洗脱多糖组分EPS。结果见图3。
在图3中,粗多糖溶于水后离心,除去不溶于水的杂质沉淀后,取上清液上样至DEAE-52阴离子交换柱后先用双蒸水洗脱5倍柱体积,将与树脂不结合或结合较弱的物质洗脱出来。继而通过用0-1mol/L的NaCl溶液梯度洗脱,检测并收集洗脱峰。结果表明EPS带有一定负电荷,能与DEAE-52离子交换树脂有一定的结合,因此需要一定浓度的盐溶液(NaCl)才能将EPS洗脱下来。
(3)超滤浓缩
用截流分子量为5000Da的超滤膜对(2)中的NaCl洗脱的收集液EPS进行超滤;压力为0.08MPa,超滤浓缩4倍体积后进行真空冷冻干燥。
(4)Sephacryl S-300凝胶层析
取(3)中真空冷冻干燥所得样品EPS 150mg分别溶于5mL双蒸水中配成30mg/mL的水溶液,于冷冻离心机8000×g离心10min后取上清液后过0.45μm滤膜过滤除菌。取溶液上样至平衡好的Sephacryl S-300凝胶层析柱(Φ1.6cm×80cm,BV=120mL)。用2倍柱体积双蒸水洗脱,流速为SV=1/500(0.25mL/min),自动分部收集器收集,每管收集3mL,用苯酚硫酸法逐管测定总糖含量,作出洗脱曲线,合并收集相同组分。结果见图4。
由图4可以看出,DEAE-52阴离子交换柱中NaCl洗脱出的盐洗组分EPS进一步通过Sephacryl S-300凝胶层析柱进行纯化,得到洗脱曲线图谱,EPS自第14管开始出峰到第28管结束,含有少量的蛋白,此多糖组分可能为结合了一定量蛋白的蛋白糖,需进一步结构鉴定来确定其多糖构成。两种组分的洗脱峰均为单一对称峰,说明鼠李糖乳杆菌胞外多糖EPS是均一的单糖组分。
(5)透析冻干
选择截流分子量为7000Da的透析袋,加入(4)中洗脱的收集液,流水透析36-48h,真空冷冻干燥得到精品糖EPS,称量标记,于-20℃冰箱保存。最终经分离纯化后的多糖收率如表1所示。
表1粗多糖和精多糖EPS的理化参数
4、鼠李糖乳杆菌胞外多糖EPS的组成及其理化参数测定
多糖含量测定
精确称取葡萄糖20mg于烘箱105℃干燥至恒重后,溶于100mL双蒸水中配成0.2mg/mL的葡萄糖标准溶液。将标准溶液按照下表分别稀释为20、40、80、100、120、160、200μg/mL,而后加入0.4mL苯酚溶液,再快速加入2.0mL浓硫酸,充分混匀,室温下静置30min,静置后依次吸取200μL加入96孔板中,用酶标仪测定在波长490nm下的吸光值,双蒸水作空白对照。以葡萄糖浓度为横坐标,A490为纵坐标,作C-A490的标准曲线并计算对应的回归方程。将多糖样品配成0.1mg/mL的溶液,按照以上方法吸取0.1mL,加入0.2mL苯酚溶液及1.0mL浓硫酸,酶标仪测其490nm下的吸光值,根据回归方程计算样品的多糖含量。
蛋白含量测定
多糖组分中蛋白质含量通过福林-酚法进行。
(1)溶液的配制
(a)标准蛋白溶液的配制:精确称取BSA 1.25mg溶于5mL双蒸水中配制成250μg/mL的溶液。(b)样品溶液配制:福林-酚甲试剂(VA:VB=50:1):A:10g Na2CO3、2g NaOH、0.25g酒石酸钾钠(KNaC4H4O6·4H2O)溶于500mL双蒸水。B:0.5g CuSO4·5H2O溶于100mL双蒸水中。福林-酚乙试剂:美国Sigma公司试剂。
将标准BSA溶液按照下表分别稀释为0、25、50、100、150、200、250μg/mL,而后加入5mL试剂甲,充分混匀,室温下静置10min,而后快速加入0.5mL试剂乙,立即摇匀,30℃水浴中静置30min,1号试管(双蒸水)为对照溶液,用分光光度计测各管在500nm处
吸光值。以蛋白浓度为横坐标,A500为纵坐标作图,绘出C-A500标准曲线并计算其C-A500方程。同法测定样品在500nm的吸光值,计算出多糖样品中的蛋白含量。
纯度鉴定
通过JASCO高效液相色谱系统进行纯度鉴定。系统配置为Shodex sugar 805串联Shodex sugar 802色谱柱,2414示差折光检测器,流动相为双蒸水,样品浓度为10.0mg/mL,进样量为20μL,流速1.0mL/min,柱温30℃,记录样品色谱曲线。结果如图5所示。
由图5可以看出,通过高效液相检测鼠李糖乳杆菌胞外多糖EPS的纯度,鼠李糖乳杆菌胞外多糖EPS的高效液相色谱结果显示为单一对称峰,出峰时间为11.7min,表明EPS为均一多糖组分,纯度为95.3%。由附图3可知,EPS是一种纯度高于95%的水溶性多糖组分,为之后的药理学活性实验提供了保证。
分子量测定
鼠李糖乳杆菌胞外多糖EPS分子量的测定通过高效凝胶渗透色谱法进行。配置为Shodex sugar 805串联Shodex sugar 802色谱柱,用2414示差折光检测器检测。以浓度为5.0mg/mL的样品及葡聚糖标准品溶液依次进样,进样量均为20μL,流动相为0.01mol/L的NaNO3溶液,流速1.0mL/min,记录各自的保留时间Tr,绘LogMr-Tr标准曲线并计算其回归方程。根据多糖样品的保留时间,通过方程计算其相对分子质量。
根据不同相对分子量的葡聚糖标准品及其对应的保留时间绘制标准曲线,其线性回归方程为Log Mr=-0.00486Tr3+0.459Tr2–14.7Tr+163。RAPS的保留时间为11.7min,代入方程能够推算出其相对分子质量约为1.4×105Da。
- 还没有人留言评论。精彩留言会获得点赞!