一种DNA损伤检测响应元件及其应用的制作方法
本发明涉及对环境中的遗传毒性物质检测的技术领域,具体为利用携带报告基因的重组大肠杆菌检测环境中的遗传毒性物质。
背景技术:
近年来,遗传毒性污染物在我国环境中分布较广,种类及数量较大,在环境污染物中有一定代表性,对人体危害较大。食品、药品、环境等中的因素引起的对DNA损伤、染色体畸变等癌变越来越多,对这些胁迫因子的检测也越来越有必要。DNA损伤一般通过遗传毒性试验检测,随着分子生物学技术的快速发展,各种遗传毒性试验方法也在不断的改进。
遗传毒性检测是指用于检测可以直接或间接诱导细胞发生遗传学损伤的试验,而DNA的损伤是恶性肿瘤发展过程的环节之一。近年来建立了一些短期快速的体外遗传毒性试验方法来检测DNA的损伤。目前已建立的遗传毒性短期检测法已超过200种。其中研究和应用较多的方法有姐妹染色单体交换(sister chromatid exchange,SCE)、程序为NDA合成(unscheduled DNA synthesis)、彗星实验(coment assay),又称单细胞凝胶电泳试验(single cell gel electrophoresis)、鼠伤寒沙门氏菌回复突变试验(reverse mutation test of salmonella typhi munine,又称Ames试验)、SOS显色试验、原噬菌体诱导试验方法等。这些检测方法通常具有操作繁杂、检测时间长、需要严格的无菌操作等不利于推广的因素。并且由于专利保护等原因,个别检测方法并不利于国内推广,限制了其广泛使用。
技术实现要素:
本发明是针对现有技术的不足,提供一种可快速响应环境中可致DNA损伤的基因元件,并将该元件应用于环境遗传毒性物质的快速检测。该检测方法操作便利、耗时短、无需额外添加化学试剂、不受色素干扰,易于实现高通量样品检测。
本发明的技术方案如下:
一种DNA损伤检测响应元件,其基因序列如SEQ ID 1所示。
所述的DNA损伤检测响应元件在遗传毒性物质快速检测方面的应用。
将该元件插入到大肠杆菌表达载体,构建DNA损伤检测重组载体,并将该重组载体转入到大肠杆菌,得到重组大肠杆菌,再将该重组大肠杆菌应用于遗传毒性物质快速检测,即将重组菌与遗传毒性物质孵育,大肠杆菌细胞裂解。
所述重组载体,自5′至3′端依次为DNA损伤检测响应元件、噬菌体裂解基因和终止子。
所述的噬菌体裂解基因,可为任意一种噬菌体裂解基因,优选为lambda噬菌体的裂解基因SRRz,其基因序列为SEQ ID2。
所述的大肠杆菌终止子可为任意一种大肠杆菌终止子,优选为T7终止子。
本发明所提供的遗传毒性物质快速检测的方法,包括以下步骤:
(1)利用所述的重组大肠杆菌制备大肠杆菌检测液;
(2)将待测样品与大肠杆菌检测液混合,同时添加同体积纯溶剂的大肠杆菌检测液作对照;两组样品均继续培养15-60min;
(3)将与待测样品混合的大肠杆菌检测液与对照组的大肠杆菌检测液分别测得OD600;
(4)计算裂解效率,根据裂解效率标准曲线计算待测样品中遗传毒性物质浓度。
所述大肠杆菌检测液的制备:
(1)将重组大肠杆菌储藏物用LB固体培养基进行培养,使其复苏活化;
(2)将得到的活化大肠杆菌单菌落接入到LB液体培养基中进行震荡培养至对数生长期后期;
(3)将得到的饱和菌液以1:100体积比接种到新鲜的LB培养基中,培养至菌液OD600为0.15-0.25,得到大肠杆菌检测液。
所述大肠杆菌表达载体可为任意一种大肠杆菌载体,如pBluescript,pUC18,pUC19,pET系列载体(如pET30a)等。以pUC18为出发载体,构建的大肠杆菌裂解载体为pRST。
所述的大肠杆菌,为E.coli BL21,E.coli DH5a,E.coli XL1-blue或E.coli HB101。
所述的遗传毒性物质可以是Cr6+、甲磺酸甲酯(MMS)和4-硝基喹啉1-氧化物(4-NQO)。
含有所述大肠杆菌遗传毒性物质响应载体的重组大肠杆菌也属于本发明的保护范围。
与现有技术相比,本发明的有益效果如下:
(1)操作对象为大肠杆菌,无致病风险,操作简便易行。
(2)测试周期短,2h内可检测完成。
(3)检测过程无需添加额外试剂(如酶底物等),成本低廉。
(4)检测灵敏度高,对Cr6+、4-NQO、MMS的敏感浓度范围分别为在0.01-0.1、1-5、40-100mg/L条件下敏感。
附图说明
图1载体构建示意图。
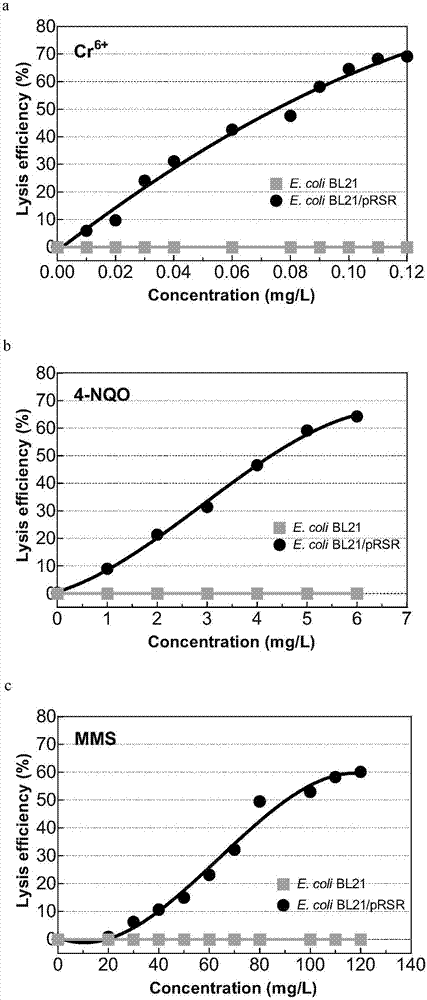
图2重组大肠杆菌(E.coli BL21/pRST)对Cr6+(a)、4-NQO(b)、MMS(c)不同遗传毒性物质的裂解响应图。
具体实施方式
下面结合具体实施例对本发明作进一步详细说明。
实施例1
遗传毒性响应载体的构建
以pUC18为出发载体,构建遗传毒性响应载体pRST。具体构建方法如下:
1.合成DNA损伤响应元件Prec(Seq ID 1)和T7终止子序列,分别在Prec和T7终止子上游添加EcoRI和XbaI位点,下游添加SpeI和PstI酶切位点。
2.以lambda噬菌体基因组DNA为模板,扩增SRRz基因。在SRRz基因的上下游也分别添加EcoRI和XbaI、SpeI和PstI酶切位点。
3.采用生物积木(Biobricks)方法,采用酶切、连接方法将各元件按照启动子-裂解基因-终止子顺序连接,插入到pUC18载体中,得到遗传毒性响应载体pRST。
4.将载体pRST转入到E.coli BL21感受态细胞,获得遗传毒性物质检测用的重组大肠杆菌E.coli BL21/pRST。
实施例2
裂解效率的计算
大肠杆菌检测液接触待测样品后20min,分别测定各测试菌液在600nm处的光吸收值(OD600)。
裂解率(%)=(A-B)/A*100%
其中,A—添加甲醇的菌液OD600
B—添加测试样的菌液OD600。
实施例3
遗传毒性物质检测
1.重组大肠杆菌的复苏活化
将重组大肠杆菌从-80°冰箱中划线于LB平板培养基中,在37°条件下恢复培养14h。挑取单菌落,接种至LB培养基中,在37°、250rpm条件下培养12-16h。
2.大肠杆菌检测液制备
将复苏活化的菌液以1:100体积比例接种至新鲜LB培养基,以190μl体积量加入到96孔培养板中,在35-38℃,600-1000rpm条件下培养至OD600到0.15-0.2(用时约1-1.5h)。
3.与受试样品接触
将受试样品10μl加入到96孔板内,在35-38℃,800rpm条件下继续培养20分钟,设置3个平行组。同时设置添加相同体积的纯溶剂(甲醇),和添加饱和浓度(Cr6+、4-NQO、MMS的饱和浓度分别为0.1、100、25mg/L)至野生型E.coli BL21菌株作为阴性对照。
4.实验结果表明,在该饱和浓度条件下,不含遗传毒性响应载体的野生型E.coli BL21菌株生长正常,未发生菌体裂解。本实施例中检测结果如图2所示,各遗传毒性物质检测的标准曲线对应为:
Cr6+,Y=3.685+601.6X,R2=0.99 (0.01<X<0.1)
4-NQO,Y=-4.532+12.58X,R2=0.99 (1<X<5)
MMS,Y=-31.14+0.9355X,R2=0.97 (40<X<100)
其中,X表示遗传毒性物质的浓度(mg/L),Y表示菌体裂解效率(%),R2表示曲线拟合相关系数。
该结果表明,在检测浓度范围内,样品浓度与菌体裂解效率成线性相关。因此,可以用该菌株E.coli BL21/pRST对样品是否含有遗传毒性物质进行检测。
实施例4
不同水样遗传毒性检测
本实施例拟针对不同来源的水样进行遗传毒性物质检测,以Cr6+为标准毒性物质,对应的检测样品的遗传毒性物质浓度,根据裂解效率换算为Cr6+当量浓度。
1.按照实施例3步骤1-2制备E.coli BL21/pRST检测菌液。
2.取待测水样,以40mL/min的速度用活化的树脂吸附,然后乙酸乙酯洗脱。洗脱液采用离心冻干方法去除乙酸乙酯,再以一定体积的蒸馏水溶解样品至所需体积。将待测水样与大肠杆菌检测液混合,同时添加同体积纯溶剂的大肠杆菌检测液做对照;两组样品均继续培养20min。所述待测水样分别取日常城市用水(实验室水龙头放出)、城市水厂水源、某化工厂废水和珠江某入水口水样B。
3.将与待测水样混合的大肠杆菌检测液与对照组的大肠杆菌检测液分别测得OD600。
4.计算裂解效率,根据裂解效率标准曲线计算待测样品中遗传毒性物质Cr6+当量浓度。所得结果如表1所示。
表1结果表明,日常城市用水和城市水厂水源的遗传毒性物质Cr6+的当量浓度低于2.5ng/L,而化工厂废水水样Cr6+的当量浓度约为9.3ng/L,珠江某入水口水样Cr6+的当量浓度约为4.8ng/L。
上述检测结果表明,包含有本发明所述遗传毒性物质快速响应元件的基因工程菌,在响应浓度范围内对待测物进行检测,最终以Cr6+当量浓度表示待测样品的遗传毒性含量。该方法无致病风险,操作简单、检测灵敏度高、耗时短、易于推广。
SEQUENCE LISTING
<110> 华南理工大学
<120> 一种DNA损伤检测响应元件及其应用
<130> 1
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> 1
<400> 1
gctacttgat actgtatgag catacagtat aattg 35
<210> 2
<211> 1320
<212> DNA
<213> Artificial Sequence
<220>
<223> 1
<400> 2
gaccttattc ctaattaaat agagcaaatc cccttattgg gggtaagaca tgaagatgcc 60
agaaaaacat gacctgttgg ccgccattct cgcggcaaag gaacaaggca tcggggcaat 120
ccttgcgttt gcaatggcgt accttcgcgg cagatataat ggcggtgcgt ttacaaaaac 180
agtaatcgac gcaacgatgt gcgccattat cgcctggttc attcgtgacc ttctcgactt 240
cgccggacta agtagcaatc tcgcttatat aacgagcgtg tttatcggct acatcggtac 300
tgactcgatt ggttcgctta tcaaacgctt cgctgctaaa aaagccggag tagaagatgg 360
tagaaatcaa taatcaacgt aaggcgttcc tcgatatgct ggcgtggtcg gagggaactg 420
ataacggacg tcagaaaacc agaaatcatg gttatgacgt cattgtaggc ggagagctat 480
ttactgatta ctccgatcac cctcgcaaac ttgtcacgct aaacccaaaa ctcaaatcaa 540
caggcgccgg acgctaccag cttctttccc gttggtggga tgcctaccgc aagcagcttg 600
gcctgaaaga cttctctccg aaaagtcagg acgctgtggc attgcagcag attaaggagc 660
gtggcgcttt acctatgatt gatcgtggtg atatccgtca ggcaatcgac cgttgcagca 720
atatctgggc ttcactgccg ggcgctggtt atggtcagtt cgagcataag gctgacagcc 780
tgattgcaaa attcaaagaa gcgggcggaa cggtcagaga gattgatgta tgagcagagt 840
caccgcgatt atctccgctc tggttatctg catcatcgtc tgcctgtcat gggctgttaa 900
tcattaccgt gataacgcca ttacctacaa agcccagcgc gacaaaaatg ccagagaact 960
gaagctggcg aacgcggcaa ttactgacat gcagatgcgt cagcgtgatg ttgctgcgct 1020
cgatgcaaaa tacacgaagg agttagctga tgctaaagct gaaaatgatg ctctgcgtga 1080
tgatgttgcc gctggtcgtc gtcggttgca catcaaagca gtctgtcagt cagtgcgtga 1140
agccaccacc gcctccggcg tggataatgc agcctccccc cgactggcag acaccgctga 1200
acgggattat ttcaccctca gagagaggct gatcactatg caaaaacaac tggaaggaac 1260
ccagaagtat attaatgagc agtgcagata gagttgccca tatcgatggg caactcatgc 1320
- 还没有人留言评论。精彩留言会获得点赞!