一种基于叶脉网眼结构仿生的多层细胞培养微器件的制作方法
本发明属于采用仿生手段进行微器件设计领域,具体涉及一种基于叶脉网眼结构仿生的多层细胞培养微器件,该细胞培养微器件用于构建细胞体外培养动态稳定均一的流体流动微环境。
背景技术:
细胞是组成生物体的基本单元,细胞研究对于揭示生命规律、诊断疾病、筛选药物等具有重要意义。细胞培养是进行细胞研究的基础,传统的细胞体外培养往往采用培养皿、培养瓶或培养板,是一种静态的培养,与细胞在体流动微环境不同。
微流控器件的微通道网络与细胞在体时所处的脉管系统非常相似,可以进行动态的培养,因此采用微流控技术进行细胞培养使细胞在体微环境的体外模拟和控制成为可能。
培养池是微流控细胞培养器件的重要功能单元之一,为保证培养区内的各细胞具有相同的微环境,要求细胞培养区的流场具有均一性。同时,为保证实验的复现性,要求细胞培养区的流场具有稳定性。因此如何设计培养池成为微器件设计的关键。
大自然经过长期的进化形成了许多优化结构。双子叶植物叶脉能够将从根部运至叶柄的液体均匀的输运至每个叶肉细胞,供给叶肉细胞进行各项生理活动。双子叶植物叶脉的这种水力特性与结构密不可分。双子叶植物叶脉具有如下特征:叶脉整体呈网状分布,且主脉中液体流量变化随中间脉密度的提高而逐渐趋于稳定,因此流量的变化对叶肉细胞影响小、输送至叶片各区域养分均匀,并且高密度的闭合叶脉可以保证液体输运不会由于局部叶脉损坏或混入气体而阻塞,保证了网眼区域内液体供给的稳定性。
技术实现要素:
本发明的目的在于,克服现有技术的缺点,采用提取生物体内影响流体流动微环境的微结构的方法,设计一种能够构建动态稳定均一的细胞体外培养流体流动微环境的细胞培养微器件,采用微加工技术制作该微器件并用于细胞体外培养。
本发明的技术方案:
一种基于叶脉网眼结构仿生的多层细胞培养微器件,包括细胞进样层1、中间过渡层2和仿生培养层3,细胞进样层1位于最上层,中间过渡层2位于中间层,仿生培养层3位于底层;
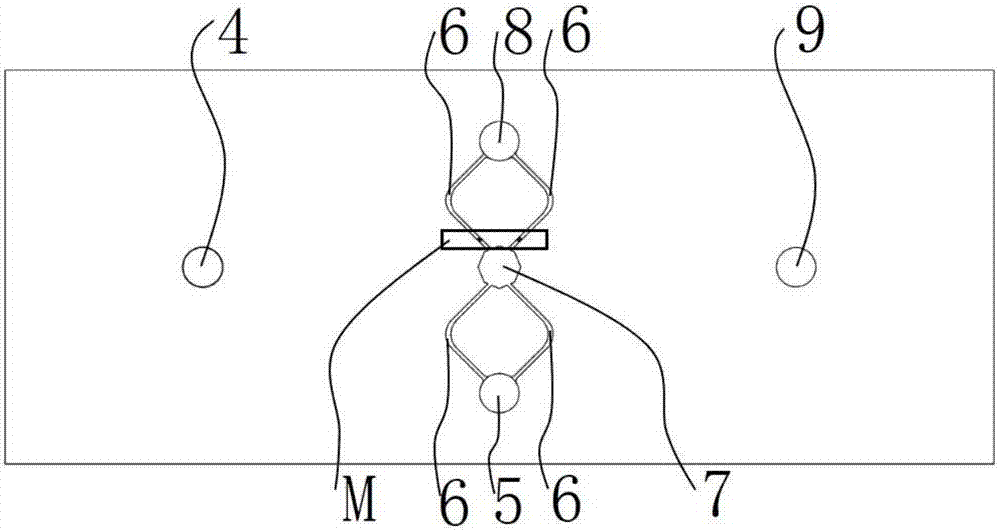
所述的细胞进样层1上设有4个通孔和1个对齐孔,4个通孔分别为培养液进样孔4、细胞进样孔5、细胞出样孔8和废液排出孔9,对齐孔7位于细胞进样层1的中心处,培养液进样孔4和废液排出孔9对称位于对齐孔7左右端,细胞进样孔5和细胞出样孔8对称位于对齐孔7上下端;细胞进样孔5和细胞出样孔8间通过通道6连通,通道6成对对称布置;与细胞出样孔8相连的通道6侧横向设有梯形微坝18,用于阻挡细胞被冲出培养池;
所述的中间过渡层2上设有3个通孔,从左到右依次为培养液进样通孔10、培养池连通孔11和废液排出通孔12,培养液进样通孔10与细胞进样层1的培养液进样孔4相通,废液排出通孔12与细胞进样层1的废液排出孔9相通,培养池连通孔11与细胞进样层1的对齐孔7相对,且形状大小相同;
所述的仿生培养层3上设有培养液储液池13、仿生培养池15和废液储液池17,培养液从培养液进样孔4通过培养液进样通孔10进入培养液储液池13,培养液储液池13与仿生培养池15间通过培养液进样通道14相连,仿生培养池15与废液储液池17间通过废液出样通道16相连;
所述的培养液储液池13分为储液区19和溢流区20,储液区19位于培养液储液池13的最内部,储液区19由多个栅栏微柱21围成,储液区19的内切圆直径不小于培养液进样通孔10的内切圆直径,培养液通过栅栏微柱间隙22进入溢流区20,溢流区20与培养液进样通道14相通;
所述的仿生培养池15设有两层微柱,为内微柱层和外微柱层,内微柱层是由多个排布紧密的内微柱24围成的多边形结构,由内微柱24围成的多边形结构内部为细胞培养区23,培养液通过内微柱24间的内微柱间隙28进入细胞培养区23;外微柱层位于内微柱层外侧,外微柱层中排布的外微柱25的数量与多边形的边数相同,将仿生培养池15内部的通道分为一级分岔子通道26和二级分岔子通道27;一级分岔子通道26为仿生培养池15与外微柱层间形成的通道、外微柱层中外微柱25间形成的通道,一级分岔子通道26的水力直径符合murray定律,即一级分岔子通道26水力直径的三次方之和等于培养液进样通道14水利直径的三次方;二级分岔子通道27为外微柱层和内微柱层间形成的通道,二级分岔子通道27为最后一级子通道,模拟叶片最细的叶脉,与一级分岔子通道26具有相同的水力直径。
所述的细胞进样层1上面的通道6关于对齐孔7成对对称布置,使细胞从多个方向进入培养池,利于细胞均匀的分布于细胞培养区23内;所述的细胞进样层1上面的通道6与对齐孔7具有相同的深度;所述的细胞进样层1上面的梯形微坝18的高度与通道6的深度相同;所述的细胞进样层1上面的对齐孔7与培养池连通孔11、细胞培养区23具有相同的形状和大小,便于键合对准。
所述的仿生培养层3设计灵感来源于双子叶植物叶片内的叶脉结构。叶脉等级分岔和闭合的结构特点增加了叶片内水分输运的冗余度,为叶脉内调整液体流量变化提供了多条路径。受这一现象的启发,本发明设计了仿叶脉结构的培养层,主要是仿叶脉细脉处的结构。所述仿生培养层3上的培养液进样通道14、一级分岔子通道26、二级分岔子通道27模拟叶脉网络结构,具有等级分岔特点;所述仿生培养层3上的仿生培养池15模拟网眼结构,具有多边形特点;所述仿生培养池上的内微柱间隙28模拟叶脉导管侧壁上的纹孔结构,用于连接二级分岔子通道27与细胞培养区23。
所述的细胞进样层1、中间过渡层2和仿生培养层3采用热固性聚合物聚二甲基硅氧烷(pdms),或者热塑性聚合物聚甲基丙烯酸甲酯(pmma)或聚苯乙烯(ps)或聚碳酸酯(pc)材料。
所述的细胞进样层1、中间过渡层2和仿生培养层3采用微加工工艺制作而成,制作过程为:采用光刻技术和干法刻蚀技术制作微模具、采用软刻蚀技术或热压技术将微模具上的图形转移至微器件材料上。
所述的中间过渡层2使用的材料厚度小于等于模具上的微柱的高度,以形成通孔。
所述的细胞进样层1采用微流控芯片专用打孔器在培养液进样孔4、细胞进样孔5、细胞出样孔8和废液排出孔9对应位置打出通孔。
所述的细胞进样层1、中间过渡层2和仿生培养层3通过氧等离子体处理或者热压的方法键合在一起。
所述的键合过程中,细胞进样层1与中间过渡层2之间需要对准,中间过渡层2与仿生培养层3之间需要对准,所述的对准过程采用可视化的显微成像技术,将对准过程呈现在计算机屏幕上,通过调整上下平台间的位置使芯片层之间实现对准。
所述的细胞培养微器件在键合好之后通入无水乙醇以保持封闭通道及培养池内表面的亲水性,并且起到消毒灭菌的作用。
所述的细胞培养微器件通过示踪粒子测速的方法来测量细胞培养区23内流体的流动速度。
所述的细胞培养微器件、硅胶管和管接头在用于细胞培养之前高温高压灭菌1小时,灭好菌后包被鼠尾胶原蛋白或纤连蛋白,包被好胶原后置于孵育箱过夜,利于后续细胞贴壁。
所述的细胞培养微器件在注入细胞后静置片刻,置于显微镜下观察细胞注入情况,放入co2孵育箱静态孵育至大多数细胞贴壁。
所述的细胞培养微器件在细胞贴壁后开始进行动态培养。
所述的细胞培养微器件在动态培养过程中每隔24小时对培养池内的细胞进行一次观察拍照至细胞铺满整个培养池。统计每个时间段内细胞的数量,绘制细胞生长曲线。
本发明的有益效果:成对对称分布的细胞进样通道通过多通道多方向的细胞注入实现培养池内细胞的均匀分布;通过模拟植物叶脉网眼结构构建的仿生培养池可以精确的控制培养池内的流体流动微环境,模拟细胞在体流动微环境,提高细胞体外实验结果的可靠性;仿生培养池具有一定的鲁棒性,可以抵抗外部扰动,减少由于增加微泵、微阀、微通道、浓度梯度发生器或者通道破坏堵塞造成的培养池内流场的变化,提高实验的可重复性,且该仿生培养池可以集成到多种细胞操控微器件中,在保证细胞培养微环境的同时,实现细胞的大批量培养;该微器件具有较高的生物兼容性,制作简单,成本低,可以实现大批量生产。
附图说明
图1是本发明中细胞培养微器件的三维结构图。
图2是本发明中细胞进样层1的二维俯视图。
图3是图2中m局部放大图,梯形坝18用于阻止细胞被冲出培养池。
图4是细胞进样层1上细胞出样区域三维结构图,梯形坝19位于通道6内,其高度与通道6的深度相同。
图5是本发明中仿生培养层3的二维俯视图。
图6为图5中a-a剖面上的三维剖视图,该图展示了培养液储液区19、溢流区20、培养液进样通道14、细胞培养区23、废液出样通道16和废液储液池17具有相同的深度。
图7为图5中培养液储液池13的放大示意图。
图8为图5中仿生培养池的放大示意图。
图9为图8中n局部放大图,内微柱间隙28模拟叶脉导管壁上的纹孔结构,用以连接二级分岔子通道27与细胞培养区23,将培养液输运至细胞培养区23,并将细胞培养区23内的废液导出。
图10是在本发明仿生细胞培养微器件内进行示踪粒子测速的粒子轨迹图。
图11是本发明仿生细胞培养微器件的培养池内均匀分布的28个粒子的平均速度。
图12是本发明仿生细胞培养微器件的培养池内平均流速随着培养液进样通道14处流速变化的曲线图。
图13是本发明仿生细胞培养微器件的细胞培养区23内细胞在不同时间段的生长状况图。
图14是本发明仿生细胞培养微器件的细胞培养区23内细胞培养84小时后使用dapi染色后的细胞图片。
图15是本发明仿生细胞培养微器件的细胞培养区23内细胞的生长曲线图。
图中:1细胞进样层;2中间过渡层;3仿生培养层;4培养液进样孔;
5细胞进样孔;6通道;7对齐孔;8细胞出样孔;9废液排出孔;
10培养液进样通孔;11培养池连通孔;12废液排出通孔;
13培养液储液池;14培养液进样通道;15仿生培养池;16废液出样通道;
17废液储液池;18梯形微坝;19储液区;20溢流区;21栅栏微柱;
22栅栏微柱间隙;23细胞培养区;24内微柱;25外微柱;
26一级分岔子通道;27二级分岔子通道;28内微柱间隙。
具体实施方式
以下结合附图和技术方案,进一步说明本发明的具体实施方式。
实施例
如图1所示,一种用于构建细胞体外培养动态稳定微环境的仿生细胞培养微器件,该微器件由三层结构组成,分别为细胞进样层1、中间过渡层2和仿生培养层3,细胞进样层1位于最上层,中间过渡层2位于中间,仿生培养层3位于底层。细胞进样层1上的培养液进样孔4与中间过渡层2上的培养液进样通孔10具有相同的尺寸,直径为0.5~1.5mm,本实施例中为1mm;细胞进样层1上的废液排出孔9和中间过渡层2上的废液排出通孔12具有相同的尺寸,直径为0.5~1.5mm,本实施例中为1mm;中间过渡层2上培养池连通孔11的大小形状与对齐孔7、细胞培养区23相同,形状可以为正方形、正六边形、正八边形或正十边形,多边形的内切圆直径为0.5~2mm,本实施例中为内切圆直径1mm的正八边形;细胞进样层上1的通道6成对对称分布,通道的深度为30~100微米,通道的宽度为100~300微米,本实施例中通道6的深度和宽度分别为50微米和100微米;与细胞出样孔8相连的通道6一侧中的梯形微坝18(如图3所示)的上底和下底分别为10~30微米和5~20微米,本实施例上底和下底分别为20微米和10微米,梯形微坝18的高度与通道的深度相同,本实施例为50微米;仿生培养层3上的培养液储液池13的直径为1~3mm,本实施例中为1.5mm,储液区19的直径为0.5~1.5mm,与培养液进样孔4大小相同,栅栏微柱21阵列的外圆直径为1.5mm~2.5mm,栅栏微柱21的周向宽度为30~150微米,本实施例中为90微米,栅栏微柱21的高度与培养液储液池14的深度相同,为50~200微米,本实施例中为60微米;培养液进样通道14的宽度为100~300微米,本实施例为200微米;一级分岔通道26与二级分岔通道27与培养液进样通道14深度相同,一级分岔通道的宽度由其水力直径计算得到,一级分岔子通道26的水力直径的三次方之和等于培养液进样通道14的水力直径的三次方,符合murray定律,本实施例中一级分岔通道26的宽度为69微米,二级分岔子通道27的宽度与一级分岔子通道26的宽度相同;细胞培养区23的形状为正多边形,正方形、正六边形、正八边形、正十边形,正多边形的内切圆直径为0.5~2mm,本实施例中为内切圆直径为1mm的正八边形,深度与培养液进样通道14相同;细胞培养区23周围的内微柱24径向宽度为50~200微米,本实施例中为100微米,内微柱间隙28径向中线均经过细胞培养区内切圆的圆心,周向宽度为5~10微米,本实施例中为6微米,深度与细胞培养区23相同;废液出样通道16与培养液进样通道14关于细胞培养区23的内切圆呈对称分布。所述的仿生培养池可以集成到依据murray定律计算的等级分岔微通道网络中,实现细胞的大批量培养。
实施例中细胞培养微器件通过示踪粒子测速的方法来测量培养池内流体的流动速度。具体的操作为先向微器件内注满去离子水,采用预先制作好的实心塞子将细胞进出样孔密封住,然后通过硅胶管(内径为0.5mm~1.5mm,本实施例为1mm)和管接头(外径为0.5mm~1.5mm,本实施例为1mm)将微器件的培养液进样孔与恒流注射泵上面的注射器连接在一起,培养液出液口通过管接头和硅胶管通入废液缸。微器件装置置于倒置荧光显微镜下,注射器内吸入混合均匀的微球悬浮液(浓度为0.005~0.05g/ml,本实施例为0.01g/ml),设定好恒流注射泵的流量(1μl/min~15μl/min,本实施例为5μl/min);开启恒流注射泵,调整显微镜的亮度与焦距,使图像聚焦在仿生培养层上的培养池的半高位置处,待观察到的微球运动稳定后,通过ccd相机记录一定时间间隔内(20ms~500ms,本实施例为50ms)的图片;采用图像处理软件中的粒子追踪模块处理多张连续图片,得到微球在培养池内运动轨迹(如图10所示)和平均运动速度(如图11所示)。在一定范围内改变恒流注射泵的流量(本实施例为2μl/min,3μl/min,5μl/min,7μl/min),以注射泵流量的变化代表微器件受到的外部扰动,测量不同注射泵流量下培养池内流场的变化(如图12所示)。
实施例中细胞培养微器件、硅胶管和管接头在用于细胞培养之前高温高压灭菌1小时,灭好菌后包被鼠尾胶原蛋白(浓度为0.01mg/ml~0.02mg/ml,本实施例0.012mg/ml)或纤连蛋白(浓度为1μg/ml~10μg/ml,本实施例5μg/ml),包被好胶原后置于孵育箱过夜,利于后续细胞贴壁。
实施例中细胞培养微器件在包被胶原过夜后通入pbs冲洗掉多余的蛋白,然后吸出pbs,随后在微器件内注满细胞培养液,待细胞培养液注满之后,通过细胞进样孔将预先制好的hela细胞悬浮液(浓度为5×105~5×106个/ml,本实施例为2×106个/ml)以5μl/min的注射泵流量注入培养池内,待细胞出样孔有液体冒出时停止注入。静置片刻,将微器件置于显微镜下观察细胞植入情况,然后将微器件放入co2孵育箱静态孵育至大多数细胞贴壁。
实施例中细胞培养微器件在hela细胞贴壁后开始进行动态培养,具体为通过硅胶管和管接头将微器件与注射泵连接在一起,预先在注射器和硅胶管内充满培养液,设定注射泵流量(2~20μl/min,本实施例为5μl/min),开启注射泵,推动注射器向微器件内源源不断的输入新鲜的培养液并将细胞代谢废液排出。细胞培养微器件在动态培养过程中每隔24小时对培养池内的hela细胞进行一次观察拍照(如图13所示),hela细胞铺满整个培养池后用dapi染色(如图14所示)。统计每个时间段内细胞的数量,绘制细胞生长曲线(如图15所示)。
- 还没有人留言评论。精彩留言会获得点赞!