ST2抗原的制备及其专用编码DNA分子的制作方法
本发明涉及基因工程技术领域,具体涉及一种st2抗原的制备及其专用编码dna分子。
背景技术:
人的st2基因约40kb,位于人类染色体2q12,可编码一种可溶性蛋白(sst2)和一种跨膜形式蛋白(st2l),两者的转录分别受到不同的启动子调控。现已知st2存在4种亚型:sst2、st2l、st2v和st2lv。st2v和st2lv是st2l的两个剪接体,st2l包括一个胞外结构域(3个连续的的免疫球蛋白模体)、一个跨膜片段和一个toll/il-1受体(tir)胞内结构域;而sst2则缺失跨膜及胞内结构域,只有一个由9个氨基酸组成的独特的c末端序列。
st2是白细胞介素1(interleukin-1,il-1)受体超家族成员之一,有跨模型(st2l)和可溶性(sst2)种形式,主要表达于th2细胞、肥大细胞和成纤维细胞中,参与多种炎症过程并发挥免疫调节功能。据文献记载il-33为st2的特异性功能配体,后来证实il-33和st2l结合具有心脏保护作用。研究表明,心力衰竭患者血清中sst2明显增高,并能够竞争性结合il-33,阻断il-33/st2l信号通路,参与心肌纤维化和心室重构。sst2作为心力衰竭的一种新的标志物近年来受到广泛的关注。近年来众多研究表明sst2在心力衰竭中的应用价值至少与nt-probn相当。
il-33是il-1家族成员,可以与靶细胞上的膜受体结合后介导下游信号通路,或者被运输到靶细胞的细胞核作为dna结合因子行使功能。当受到生物应力刺激时,由心脏成纤维细胞合成的il-33与细胞膜表面的st2l结合形成复合物后,将活化信号传递至细胞内,经过下游的il-1相关蛋白激酶、髓样分化因子88和肿瘤坏死因子受体相关因子6等一系列信号分子,激活核转录因子kb(nuclearfactorkb,nf-kb)和促分裂原活化蛋白激酶(mitogen-activatedproteinkinase,mapk),从而调节基因转录,导致th2细胞效应分子il-5、il-4和il-13等的释放。急性心肌梗死发生后,患者血清中sst2升高,sst2与il-33结合,抑制nf-kb的活化,阻断一系列反应发生。
蛋白质抗原可以通过以下方式制备:(1)天然蛋白质,天然蛋白结构正确,活性稳定,是良好的抗原,但是其来源于组织和细胞,成分复杂,难以分离纯化;(2)重组蛋白质,随着基因工程技术的发展,重组蛋白质已经成为制备抗原的主旋律。目前,重组蛋白表达系统主要有原核表达系统、酵母表达系统、昆虫表达系统、哺乳细胞表达系统等。其中大肠杆菌(e.coli)原核表达系统是应用最广泛的表达系统,此系统的优点是遗传背景相对清楚,具有使用安全、操作简单、生产量大、生产成本低、周期短等特点;(3)人工合成多肽,为了制备特异针对某一抗原表位(抗原决定簇)的抗体,可以制备人工表位肽用于免疫,但是多肽分子一般8~20个氨基酸,分子量太小,很难引起机体的免疫反应,所以合成的多肽需要与一个载体蛋白连接以增强其免疫原性,常用的载体蛋白有:bsa(牛血清白蛋白)、ova(卵清蛋白)、klh(knoweyholelimpethemocyanin,钥孔戚血蓝蛋白)、rsa(兔血清白蛋白)、hsa(人血清白蛋白)、gst(谷胱甘肽s转移酶)、map(多价抗原肽,主要指多聚lys),且这种方法的成本较高且制备出的抗体亲和力较低。
现有大肠杆菌原核表达系统制备重组蛋白时,由于天然st2dna序列存在较多的大肠杆菌稀有密码子和二硫键等原因,表达量较低,且存在发卡结构和转录提前终止等现象。
技术实现要素:
本发明所要解决的技术问题之一是通过优化st2dna序列构建了一种表达st2的重组载体,提出了一种st2抗原的制备方法,解决了天然st2基因序列中局部gc含量过高而出现发卡结构的问题,同时降低了因局部at含量过高而导致的转录提前终止的可能性,并且所有氨基酸的密码子均为大肠杆菌系统中有利于高水平表达的高频密码子。
本发明的一个目的是提供一种dna分子。
本发明提供的dna分子,为如下1)或2)或3)的dna分子:
1)编码区为序列表中序列1所示的dna分子;
2)与1)限定的dna序列至少具有70%、至少具有75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同源性且编码具有相同功能蛋白质的dna分子;
3)在严格条件下与1)或2)限定的dna序列杂交且编码具有相同功能蛋白质的dna分子。
上述严格条件为上述2)中严格条件是指:0.2×ssc,0.1%sds,60℃杂交。
含有上述dna分子的重组载体、表达盒、转基因细胞系、重组菌或重组病毒也是本发明保护的范围。
上述重组载体为将上述dna分子插入表达载体得到的载体。
上述重组载体中,所述表达载体为pet-28a(+)。
st2天然序列中ggtacagggcgcac、gtgtgacggcgaccaggtcc、ggctgccgtcctgtggcagc等局部序列的gc含量高于70%,高于50%的gc含量的序列,在dna复制时双链打开需要更高的能量,所以高gc含量会导致复制效率底下。再比如,st2天然序列整体的特点是gc含量为41%,at含量为59%,atatataaaaaacaatcagattgcaatgttccagattatttgatgtattcaacagtatctggatcagaaaaaaattccaaaatttatt的gc含量只有23.9%。
选择的表达载体pet-28a(+)中,表达其实氨基酸密码atg的上游的91个核苷酸序列为aaattaatacgactcactataggggaattgtgagcggataacaattcccctctagaaataattttgtttaactttaagaaggagatatacc,gc含量为33%,其中tagaaataattttgtttaactttaagaaggagatata序列的gc含量只有18.9%。这91个核苷酸序列中,有启动子(转录起始)序列。如果一个蛋白质编码区内部序列gc含量偏低,极有可能在编码区出现短的不需要的转录产物(rna),造成转录水平的资源浪费。
上述的重组菌中,所述重组菌为将上述dna分子插入表达载体得到的重组菌。
上述dna分子或上述的重组载体、表达盒、转基因细胞系、重组菌或重组病毒在制备st2蛋白中的应用也是本发明保护的范围。
本发明另一个目的是提供一种制备st2蛋白的方法。
本发明提供的方法,包括如下步骤:诱导表达上述的重组菌,得到st2蛋白。
上述方法中,所述诱导表达的诱导物为iptg,所述iptg诱导的浓度为0.2mmol/l。
由上述方法制备的st2蛋白也是本发明保护的范围。
上述dna分子在制备免疫检测试剂盒中抗原st2中的应用也是本发明保护的范围。
与现有技术相比,本发明的有益效果在于,本发明利用基因工程手段得到重组表达的st2抗原,解决了目前st2重组表达的空白,并且对st2天然dna序列进行优化,解决了天然st2基因序列中局部gc含量过高而出现发卡结构的问题,同时降低了因天然st2基因序列中局部at含量过高而导致的转录提前终止的可能性,并且所有氨基酸的密码子均为大肠杆菌系统中有利于高水平表达的高频密码子,提高了st2抗原原核表达量。
附图说明
图1为pet-28a(+)载体的结构图;
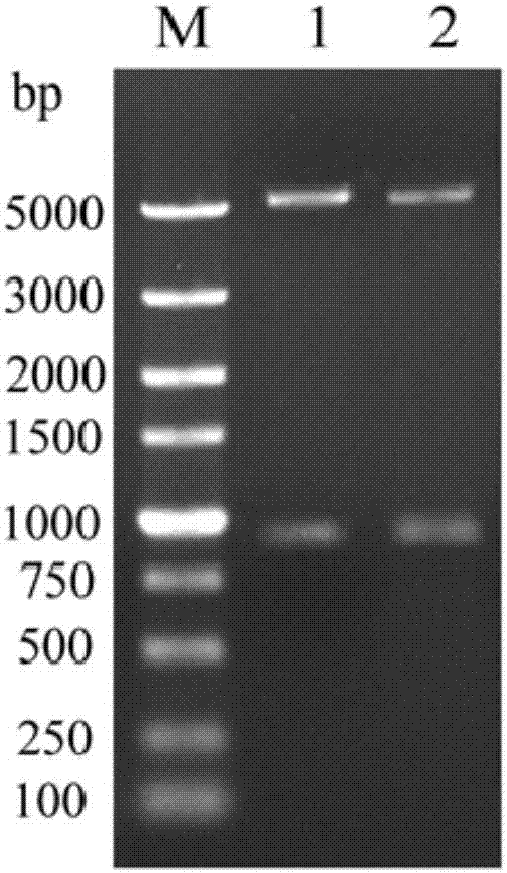
图2为阳性克隆鉴定结果的核酸电泳图;
图3为包涵体沉淀的sds-page电泳图;
图4为纯化产物的sds-page电泳图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
为了使本发明的目的、技术方案及优点更加清楚明白,下面结合附图和具体实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
实施例1、st2编码基因的优化
st2天然序列存在不利于蛋白表达的几点缺陷:1、gc含量为41%,at含量偏离50%较多,有较多的at丰富区域,在所需要表达蛋白的编码区内出现潜在的转录起始、提前终止(转录起始和提前终止会导致mrna长度变短或出现不需要的rna片段,不利于目标蛋白的完整表达)的可能性非常大。2、局部gc含量偏高(>70%),易于形成局部发卡结构,不利于复制、转录、翻译等遗传信息传递过程的顺利进行。3、个别氨基酸的密码子属于大肠杆菌表达系统的低频密码子,比如r(aga、agg)、p(ccc)、i(ata)、l(cta)、g(gga、ggg)等,不利于蛋白的高效表达。因此,对天然st2核苷酸序列进行了全面优化,以实现st2基因在大肠杆菌系统中的高效表达。
根据ncbi公布st2蛋白的氨基酸序列(序列2),优化出dna序列(序列1)。
在优化后的dna序列5’端添加限制性内切酶nhei识别序列,3’端添加限制性内切酶xhoi识别序列,得到优化后的st2编码基因。
人工合成优化后st2编码基因的核苷酸序列序列1,该优化后st2编码基因编码st2蛋白。
优化前st2编码基因的核苷酸序列为序列3,人工合成。
实施例2、st2抗原的制备
1、表达载体的构建
将实施例1中人工合成优化后st2编码基因序列1用xhoi和nhei双酶切后替换原核表达载体pet-28a(+)(merckmillipore公司,目录号是69864,图1)的xhoi/nhei之间的片段,得到pet-28a(+)-st2(优化后)。
将实施例1中人工合成优化前st2编码基因将实施例3中人工合成优化后st2编码基因用xhoi和nhei双酶切后替换原核表达载体pet-28a(+)的xhoi/nhei之间的片段,得到pet-28a(+)-st2(优化前)。
对重组质粒pet-28a(+)-st2(优化后)或重组质粒pet-28a(+)-st2(优化前)分别进行xhoi和nhei双酶切鉴定,结果如图2所示,m:dl5000marker;1:优化前重组质粒双酶切;2:优化后重组质粒双酶切,可以看出,重组质粒经xhoi和nhei双酶切后,电泳均可见到两条与预期分子量大小一致条带,与pet-28a(+)和优化后st2编码基因(或优化前st2编码基因)的大小相符。
2、重组菌的构建
1)从-80℃低温冰箱中取出大肠杆菌感受态细胞bl-21,迅速冰浴化开;
2)分别取10μl上述重组载体pet-28a(+)-st2(优化后)和重组质粒pet-28a(+)-st2(优化前)加入100μl感受态细胞内,轻轻混匀,冰浴30分钟;
3)于42℃下热激90秒;
4)迅速冰浴5分钟;
5)加入1mllb培养基,混匀,160rpm,37℃下复苏培养1h;
6)取100μl震荡培养物涂布于含卡那霉素的lb平板上,于37℃培养16小时,挑选单克隆菌落,小样摇起来6h左右至对数期,iptg诱导过夜后sds-page电泳,选取表达目的蛋白量高的菌种进行测序,测序结果正确,此即为成功转化的宿主细胞,命名为bl21/pet-28a(+)-st2(优化前)和bl21/pet-28a(+)-st2(优化后)。
4、诱导表达纯化st2抗原
1)将所得阳性克隆bl21/pet-28a(+)-st2(优化前)和bl21/pet-28a(+)-st2(优化后)分别接种于含有卡那青霉素的lb培养基中,于37℃,150rpm下培养8~12小时,得到第一菌液;将第一菌液接种于lb培养基中,于37℃,150rpm下培养至od600达到0.6,得到第二菌液;于第二菌液中添加终浓度为0.2mmol/l的iptg,于37℃,150rpm下培养16小时,得到第三菌液;
2)将所得第三菌液中的细胞进行破碎,离心后弃上清液,收集包涵体沉淀;
将包涵体沉淀sds-page电泳检,结果如图3所示,m:marker;1:优化前包涵体;2:优化后包涵体,可以看出,bl21/pet-28a(+)-st2(优化前)和bl21/pet-28a(+)-st2(优化后)沉淀中均含有约35kd的目标蛋白st2抗原。
3)将上述包涵体沉淀用6m脲(用25mmph8.5tris-hcl缓冲液配制)溶解,过滤去沉淀取上清液;
4)用镍树脂对所得上清液进行过博格隆10mlni柱进行纯化,平衡液为25mmph8.5tris-hcl6m脲,分别收集穿过峰,30mm咪唑洗脱液(配方25mmph8.5tris-hcl6m脲)进洗脱峰,60mm咪唑洗脱液进洗脱峰,120mm咪唑洗脱液进洗脱峰,240mm咪唑洗脱液进洗脱峰,300mm咪唑洗脱液进洗脱峰。300mm咪唑洗脱峰含有目的蛋白,25mmph8.5tris-hcl透析后分装保存(收集原则为紫外检测仪数值上升开始收集,数值出现下降趋势停止收集)。
分别取20μl300mm咪唑洗脱液进行sds-page电泳检测,结果如图4所示,m:marker;1:优化前表达蛋白;2:优化后表达蛋白,bl21/pet-28a(+)-st2(优化前)和bl21/pet-28a(+)-st2(优化后)的纯化效果均较好,300mmol/l的咪唑洗脱液得到产物为约35kd大小的目的蛋白,即为st2抗原(dna优化前)和st2抗原(dna优化后)。
5、比较dna分子优化前后制备的st2抗原的差异
1)蛋白浓度
采用紫外分光光度法检测蛋白浓度,检测st2抗原在280nm处的od值,结合st2蛋白的消光系数计算st2的浓度。测定200mllb培养基中st2蛋白表达量,其中st2抗原(dna优化后)的蛋白浓度为2.1mg/ml,体积为8.2ml,总计17.22mg;st2抗原(dna优化前)的蛋白浓度约为1.5mg/ml,体积为7.1ml,总计10.65mg。可以看出,dna优化后st2抗原的蛋白表达量远远高于dna优化前st2抗原的蛋白表达量。
2)天然st2基因序列中局部gc含量过高而出现发卡结构的问题
st2天然序列中ggtacagggcgcac、gtgtgacggcgaccaggtcc、ggctgccgtcctgtggcagc等局部序列的gc含量高于70%,高于50%的gc含量的序列,在dna复制时双链打开需要更高的能量,所以高gc含量会导致复制效率底下。而经过修饰后的序列分别为gctatcgtgctcac、gcgtaactgcaactcgttcc、cactgacttcggtgaaccac,降低了局部gc含量,减少发卡结构的出现概率。
3)降低了因天然st2基因序列中局部at含量过高而导致的转录提前终止的可能性
由图3可知,优化前的dna序列表达中除了目标蛋白外,还存在比目标蛋白要小的一种蛋白,而优化后的dna序列中这种非目标蛋白表达量就很低,甚至没有,同时天然st2基因序列中局部at含量过高而导致目标蛋白表达量要低于优化后的dna序列蛋白表达量,因此通过优化st2基因序列中局部at含量过高可以减少转录提前终止的可能性。
以上所述本发明的具体实施方式,并不构成对本发明保护范围的限定。任何根据本发明的技术构思所做出的各种其他相应的改变与变形,均应包含在本发明权利要求的保护范围内。
序列表
<110>北京市华信行生物科技有限公司
<120>表达st2重组载体的构建及st2抗原的制备方法
<160>3
<170>patentinversion3.3
<210>1
<211>975
<212>dna
<213>人工序列
<220>
<223>
<400>1
gctagcggtggtggcggtatgtattccacagcagcaaagtttagtaaacaatcatggggc60
ctggaaaatgaggctttaattgtaagatgtcctagacaaggaaaacctagttacaccgtg120
gattggtattactcacaaacaaacaaaagtattcccactcaggaaagaaatcgtgtgttt180
gcctcaggccaacttctgaagtttctaccagctgaagttgctgattctggtatttatacc240
tgtattgtcagaagtcccacattcaataggactggatatgcgaatgtcaccatatataaa300
aaacaatcagattgcaatgttccagattatttgatgtattcaacagtatctggatcagaa360
aaaaattccaaaatttattgtcctaccattgacctctacaactggacagcacctcttgag420
tggtttaagaattgtcaggctcttcaaggatcaaggtacagggcgcacaagtcatttttg480
gtcattgataatgtgatgactgaggacgcaggtgattacacctgtaaatttatacacaat540
gaaaatggagccaattatagtgtgacggcgaccaggtccttcacggtcaaggatgagcaa600
ggcttttctctgtttccagtaatcggagcccctgcacaaaatgaaataaaggaagtggaa660
attggaaaaaacgcaaacctaacttgctctgcttgttttggaaaaggcactcagttcttg720
gctgccgtcctgtggcagcttaatggaacaaaaattacagactttggtgaaccaagaatt780
caacaagaggaagggcaaaatcaaagtttcagcaatgggctggcttgtctagacatggtt840
ttaagaatagctgacgtgaaggaagaggatttattgctgcagtacgactgtctggccctg900
aatttgcatggcttgagaaggcacaccgtaagactaagtaggaaaaatccaagtaaggag960
tgtttctgactcgag975
<210>2
<211>322
<212>prt
<213>人工序列
<220>
<223>
<400>2
alaserglyglyglyglymettyrserthralaalalyspheserlys
151015
glnsertrpglyleugluasnglualaleuilevalargcysproarg
202530
glnglylysprosertyrthrvalasptrptyrtyrserglnthrasn
354045
lysserileprothrglngluargasnargvalphealaserglygln
505560
leuleulyspheleuproalagluvalalaaspserglyiletyrthr
65707580
cysilevalargserprothrpheasnargthrglytyralaasnval
859095
thriletyrlyslysglnseraspcysasnvalproasptyrleumet
100105110
tyrserthrvalserglyserglulysasnserlysiletyrcyspro
115120125
thrileaspleutyrasntrpthralaproleuglutrpphelysasn
130135140
cysglnalaleuglnglyserargtyrargalahislysserpheleu
145150155160
valileaspasnvalmetthrgluaspalaglyasptyrthrcyslys
165170175
pheilehisasngluasnglyalaasntyrservalthralathrarg
180185190
serphethrvallysaspgluglnglypheserleupheprovalile
195200205
glyalaproalaglnasngluilelysgluvalgluileglylysasn
210215220
alaasnleuthrcysseralacyspheglylysglythrglnpheleu
225230235240
alaalavalleutrpglnleuasnglythrlysilethraspphegly
245250255
gluproargileglnglnglugluglyglnasnglnserpheserasn
260265270
glyleualacysleuaspmetvalleuargilealaaspvallysglu
275280285
gluaspleuleuleuglntyraspcysleualaleuasnleuhisgly
290295300
leuargarghisthrvalargleuserarglysasnproserlysglu
305310315320
cysphe
<210>3
<211>975
<212>dna
<213>人工序列
<220>
<223>
<400>3
gctagcggtggtggcggtatgtacagcactgcagctaagttcagcaaacagtcttggggt60
ctggagaacgaagctctgatcgtacgttgtccacgtcagggcaaacctagctacactgtg120
gattggtactacagccagactaacaagtccattccgactcaagaacgcaatcgtgtgttc180
gcatccggtcaactgctgaagtttctgccagctgaagttgcagactctggtatctacacc240
tgtatcgtacgttctccgactttcaatcgcactggttacgccaatgtcaccatctacaag300
aaacagtccgattgcaacgtaccggactacctgatgtatagcaccgtatccggtagcgag360
aagaactccaagatctactgtccgactatcgatctgtacaactggactgcaccactggaa420
tggttcaagaactgccaagctctgcagggttctcgctatcgtgctcacaagtcctttctg480
gtcatcgacaatgtgatgactgaagacgcaggtgattacacctgcaagttcatccacaac540
gagaacggtgctaactacagcgtaactgcaactcgttccttcactgtcaaagatgagcaa600
ggctttagcctgttcccagtaatcggtgcacctgcacagaatgagatcaaagaagtcgag660
atcggcaagaacgctaacctgacttgctctgcatgcttcggtaaaggcactcagttcctg720
gctgcagtactgtggcaactgaacggtaccaagatcactgacttcggtgaaccacgcatt780
cagcaagaagagggtcagaaccaatccttcagcaatggtctggcatgtctggacatggta840
ctgcgtatcgctgatgtcaaagaagaagatctgcttctgcagtacgactgtctggcactg900
aatctgcatggtctgcgtcgtcataccgtacgtctgtctcgcaagaatccgagcaaagag960
tgcttctaactcgag975
- 还没有人留言评论。精彩留言会获得点赞!