提高果胶酶活性的方法与流程
本发明涉及生物酶改性加工处理技术领域,尤其涉及一种提高果胶酶活性的方法。
背景技术:
果胶酶是一类分解果胶质的酶的总称,是含有多种组分的复合酶。果胶酶广泛分布于高等植物和微生物中,在某些原生动物和昆虫中也存在。在微生物中,细菌、放线菌、酵母和霉菌都能代谢合成果胶酶。果胶酶一般分为原果胶酶、果胶水解酶、果胶裂解酶和果胶脂酶。目前果胶酶在食品、纺织、医药、造纸、环境、生物技术、饲料等领域得到广泛应用。例如,对于高污染、高能耗的纺织工业,随着近年来环境污染和能源危机等问题日益加剧,“清洁生产,绿色纺织”便成为人们关注的话题。果胶酶应用于纺织品前处理的精练、漂白、纤维精细化处理以及脱胶等多个工序,取代传统的化学处理工艺,不但能够降低能耗和废水处理难度,同时还可以提高产品质量,提升产品的国际竞争力,成为目前纺织生物技术领域的一个研究热点。
果胶酶在多个行业应用效果良好,未来有望进一步扩大其应用范围。但由于其价格昂贵,因此应用受限。为此需要在以下几个方面对果胶酶进行改进:(l)继续加强优良果胶酶菌种的筛选,进一步降低使用价格;(2)优化果胶酶作用的工艺条件,减少使用量;(3)加强果胶酶作用机理的研究;(4)利用新技术,使果胶酶保持良好的活性和稳定性。
低温等离子体是继固态、液态、气态之后的物质第四态,当外加电压达到气体的着火电压时,气体分子被击穿,产生包括电子、离子、原子和自由基等混合体。低温等离子体属于激发、电离的高能状态,其电子的负电荷和离子的正电荷总数相等,宏观上对外不显电性,呈中性。低温等离子体放电过程虽然电子温度很高,但重粒子温度很低,整个体系呈现低温状态,所以称为低温等离子体,也叫非平衡状态等离子体。
技术实现要素:
为解决上述技术问题,本发明的目的是提供一种提高果胶酶活性的方法,本发明提供的方法可以有效地提高果胶酶的活性,改善处理效果,且处理效率高,处理过程中不使用化学药品,绿色环保,节能减排,具有非常广阔的市场前景。
本发明的一种提高果胶酶活性的方法,包括以下步骤:
(1)在低温等离子体处理装置的处理腔室中设置一上下通透的水平支架台,支架台上设有呈薄型平面状的多孔材料,将果胶酶放在多孔材料上;
(2)对处理腔室进行排空,通入工作气体,并放电处理2-8min,其中气体压强为20-90pa,放电功率为50-300w。
进一步地,在步骤(1)中,多孔材料为多孔网状物或多孔薄膜。
进一步地,在步骤(1)中,多孔材料的材质为高分子纤维或金属纤维。高分子纤维为有机高分子纤维或无机高分子纤维。
进一步地,在步骤(1)中,果胶酶为固态果胶酶。
进一步地,在步骤(1)中,将果胶酶薄薄地、均匀地铺放在多孔材料上。
进一步地,在步骤(1)中,在步骤(2)中,放电形式为辉光放电。
进一步地,在步骤(2)中,使用工作气体先洗气2-3次。洗气结束后,开启进气阀,待气流稳定后,打开放电装置。
进一步地,在步骤(2)中,工作气体为氧气、氮气和氩气中的一种或几种。
进一步地,在步骤(2)中,工作气体为氧气时,气体压强为35-95pa,放电功率为50-250w,放电处理时间为2-8min。
进一步地,在步骤(2)中,工作气体为氮气时,气体压强为20-95pa,放电功率为50-250w,放电处理时间为2-6min。
进一步地,在步骤(2)中,工作气体为氩气时,气体压强为80-95pa,放电功率为50-100w,放电处理时间为4-6min。
进一步地,在步骤(2)之后,还包括以下步骤:
收集步骤(2)处理后的果胶酶,将其在2-8℃下密封保存。
本发明采用不同实验气氛、气体压强、处理时间和放电功率等条件,对果胶酶进行低温等离子体干态处理,采用低温等离子体中系列高能离子、电子等活性物质与果胶酶作用,可实现对果胶酶的大分子及其链上官能团进行修饰,甚至可起空间构象等发生改变,从可导致其活性和稳定性发生明显改善,有利于进一步开发果胶酶在纺织等领域的应用潜力。
借由上述方案,本发明至少具有以下优点:
1、本发明提供了一种提高果胶酶活性及稳定性的低温等离子体处理方法,通过对比低温等离子体的处理前后果胶酶酶活性,发现低温等离子体处理后果胶酶活性及稳定性明显提高;
2、本发明方法是对常规生物酶的改性加工处理,等离子体处理周期短、操作简单、方便快捷,处理成本低;
3、本发明方法属于干态处理,没用使用化学药品,对环境无污染,有效地避免了传统化学脱胶所带来的化学药品用量大,能耗水耗高,环境污染严重等问题。
附图说明
图1是本发明果胶酶活性测试的标准曲线;
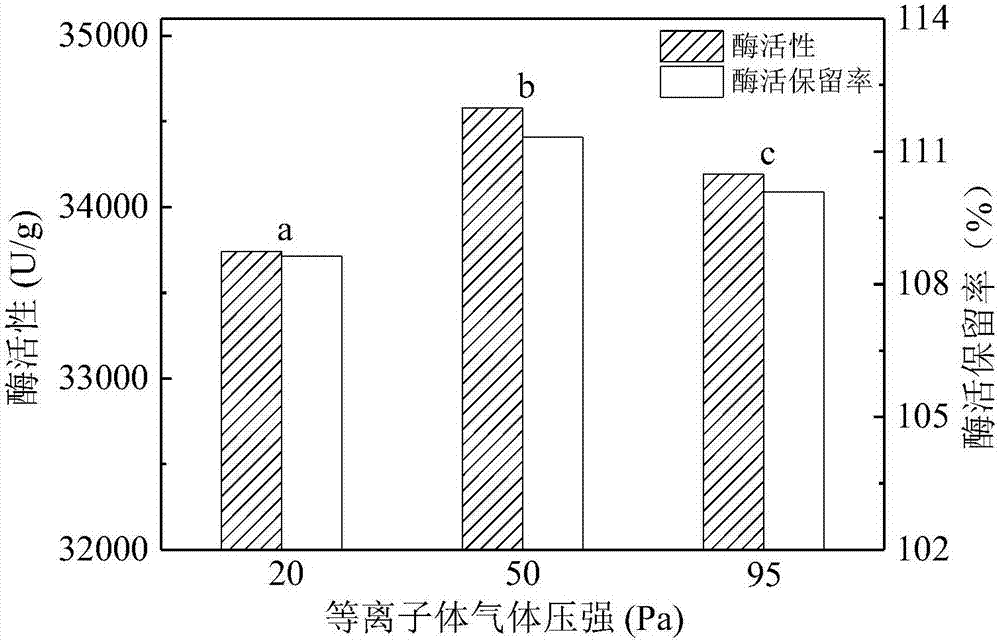
图2是本发明实施例1、2、3中果胶酶处理结果图;
图3是本发明实施例4、5、6中果胶酶处理结果图;
图4是本发明实施例7、8、9中果胶酶处理结果图。
具体实施方式
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
本发明使用的试剂及其配制方法如下:
dns试剂:称取3,5-二硝基水杨酸3.15g溶于500ml水,搅拌5s后置于45℃的水浴中。然后逐步加入100ml0.2g/ml的氢氧化钠溶液,同时不断搅拌,保证温度不高于48℃,直到溶液清澈透明。再逐步加入四水酒石酸钾钠91.0g、苯酚2.50g和无水亚硫酸钠2.50g。继续45℃水浴加热,同时补加水300ml,不断搅拌,直到加入的物质完全溶解。停止加热,冷却至室温后,加水定容1000ml。用烧结玻璃过滤器过滤。取滤液,储存在棕色瓶中,避光保存。室温下存放7天后可以使用,有效期为6个月。
缓冲液(ph=4.2,0.1mol/l):称取柠檬酸12.315g,磷酸氢二钠29.655g,缓慢加水1000ml,搅拌使溶解,用磷酸氢二钠调节ph值至4.2备用。
d-半乳糖醛酸溶液(1mg/ml):称取80℃下干燥直至恒重的d-半乳糖醛酸0.10000g,精确至0.0001g,用ph=4.2的柠檬酸-磷酸氢二钠缓冲液溶解,定容至100ml。
果胶溶液(1mg/ml):称取果胶5.00000g,精确至0.0001g,用ph=4.2的柠檬酸-磷酸氢二钠缓冲液溶解,定容至500ml。
图1是本发明果胶酶活性测试的标准曲线,其制作方法如下:
取7支25ml具塞比色管依次编号,按表1分别加入相应的1mg/mld-半乳糖醛酸和缓冲液,混合均匀,配得的d-半乳糖醛酸溶液浓度依次为0、0.4、0.5、0.6、0.7、0.8、0.9、1.0mg/ml。分别加入去离子水2ml和dns试剂3ml,混合均匀,放入沸水浴中反应5min,取出后立即用冷水冷却,加去离子水定容25ml,摇匀。以1号试管为空白,校基线,用lcm的比色皿于200-800nm范围内连续测定6号试管,确定最大吸收波长λmax为488nm。再以1号试管为空白,依次测定其他试管在488nm处的吸光度值,并记录测得的各样品吸光度值。以d-半乳糖醛酸含量c纵坐标,对应的吸光度值a为横坐标,建立标准曲线。表1为标准曲线的各样液配制过程中使用的各物质的体积。
表1标准曲线的各样液配制
实施例1
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氮气对反应腔体进行洗气或气体置换2-3次。本实施选用氮气作为工作气体,工作条件为:气体压强20pa,放电功率200w,处理时间4min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用以下方法进行酶活性和酶活性保留率测试:
果胶酶溶液(0.5mg/ml):称取上述方法处理后的果胶酶0.02500g,精确到0.0001g,用ph=4.2的柠檬酸-磷酸氢二钠缓冲液溶解,定容至50ml。
在具塞比色管中加入10mg/ml果胶溶液4ml、柠檬酸-磷酸氢二钠缓冲液5ml,摇匀,放入50℃恒温水浴锅中平衡10min,再加入同样在50℃水浴锅中平衡过的0.5mg/ml果胶酶溶液1ml,摇匀,同时秒表立刻开始计时。精确反应30min后取出比色管,立刻放入沸水中沸煮6min以终止酶解反应,取出后用冷水冷却至室温。取1ml酶解反应液加入装有2ml去离子水、2mldns试剂的试管,摇匀,放入沸水中沸煮5min,进行显色反应。取出后用冷水冷却至室温,加去离子水定容25ml,摇匀。空白样的制备与上述相同,只是用于酶解反应的果胶酶溶液预先在沸水中煮沸6min灭活。1ml缓冲液、2ml去离子水与2mldns混匀,沸煮5min定容25ml后的溶液为基线,测定488nm处实验样和空白样的吸光度值。酶活性计算如下:
酶活性定义:在50℃、ph为4.2条件下,1g果胶酶1h水解果胶生成1mgd-半乳糖醛酸为1个果胶酶活力单位,以u/g表示。计算公式如下:
式中,x表示样品中的果胶酶活性,u/g;ae为试验样中酶水解反应液的吸光度;ab为对应空白样的吸光度;k和b分别是标准曲线的斜率和截距;t是酶水解反应时间,单位h;m反应中加入的果胶酶质量,单位g。
经低温等离子体处理后,果胶酶催化活性保留率r可依据如下公式计算得到:
式中,r为酶活性保留率,x0和x1分别指低温等离子体处理前后果胶酶的活性,单位u/g。
采用上述方法测得低温等离子体处理前果胶酶活性为31061.31u/g,而本实施例处理过的果胶酶活性为33741.93u/g,酶活性保留率为108.63%。结果如图2中a所示。可以看出在实施例1处理条件下酶活性保留率大于100%,说明果胶酶的酶活性优于处理前酶活性,酶活性得到了提高。
实施例2
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氧气对反应腔体进行洗气或气体置换2-3次。本实施选用氧气作为工作气体,工作条件为:气体压强50pa,放电功率200w,处理时间4min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用实施例1中的方法测试处理前后的酶活性及酶活性保留率测试,结果如图2中b所示。结果表明,低温等离子体处理后本实施例果胶酶活性为34578.28u/g,酶活性保留率为111.32%。可以看出,在本实施例的处理条件下果胶酶的酶活性和酶活性保留率都得到了显著提高。
实施例3
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氮气对反应腔体进行洗气或气体置换2-3次。本实施选用氮气作为工作气体,工作条件为:气体压强95pa,放电功率200w,处理时间4min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用实施例1中的方法测试处理前后的酶活性及酶活性保留率测试,结果如图2中c所示。结果表明,低温等离子体处理后本实施例果胶酶活性为334192.28u/g,酶活性保留率为110.08%。可以看出在本实施例的处理条件下果胶酶的酶活性和酶活性保留率都得到了提高。
实施例4
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氩气对反应腔体进行洗气或气体置换2-3次。本实施选用氩气作为工作气体,工作条件为:气体压强80pa,放电功率50w,处理时间4min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用实施例1中的方法测试处理前后的酶活性及酶活性保留率测试,结果如图3中a所示。结果表明,低温等离子体处理后本实施例果胶酶活性为31833.33u/g,酶活性保留率为102.49%。可以看出,在本实施例的处理条件下果胶酶的酶活性和酶活性保留率都得到提高。
实施例5
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氧气对反应腔体进行洗气或气体置换2-3次。本实施选用氧气作为工作气体,工作条件为:气体压强65pa,放电功率200w,处理时间4min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用实施例1中的方法测试处理前后的酶活性及酶活性保留率测试,结果如图3中b所示。结果表明,低温等离子体处理后本实施例果胶酶活性为34792.73u/g,酶活性保留率为112.01%。
实施例6
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氮气对反应腔体进行洗气或气体置换2-3次。本实施选用氮气作为工作气体,工作条件为:气体压强90pa,放电功率300w,处理时间4min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用实施例1中的方法测试处理前后的酶活性及酶活性保留率测试,结果如图3中c所示。结果表明,低温等离子体处理后本实施例果胶酶活性为31575.99u/g,酶活性保留率为101.66%。
实施例7
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氧气对反应腔体进行洗气或气体置换2-3次。本实施选用氧气作为工作气体,工作条件为:气体压强65pa,放电功率200w,处理时间2min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用实施例1中的方法测试处理前后的酶活性及酶活性保留率测试,结果如图4中a所示。结果表明,低温等离子体处理后本实施例果胶酶活性为334535.39u/g,酶活性保留率为111.18%。
实施例8
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氩气对反应腔体进行洗气或气体置换2-3次。本实施选用氩气作为工作气体,工作条件为:气体压强80pa,放电功率50w,处理时间6min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用实施例1中的方法测试处理前后的酶活性及酶活性保留率测试,结果如图4中b所示。结果表明,低温等离子体处理后本实施例果胶酶活性为31404.43u/g,酶活性保留率为101.10%。可以看出在本实施例处理条件下果胶酶的酶活性和酶活性保留率都得到了提高。
实施例9
称取果胶酶0.200g,在低温等离子腔体中设置一上下通透的水平支架台,在该支架台上设置一展开的薄型平面多孔网状物,再将果胶酶薄薄地、均匀地进行分散布置,然后关闭低温等离子体处理装置的腔体门。
采用系统配置的真空泵对上述腔体进行排空,并采用氧气对反应腔体进行洗气或气体置换2-3次。本实施选用氧气作为工作气体,工作条件为:气体压强65pa,放电功率200w,处理时间8min。洗气过程结束后,开启进气阀,待处理气氛压强和气流稳定后,开启放电开关进行辉光放电,开启放电功率的同时开始倒计时。处理完成后,关闭放电开关、真空阀,然后关闭进气阀,待反应腔体气压恢复到大气压后,开启腔体门,并收集处理后的果胶酶,在2-8℃下密封保存。
采用实施例1中的方法测试处理前后的酶活性及酶活性保留率测试,结果如图4中c所示。结果表明,低温等离子体处理后本实施例果胶酶活性为32176.45u/g,酶活性保留率为103.59%。
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!