一种酿酒酵母及其用途的制作方法
本发明涉及生物工程领域,特别涉及一种酿酒酵母及其用途。
背景技术:
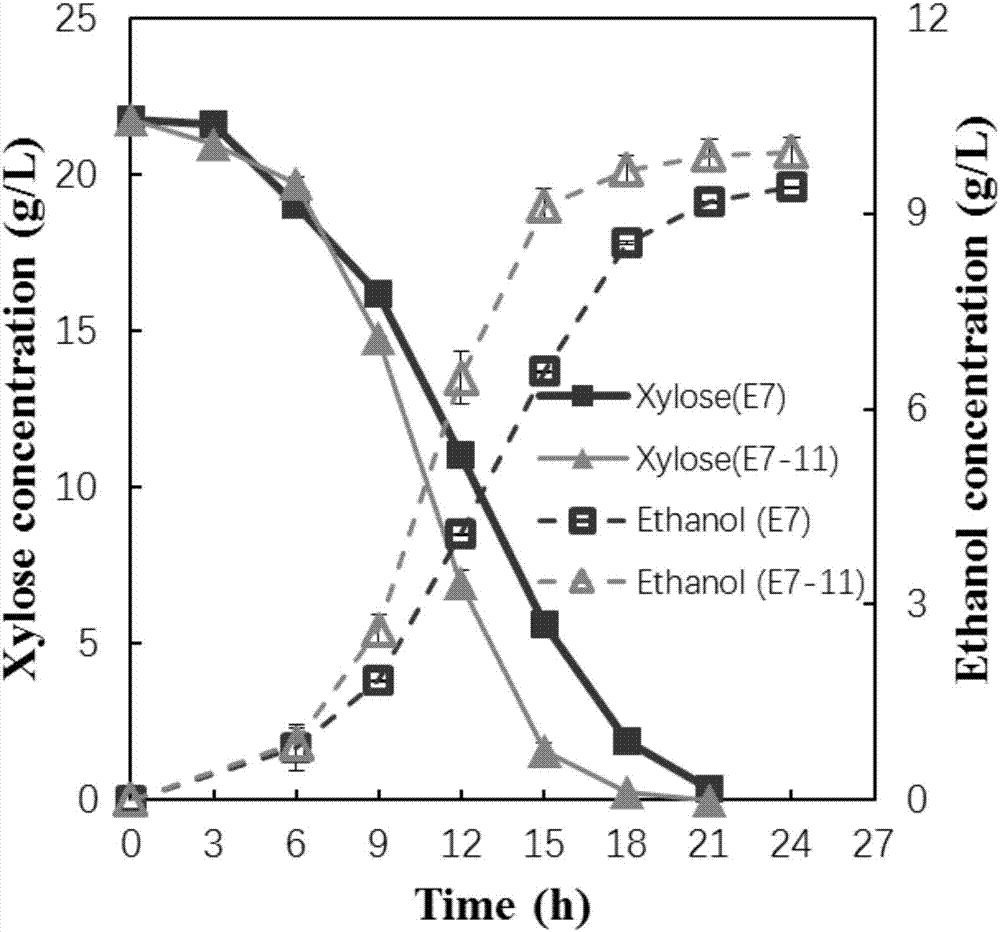
:在纤维素乙醇生产工艺中,酸法预处理由于其成本低廉和可操作性强,受到多数机构的青睐,被认为是最容易实现工业化的预处理方法,如稀酸预处理和蒸汽爆破预处理。然而,由于这些化学预处理的条件一般都是高温高压,所以会导致一些抑制性物质的产生,如呋喃类、弱酸类、酚类等。这些抑制性物质对后续发酵微生物有非常强烈的抑制作用,严重影响纤维素水解液的乙醇发酵产率和速率。在纤维素乙醇生产工艺中,稀酸预处理法被认为是最有潜力的纤维素预处理方法,但由于抑制剂的产生及其对微生物的毒害作用而使该方法的广泛应用受到限制。已有实验证明这些抑制剂抑制多种发酵微生物,包括大肠杆菌、运动发酵单胞菌、树干毕赤酵母和酿酒酵母等,其中,酿酒酵母是其中耐受能力最强的菌种之一。另外,酿酒酵母是在乙醇发酵中应用最广泛的菌株,酿酒酵母的优势包括:(1)葡萄糖的转化速率快,(2)产物专一性高,(3)对工业生产环境具有稳健性等。能够耐受纤维素水解液中的抑制剂的菌株的筛选和构建是纤维素乙醇生产研究中的一个重要问题。早期有研究表明,这些抑制剂主要抑制微生物的生长,而对发酵能力的影响比对生长的影响小的多。人们希望获得能耐受多种抑制剂的酿酒酵母菌株来实现纤维素乙醇生产中的原位脱毒和高效发酵,因为脱毒步骤会明显增加纤维素乙醇的生产成本,降低纤维素乙醇的市场竞争力。因此,提供一种能够在含有多种纤维素乙醇生产中产生的抑制剂的培养基中正常生长并具有很好的生长优势、实现乙醇高效生产的菌株具有重要的现实意义。技术实现要素:有鉴于此,本发明提供一种酿酒酵母及其用途。该菌株在含有多种纤维素乙醇生产中产生的抑制剂的培养基中正常生长,并能够在纤维素水解液中表现出很好的生长优势,并实现高效的乙醇生产。本发明提供的菌株突破了限制稀酸预处理法生产纤维素乙醇的一个瓶颈问题。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种酿酒酵母,其保藏编号为:CGMCCNo.13906。本发明还提供了所述酿酒酵母作为木糖利用菌株的用途。本发明还提供了所述酿酒酵母作为高温耐受菌株的用途;所述高温不低于30℃。在本发明的一些具体实施方案中,所述高温为30~38℃。本发明还提供了所述酿酒酵母作为乙醇发酵中抑制剂的耐受菌株的用途。在本发明的一些具体实施方案中,所述抑制剂选自糠醛、苯酚或乙酸。在本发明的一些具体实施方案中,所述抑制剂中糠醛的含量为1~1.5g/L,苯酚的含量为0.3~0.7g/L,乙酸的含量为5~6g/L。在本发明的一些具体实施方案中,所述抑制剂中糠醛的含量为1.3g/L,苯酚的含量为0.5g/L,乙酸的含量为5.3g/L。本发明还提供了所述酿酒酵母在生产纤维素乙醇中的应用。本发明还提供了所述酿酒酵母在生产乙醇中的应用。本发明还提供了一种发酵生产乙醇的方法,取所述酿酒酵母接种于发酵原料中发酵制得乙醇。在本发明的一些具体实施方案中,所述酿酒酵母的种子培养基或发酵培养基包括:蛋白胨,15~25g/L;酵母粉,5~15g/L;木糖,15~25g/L;更具体的包括:蛋白胨,20g/L;酵母粉,10g/L;木糖,20g/L;121℃20min高温高压湿热灭菌;木糖单独灭制后添加。所述酿酒酵母的扩大培养的条件为:于25~35℃、200~250rpm培养20~30h;,更具体的为于30℃、220rpm培养24h;所述酿酒酵母的发酵生产的条件为:于25~35℃、100~200rpm条件下培养70~80h,更具体的为于30℃、150rpm条件下培养72h。本发明提供了一种酿酒酵母,其保藏编号为:CGMCCNo.13906。实验结果表明:本发明提供的菌株在经过72h后开始进入稳定期,OD600是7.04,且糖耗剩余量不足1g/l。而原始菌株仍处于对数期,OD600是3.94,(且木糖剩余量为7.18g/l。由此可知,E7菌株在含有抑制剂的条件下,表现出明显的生长优势,与原始菌株相比,本发明提供的菌株能够适应含有抑制剂的环境,且展现出良好的木糖利用优势。在30%FAP下原始菌株的抑制率是55.13%,本发明提供的菌株的抑制率是12.74%;在50%FAP下原始菌株抑制率是68.58%,本发明提供的菌株抑制率是28.43%;在70%抑制率下原始菌株的抑制率86.55%,本发明提供的菌株抑制率是35.29%;在100%抑制率下原始菌株的抑制率是89.47%,本发明提供的菌株的抑制率是45.78%。与原始菌株相比,本发明提供的菌株能够适应含有抑制剂的环境。在34℃下原始菌株的抑制率是10.74%,本发明提供的菌株的抑制率是8.23%;在36℃下原始菌株抑制率是73.24%,本发明提供的菌株抑制率是18.47%;在38℃抑制率下原始菌株的抑制率82.85%,本发明提供的菌株抑制率是53.42%。在同步糖化共发酵过程中,本发明提供的菌株在发酵后期仍然能够保持好的发酵活性,葡萄糖仍然维持在一个低的水平,但是原始菌株E7逐渐积累到45.8g/l。且本发明提供的菌株E7-11最终乙醇的浓度达到69.7g/l。而原始菌株E7是44.4g/l。在24h菌株活性,本发明提供的菌株E7-11的菌株活性是原始菌株E7的179倍。综上所述,本发明提供的菌株能够适应含有抑制剂的环境、高温环境,在含有多种纤维素乙醇生产中产生的抑制剂的培养基中正常生长,并能够在纤维素水解液中表现出很好的生长优势,并实现高效的乙醇生产。与原始菌株相比,本发明提供的菌株极显著(P<0.01)提高了生长优势和木糖利用率,显著(P<0.01)提高了乙醇的产量。生物保藏说明生物材料SyBE-SC02100031,分类命名:酿酒酵母,Saccharomycescerevisiae,于2017年3月21日保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为CGMCCNo.13906。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示验证构建出的菌株为二倍体菌株;图2示在摇瓶上SyBE-SC02100031(E7-11)菌株与原始S(E7)菌株在YPX混合抑制剂下的生长曲线;图3示SyBE-SC02100031(E7-11)菌株与原始S(E7)菌株在YPX培养不同温度下抑制率;图4示SyBE-SC02100031(E7-11)菌株与原始S(E7)菌株在含不同浓度混合抑制剂的YPX平板上抑制率;图5示SyBE-SC02100031(E7-11)菌株与原始S(E7)菌株在不同高温条件发酵条件下,在YPX平板上的抑制率;图6示SyBE-SC02100031(E7-11)菌株与原始S(E7)菌株在同步糖化共发酵25%高固含量下,30℃糖耗曲线;图7示SyBE-SC02100031(E7-11)菌株与原始S(E7)菌株在同步糖化共发酵25%高固含量下,30℃乙醇产量和菌株活性图。具体实施方式本发明公开了一种酿酒酵母及其用途,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。一种酿酒酵母的耐受多种抑制剂的菌株,其命名为酿酒酵母(Saccharomycescerevisiae)SyBE-SC02100031。本发明的一株酿酒酵母的耐受多种抑制剂和高温的新菌株SyBE-SC02100031,是菌株是在对工业酿酒酵母双倍体(Saccharomycescerevisiae)进行拆孢分离得到MATa10#,经紫外线诱变后得到耐受抑制剂提升的菌株11#。再将其与木糖利用菌株E7进行杂交构建出二倍体木糖利用菌株。紫外线诱变策略是:将10#菌株的培养液(YEPD培养基:葡萄糖20g/L,酵母粉10g/L,蛋白胨20g/L)进行稀释后铺于含抑制剂的筛选培养基(添加抑制剂的YEPD培养基),将铺好的平板距离15W紫外灯下56cm处照射7min,放于30℃培养箱中避光培养2天。菌株杂交的条件是:将筛选出的11#菌落接到5mlYPD液体培养基,培养条件是30℃,220rpm,8h。木糖利用菌株E75mlYPX液体培养基,培养条件是30℃,220rpm,8h。然后将SyBE-SC02100031和E7以OD为0.5:0.5转接到新鲜的YPD液体培养基中,30℃,220rpm,6h。然后将100ul涂布在YNBX固体平板上(6.7g/L酵母氮源,20g/L木糖),挑取形态大的菌落进行酵母菌落PCR验证其为二倍体和单倍体,验证结果如图1所示。E7-11为二倍体菌株。该菌株在含有多种纤维素乙醇生产中产生的抑制剂的培养基中正常生长能够在纤维素水解液中表现出很好的生长优势。所述抑制剂为糠醛、苯酚和乙酸。所述抑制剂糠醛的含量为1.3g/L,苯酚的含量为0.5g/L,乙酸的含量为5.3g/L。在纤维素乙醇生产工艺中,稀酸预处理法被认为是最有潜力的纤维素预处理方法,但由于抑制剂的产生及其对微生物的毒害作用而使该方法的广泛应用受到限制。本发明一种酿酒酵母的耐受多种抑制剂的菌株可以在含有稀酸预处理产生的抑制剂的培养基中正常生长并实现高效的乙醇生产。本发明的菌株突破了限制稀酸预处理法生产纤维素乙醇的一个瓶颈问题。本发明提供的菌株能够适应含有抑制剂的环境、高温环境,在含有多种纤维素乙醇生产中产生的抑制剂的培养基中正常生长,并能够在纤维素水解液中表现出很好的生长优势,并实现高效的乙醇生产。与原始菌株相比,本发明提供的菌株极显著(P<0.01)提高了生长优势和木糖利用率,显著(P<0.01)提高了乙醇的产量。本发明提供的一种酿酒酵母及其用途中所用原料及试剂均可由市场购得。下面结合实施例,进一步阐述本发明:实施例1SyBE-SC02100031菌株的构建本发明的一株酿酒酵母的耐受多种抑制剂和高温的新菌株SyBE-SC02100031,是菌株是在对工业酿酒酵母双倍体(Saccharomycescerevisiae)进行拆孢分离得到MATa10#,经紫外线诱变后得到耐受抑制剂提升的菌株11#。再将其与木糖利用菌株E7进行杂交构建出二倍体木糖利用菌株。紫外线诱变策略是:将10#菌株的培养液(YPD培养基:葡萄糖20g/L,酵母粉10g/L,蛋白胨20g/L)进行稀释后铺于含抑制剂的筛选培养基(添加抑制剂的YPD培养基),将铺好的平板距离15W紫外灯下56cm处照射7min,放于30℃培养箱中避光培养2天。菌株杂交的条件是:将筛选出的11#菌落接到5mlYPD液体培养基,培养条件是30℃,220rpm,8h。木糖利用菌株E75mlYPX液体培养基,培养条件是30℃,220rpm,8h。然后将SyBE-SC02100031和E7以OD为0.5:0.5转接到新鲜的YPD液体培养基中,30℃,220rpm,6h。然后将100ul涂布在YNBX固体平板上(6.7g/L酵母氮源,20g/L木糖),挑取形态大的菌落进行酵母菌落PCR验证其为二倍体和单倍体,验证结果如图1所示。SyBE-SC02100031为二倍体菌株。实施例2在摇瓶上比较SyBE-SC02100031菌株与原始菌株的生长1、试验材料:菌株E7-11由本实验室筛选构建的菌株;原始菌株E7实验室前期构建木糖利用菌株S.cerevisiaeCGMCCNO.6634。2、试验方法:种子培养基:SyBE-SC02100031菌株:蛋白胨,20g/L;酵母粉,10g/L;木糖,20g/L。121℃20min高温高压湿热灭菌。木糖单独灭菌后再混合。原始菌株:蛋白胨,20g/L;酵母粉,10g/L;木糖,20g/L。121℃20min高温高压湿热灭菌。木糖单独灭菌后再混合。发酵培养基:蛋白胨,20g/L;酵母粉,10g/L;木糖,20g/L。121℃20min高温高压湿热灭菌。木糖单独灭菌后再混合。发酵前加入抑制剂使其终浓度达到糠醛0.39g/L,苯酚0.15g/L,乙酸1.59g/L。将SyBE-SC02100031菌株和原始菌株S.cerevisiaeCGMCCNO.6634分别接种于50mL种子培养基中,在30℃、220rpm培养24h,均以初始菌体浓度OD600=1.0接种于有100mL发酵培养基的250mL锥形瓶中,于30℃、150rpm条件下培养,使用722型分光光度计测定菌体生长曲线。3、试验结果:如图2(数据见表1、表2)、图3(数据见表3)所示,E7-11菌株在经过72h后开始进入稳定期,OD600是7.04,且糖耗剩余量不足1g/l。而原始菌株仍处于对数期,OD600是3.94,且木糖剩余量为7.18g/l,与原始菌株相比,糖耗较高,生长较快。由此可知,SyBE-SC02100031菌株在含有抑制剂的条件下,表现出明显的生长优势,与原始菌株相比,能够适应含有抑制剂的环境,且展现出良好的木糖利用优势。表1表2表3时间(h)E7(平均值E7(方差)E7-11(平均值)E7-11(方差)01010121.30.0168311621.50.010434138241.960.0386670542.5650.205489614362.5450.0099342023.870.026217047482.9250.048509875.590.418929816603.410.0074882816.7150.25669806723.9450.0340332437.040.068023481844.20.0090149667.10504、结论:在含有抑制剂(浓度如上所述)条件下,原始菌株表现出较弱的生长发酵能力,而E7-11则能够适应抑制剂环境,实现在抑制剂环境下良好的生长及木糖利用优势。实施例3在不同抑制剂浓度YPX平板上比较E7-11菌株和原始菌株的生长特定1、试验材料:同实施例2。2、试验方法:种子、发酵培养基的制备同实施例2。将SyBE-SC02100031菌株和原始菌株S.cerevisiaeCGMCCNO.6634分别接种于50mL种子培养基中,在30℃、220rpm培养24h,均以初始菌体浓度OD600=1.0接种于有100mL发酵培养基的250mL锥形瓶中,于30℃、150rpm条件下培养24h,取100ul发酵混菌株,用无菌水稀释到所需浓度,琼脂板上行程单位(CFU)最好在20-200个之间。然后在超净台中将混合物涂布到木糖琼脂固体培养基(YPX-Agarplate,蛋白胨,20g/L;酵母粉,10g/L;琼脂粉,20g/L;木糖,20g/L。121℃20min高温高压湿热灭菌。木糖单独灭菌后再混合。)30%,50%,70%,100%FAP加到YPX固体平板上。将涂布好的平板放在培养箱中,在30℃下培养48h。待菌落长出之后,记录每个平板上菌落的数量。以不加抑制的平板作为对照,计算抑制程度。3、实验结果:如图4(数据见表4)所示。表44、计算方法:抑制程度=1-N/N0N0是不加抑制剂的平板上长出的菌落个数,N是加入不同浓度的抑制剂长出的菌落个数。5、实验结果见表5:表5组别原始菌株的抑制率(%)本发明菌株E7-11的抑制率(%)30%FAP55.1312.74**50%FAP68.5828.43**70%FAP86.5535.29**100%FAP89.4745.78**注:与原始菌株比较,*示P<0.05,**示P<0.01.6、结论:在含有抑制剂(浓度如上所述)条件下,原始菌株表现出较弱的生长能力,而E7-11则能够适应抑制剂环境,实现在抑制剂环境下良好的生长状况。实施例4在不同温度摇瓶发酵下,YPX平板上比较E7-11菌株和原始菌株的生长特性1、试验材料:同实施例2。2、试验方法:种子、发酵培养基的制备同实施例2。将E7-11菌株和原始菌株S.cerevisiaeCGMCCNO.6634分别接种于50mL种子培养基中,在30℃、220rpm培养24h,均以初始菌体浓度OD600=1.0接种于有100mL发酵培养基的250mL锥形瓶中,于30℃、34℃、36℃、38℃下培养,150rpm条件下培养24h,取100ul发酵混菌株,用无菌水稀释到所需浓度,琼脂板上行程单位(CFU)最好在20-200个之间。然后在超净台中将混合物涂布到木糖琼脂固体培养基(YPX-Agarplate,蛋白胨,20g/L;酵母粉,10g/L;琼脂粉,20g/L;木糖,20g/L。121℃20min高温高压湿热灭菌。木糖单独灭菌后再混合。)将涂布好的平板放在培养箱中,在30℃下培养48h。待菌落长出之后,记录每个平板上菌落的数量。以在30℃摇瓶培养的平板作为对照,计算抑制程度。如图5(数据见表6)所示。表6条件E7(平均值)方差E7-11(平均值)方差34℃10.74%3.32%8.23%1%38℃73.24%0.97%18.47%1.21%42℃82.85%0.82%53.42%1.21%3、实验结果见表7:表7组别原始菌株的抑制率(%)本发明菌株E7-11的抑制率(%)34℃10.748.23*36℃73.2418.47**38℃82.8553.42**注:与原始菌株比较,*示P<0.05,**示P<0.01.4、结论:在高温条件(温度如上所述)条件下,原始菌株表现出较弱的生长能力,而E7-11则能够适应高温环境,实现在高温环境下良好的生长状况。实施例5应用干酸处理的木质纤维素,在25%固体含量中,比较E7-11和原始菌株的发酵性能1、试验材料:木质纤维素干酸预处理经过粉碎筛选后的玉米秸秆首先要用稀硫酸溶液预浸泡,时经过粉碎筛选后的玉米秸秆首先要用稀硫酸溶液预浸泡,时经过粉碎筛选后的玉米秸秆首先要用稀硫酸溶液预浸泡,时经过粉碎筛选后的玉米秸秆首先要用稀硫酸溶液预浸泡,时经过粉碎筛选后的玉米秸秆首先要用稀硫酸溶液预浸泡,时经过粉碎筛选后的玉米秸秆首先要用稀硫酸溶液预浸泡,时经过粉碎筛选后的玉米秸秆首先要用稀硫酸溶液预浸泡,时经过粉碎筛选后的玉米秸秆首先要用稀硫酸溶液预浸泡,时秆固体和稀硫酸溶液的比例为秆固体和稀硫酸溶液的比例为秆固体和稀硫酸溶液的比例为2.0~0.5,将稀硫酸溶液缓慢的倾倒在塑料容器内,将稀硫酸溶液缓慢的倾倒在塑料容器内,将稀硫酸溶液缓慢的倾倒在塑料容器内,将稀硫酸溶液缓慢的倾倒在塑料容器内,将稀硫酸溶液缓慢的倾倒在塑料容器内的玉米秸秆上,然后剧烈摇晃充分混合均匀。将物密封在塑料容的玉米秸秆上,然后剧烈摇晃充分混合均匀。将物密封在塑料容的玉米秸秆上,然后剧烈摇晃充分混合均匀。将物密封在塑料容器内,室温放置18小时,充分预浸泡。预处理反应按以下过程进行:首先,将浸泡的玉米秸秆填充到一个不锈钢筛筒,然后将填充到预处理反应器中。密封蒸汽喷射进筛筒,然后将填充到预处理反应器中。密封蒸汽喷射进筛筒,然后将填充到预处理反应器中。密封蒸汽喷射进筛筒,然后将填充到预处理反应器中。密封蒸汽喷射进应器启动预处理。当内温达到应器启动预处理。当内温达到100℃时,稍微打开排气阀,以释放反应器内的空打开排气阀,以释放反应器内的空气。当温度达到预处理所需的值时气。当温度达到预处理所需的值时(190℃),预处理时间开始计,预处理时间开始计(需要反应3分钟)。要将反应器内的温度控制在目标。要将反应器内的温度控制在目标±2℃之间。当预处理结束后,将当预处理结束后,将两个向上的阀门完全打开,反应器内压力迅速降低至大气。将两个向上的阀门完全打开,反应器内压力迅速降低至大气。将两个向上的阀门完全打开,反应器内压力迅速降低至大气。将预处理玉米秸秆从反应器中拿出,然后将的倒入另一不锈钢容预处理玉米秸秆从反应器中拿出,然后将的倒入另一不锈钢容中,最后放入冷水浴进行却将这些经过预处理的玉米秸秆装塑料袋密中,最后放入冷水浴进行却将这些经过预处理的玉米秸秆装塑料袋密中,最后放入冷水浴进行却将这些经过预处理的玉米秸秆装塑料袋密中,最后放入冷水浴进行却将这些经过预处理的玉米秸秆装塑料袋密封,并保存于4℃直到使用。12h预酶解。2、试验方法:种子、发酵培养基的制备同实施例2。将E7-11菌株和原始菌株S.cerevisiaeCGMCCNO.6634分别用无菌墙头挑取木糖琼脂培养基(蛋白胨,20g/L;酵母粉,10g/L;木糖,20g/L;琼脂粉,20g/L。121℃20min高温高压湿热灭菌。木糖单独灭菌后再混合。)上的单个菌落,放入含有5ml液体木糖培养基试管中,30℃,150rpm,培养24h后。取500ul一级种子,转移到100ml液体木糖培养基的250ml摇瓶中。之后30℃,150rpm,培养18h。之后离心机4000rpm离心5min接种在25%干物质含量的同步糖化共发酵的培养基中。3、分析方法:菌体浓度以722型分光光度计测定其在600nm处吸光值表征。葡萄糖浓度、乙醇浓度用高效液相色谱(Waters1515)测定,色谱柱为AminexHPX-87H,柱温:65℃,检测器:Waters示差检测器2421,流动相为5mM硫酸溶液,流速0.6mL/min,进样量为10μL。4、计算方法:乙醇含量(g/L)=(样品峰面积×标准溶液浓度)/标准溶液峰面积×100%;乙醇产率(g/g)=测得乙醇含量/(消耗糖的量×0.51)葡萄糖和木糖含量计算同乙醇含量。5、实验结果:如图6(数据见表8、表9)、图7(数据见表10、11、12)所示。表8E7平均值方差平均值方差Time(h)glucosexylose079.314442233.79991747645.414072170.638089248654.816476354.62568000239.859602430.9823435361141.202042170.23654247839.007886620.2553607062427.453527481.97892490538.122237720.4305782914821.649950661.96083887629.955312420.7336498497229.258000524.1957451829.225038791.0590142529636.802660461.62055094729.959633861.8769046612045.753630191.55796189329.476664241.257358058表9E7-11平均值方差平均值方差Time(h)glucosexylose079.314442233.79991747645.414072170.638089248654.816476354.62568000239.859602430.9823435361141.202042170.23654247839.007886620.2553607062427.453527481.97892490538.122237720.4305782914821.649950661.96083887629.955312420.7336498497229.258000524.1957451829.225038791.0590142529636.802660461.62055094729.959633861.8769046612045.753630191.55796189329.476664241.257358058表10E7-11平均值方差Time(h)Ethanol000.24109958765.487967722.1629894161110.599581990.435203982428.127086425.7753533444854.00592180.7767735967262.218351771.2983490479666.83953094.27407050312069.683154812.899389868表11E7-11平均值方差Time(h)CFU01.55E+080.00E+00128.80E+072.83E+06245.00E+071.41E+06487.30E+061.41E+05724.15E+066.36E+05963.55E+067.78E+05表12E7平均值方差Time(h)Ethanol000612.273070349.7501463651117.908357280.7346324042429.323928130.4704603164840.246160990.5624176557243.922900520.2163460629645.698423760.90294717712044.416528781.54008017表13E7平均值方差Time(h)CFU01.20E+080.00E+00123.70E+062.76E+06242.20E+058.49E+04481.05E+057.07E+02721.24E+052.26E+04969.80E+047.78E+03在同步糖化共发酵过程中E7-11在发酵后期仍然能够保持好的发酵活性,葡萄糖仍然维持在一个低的水平,但是原始菌株E7逐渐积累到45.8g/l。且E7-11最终乙醇的浓度达到69.7g/l。而原始菌株E7是44.4g/l。在24h菌株活性,E7-11的菌株活性是原始菌株E7的179倍。6、结论菌株E7-11能够以较快的速度代谢干酸木质纤维素酶解过程中产生的葡萄糖和木糖,且在发酵后期仍然具有较高的菌株活性。在24h的菌株活性E7-11是E7的179倍。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1