一种通过高碘酸氧化得到的新型抗肿瘤化合物的制作方法
本发明涉及一种新型抗肿瘤化合物,尤其涉及一种通过高碘酸氧化得到的新型抗肿瘤化合物。
背景技术:
近年来随着人们生活方式的改变和医疗技术的提高,肿瘤检出人数也呈增高趋势,肿瘤已成为对人类健康造成严重威胁的重要疾病之一,由于对患者机体具有较高的损害性和较高的病死率,抗肿瘤药物的应用和研究一直是人们所关注的焦点,新的治疗理论和新型药物不断被开发和应用。
科学家们合成了许多分子靶标明确的抗肿瘤分子药物,但是由于化学合成药物的开发周期长以及研发费用昂贵,且临床毒副作用大,制约了药物的进一步研发和应用。中草药和植物药等天然药用材料中存在着广泛的生物活性物质,研究者可从中药中寻找毒副作用小、药理作用独特的抗肿瘤药物及抗肿瘤辅助药物。
技术实现要素:
本发明的目的是提供一种新型抗肿瘤药物,对免疫巨噬细胞则有明显的激活作用,通过刺激机体的免疫功能来消灭肿瘤细胞,而不是通过细胞毒作用直接抗肿瘤。
本发明的技术方案如下:
一种通过高碘酸氧化得到的新型抗肿瘤化合物,制备方法为:
(1)取干燥黑灵芝药材100g,加95%乙醇室温浸泡提取48h,过滤,重复一次,药渣于室温下置通风处晾干,然后将药渣与蒸馏水按质量体积(kg/L)比为1:20的比例混合,回流提取两次,每次提取时间依次为2h,1h,合并提取液,离心分离,减压浓缩;所得样品加入适量的95%乙醇使溶液中使得乙醇的体积分数为80%,然后进行沉淀,4℃下静置24h,离心过滤;沉淀物合并,依次以无水乙醇、无水乙醚、丙酮洗涤沉淀物,冷冻干燥得样品;取得到的干燥样品,以Sevag法除蛋白,即Sevag试剂(体积比氯仿∶正丁醇=5∶1)和干燥样品以质量比1∶1混匀,静置,除去下层蛋白质变性层;将样品浓缩,重复除蛋白操作10次;浓缩除蛋白样品后用95%乙醇洗涤,再浓缩,冻干得粗提物样品;将粗提物样品使用透析袋透析3天,将袋内样品浓缩至小体积,冷冻干燥,得黑灵芝精提物;
(2)取上述得到的黑灵芝精提物500mg,加入蒸馏水配成浓度为3~5mg/mL的溶液,离心,上清液过凝胶柱层析,使用的层析系统是 Purifier 100生物大分子纯化系统,凝胶柱Hiload 26/60Superdex-200prep grade,上样前将样品和洗脱液过0.22μm微孔滤膜以保护分离柱,洗脱液为蒸馏水,流速为2mL/min,上样体积为5mL,分部收集体积为8mL/管,紫外检测器和示差折光检测器检测(RID-10A示差检测器)在线监测洗脱情况;取第6-14管合并,浓缩,冷冻干燥得到黑灵芝提取物PSG,为黄色或棕色的絮状固体;
(3)PSG-NaI04的制备:将100mg PSG与0.35mo1/L高碘酸钠(NaI04)100mL,在18℃于暗处缓慢氧化108h,紫外光(223nm)处检测其光密度达一稳定值后,反应即完毕,立即用蒸馏水透析1d后,加乙醇醇析,真空干燥即得样品,记为PSG-NaI04。
本发明高碘酸氧化产物PSG-NaIO4,能够刺激巨噬细胞,明显增强巨噬细胞的吞噬能力和细胞上清中TNF-α的蛋白表达量,使机体的免疫功能加强,进而增强抵抗疾病的能力,可用于抗肿瘤。
附图说明
图1为PSG-NaI04的高效凝胶渗透色谱图。
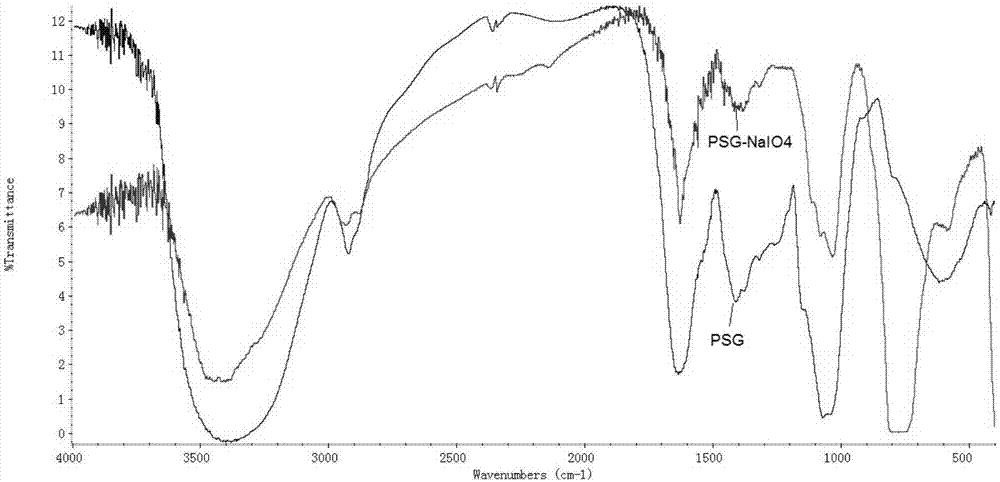
图2为PSG、PSG-NaI04的红外光谱图。
具体实施例
实施例1:一种通过高碘酸氧化得到的新型抗肿瘤化合物,制备方法为:
(1)取干燥黑灵芝药材100g,加95%乙醇室温浸泡提取48h,过滤,重复一次,药渣于室温下置通风处晾干,然后将药渣与蒸馏水按质量体积(kg/L)比为1:20的比例混合,回流提取两次,每次提取时间依次为2h,1h,合并提取液,离心分离,减压浓缩;所得样品加入适量的95%乙醇使溶液中使得乙醇的体积分数为80%,然后进行沉淀,4℃下静置24h,离心过滤;沉淀物合并,依次以无水乙醇、无水乙醚、丙酮洗涤沉淀物,冷冻干燥得样品;取得到的干燥样品,以Sevag法除蛋白,即Sevag试剂(体积比氯仿∶正丁醇=5∶1)和干燥样品以质量比1∶1混匀,静置,除去下层蛋白质变性层;将样品浓缩,重复除蛋白操作10次;浓缩除蛋白样品后用95%乙醇洗涤,再浓缩,冻干得粗提物样品;将粗提物样品使用透析袋透析3天,将袋内样品浓缩至小体积,冷冻干燥,得黑灵芝精提物;
(2)取上述得到的黑灵芝精提物500mg,加入蒸馏水配成浓度为3~5mg/mL的溶液,离心,上清液过凝胶柱层析,使用的层析系统是 Purifier 100生物大分子纯化系统,凝胶柱Hiload 26/60Superdex-200prep grade,上样前将样品和洗脱液过0.22μm微孔滤膜以保护分离柱,洗脱液为蒸馏水,流速为2mL/min,上样体积为5mL,分部收集体积为8mL/管,紫外检测器和示差折光检测器检测(RID-10A示差检测器)在线监测洗脱情况;取第6-14管合并,浓缩,冷冻干燥得到黑灵芝提取物PSG,为黄色或棕色的絮状固体;
(3)PSG-NaI04的制备:将100mg PSG与0.35mo1/L高碘酸钠(NaI04)100mL,在18℃于暗处缓慢氧化108h,紫外光(223nm)处检测其光密度达一稳定值后,反应即完毕,立即用蒸馏水透析1d后,加乙醇醇析,真空干燥即得样品,记为PSG-NaI04。
一、产物的理化性质
对实施例1制得的PSG-NaI04进行红外光谱分析,同时测定纯度、平均分子量、糖醛酸含量。
(1)纯度鉴定
用高效渗透凝胶色谱法进行纯度的检测,取测试样品3mg溶于1mL蒸馏水,1000rpm离心10min,用微孔过滤膜过滤后自动上样20μL,记录洗脱曲线用于判定该组分的纯度。
实验所用的HPLC的具体测试条件如下:
色谱柱为UltrahydrogelTM500 300mm×7.8mmid;流动相为0.1MNaCl;流速0.6mL/min;柱温35℃。
(2)分子量测定
液相色谱柱为UltrahydrogelTM500 300mm×7.8mmid,流动相为0.1MNaCl,流速为0.6mL/min,柱温为35℃。
配制各标准品Glc,T10,T40,T70,T500,T2000 2%溶液,各溶液在HPLC进样后得到相应的液相图谱。设定T2000的洗脱体积为柱的空体积V0,Glc的洗脱体积作为柱的总体积Vt,以公式Kav=(Ve-V0)/(Vt-V0)计算,以LogMw-Kav作图得标准曲线。根据样品的Ve,从标准曲线上即得样品的分子量。由于洗脱液的流速恒定,所以可以绘制出保留时间与分子量关系的标准曲线,根据其回归方程即可求得各产物的分子量。
(3)糖醛酸含量测定
a、采用改良的硫酸咔唑法,以半乳糖醛酸为标准测定糖醛酸的含量。
b、高效液相色谱法
色谱条件
色谱柱:Sugar-PakⅠ(300mm×6.5mm),流动相:0.0001mol/L EDTA水溶液,流速:0.6mL/min,示差检测器,柱温:90℃,示差检测池温度:40℃,进样量:20μL。
标准曲线的绘制
精密称取半乳糖醛酸对照品适量,加超纯水溶解,摇匀,制得0.16432,0.32864,0.49296,0.65728,0.8216,0.98592,1.15024,1.31456,1.47888mg/mL的系列标准溶液。按上述色谱条件分别进样20μL,测定半乳糖醛酸峰面积,以半乳糖醛酸峰面积为横坐标,对照品浓度(mg/mL)为纵坐标,绘制标准曲线。求得回归方程。
样品糖醛酸含量的测定
分别称取一定量的样品,加超纯水溶解并定容至10mL,配制得到样品溶液。按标准曲线制作时的色谱条件测定,由回归方程计算样品中糖醛酸的含量。
(4)红外光谱(IR)分析
取1-2mg样品,用KBr压片进行常规IR分析,红外光谱仪测定参数如下:背景扫描次数:128次;分辨率:4.0cm-1;检测器:DTGS。
表1PSG和PSG-NaI04的糖醛酸含量和平均分子量
表1的结果表明,PSG经高碘酸氧化后,其平均分子量和糖醛酸都显著降低,平均分子量由原来的8.89×106Da变为0.02×106Da,而糖醛酸含量也降到了原来的四分之一。原因可能是高碘酸可以氧化PSG糖蛋白糖链上的连二和连三羟基,同时糖环转化为非环状的半缩醛,并且以1,6-键连接的单糖侧链同时也将被切断,所以PSG的糖链高级结构将被彻底破坏,而位于侧链或终端的糖醛酸也随着侧链基团或末端单糖的降解而被切除,最终导致了氧化后样品的平均分子量和糖醛酸含量的急剧减少。
图1显示的是PSG、PSG-NaI04红外光谱图。图中1610cm-1附近的吸收是COO-共轭体系的反对称伸缩振动,而在1400cm-1附近是COO-对称伸缩振动吸收,我们发现氧化后的PSG在这两处的吸收明显变弱,说明高碘酸氧化可以去除大部分的糖醛酸。同时在1040,1078和1156cm-1的三个吸收峰,为环内醚C-O-C和C-O-H中的C-O伸缩振动,氧化后此区域的吸收也发生了改变,另外898cm-1处的β构型糖苷键的特征吸收,878cm-1处的吡喃糖环的特征吸收,都在水解后的两种样品中消失,说明高碘酸氧化严重破坏了PSG的β构型糖链结构。
二、功能活性研究
1.体外免疫活性实验
(1)巨噬细胞的分离与纯化
取2只小鼠颈椎脱臼处死,先放入碘伏中3~5min,再放入体积分数75%酒精中浸泡5min脱色,腹腔注入10mL PBS缓冲液,用棉球轻揉腹部1~2min后吸取腹腔液于离心管中,以1000r/min离心5min,弃上清液收集巨噬细胞,胎盼兰染色证实细胞存活率在95%以上,用RPMI-1640培养液调整细胞密度至1.5×105个/mL。将巨噬细胞悬液接种于96孔细胞培养板中,置二氧化碳培养箱(5%CO2、37℃)培养3h后,轻轻吸弃培养液,用PBS洗去未贴壁细胞,即得到纯化的腹腔巨噬细胞。
(2)试验分组及处理
将纯化的巨噬细胞用RPMI-1640培养液调整细胞密度为5×105/mL,并分为空白对照组(PBS)、阳性对照组(LPS)和不同剂量的给药组接种于96孔培养板中,每组设3个重复孔。每孔培养液总体积100μL,给药组添加GP的终浓度分别为0、10、100、200、400μg/mL,阳性对照组RPMI-1640培养液含LPS终浓度为2μg/mL。将各试验组均置于二氧化碳培养箱(5%CO2、37℃)中孵育至所需的时间,根据测定方法的不同进行不同处理,测定各个指标。
(3)巨噬细胞吞噬能力的检测
参考王晓京的方法进行。调节巨噬细胞的浓度5×105/mL,以每孔100μ1接种于96孔板,置5%CO2,37℃培养箱培养3h后洗去未贴壁细胞。每孔加入100μL含10%小牛血清的RPMI-1640,按所需剂量加入药物进行培养。培养48h后,每孔加入0.1%中性红生理盐水溶液100μ1,继续培养4h,倾去上清液,用PBS洗3遍,每孔加入细胞溶解液(冰醋酸:乙醇=1:1)100μL,4℃下放置2-3h,待细胞溶解后在酶标仪上测定540nm处吸光度。
(4)TNF-α的蛋白表达检测
TNF-α的诱生:制备的巨噬细胞,加入100μg/mL的样品,在5%CO2,37℃下孵育48h后,收集巨噬细胞上清,-70℃保存,供测定TNF-α活性时使用。
细胞上清TNF-α的Western blot法:以牛血清白蛋白为标准蛋白,用考马斯亮蓝法测定蛋白浓度,样品分装-70℃保存。根据各样品蛋白浓度计算上样体积,将细胞上清液进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)。再通过电泳将凝胶上的样本转印到PDVF膜上。加入一抗Goat anti-TNF-α进行4℃孵育10~14h,然后加入HRP标记的二抗Rabbit anti-goat Ig-G温育,最后采用ECL法进行显色定影,以β-actin作内参。
(5)统计学处理
所有数据以均数±标准差(x±s)表示,用SPSS11.0统计软件对数据进行处理,检验水准ɑ=0.05。
3.结果与讨论
(1)各受试物对巨噬细胞吞噬能力的影响
非特异性免疫应答是机体生来就有的免疫特性,例如机体皮肤表面的自然屏障,对病毒复制的干扰,吞噬细胞对异物的吞噬等生理的、化学的及细胞的防御。巨噬细胞参与非特异性免疫,其吞噬功能是免疫系统维持自身内环境稳定的重要手段,也是机体产生免疫应答的基础,大多数抗原经巨噬细胞处理后,免疫原性大大增加。因此吞噬是非特异性免疫的关键环节。测定小鼠巨噬细胞的吞噬能力,一般是观察巨噬细胞吞噬鸡红细胞的情况,通过计数来计算吞噬百分率。本发明是采用细胞培养液中添加不同终浓度的受试物,测定巨噬细胞吞噬中性红的能力,根据测定OD值的大小来判定各样品对巨噬细胞吞噬能力的影响。
表2PSG及PSG-NaIO4对巨噬细胞吞噬中性红的影响(x±s,n=3)
注:▲与空白对照组相比p<0.05,▲▲与空白组相比p<0.01;
由表2可知,PSG经高碘酸钠氧化处理后,巨噬细胞的吞噬功能与对照组相比都能明显提高,尤其是在添加浓度≥25μg/mL时,差异具有显著性意义(P<0.01)。与未处理前相比,巨噬细胞的吞噬能力也均有所提高,且当浓度在6.25-100μg/mL范围内呈一定的量效关系,但是当样品添加浓度继续升高(>100μg/mL)时,巨噬细胞的吞噬能力逐渐趋于平稳,达到400μg/mL的添加浓度时,对巨噬细胞吞噬能力的促进作用与同等浓度下的PSG相当。说明在中低浓度范围内,PSG-NaIO4能明显促进巨噬细胞的吞噬功能。
(2)各受试物对细胞上清TNF-α的蛋白表达的影响
TNF-α主要是由激活的巨噬细胞产生的一种内源性细胞因子,是一种具有广泛重要生物学作用的蛋白质。它能作用于淋巴细胞、肝细胞、血管内皮细胞和成纤维细胞,使机体的免疫功能加强,进而增强抵抗疾病的能力。我们利用Western blot法检测了PSG及PSG-NaIO4对小鼠腹腔巨噬细胞培养上清中TNF-α蛋白表达情况的影响。
表3PSG及PSG-NaIO4对巨噬细胞上清TNF-α蛋白表达的影响(x±s,n=3)
表3的结果表明,PSG经高碘酸钠氧化处理后,对巨噬细胞的刺激作用明显增强,其细胞上清中TNF-α的蛋白表达量与未氧化前相比有显著提高。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种(S)-4-羟基-2氧代-1-吡咯烷乙酰胺无菌粉末注射剂及其制备方法与流程
- 一种(S)-4-羟基-2氧代-1-吡咯烷乙酰胺冻干粉针及其制备方法与流程
- 一种(S)-4-羟基-2氧代-1-吡咯烷乙酰胺无菌粉末及其制备方法与流程
- 一种(S)-4-羟基-2氧代-1-吡咯烷乙酰胺冻干粉针及其制备方法与流程
- 一种(S)-4-羟基-2氧代-1-吡咯烷乙酰胺冻干粉针及其制备方法与流程
- 一种(S)-4-羟基-2氧代-1-吡咯烷乙酰胺无菌粉末注射剂及其制备方法与流程
- 一种基于高碘酸盐氧化去除有机污染物的方法与流程
- 一种海泡石羟基氧化铁活性炭复合吸附剂的制备与应用的制作方法与工艺
- 一种(S)-4-羟基-2氧代-1-吡咯烷乙酰胺无菌粉末及其制备方法与流程
- 一种(S)‑4‑羟基‑2氧代‑1‑吡咯烷乙酰胺缓释胶囊及其制备方法与流程