一种精确定量HIVDNA的检测试剂盒及其检测方法与流程
本发明属于分子检测领域,涉及一种精确定量hivdna的检测试剂盒,具体涉及一种联合多种pcr方法精准定量hivdna检测试剂盒。
背景技术:
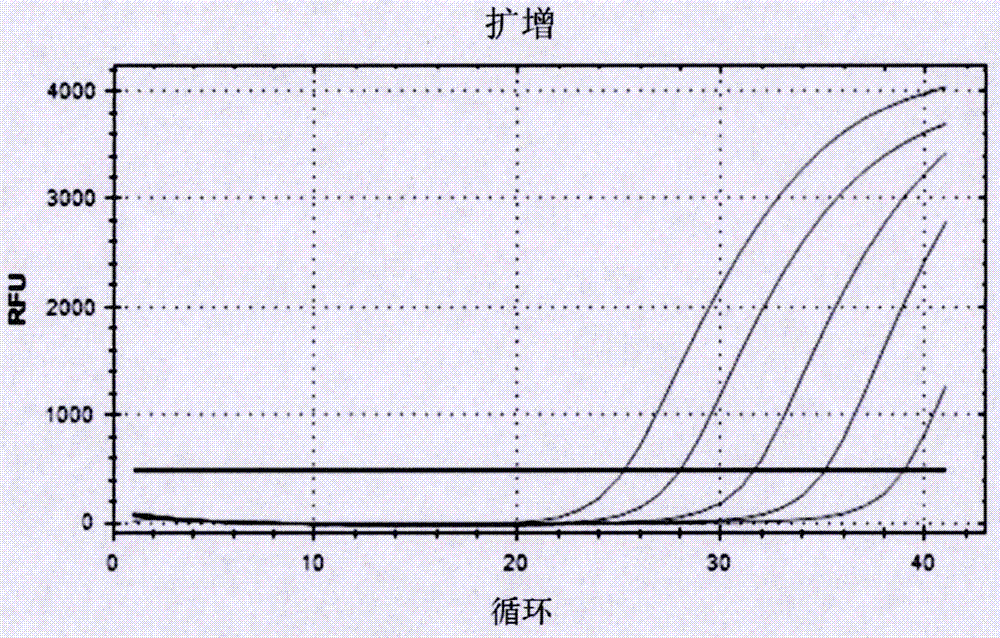
:目前art治疗可以将hivrna降低到检测不到的水平,由于hiv病毒储存库的存在,使得art治疗不能停药,hiv病毒储存库主要以hivdna的形式存在,以hivdna形式存在的病毒储存库成为hiv根治的障碍。研究表明hivdna水平与停药后病毒反弹时间密切相关。hivdna水平越低,停药后病毒反弹时间越长。因此对hivdna的精确定量非常重要。由于hivdna的量非常低,对其精确定量非常困难。目前对hivdna定量的pcr方法主要有实时定量pcr技术及digitalpcr技术。目前所有这些技术均使用通用引物,由于hiv变异度非常高,hiv的亚型也非常多,不同亚型之间的基因差异在30%左右,不同地区流行的亚型不同,欧美主要流行的是b亚型,我国流行的主要有b’,b’c及ae重组亚型,目前实时定量pcr及digitalpcr所用的通用引物一般对b亚型敏感,定量b亚型相对准确,而对我国流行的亚型尤其是ae亚型不敏感。与实时定量pcr技术相比,digitalpcr技术的优点为可以对大量的dna模板进行定量,缺点为每次都需要芯片,价格比较昂贵。另外,巢式pcr因其在第一轮pcr产物内部用第二对引物进行扩增,在定性方面,其扩增的特异性和灵敏性都会大大提高,但由于巢式pcr引物是结合在第一次pcr产物内部进行的第二轮扩增,其无法实现精确定量。本申请首次将实时定量pcr、digitalpcr及巢式pcr的技术结合,并利用中国艾滋病流行毒株的特点,建立了巢式pcr-实时定量pcr-digitalpcr相结合精准定量hivdna的方法。技术实现要素:为了克服现有技术存在的缺陷,本发明的目的在于提供一种联合多种pcr精确定量hivdna的检测方法,并且根据该检测方法开发了精确定量hivdna的检测试剂盒。由于hivdna在人体内量比较少,hiv变异度特别高,不同亚型之间hiv基因序列的差异非常大。而digitalpcr由于需要特殊的芯片,价格比较贵。通过三种pcr方法的结合,设计特异的针对各个亚型的特异引物,达到对hivdna进行精准定量和节约成本的目的。为了实现上述目的,本发明采用了如下技术方案:本发明提供了一种精确定量hivdna的检测方法,所述方法包括如下步骤:(1)利用巢式pcr对样本进行特异性扩增以鉴定hivdna的有无;(2)将巢式pcr阳性样本进行实时荧光定量pcr以确定hivdna量和亚型;(3)将巢式pcr阳性、实时定量pcr阴性的样本进行digitalpcr定量hivdna拷贝数。进一步,所述巢式pcr使用两组引物进行两轮pcr,每组引物包括外套和内套两对引物。在具体的实施方案中,第一组引物中,所述外套引物中上游引物的碱基序列如seqidno.1所示,所述外套引物中下游引物的碱基序列如seqidno.2所示,所述内套引物中上游引物是seqidno.3所示的引物和seqidno.4所示的引物的混合,所述内套引物中下游引物的碱基序列如seqidno.5所示;第二组引物中,所述外套引物中上游引物的碱基序列如seqidno.6所示,所述外套引物中下游引物是seqidno.7所示的引物和seqidno.8所示的引物的混合,所述内套引物中上游引物是seqidno.9所示的引物和seqidno.10所示的引物的混合,所述内套引物中下游引物的碱基序列如seqidno.11所示。进一步,所述实时荧光定量pcr使用针对hiv不同亚型的dna序列设计亚型特异性引物。在具体的实施方案中,针对hiv的ae亚型设计的引物序列为:上游引物序列如seqidno.17所示,下游引物序列如seqidno.18所示;针对hiv的bc亚型设计的引物序列为:上游引物是seqidno.19所示的引物和seqidno.20所示的引物的混合,下游引物序列如seqidno.21所示;针对hiv的b亚型设计的引物序列为:上游引物序列如seqidno.22所示,下游引物是seqidno.23所示的引物和seqidno.24所示的引物的混合。进一步,所述digitalpcr使用hivdna的通用扩增引物。在具体的实施方案中,上游引物序列如seqidno.15所示,下游引物序列如seqidno.16所示。优选地,所述样本是血液。本发明还提供了一种精确定量hivdna的检测试剂盒,所述试剂盒包括巢式pcr所需的试剂、和/或实时荧光定量pcr所需的试剂、和/或digitalpcr所需的试剂。进一步,巢式pcr所需的试剂包括进行两轮pcr使用的两组引物,每组引物包括外套和内套两对引物。第一组引物中,所述外套引物中上游引物的碱基序列如seqidno.1所示,所述外套引物中下游引物的碱基序列如seqidno.2所示,所述内套引物中上游引物是seqidno.3所示的引物和seqidno.4所示的引物的混合,所述内套引物中下游引物的碱基序列如seqidno.5所示;第二组引物中,所述外套引物中上游引物的碱基序列如seqidno.6所示,所述外套引物中下游引物是seqidno.7所示的引物和seqidno.8所示的引物的混合,所述内套引物中上游引物是seqidno.9所示的引物和seqidno.10所示的引物的混合,所述内套引物中下游引物的碱基序列如seqidno.11所示;所述实时荧光定量pcr所需的试剂包括针对hiv不同亚型的dna序列设计的亚型特异性引物,其中,针对hiv的ae亚型设计的引物序列为:上游引物序列如seqidno.17所示,下游引物序列如seqidno.18所示;针对hiv的bc亚型设计的引物序列为:上游引物是seqidno.19所示的引物和seqidno.20所示的引物的混合,下游引物序列如seqidno.21所示;针对hiv的b亚型设计的引物序列为:上游引物序列如seqidno.22所示,下游引物是seqidno.23所示的引物和seqidno.24所示的引物的混合;所述digitalpcr所需的试剂包括hivdna的通用扩增引物,其中,上游引物序列如seqidno.15所示,下游引物序列如seqidno.16所示。进一步,所述试剂盒还包括pcr反应液、dntps、mgcl2、taqdna聚合酶。进一步,所述试剂盒还包括样本dna提取液、和/或阳性对照品、和/或阴性对照品。本发明还提供了针对hiv不同亚型的dna序列设计的亚型特异性引物在制备hivdna精确定量检测试剂中的用途。在具体的实施方案中,所述针对hiv不同亚型的dna序列设计的亚型特异性引物包括:针对hiv的ae亚型设计的引物序列为:上游引物序列如seqidno.17所示,下游引物序列如seqidno.18所示;针对hiv的bc亚型设计的引物序列为:上游引物是seqidno.19所示的引物和seqidno.20所示的引物的混合,下游引物序列如seqidno.21所示;针对hiv的b亚型设计的引物序列为:上游引物序列如seqidno.22所示,下游引物是seqidno.23所示的引物和seqidno.24所示的引物的混合。本发明根据hiv病毒基因序列设计2对特异性引物(外套引物1对、内套引物1对),经过大量筛选实验,优化确定了最佳反应体系和反应程序,实现了对hiv病毒的快速、准确、灵敏检测。较之现有技术而言,本发明所提供的巢式pcr检测试剂盒及其检测方法有益效果在于:(1)特异性强:由于使用内外2对特异性引物,大大提高了pcr扩增的特异性,有效避免了非目的片段的扩增;(2)灵敏度高:与普通pcr相比,本发明经过2轮pcr反应,检测灵敏度得到了显著提高,这对于hiv病毒含量低的样本检测具有极其重要的意义;(3)检测用时短:本发明检测时间快,能够克服电镜观察和血清学检测方法存在的不足,实现对hiv病毒的快速、准确和高效检测。实时荧光定量pcr检测技术与目前已报道的其它检测技术相比,该技术具有巨大的优越性,主要体现在:(1)通过荧光信号,能实时观察pcr过程中待检测样品模板dna(或cdna)扩增情况,无需进行染色、电泳和紫外检测,大大简化了检测程序并缩短检测时间;(2)采用荧光信号放大功能,其检测的灵敏度得到了大大提高;(3)全封闭的操作系统,减少了pcr产物对试验室环境的染污和样品间的交叉染污,有效降低和避免了假阳性结果。但是一般国内外建立的用于检测hiv病毒的实时定量pcr技术都使用的通用引物,由于hiv的变异度非常高,这些通用引物对不同亚型的敏感度是不同的,一般检测的结果对以前流行的b亚型和bc重组亚型比较敏感,而对ae亚型不敏感。为此,本申请针对不同亚型的hiv设计了亚型特异性引物,使得实时荧光pcr检测技术更加灵敏的区别不同亚型的hiv。与实时荧光定量pcr扩增相比,digitalpcr利用芯片技术可以对大量的dna进行定量,提高了定量的准确度。因此本申请利用digitalpcr的方法,精确定量hivdna拷贝数。本发明的创新点在于:首次将巢式pcr、实时荧光定量pcr和digitalpcr联合应用以精确定量hivdna。巢式pcr在样本中hivdna含量极低的情况下即可确定hivdna的有无。实时荧光定量pcr对含有hivdna的样本进行亚型的确定,同时初算特定细胞群体中hivdna的总量。digitalpcr在实时荧光定量pcr无法精确定量的情况下,可以对大量的dna进行精确定量,确定hivdna拷贝数,最终实现精准定量hivdna的目的。附图说明图1显示hivdna标准品巢式pcr的电泳图;图2显示利用实时定量pcr扩增ccr5得到细胞数的扩增反应图;图3显示利用实时定量pcr扩增hivdna标准品的扩增反应图;图4显示利用digitalpcr对hivdna标准品拷贝数检测图;图5显示hiv感染者临床样本中hivdna巢式pcr的电泳图,其中,a代表编号为1-7的hiv感染者临床样本的电泳图;b代表编号为8-14的hiv感染者临床样本的电泳图;c代表编号为15-20的hiv感染者临床样本的电泳图;图6显示hiv感染者临床样本中hivdna的实时定量pcr扩增反应图;图7显示实时定量pcr的标准曲线图;图8显示digitalpcr对hiv感染者临床样本的hivdna拷贝数检测图,其中,a:编号为3的hiv感染者临床样本;b:编号为9的hiv感染者临床样本;c:编号为4的hiv感染者临床样本;d:编号为15的hiv感染者临床样本;e:编号为17的hiv感染者临床样本;f:编号为18的hiv感染者临床样本;g:编号为16的hiv感染者临床样本;h:正常对照。具体实施方式实施例1巢式pcr方法的建立1、dna制备将标准品细胞系-jurket细胞系按照106、105、104、103、102倍比稀释后,提取dna,最后一步收集dna时用60μl的体系来溶解,1μl中含hivdna拷贝数分别为17000、1700、170、17、1.7作为标准品;2、pcr扩增2.1引物设计在巢式pcr中,共设计a、b两组引物(如表1),每组由outer(外套)和inner(内套)两对引物组成,目的是提高实验的灵敏度和特异性,引物终浓度为0.4μmol/l。表1巢式pcr引物序列2.2反应体系和反应条件按照表2配制反应体系根据表3和表4中的反应条件(均为30个循环)进行两轮pcr,验证标准品中hivdna的存在。表2巢式pcr反应体系单位(微升)第一轮第二轮2*mix12.512.5a组引物outera上游0.5innera上游0.5outera下游0.5innera下游0.5b组引物outerb上游0.5innerb上游0.5outerb下游0.5innerb下游0.5h2o9.59.5模板11总量2525表3巢式pcr第一轮反应条件第一轮预变性变性复性延伸后延伸温度94℃94℃52℃72℃72℃时间2min30s30s90s5min表4巢式pcr第二轮反应条件第一轮预变性变性复性延伸后延伸温度94℃94℃52℃72℃72℃时间3min30s30s30s5min3、实验结果如图1所示,巢式pcr产物进行3%的琼脂糖凝胶电泳,在122bp和264bp两个目标条带中的任何一个出现阳性,结果则判断为阳性,否则判断为阴性。其中,图1中1泳道为空白对照,2泳道为阴性对照,3泳道为含hivdna1.7个拷贝的标准品,4泳道为含hivdna17个拷贝的标准品,5泳道为含hivdna170个拷贝的标准品,6泳道为含hivdna1700个拷贝的标准品,7泳道为含hivdna17000个拷贝的标准品。实施例2实时荧光定量pcr方法的建立1、dna制备同实施例12、引物和探针设计设计p1-p5共五对引物,分别对应hivdna、ccr5及ae、bc、b三个hiv亚型(如表5)。利用每个细胞含有两个拷贝的ccr5的特点,通过扩增ccr5定量细胞数量,从而计算出每106个细胞中平均所含hivdna的量。表5实时荧光定量pcr引物及探针序列备注:①p5上游引物与p2上游引物相同②108探针使用fam荧光,136探针使用vic荧光③p1引物使用136探针,p2、p3、p4、p5引物均使用108探针④136探针下划线部分为发卡结构。3、进行实时荧光定量pcr检测根据表6配制反应体系,利用表7中的反应条件(40个循环)进行hivdna及细胞数量的pcr扩增,利用标准曲线ct值算出hivdna/106的拷贝数。表6实时荧光定量pcr体系单位(微升)p3p4p5p12*mix12.512.512.512.5上游引物0.50.50.50.5下游引物0.50.50.50.5探针0.1250.1250.1250.125h2o10.37510.37510.37510.375模板1111总量25252525表7实时荧光定量pcr反应条件预变性变性复性&延伸温度95℃95℃60℃时间10min15s1min4、实验结果(1)实时定量pcr扩增标准品细胞数量的结果经过40轮循环后,1微升中含hivdna拷贝数分别为17000、1700、170、17、1.7的标准品通过扩增ccr5得到细胞数的pcr扩增反应如图2所示。(2)实时定量pcr扩增标准品hivdna的结果经过40轮循环后,1微升中含hivdna拷贝数分别为17000、1700、170、17、1.7的标准品扩增hivdna的pcr扩增反应如图3所示。(3)利用实时定量pcr计算标准品的拷贝数标准品计算的拷贝数如表8所示,结果表明实时定量pcr能够精确计算hivdna的拷贝数。表8标准品的拷贝数计算标本品编号hivdnacopies/μlcells/μlhiv-1dnacopies/106cells11.71.7106copies/106cells21717106copies/106cells3170170106copies/106cells417001700106copies/106cells51700017000106copies/106cells实施例3digital-pcr方法的建立按照表9配制反应体系,最后加入25x的稳定剂,采用raindance成熟的rainstromtm皮液滴专利技术进行油滴的制备。完成油滴制备后进行pcr扩增,反应条件如表7。pcr扩增后利用仪器检测荧光计数。digitalpcr在扩增结束后对每个反应单元的荧光信号进行采集。有荧光信号记为1,无荧光信号记为0。因digitalpcr通过终点检测计算目标序列的拷贝数,所以无需采用内参和标准曲线就可以进行精确的绝对定量检测。此外,由于digitalpcr采用终点检测,因此也不依赖于ct值,所以digitalpcr反而受扩增效率的影响大大降低,对于pcr反应抑制物的耐受能力也大大提高,具有很高的准确度和重现性。对于标准品检测的结果如图4所示,检测的标准品拷贝数的结果如表10所示。表9digital-pcr反应体系单位(微升)p3/p1p4/p1p5/p12*mix757575上游引物3/33/33/3下游引物3/33/33/3探针(fam)0.750.750.75探针(vic)0.750.750.75模板61.561.561.525x稳定剂666总量156156156表10digital-pcr扩增后标准品拷贝数量的计数标本品编号hivdnacopies/反应体系cell/反应体系hiv-1dnacopies/106cells11111106copies/106cells2394394106copies/106cells343884388106copies/106cells44282842828106copies/106cells5133029133029106copies/106cells实施例4巢式pcr、实时荧光定量pcr、digitalpcr在临床检测上的联合应用1、临床样本来源:hiv阴性健康人标本3例,因hiv感染治疗后,hivdna水平会有不同程度的降低,art治疗后的hivdna更难检测到。本申请入组未治疗病人50例及抗病毒治疗两年以上的病人20例。50例没有治疗的病人巢式pcr、实时定量pcr及digitalpcr检测结果值均非常高,结果未在本申请中呈现。对于art治疗两年后的病人,所有病人巢式pcr定量血液中的hivdna均阳性,实时定量pcr对20例病人hivdna进行了定量,其中13例病人通过实时定量pcr得到了hivdna拷贝数,另外7例病人通过实时定量pcr没有检测到(实时定量pcr起跳的循环数均高于35个循环),没有检测到的这7例病人进一步通过digitalpcr得到了结果。所有检测样本均来自解放军302医院感染三科采集的edta抗凝血。2、hivdna制备:利用ficoll淋巴细胞分离液从样本中分离出pbmc,然后利用qiagen提取试剂盒说明书的方法提取dna。3、巢式pcr对临床样本hivdna的检测方法同实施例1。结果:通过巢式pcr对20例抗病毒治疗两年以上的hiv感染者外周血样本进行定性检测的结果如图5所示,所有病人巢式pcr定量血液中的hivdna均阳性。图5中,hc:正常对照;blank:空白对照;1-20为病人的编号;由于对人的基因组的非特异性扩增其中正常人及病人都会在122和264之间会出现一条非特异性条带,只有出现122及264的位置出现的条带认为是hiv特异性的。4、实时定量pcr对hiv感染者样本的扩增使用bio-rad公司的cfx96real-timesystem进行pcr扩增反应,步骤同实施例2。结果:结果如图6和图7所示;图7中两条线中上面的为hiv标准曲线,下面的为ccr5标准曲线,×为样品有ct值起跳,对于样品有多个亚型结果的,取ct值最小的为匹配亚型。利用两条标准曲线所得ct值计算出检测样本hivdna/106的拷贝数(表11)。通过实时定量pcr对20例病人hivdna进行检测的结果。其中13例病人得到了hivdna拷贝数,7例病人通过实时定量pcr没有得到结果,进一步通过digitalpcr进行检测。表11实时定量pcr对20例病人hivdna拷贝数的检测结果5、digitalpcr对hiv感染者样本的扩增对于巢式pcr阳性而实时定量pcr阴性的病人样本,则提取20ml以上全血中pbmc的hivdna,按照表9配制反应体系,最后加入25x的稳定剂,采用raindance成熟的rainstromtm皮液滴专利技术进行油滴的制备。完成油滴制备后进行pcr扩增,反应条件如表7。digitalpcr在扩增结束后对每个反应单元的荧光信号进行采集。有荧光信号记为1,无荧光信号记为0。digitalpcr对通过实时定量pcr没有得到结果的7例病人的检测结果如图8所示,拷贝数计算结果如表12所示。表12digitalpcr得到的hivdna拷贝数病人编号体系中hivdna拷贝数体系中细胞数hivdnacopies/106cells315784013829366412411221535410371705171047167424181143107510463769531816514612684虽然以上仅描述了本发明的具体实施方式范例,但是本领域的技术人员应当理解,这些仅是举例说明,本发明的保护范围是由所附权利要求书限定的。本领域的技术人员在不背离本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改,但这些变更或修改均落入本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1