用于免疫测定的喹硫平半抗原的制作方法
本申请是申请日为2013年8月20日,中国国家申请号为201380054991.5,发明名称为“用于免疫测定的喹硫平半抗原”的发明申请的分案申请。
相关申请的交叉引用
本专利申请要求2012年8月21日提交的美国临时专利申请序列号61/691,462的优先权。前述相关美国专利申请的全部公开内容据此以引用方式并入本文用于所有目的。
本发明涉及用于确定在人生物体液中喹硫平的存在的免疫测定技术领域。
背景技术:
精神分裂症是一种慢性衰竭性精神疾病,影响世界上大约0.45-1%的人群(vanos,j.;kapur,s.“schizophrenia”lancet2009,374,635-645)。治疗的主要目标是为了持续消除精神病性症状、减轻复发的风险和严重程度、以及改善患者的功能和总体生活质量。虽然许多患有精神分裂症的患者能够利用可用的安定药物实现症状稳定,但是对日常服用的口服药物的依从性不佳是复发的常见原因。探索不依从的后果的多项研究(abdel-baki,a.;ouellet-plamondon,c.;malla,a.“pharmacotherapychallengesinpatientswithfirst-episodepsychosis”journalofaffectivedisorders2012,138,s3-s14)已经表明不按处方服用药物的精神分裂症患者具有较高的复发率、住院率和自杀率、以及提高的死亡率。估计有40至75%的精神分裂症患者难以依从日常口服治疗方案(lieberman,j.a.;stroup,t.s.;mcevoy,j.p.;swartz,m.s.;rosenheck,r.a.;perkins,d.o.;keefe,r.s.e.;davis,s.m.;davis,c.e.;lebowitz,b.d.;severe,j.;hsiao,j.k.“effectivenessofantipyschoticdrugsinpatientswithchronicschizophrenia”newenglandjournalofmedicine2005,353(12),1209-1223)。治疗药物监测(tdm)是包括安定药在内的药物的血清或血浆浓度定量,用于治疗监测及优化。此类监测允许例如识别不依从他们的服药方案的患者、未达到治疗剂量的患者、在治疗剂量下非响应的患者、具有亚最佳耐药性的患者、具有药代动力学药物-药物相互作用的患者、或具有导致血浆浓度不良的异常代谢的患者。患者吸收、分布、代谢、及排泄安定药物的能力存在相当大的个体差异。此类差异可能由并发症、年龄、伴随药物或遗传特性引起。不同的药物配方也能够影响安定药物的代谢。tdm允许进行剂量优化用于个体患者,改善治疗和功能结果。tdm还允许开处方的临床医生确保处方规定的剂量的依从性以及达到有效的血清浓度。
时至今日,用于测定安定药物的血清或血浆浓度水平的方法涉及使用带有uv或质谱检测的液相色谱(lc),以及放射性免疫测定(参见例如woestenborghs等人,1990,“ontheselectivityofsomerecentlydevelopedria's”,methodologicalsurveysinbiochemistryandanalysis20:241-246。药物和代谢物分析,包括抗感染剂(analysisofdrugsandmetabolites,includinganti-infectiveagents);heykants等人,1994,“thepharmacokineticsofrisperidoneinhumans:asummary”,jclinpsychiatry55/5,suppl:13-17;huang等人,1993,“pharmacokineticsofthenovelanti-psychoticagentrisperidoneandtheprolactinresponseinhealthysubjects”,clinpharmacolther54:257-268)。放射性免疫测定检测利培酮和帕潘立酮之一或二者。salamone等人在美国专利8,088,594中公开了一种用于利培酮的竞争性免疫测定,其利用抗体检测利培酮和帕潘立酮两者,但是不检测药理学上非活性的代谢物。在竞争性免疫测定中使用的抗体针对特定免疫原开发。idlabsinc.(london,ontario,canada)售卖一种用于奥氮平的elisa,奥氮平是另一种安定药物,其也利用竞争性模式。使用说明指示该分析设计用于筛选目的并旨在用于鉴定或研究用途,并且具体地不旨在用于治疗用途。使用说明推荐所有阳性样品应利用气相色谱-质谱联用分析仪(gc-ms)进行确认,并且指示使用的抗体检测奥氮平和氯氮平(参见idlabsinc.,“instructionsforusedatasheetidel-f083”,版本日期为2011年8月8日)。这些方法中的一些,即hplc和gc/ms,可能是昂贵的和劳动密集型的,并且一般仅在具有适当设备的大型或专业实验室中进行。
存在对用于测定安定药物水平的其它方法的需要,尤其是能够在开处方的临床医生办公室中(其中对于个体患者的治疗可以及时得多的方式进行相应的调整)以及在其它缺乏lc或gc/ms设备或需要快速测试结果的医疗设施中进行的方法。
喹硫平是:
技术实现要素:
本主题发明提供允许此种用于测定安定药物喹硫平水平的改善方法的化合物和缀合物。
本发明包括式i的化合物
其中:
r1为h、
r2为h、
r3为h、或w-(y)p-g;前提条件是r1、r2、r3中的两个必须为h,并且另外的前提条件是r1、r2和r3不可同时全为h;
其中:
z选自:
-n(r4)-、-o-、-s-、-烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-、
r4为h、烷基基团、环烷基基团、芳烷基基团或者取代或未取代的芳基基团;
其中:
w选自:
-c(o)-、-烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-;
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为0、或1;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明包括本发明的化合物与免疫原性载体(诸如蛋白质)的缀合物,以及通过使本发明的化合物与免疫原性载体接触的方法制备的产物。
附图说明
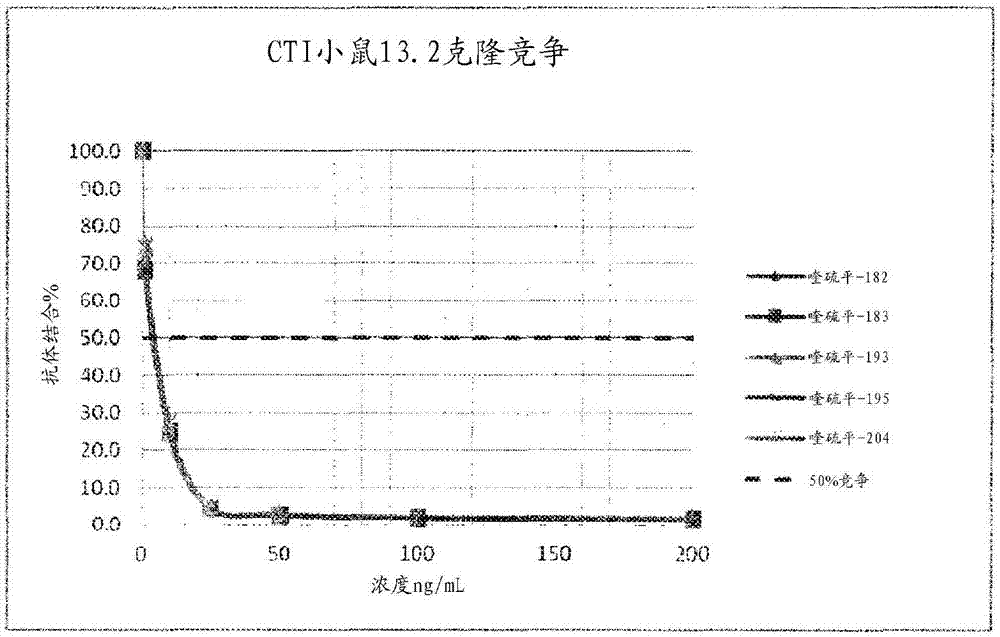
图1和2示出用各种杂交瘤生成的竞争性elisa的结果;
图3示出在侧流测定装置上使用的竞争性免疫测定模式;并且
图4示出用喹硫平亚克隆89-3、89-13、和89-5生成的典型剂量响应曲线。
具体实施方式
本主题发明提供允许测定安定药物水平的化合物和缀合物。此类方法将允许临床医生客观评估由于缺乏依从性导致患者症状恶化的可能性。另选地,如果依从的话,临床医生能够考虑不同的治疗方案。可通过此类方法进行治疗药物监测,它是识别最有效的治疗方案的关键。此外,临床医生相信这种tdm将帮助他们与患者建立一种非同一般的关系,即,通过使患者积极地参与优化他们的治疗方案,从对不依从治疗的假设论点变为更合作的方案。
该方法的开发需要首先合成多个免疫原,包括连接到蛋白质的合成半抗原。半抗原是一种当连接到大载体诸如蛋白质上时能够引发免疫应答的小分子。它们是不含蛋白质的物质,大多数是低分子量的,不能够单独刺激抗体形成,但是确实与抗体反应。半抗原-蛋白质缀合物能够刺激抗体产生。针对小分子生成特异性抗体可用于免疫测定开发(pharmres.1992,9(11):1375-9,annalidell'istitutosuperioredisanita.1991,27(1):167-74,annalidell'istitutosuperioredisanita.1991,27(1):149-54,immunologyletters.1991,28(1):79-83)。
本发明包括式i的化合物
其中:
r1为h、
r2为h、
r3为h、或w-(y)p-g;前提条件是r1、r2、r3中的两个必须为h,并且另外的前提条件是r1、r2和r3不可同时全为h;
其中:
z选自:
-n(r4)-、-o-、-s-、-烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-、
r4为h、烷基基团、环烷基基团、芳烷基基团或者取代或未取代的芳基基团;
其中:
w选自:
-c(o)-、烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-;
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为0、或1;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明包括式i的化合物
其中:
r1为h、
r2为h、
r3为h,前提条件是r1或r2必须为h,并且另外的前提条件是r1和r2不可同时为h;
其中:
z选自:
-n(r4)-、-o-、-s-、-烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-、
r4为h、烷基基团、环烷基基团、芳烷基基团或者取代或未取代的芳基基团;
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为0、或1;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明包括式i的化合物:
其中:
r1为h、或ch2nh-(y)p-g;
r2为h、或ch2nh-(y)p-g;前提条件是r1或r2必须为h,并且另外的前提条件是r1和r2不可同时为h;
r3为h;
其中:
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为1。
本发明包括式i的化合物
其中r1为h、
r2为h、
r3为h;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
在本发明的另一个实施例中:
r1为h、
r2为h、
r3为h;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的另一个实施例是式i的化合物,所述化合物是:
本发明还提供上述化合物与免疫原性载体的缀合物。
本发明的另一个实施例因此是式i的化合物与免疫原性载体的缀合物其中:
r1为h、
r2为h、
r3为h、或w-(y)p-g;前提条件是r1、r2、r3中的两个必须为h,并且另外的前提条件是r1、r2和r3不可同时全为h;
其中:
z选自:
-n(r4)-、-o-、-s-、-烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-、
r4为h、烷基基团、环烷基基团、芳烷基基团或者取代或未取代的芳基基团;
其中:
w选自:
-c(o)-、烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-;
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为0、或1;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的另一个实施例是式i的化合物与免疫原性载体的缀合物其中:
r1为h、
r2为h、
r3为h,前提条件是r1或r2必须为h,并且另外的前提条件是r1和r2两者不可同时为h;
其中:
z选自:
-n(r4)-、-o-、-s-、-烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-、
r4为h、烷基基团、环烷基基团、芳烷基基团或者取代或未取代的芳基基团;
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为0、或1;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的另一个实施例是式i的化合物与免疫原性载体的缀合物,其中:
r1为h、或ch2nh-(y)p-g;
r2为h、或ch2nh-(y)p-g;前提条件是r1或r2必须为h,并且另外的前提条件是r1和r2两者不可同时为h;
r3为h;
其中:
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为1。
本发明的另一个实施例是式i的化合物与免疫原性载体的缀合物其中r1为h、
r3为h;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的另一个实施例是式i的化合物与免疫原性载体的缀合物其中:
r1为h、
r2为h、
r3为h;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的另一个实施例是下列化合物与免疫原性载体的缀合物:
本发明的一个优选的实施例是上述缀合物中的任一个,其中免疫原性载体是蛋白质。
本发明的一个优选的实施例是上述缀合物中的任一个,其中所述蛋白质是钥孔
本发明的另一个优选的实施例是免疫原性载体与选自下列的化合物的缀合物:
本发明的另一个优选的实施例是选自下列的化合物与蛋白质的缀合物:
本发明的另一个更优选的实施例是蛋白质与选自下列的化合物的缀合物:
本发明也提供通过使上述化合物与免疫原性载体接触的方法形成的产物。
本发明的另一个实施例因此是通过使式i的化合物与免疫原性载体接触的方法制备的产物
其中:
r1为h、
r2为h、
r3为h、或w-(y)p-g;前提条件是r1、r2、r3中的两个必须为h,并且另外的前提条件是r1、r2和r3不可同时全为h;
其中:
z选自:
-n(r4)-、-o-、-s-、-烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-、
r4为h、烷基基团、环烷基基团、芳烷基基团或者取代或未取代的芳基基团;
其中:
w选自:
-c(o)-、烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-;
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为0、或1;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的另一个实施例是通过使式i的化合物与免疫原性载体接触的方法制备的产物
其中:
r1为h、
r2为h、
r3为h,前提条件是r1或r2必须为h,并且另外的前提条件是r1和r2两者不可同时为h;
其中:
z选自:
-n(r4)-、-o-、-s-、-烷基-、-氨基烷基-、-硫代烷基-、-杂烷基-、-烷基羰基-、
r4为h、烷基基团、环烷基基团、芳烷基基团或者取代或未取代的芳基基团;
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为0、或1;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的另一个实施例是通过使式i的化合物与免疫原性载体接触的方法制备的产物
其中:
r1为h、或ch2nh-(y)p-g;
r2为h、或ch2nh-(y)p-g;前提条件是r1或r2必须为h,并且另外的前提条件是r1和r2两者不可同时为h;
r3为h;
其中:
y为有机间隔基团;
g为能够结合至载体的官能连接基团;
p为1。
本发明的另一个实施例是通过使式i的化合物与免疫原性载体接触的方法制备的产物
其中r1为h、
r3为h;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的另一个实施例是通过使式i的化合物与免疫原性载体接触的方法制备的产物
其中:
r1为h、
r2为h、
r3为h;
m为1、2、3、4、或5;
n为1、2、3、4、或5。
本发明的一个优选的实施例是通过使上述化合物中的任一个与免疫原性载体接触的方法制备的产物,其中免疫原性载体是蛋白质。
本发明的一个更优选的实施例是通过使上述化合物中的任一个与免疫原性载体接触的方法制备的产物,其中免疫原性载体是蛋白质并且其中所述蛋白质是钥孔
本发明的另一个实施例是通过使化合物与免疫原性载体接触的方法制备的产物,所述化合物是
本发明的另一个实施例是通过使化合物与蛋白质接触的方法制备的产物,所述化合物是
本发明的另一个实施例是通过使化合物与蛋白质接触的方法制备的产物,所述化合物是
其中所述蛋白质是钥孔
缩写
在本专利申请说明书以及整个专利申请中,使用了如下缩写。
amasn-(α-马来酰亚胺基乙酸)琥珀酰亚胺酯
binap2,2’-双(二苯基膦基)-1,1’-二萘基
boc或boc叔-丁氧羰基
btg牛甲状腺球蛋白
bu3n三丁胺
dcc二环己基碳二亚胺
dcm二氯甲烷
diea二异丙基乙胺
dmfn,n-二甲基甲酰胺
edci或edc1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐
edta乙二胺四乙酸
hobt或hobt1-羟基苯并三唑水合物
klh钥孔
pd2(dba)3三(二亚苄基丙酮)二钯(0)
satan-琥珀酰亚胺s-乙酰硫代乙酸酯
tea或et3n三乙胺
thf四氢呋喃
tfa三氟乙酸
r.t.室温
dead偶氮二甲酸二乙酯
dic二异丙基碳二亚胺
nhsn-羟基琥珀酰亚胺
tfp四氟苯基
pnp对-硝基苯
tbtu邻-(苯并三唑-1-基)-n,n,n',n'-四甲基脲四氟硼酸盐
depbt3-(二乙氧基磷酰氧基)-1,2,3-苯并三嗪-4(3h)-酮
bop-cl双(2-氧代-3-
dtt二硫赤藓糖醇
定义
术语“缀合物”是指通过将独立部分接合到一起形成的任何物质。根据本发明的代表性缀合物包括通过将小分子诸如式i的化合物与大分子诸如载体或聚胺聚合物(尤其是蛋白质)接合在一起形成的那些缀合物。在缀合物中,小分子可接合在大分子上的一个或多个活性位点处。
术语“半抗原”是指部分的或不完全的抗原。半抗原是不含蛋白质的物质,其不能够刺激抗体形成,但是确实与抗体反应。抗体通过偶联半抗原与高分子量免疫原性载体形成,并且随后将这种偶联产物(即,免疫原)注入人或动物受试者中。
术语“免疫原”是指能够在生物体内引发、产生、或生成免疫应答的物质。
如本文所用,“免疫原性载体”是一种免疫原性物质,通常为蛋白质,其能够在一个或多个位置处与半抗原接合,从而能够生成抗体,抗体能够特异性地与这些半抗原结合。免疫原性载体物质的示例包括但不限于蛋白质、糖蛋白、聚氨基-多糖复合物、颗粒、和核酸,它们被认为是外源物质并因此引发宿主的免疫应答。聚氨基-多糖可使用任何已知用于这种制备的常规方法由多糖制备。
可使用各种蛋白类型作为免疫原性载体,非限制地包括白蛋白、血清蛋白、脂蛋白等等。例示性的蛋白包括牛血清白蛋白、钥孔
免疫原性载体也可包括聚氨基-多糖,它们是通过重复缩合单糖积聚的高分子量聚合物。多糖的示例是淀粉、糖原、纤维素、糖胶诸如阿拉伯树胶、琼脂等等。多糖也包含聚(氨基酸)残基和/或脂质残基。
免疫原性载体也可为聚(核酸),它们是单独的或缀合至上文提到的聚(氨基酸)或多糖中的一个。
免疫原性载体也可包括固体颗粒。颗粒直径一般为至少约0.02微米(μm)并且不超过约100μm,并且通常为约0.05μm至10μm。颗粒可为有机的或无机的、溶胀性的或非溶胀性的、多孔的或无孔的,优选接近水的密度,一般为约0.7至1.5g/ml,并且组成材料可为透明的、部分透明的、或不透明的。颗粒可为生物材料诸如细胞和微生物,包括非限制性的示例诸如红细胞、白细胞、淋巴细胞、杂交瘤、链球菌(streptococcus)、金黄色葡萄球菌(staphylococcusaureus)、大肠杆菌(e.coli)、和病毒。颗粒也可由有机和无机聚合物、脂质体、胶乳、磷脂囊泡、或脂蛋白组成。
术语“衍生物”是指由母体化合物通过一个或多个化学反应制成的化学化合物或分子。
术语化学化合物的“类似物”是指一种化学化合物,其包含碳原子链和与参考化合物相同的特定官能团,但是类似物的碳链比参考化合物的碳链更长或更短。
“标签,”“检测分子,”或“报告物”是产生或能够被诱导产生可检测信号的任何分子。标签可缀合至分析物、免疫原、抗体、或另一个分子诸如受体或能够结合至受体诸如配体(尤其是半抗原或抗体)的分子。标签的非限制性示例包括放射性同位素(例如125i)、酶(例如β-半乳醣苷酶、过氧化物酶)、酶片段、酶底物、酶抑制剂、辅酶、催化剂、荧光基团(例如若丹明、荧光素异硫氰酸酯或fitc、或dylight649)、染料、化学发光剂和发光剂(例如二氧杂环丁烷、虫荧光素)、或敏化剂。
如本文所用,“间隔”是指通过官能连接基团连接两个或更多个子结构诸如半抗原、载体、免疫原、标签或结合伴侣的化学结构的一部分。这些间隔基团由通常存在的原子构成并且以通常存在于有机化合物中的方式进行装配,并且因此可称为“有机间隔基团”。用于装配间隔的化学构件将在本专利申请的下文中描述。其间优选的间隔是直链或支化的、饱和或不饱和的碳链。这些碳链也可包括在链内的一个或多个杂原子、在链中或在链末端取代任何碳原子的一个或多个氢的一个或多个杂原子。“杂原子”是指不是碳的原子,它们选自氧、氮、磷和硫,其中氮、磷和硫原子可以任何氧化状态存在并且可具有结合到它们上的碳或其它杂原子。间隔也可包括环状或芳族基团作为链的一部分或取代链中的原子中的一个。
在间隔基团中的原子的数目通过计算除氢之外的原子数目来确定。在间隔基团内的链中原子数通过计算沿着在连接的子结构之间的最短途径的非氢原子数进行确定。优选的链长度介于1至20个原子之间。
“官能连接基团”是指存在于半抗原上并且可用于提供可用活性位点的活性基团,通过官能连接基团,半抗原部分可通过形成共价化学键偶联至另一部分,从而产生半抗原与另一部分(诸如标签或载体)的缀合物。半抗原可以这种方式连接到部分诸如生物素以形成半抗原的竞争性结合伴侣。
间隔基团可用于连接半抗原与载体。不同长度的间隔允许其以距载体的不同距离连接半抗原,用于使被免疫的动物或人的免疫系统优化抗体形成过程。连接至半抗原分子中的不同位置提供呈现半抗原上的特定位点于免疫系统的机会,从而影响抗体识别。间隔可包含亲水性增溶基团以制备在含水介质中可溶性较高的半抗原衍生物。亲水性增溶基团的示例包括但不限于聚氧烷氧基基团,例如聚乙二醇链;羟基、羧酸基和磺酸基。
术语“亲核基团”或“亲核物质”是指提供电子对以在反应中形成化学键的物质。术语“亲电子基团”或“亲电子物质”是指接受来自亲核物质的电子对以在反应中形成化学键的物质。
术语“取代的”是指在母体分子的任何位置上取代碳原子上的氢原子的原子或原子基团的取代。取代基的非限制性示例包括卤素原子、氨基、羟基、羧基、烷基、芳基、杂烷基、杂芳基、氰基、烷氧基、硝基、醛基和酮基。
术语“烷基”是指直链和支链基团,除非另外指明,其至多12个碳原子,并且具体地旨在包括具有任意饱和度或饱和水平的基团。烷基包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、仲-丁基、叔-丁基、戊基、异戊基、己基、异己基、庚基、辛基、2,2,4-三甲基戊基、壬基、癸基、十一烷基和十二烷基。
术语“环烷基”是指饱和的或部分不饱和的单环或二环烃环基团,其由3至10个碳原子构成。烷基取代基可任选地存在于环上。示例包括环丙基、1,1-二甲基环丁基、1,2,3-三甲基环戊基、环己基和环己烯基。
术语“杂原子”指氮原子、氧原子、磷原子或硫原子,其中氮、磷和硫原子可以任何允许的氧化状态存在。
术语“杂烷基”是指包括在链内的一个或多个杂原子、在链中或在链末端取代任何碳原子的一个或多个氢的一个或多个杂原子的烷基基团。
术语“杂环基”是指非芳族(即,饱和的或部分不饱和的)环,其由3至7个碳原子与至少一个杂原子构成,杂原子选自n、o或s。烷基取代基可任选地存在于环上。示例包括四氢呋喃基、二氢吡喃基、哌啶基、2,5-二甲基哌啶基、吗啉基、哌嗪基、硫代吗啉基、吡咯烷基、吡咯啉基、吡唑烷基、吡唑啉基、咪唑烷基和咪唑啉基。
术语“羟烷基”是指结合到沿着烷基链的任何碳原子上的至少一个羟基。
术语“氨基烷基”是指结合到沿着烷基链的任何碳原子上的至少一个伯氨基或仲氨基基团。
术语“烷氧基烷基”是指结合到沿着烷基链的任何碳原子上的至少一个烷氧基基团。
术语“聚烷氧基烷基”是指长链烷氧基化合物并且包括不连续的或单分散尺寸的聚乙二醇类。
术语“硫代烷基”是指结合到沿着烷基链的任何碳原子上的至少一个硫基。硫基可处于任何氧化状态并且包括亚砜、砜和硫酸盐。
术语“羧基烷基”是指结合到沿着烷基链的任何碳原子上的至少一个羧酸基。术语“羧酸基”包括羧酸和烷基、环烷基、芳基或芳烷基羧酸酯。
术语“烷基羰基”是指具有结合到沿着烷基链的任何碳原子上的羰基基团的基团。术语“杂芳基”指5-至7-元单环芳环基团或8-至10-元双环芳环基团,其中任何环均可含有选自n、o或s的一至四个杂原子,其中氮和硫原子可以任何允许的氧化状态存在。示例包括苯并咪唑基、苯并噻唑基、苯并噻吩基、苯并
术语“杂芳烷基”是指c1-6烷基基团,其具有杂芳基取代基。示例包括呋喃基乙基和2-喹啉基丙基。
除非另外指明,否则术语“烷氧基”指具有与氧原子结合的至多12个碳原子的直链或支链基团。示例包括甲氧基、乙氧基、丙氧基、异丙氧基和丁氧基。
术语“芳基”是指单环或二环芳族环基团,其环中包含6至12个碳。烷基取代基可任选地存在于环上。示例包括苯基、联苯基和萘。
术语“芳烷基”是指c1-6烷基基团,其包含芳基取代基。示例包括苄基、苯乙基或2-萘基甲基。
术语“杂芳烷基”是指c1-6烷基基团,其包含杂芳基取代基。示例包括呋喃基甲基和吡啶基丙基。
术语“芳氧基”是指结合到芳基取代基上的氧原子。示例包括苯氧基和苄氧基。
术语“芳基烷氧基”是指结合到芳基取代基上的烷氧基基团。示例包括苯基甲醚。
术语“酰基”是指基团-c(o)ra,其中ra为烷基、芳基、芳烷基、杂芳基和杂芳烷基。“酰化剂”将-c(o)ra基团加到分子上。
术语“磺酰基”是指基团-s(o)2ra,其中ra为氢、烷基、环烷基、卤代烷基、芳基、芳烷基、杂芳基和杂芳烷基。“磺酰化剂”将-s(o)2ra基团加到分子上。
可通过广泛多种方法制备带有活性官能连接基团的间隔,该连接基团用于连接半抗原与载体部分。间隔可使用不同功能的分子形成,或者用在任一端的基团活化以允许与半抗原和载体选择性的顺序反应,但是也可在两端使用相同的反应性部分。选择用于与半抗原和官能连接基团反应以结合到载体上的基团通过半抗原和半抗原将结合的载体的功能类型确定。间隔以及连接至半抗原和载体的方法包括但不限于下述的那些:brinkley,m.,a.,bioconjugatechem.1992,3:2-13,hermanson,gregt.,bioconjugatetechniques,.academicpress,london,amsterdam,burlington,ma,usa,2008和thermoscientificpiercecrosslinkingtechnicalhandbook;可下载自或从thermoscientific3747nmeridianrd,rockford,ilusa61101,ph800-874-3723或在:http://www.piercenet.com/获得复印文本及其中的参考文献。用于形成间隔基团的许多差异活化的分子可从供应商例如thermoscientific商购获得。
对于带有氨基基团的半抗原,连接间隔与半抗原的模式包括半抗原上的氨基与带有酰基卤或活性酯的间隔构件反应。“活性酯”定义为在温和条件下与亲核基团例如氨基基团发生反应以形成稳定键的酯。稳定键定义为在进一步使用的条件下(例如后续的合成步骤,用作免疫原,或用于生物化学分析)保持完整的键。稳定键的优选示例是酰胺键。活性酯及形成方法描述于benoiton,n.l.,houben-weyl,methodsoforganicchemistry,thiemestuttgart,newyork,vole22section3.2:443和benoiton,n.l.,chemistryofpeptidesynthesis,taylorandfrancis,ny,2006。优选的活性酯包括对-硝基苯酯(pnp)、n-羟基琥珀酰亚胺酯(nhs)和四氟苯基酯(tfp)。酰基卤可通过本领域技术人员已知的多种方法制备,例如羧酸与亚硫酰氯或草酰氯的反应,参见:fieser,l.f.和fieser,m.reagentsfororganicsynthesis,johnwileyandsons,ny,1967以及其中的参考文献。这些可转化成其它活性酯诸如对-硝基苯酯(pnp),其也可用于活性双-功能间隔,如wu等人,organicletters,2004,6(24):4407所述。n-羟基琥珀酰亚胺(nhs)酯可通过在有机碱诸如三乙胺或二异丙基乙胺存在下n,n-二琥珀酰亚胺基碳酸酯(cas74124-79-1)与羧酸化合物的反应制备,该反应在非质子溶剂中,在无水条件下进行,如wo2012012595的实例35中所描述,或者通过使用n-羟基琥珀酰亚胺和二环己基碳二亚胺(dcc)或其它脱水剂在无水条件下进行制备。四氟苯基酯(tfp)可通过在有机碱诸如三乙胺或二异丙基乙胺存在下羧酸与2,3,5,6-四氟苯基三氟乙酸的反应制备,该反应在非质子溶剂中,在无水条件下进行,如wilbur等人,bioconjugatechem.,2004,15(1):203中所报道。本领域技术人员将认识到,表1所示的间隔等等能够使用已知的方法获得并利用常规优化的反应条件连接到带有氨基的半抗原上。这些间隔允许将半抗原连接到载体上的硫醇基团。
表1:
在偶联剂的存在下直接偶联半抗原上的胺和间隔构件上的羧酸官能团也可用作一种连接模式。优选的试剂是那些通常用于肽合成的试剂。肽偶联试剂包括但不限于o-(苯并三唑-1-基)-n,n,n',n'-四甲基脲四氟硼酸盐(tbtu,cas#125700-67-6),参见:pruhs,s.,org.process.res.dev.2006,10:441;n-羟基苯并三唑(hobt,cas#2592-95-2)与碳二亚胺脱水剂,例如n-n-二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dic)、或1-乙基-3(3-二甲氨基丙基)碳二亚胺盐酸盐(edc),参见:
表2:
间隔也可以通过顺序连接合适的化学基团到半抗原上的逐步方式构造,包括形成能够结合至载体的官能连接基团的步骤。参见一般反应方案中的例示性实例。
另外,当半抗原具有亲核基团,例如硫醇基团时,氨基基团或羟基将变为连接间隔的点,间隔也可通过硫醇、胺或羟基的烷化反应构造。用能够经历取代反应的部分进行适当取代的任何烷基基团,例如卤代烷或磺酸酯诸如对甲苯磺酸酯,可用于连接间隔。烷化反应的许多示例是本领域技术人员已知的,并且具体示例可见于一般化学文献并通过常规实验优化。烷化反应的讨论及许多参考文献可见于三月的advancedorganicchemistry,第10章,smith,m.b.,和march,j.,johnwiley&sons,inc.ny,2001。也可使用其它键,例如亲核部分例如半抗原上的胺与异氰酸酯形成脲的反应,或与异硫氰酸酯形成硫脲键的反应,参见:li,z.等人,phosphorus,sulfurandsiliconandtherelatedelements,2003,178(2):293-297。间隔可经由与异氰酸酯基团形成氨基甲酸酯或氨基甲酸酯键的反应连接到带有羟基的半抗原上。间隔可用在一端上的异氰酸酯官能团和能够与载体反应的官能连接基团进行差异活化,参见:annunziato,m.e.,patel,u.s.,ranade,m.和palumbo,p.s.,bioconjugatechem.,1993,4:212-218。
对于带有羧酸基团的半抗原,连接间隔部分与半抗原的模式包括活化羧酸基团成为酰基卤或活性酯,其示例在表3中示出,其制备方法如前文所述,随后在间隔部分上进行与氨基(-nh2-)、肼基(-nh-nh2-)、脒基(-c(o)-nh-nh2-)或羟基(-oh)的反应以形成酰胺、酰肼、二酰基肼或酯键,或者在间隔部分上直接偶联羧酸基团与氨基基团,或直接在载体上偶联肽偶联试剂和/或碳二亚胺脱水试剂,如前文所述,其示例在表4和表5中示出。存在于前文所引用的参考文献中,用于形成活化酯并使用肽偶联剂的程序可用于利用常规优化的反应条件,连接带有羧酸的半抗原与间隔构件及带有可用氨基基团的蛋白质载体。
表3:
表4:
表5:
其它亲电子基团可存在于半抗原上以连接间隔,例如磺酰卤化物
或亲电子磷基团,例如:
参见:malachowski,williamp.,coward,jamesk.,journaloforganicchemistry,1994,59(25):7616
或:
rc为烷基、环烷基、芳基、取代的芳基、芳烷基。
参见:aliouane,l.等人,tetrahedronletters,2011,52(28):8681。
带有醛或酮基团的半抗原可连接到间隔上,使用的方法包括但不限于与酰肼基团h2n-nh-c(o)-在间隔上形成酰基腙的反应,参见:chamow,s.m.,kogan,t.p.,peers,d.h.,hastings,r.c.,byrn,r.a.和askenaszi,a.,j.biol.chem.,1992,267(22):15916。允许连接至载体上的硫醇基团的双官能酰肼间隔基团的示例在表6中示出。
表6:
半抗原也可包含硫醇基团,其可与载体反应,前提条件是载体已被修饰以提供可与硫醇反应的基团。载体基团可通过以下方法修饰,包括但不限于:通过在载体上的氨基基团与n-马来酰亚胺基乙酸琥珀酰亚胺酯(amas,cas#55750-61-3)、碘乙酸羟基琥珀酰亚胺酯(cas#151199-81-4)、或表1所示的任何双官能间隔基团的反应连接包含马来酰亚胺官能团的基团,该反应导入可发生导致将半抗原连接到载体的反应的基团。
能够形成与载体的化学键的官能连接基团可为能够形成稳定键并且可与载体上的多个不同基团反应的任何基团。官能连接基团可优选地与载体或其衍生物上的氨基基团、羧酸基团或硫醇基团反应。官能连接基团的非限制性示例是羧酸基团、酰基卤、活性酯(如前文所定义)、异氰酸酯、异硫氰酸酯、卤代烷、氨基基团、硫醇基团、马来酰亚胺基团、丙烯酸酯基团(h2c=ch-c(o)-)或乙烯砜基团h2c=ch-so2-)参见:park,j.w.等人,bioconjugatechem.,2012,23(3):350。官能连接基团可作为差异活化的间隔构件的一部分存在,其可逐步与半抗原反应,并且所得的半抗原衍生物可随后与载体反应。另选地,半抗原可用带有前体基团的间隔衍生化,该前体基团可通过后续反应转化成官能连接基团。当间隔上的官能连接基团是胺或羧酸基团时,与载体上的羧酸基团或胺的偶合反应可根据上文引用的参考文献中用于这些试剂的方法,通过利用肽偶联剂直接进行。
特定的二硫化物基团,例如吡啶基二硫化物,可用作间隔上的官能连接基团,其可发生与载体上的硫醇基团的交换,形成混合的二硫键,参见:ghetie,v.等人,bioconjugatechem.,1990,1:24-31。这些间隔可通过带有胺的半抗原与活性酯的反应连接,活性酯连接到带有吡啶基二硫化物基团的间隔上,其示例包括但不限于在表7中示出的那些。
表7
最常见的载体是蛋白质并且赖氨酸残基的ε-氨基可用于连接,连接通过与胺-反应性官能连接基团的反应直接连接,或者在用包含硫醇的基团(包括n-琥珀酰亚胺s-乙酰硫代乙酸酯(sata,cas76931-93-6)或其类似物)衍生化后,随后用羟胺裂解乙酸基团以暴露硫醇基团,用于与半抗原上的官能连接基团反应。硫醇基团也可通过利用温和还原剂还原蛋白质载体内的二硫键被导入载体中,温和还原剂包括但不限于2-巯基乙胺,参见:bilah,m.等人,bioelectrochemistry,2010,80(1):49,膦试剂,参见:kirley,t.l.,analyticalbiochemistry,1989,180(2):231或二硫赤藓糖醇(dtt,cas3483-12-3)cleland,w.,biochemistry,1964,3:480-482。
一般反应方案
本发明的代表性化合物可根据下文所述的一般合成方法合成。式(i)的化合物可通过本领域的技术人员已知的方法制备。以下反应方案仅意在表示本发明的实例且绝不意在限制本发明。
喹硫平的衍生物可通过多种方法制备。在方案1中示出的起始化合物(r1和r2=h),喹硫平中的伯羟基可使用例如琥珀酸酐和如fiedler,h.等人,langmuir,1994,10:3959所述的方法进行酰化。所得的酸可如本公开别处所述进一步官能化或使用任意数量的前述方法(包括在下文实例中示出的那些)直接连接到载体上。
方案1
喹硫平的伯羟基也可根据us20100069356的方法,如方案2所示被烷基化以形成醚,该过程使用卤代烷或磺酸酯诸如4-溴甲基戊酸酯,在四丁基硫酸氢铵和氢氧化钠水溶液的存在下进行,从而提供一种酸,其可如上所述使用。
方案2
方案3
其中r2为ch2nhc(o)(ch2)mco2h的式i的化合物可根据方案3来制备。如实例1所述制备的2-(2-(2-(氨基甲基)-4-(二苯并[b,f][1,4]硫氮杂卓-11-基)哌嗪-1-基)乙氧基)乙醇与环状酸酐化合物诸如琥珀酸酐或戊二酸酐的反应在溶剂诸如吡啶中,在室温至60℃的温度范围内进行约48小时。本领域的技术人员将认识到相同化学可用于产生式i的化合物,其中r1为ch2nhc(o)(ch2)mco2h。
方案4
其中r2为
方案5
其中r1为
方案6
其中r1或r2为
方案7:
其中r1或r2为ch2nhc(o)(ch2)mco2h的羧酸官能化的半抗原可根据方案7所示方法缀合至蛋白质。与n-羟基琥珀酰亚胺和合适的偶联剂诸如二环己基碳二亚胺及碱诸如三丁胺在溶剂诸如dmf中,在约20℃的温度下反应约18小时,用羟基吡咯烷-2,5-二酮离去基团活化羧酸。活化的连接基和半抗原随后可在溶剂诸如ph7.5的磷酸盐缓冲液中,在约20℃下约2.5小时以缀合至蛋白质。合适的蛋白质是本领域技术人员已知的并且包括钥孔
抗体制备
上述缀合物可用于制备结合安定药物的抗体,该抗体由安定药物(喹硫平)产生。这些抗体可用于分析以检测患者样本中安定药物的存在和/或量。此种检测允许治疗药物监测,具有它的所有有益效果。安定药物的水平检测可用于多个目的,包括:与其它安定药物的检测结合的检测,包括选自利培酮、帕潘立酮、阿立哌唑、奥氮平、以及它们的代谢物的那些,此种检测允许同时测量这些安定药物;测定对医嘱治疗的患者依从性或服从性;用作一种决定工具,该工具用于确定患者是否应从口服安定药方案转变为长效注射安定药方案;用作一种决定工具,该工具用于确定是否口服或注射安定药的剂量水平或给药间隔应提高或降低以确保达到或保持有效药物水平或安全药物水平;通过提供达到最低pk水平的证据,用于帮助启动安定药物治疗;用于测定安定药物在多个制剂中或来自多个来源的生物等效性;用于评估复方用药和潜在药物-药物交互作用的影响;以及用作患者应被排除在临床试验外或包括在临床试验中的指示,并且作为后续监测对临床试验药物需求依从性的辅助手段。
已经提供了本主题发明的缀合物,其包含本文的化合物和免疫原性载体,能够产生抗体,例如多克隆、单克隆、嵌合、和人源化抗体,它们结合至安定药物。具体设想的此类抗体包括单克隆和多克隆抗体以及它们的片段,例如重组蛋白,它们包含抗原结合结构域和/或这些抗体的一个或多个互补决定区。优选地,抗体将结合至药物以及任何期望的药理学上活性的代谢物。通过改变免疫原性载体在药物缀合物中的连接位置,可将选择性和与代谢物和/或相关药物的交叉反应性工程化到抗体中。对于喹硫平,可期望或可不期望与喹硫平代谢物如n-去甲基喹硫平(norquetiapine)、喹硫平亚砜、o-去甲基喹硫平或7-羟基喹硫平的交叉反应性。可生成检测这些药物和/或代谢物中的多个的抗体,或者可生成单独检测每种药物的抗体(因此限定抗体“特异性结合”的特性)。当抗体与一种或多种化合物的结合是克分子数相等的或基本上克分子数相等的时,抗体特异性地结合一种或多种化合物。
制备此类抗体的方法包括用本发明的缀合物(成为免疫原的化合物和免疫原性载体)具体特征结构接种宿主。合适的宿主包括但不限于小鼠、大鼠、仓鼠、豚鼠、兔子、鸡、驴、马、猴子、黑猩猩、猩猩、大猩猩、人、和能够发生成熟免疫应答的任何物种。免疫方法在本领域完全建立并在多个文献和出版物中示出,包括“theimmunoassayhandbook”,第2版,由davidwild编辑(naturepublishinggroup,2000),及其引用的参考文献。
优选地,本发明的免疫原具体特征结构与辅助剂结合施用给宿主受试者,例如动物或人。合适的辅助剂包括但不限于freund辅助剂、粉末状氢氧化铝(矾)、带有百日咳博代氏杆菌(bordetellapertussis)的氢氧化铝、和单磷酰脂质a-合成海藻糖双白喉菌酸酯(mpl-tdm)。
多克隆抗体可在哺乳动物宿主中通过一次或多次免疫原注射生成,免疫原能够任选地与辅助剂一起施用。通常通过一次或多次皮下注射或腹膜内注射将免疫原或免疫原与辅助剂的组合注入哺乳动物宿主中。优选地,免疫程序进行至少一周,还更优选地,进行两周或更长时间。这样产生的多克隆抗体可分离并用本领域熟知的方法纯化。
单克隆抗体可通过已广泛建立的kohler和milstein杂交瘤方法制备,例如nature256:495-497(1975)。杂交瘤方法通常涉及免疫宿主或来自宿主的淋巴细胞,收获分泌单克隆抗体或具有分泌潜力的淋巴细胞,将淋巴细胞与无限增殖化细胞融合,并且选择分泌期望的单克隆抗体的细胞。
宿主能够被免疫以生成产生或能够产生免疫原特异性抗体的淋巴细胞。另选地,淋巴细胞能够进行体外免疫。如果期望人类细胞,可使用外周血淋巴细胞,但是优选来自其它哺乳动物来源的脾细胞或淋巴细胞。
淋巴细胞能够与无限增殖化细胞系融合以形成杂交瘤细胞,这是一种可通过利用融合剂如聚乙二醇促进的方法。通过例证的方式,可使用通过转化来无限增殖化的突变型啮齿动物、牛、或人骨髓瘤细胞。基本上优选杂交瘤细胞的纯群体,其相对于未融合的无限增殖化细胞。因此,在融合后,细胞可在合适的培养基中生长,该培养基抑制未融合的无限增殖化细胞的生长或存活,例如通过利用缺乏次黄嘌呤鸟嘌呤磷酸核糖转移酶(hgprt)的突变骨髓瘤细胞达到这一目的。在这一示例中,可将次黄嘌呤、氨喋呤、和胸腺嘧啶核苷加入培养基(hat培养基)以阻止hgprt-缺失细胞的生长,同时允许杂交瘤生长。
优选地,有效融合的无限增殖化细胞可通过在培养基诸如hat中选择而分离自混合群体,并且在融合后维持稳定的和高水平的抗体表达。优选的无限增殖化细胞系包括骨髓瘤细胞系,其购自美国典型培养物保藏中心(americantypeculturecollection,manassas,va)。
因为杂交瘤细胞通常在细胞外分泌抗体,可分析培养基是否存在安定药物特异性的单克隆抗体。体外结合测定例如放射性免疫测定(ria)或酶联免疫吸附测定(elisa)的免疫沉淀可用于测量单克隆抗体的结合特异性。
通过有限稀释法和传代培养,可分离分泌单克隆抗体的杂交瘤细胞作为单克隆。合适的培养基包括但不限于达尔伯克改良伊格尔培养基(dulbecco'smodifiedeagle'smedium)、rpmi-1640、和无多肽的、多肽减量的、或无血清的培养基,例如ultradomapf或hl-1,它们购自biowhittaker,walkersville,md。另选地,杂交瘤细胞可体内生长为腹水。
单克隆抗体可通过常规免疫球蛋白(ig)纯化方法分离自和/或纯化自培养基或腹水,所述方法包括但不限于多肽a-sepharose、羟磷灰石色谱法、凝胶电泳、渗析、硫酸铵沉淀、以及亲和色谱法。
单克隆抗体也可通过重组方法制备,例如在美国专利4,166,452中描述的方法。dna编码单克隆抗体也可使用常规方法进行分离和测序,例如使用寡核苷酸探针,其特异性结合至鼠重抗体链和轻抗体链基因,优选地结合至分离自单克隆抗体杂交瘤细胞系的探针dna,该细胞系分泌安定药物特异性的抗体。
免疫测定
因此产生的抗体可用于免疫测定以识别/结合至安定药物,从而检测患者样本中药物的存在和/或量。优选地,测定模式是竞争性免疫测定模式。此种测定模式和其它测定描述于(除了别处以外)hampton等人(serologicalmethods,alaboratorymanual,apspress,st.paul,mn1990)和maddox等人(j.exp.med.158:12111,1983)中。
也可提供试剂盒,其包含如上所述的抗体。代表性的试剂盒可包含结合至安定药物喹硫平的抗体、包含偶联到标签部分的安定药物或其衍生物的类似物的复合物、并且也可任选地包含一种或多种校准物质,该校准物质包含已知量的安定药物或相关的标准品。
如上所述,试剂盒可包含校准物质和/或对照物质,它们包含已知量的待测量的分析物。分析物的浓度可通过比较获得的样本结果与获得的标准品的结果进行计算。可绘制校准曲线并用于关联结果组以及用于测定样本中分析物的浓度。
任何怀疑包含分析物例如安定药物的样本可根据目前优选的实施例的方法进行测定。如果需要,可预处理样本,并且可在不干扰测定的任何方便的介质中制备。优选地,样本包含含水介质诸如来自宿主的体液,最优选血浆或血清。
共同未决的专利申请名称为“haptensofaripiprazole”(代理人案卷号prd3265uspsp,第一发明人:remmerie),“haptensofolanzapine”(代理人案卷号prd3266uspsp,第一发明人:remmerie),“haptensofpaliperidone”(代理人案卷号prd3267uspsp,第一发明人:remmerie),“haptensofquetiapine”(代理人案卷号prd3268uspsp,第一发明人:remmerie),“haptensofrisperidoneandpaliperidone”(代理人案卷号prd3269uspsp,第一发明人:remmerie),“antibodiestoaripiprazolehaptensandusethereof”(代理人案卷号cds5128uspsp,第一发明人:hryhorenko),“antibodiestoolanzapinehaptensandusethereof”(代理人案卷号cds5132uspsp,第一发明人:hryhorenko),“antibodiestopaliperidonehaptensandusethereof”(代理人案卷号cds5126uspsp,第一发明人:hryhorenko),“antibodiestoquetiapinehaptensandusethereof”(代理人案卷号cds5134uspsp,第一发明人:hryhorenko),“antibodiestorisperidonehaptensandusethereof”(代理人案卷号cds5130uspsp,第一发明人:hryhorenko),“antibodiestoaripiprazoleandusethereof”(代理人案卷号cds5129uspsp,第一发明人:hryhorenko),“antibodiestoolanzapineandusethereof”(代理人案卷号cds5133uspsp,第一发明人:hryhorenko),“antibodiestopaliperidoneandusethereof”(代理人案卷号cds5127uspsp,第一发明人:hryhorenko),“antibodiestoquetiapineandusethereof”(代理人案卷号cds5135uspsp,第一发明人:hryhorenko),“antibodiestorisperidoneandusethereof”(代理人案卷号cds5131uspsp,第一发明人:hryhorenko),所有与其同时提交的专利申请均全文以引用方式并入本文中。
实例
本发明的代表性化合物可根据下文所述的一般合成方法合成。式(i)的化合物可通过本领域的技术人员已知的方法制备。以下实例仅意在表示本发明的实例且绝不意在限制本发明。
实例1
2-(2-(2-(氨基甲基)-4-(二苯并[b,f][1,4]硫氮杂卓-11-基)哌嗪-1-基)乙氧基)乙醇
步骤a
哌嗪-2-甲腈
四氢呋喃(300ml)和乙二胺(108.2g)在30℃下的搅拌溶液经2小时滴加2-氯丙烯腈(105.0g)进行处理,并且在30℃下搅拌另外的6小时。将反应混合物冷却至20℃并形成沉淀。反应经过滤,并且滤液通过加入35%盐酸调节ph至4。通过过滤收集所得沉淀。合并的沉淀溶解在20%盐酸溶液中,并且随后倾注到thf溶液中以沉淀目标化合物,其经减压干燥并用于下一反应,无需另外纯化。1hnmr:(d2o,400mhz):δ(ppm)5.00-4.97(m,1h),3.79(d,j=4.8hz,2h),3.62-3.44(m,4h)。
步骤b
叔-丁基3-氰基哌嗪-1-羧酸酯
向如之前步骤所述制备的化合物哌嗪-2-甲腈(90.6g,0.492摩尔)的溶液加入三乙胺(206ml,1.476摩尔)和boc2o(117g,0.542摩尔)。在室温下搅拌反应混合物过夜,并且随后浓缩。残余通过硅胶色谱法纯化以提供目标化合物。1hnmr:(cdcl3,400mhz):δ(ppm)4.06-3.91(m,3h),3.28-2.83(m,4h),1.47(s,9h)。
步骤c
叔丁基3-氰基-4-(2-(2-羟基乙氧基)乙基)哌嗪-1-羧酸酯
如之前步骤所述制备的叔丁基3-氰基哌嗪-1羧酸酯的(10g,0.047摩尔)和2-(2-羟基乙氧基)乙醛(14.8g)(参见:bodin,a.,contactdermatitis,2001,44:207)在二氯甲烷中的溶液用甲酸(12.7g)处理,并且在室温下搅拌反应混合物过夜。分批加入氰基硼氢化钠(7.2g,0.118摩尔)。在室温下将反应混合物搅拌3小时,随后加入水并用二氯甲烷提取。有机层用盐水洗涤,在硫酸钠上干燥、过滤、并且浓缩。粗产物通过柱层析纯化以提供产物。
1hnmr:(cdcl3,400mhz):δ(ppm)4.15(s,1h),3.69-3.63(m,4h),3.58(d,j=4.4hz,2h),3.47-3.44(m,4h),2.61(d,j=5.2hz,2h),2.51-2.48(m,4h),1.43(s,9h)。
步骤d
叔丁基3-(氨基甲基)-4-(2-(2-羟基乙氧基)乙基)哌嗪-1-羧酸酯
向如之前步骤所述制备的叔丁基3-氰基-4-(2-(2-羟基乙氧基)乙基)哌嗪-1羧酸酯(9.9g,33.1毫摩尔)在甲醇(20ml)中的溶液加入raneyni(15g)。在氢气氛(50psi)下,在室温下搅拌反应溶液过夜。过滤并浓缩混合物以提供产物,其用于下一步骤,无需另外纯化。
esi-ms(m+1):304计算为c14h29n3o4303。
步骤e
叔丁基4-(2-(2-羟基乙氧基)乙基)-3-((2,2,2-三氟乙酰氨基)甲基)哌嗪-1-羧酸酯
向如之前步骤所述制备的叔丁基3-(氨基甲基)-4-(2-(2-羟基乙氧基)乙基)哌嗪-1羧酸酯(8.8g)在二氯甲烷(100ml)中的溶液加入三乙胺(8.8g,87.0毫摩尔)和三氟乙酸酐(6.1g,29.0毫摩尔)。在室温下将反应混合物搅拌12小时,用二氯甲烷稀释并用水洗涤。有机层用盐水洗涤,在硫酸钠上干燥、过滤、并浓缩以提供粗产物,其通过柱层析纯化以提供目标化合物。
esi-ms(m+1):400计算为c16h28f3n3o5399。
步骤f
2,2,2-三氟-n-((1-(2-(2-羟基乙氧基)乙基)哌嗪-2-基)甲基)乙酰胺
如之前步骤所述制备的叔丁基4-(2-(2-羟基乙氧基)乙基)-3-((2,2,2-三氟乙酰氨基)甲基)哌嗪-1羧酸酯(8.6g,粗制)在氯化氢甲醇(20ml)中的溶液在室温下搅拌1小时,随后浓缩以提供目标化合物,其使用无需进一步纯化。esi-ms(m+1):300计算为c11h20f3n3o3299。
步骤g
2-((2-硝基苯基)硫代)苯甲酸
在室温下向2-巯基-苯甲酸(30g,0.195摩尔)在异丙醇(500ml)中的溶液加入1-氟-2-硝基-苯(30.2g,0.214摩尔)、水(100ml)和氢氧化钾(31.1g,0.555摩尔)。在室温下将反应混合物搅拌过夜,用水猝灭并用乙酸乙酯稀释。水相用乙酸乙酯(3×400ml)提取并且合并的有机提取物用饱和氯化钠水溶液(500ml)洗涤,在硫酸镁上干燥、过滤、并且浓缩。粗制残余通过在硅胶上的快速柱层析纯化以提供目标化合物。esi-ms(m+1):276计算为c13h9no4s275。1hnmr:(cdcl3,400mhz):δ(ppm)8.12-8.07(m,2h),7.54-7.43(m,2h),7.42-7.39(m,2h),7.35-7.31(m,1h),7.12-7.09(m,1h)。
步骤h
2-((2-氨基苯基)硫代)苯甲酸
向如之前步骤所述制备的2-((2-硝基苯基)硫代)苯甲酸(43.3g,0.157摩尔)在乙酸乙酯(500ml)中的溶液加入pd/c(8g)。在氢气气氛下,在室温下搅拌反应溶液过夜。过滤并浓缩混合物以提供目标化合物。esi-ms(m+1):246计算为c13h11no2s245。1hnmr:(cdcl3,400mhz):δ(ppm)8.20-8.17(m,1h),7.51-7.48(m,1h),7.36-7.30(m,2h),7.21-7.17(m,1h),6.88-6.80(m,3h)。
步骤i
二苯并[b,f][1,4]硫氮杂卓-11(10h)-酮
向如之前步骤所述制备的2-((2-氨基苯基)硫代)苯甲酸(30g,0.122摩尔)在二氯甲烷(300ml)中的溶液加入edci(35.2g,0.183摩尔)、三乙胺(51ml,0.366摩尔)和hobt(24.7g,0.183摩尔)。反应混合物在室温下搅拌12小时,用1maq.hcl、饱和碳酸氢钠水溶液、饱和氯化钠水溶液洗涤,并且在mgso4上干燥。溶液经过滤、浓缩、以及通过柱层析纯化以提供目标化合物。esi-ms(m+1):228计算为c13h9nos227.1hnmr:(cdcl3,400mhz):δ(ppm)7.70-7.67(m,1h),7.58-7.52(m,2h),7.50-7.42(m,2h),7.39-7.35(m,1h),7.24-7.22(m,1h),7.17-7.13(m,1h)。
步骤j
11-氯代二苯并[b,f][1,4]硫氮杂卓
将如之前步骤所述制备的二苯并[b,f][1,4]硫氮杂卓-11(10h)-酮(14.6g,64毫摩尔)在三氯氧磷(20ml)中的溶液加热回流2小时。浓缩混合物以提供粗产物,其直接使用,无需进一步纯化。esi-ms(m+1):246计算为c13h8clns245。
步骤k
n-((4-(二苯并[b,f][1,4]硫氮杂卓-11-基)-1-(2-(2-羟基乙氧基)乙基)哌嗪-2-基)甲基)-2,2,2-三氟乙酰胺
向如之前步骤所述制备的11-氯代二苯并[b,f][1,4]硫氮杂卓(2g,粗制)在二氧杂环己烷(20ml)中的溶液加入pd2(dba)3(327mg,0.357毫摩尔)、binap(225mg,0.357毫摩尔)、三乙胺(6ml,42.9毫摩尔)和如步骤f所述制备的2,2,2-三氟-n-((1-(2-(2-羟基乙氧基)乙基)哌嗪-2-基)甲基)乙酰胺(2.4g,粗制)。在氮气氛下加热所得的混合物以回流过夜,通过celitetm过滤,并且浓缩。残余通过硅胶色谱法纯化以提供目标化合物。esi-ms(m+1):509计算为c24h27f3n4o3s508。
步骤l
2-(2-(2-(氨基甲基)-4-(二苯并[b,f][1,4]硫氮杂卓-11-基)哌嗪-1-基)乙氧基)乙醇
将如之前步骤所述制备的n-((4-(二苯并[b,f][1,4]硫氮杂卓-11-基)-1-(2-(2-羟基乙氧基)乙基)哌嗪-2-基)甲基)-2,2,2-三氟乙酰胺(2.0g)和碳酸钾水溶液(5%)(15ml)在甲醇(20ml)中的混合物在室温下搅拌18小时并用乙酸乙酯提取。有机层用饱和氯化钠水溶液洗涤,在硫酸钠上干燥、过滤、蒸发以提供粗产物,其通过柱层析纯化,并且随后通过制备型hplc以提供为黄色固体的目标化合物。esi-ms(m+1):413计算为c22h28n4o2s412。1hnmr:(cdcl3,400mhz):δ(ppm)7.52-7.50(m,1h),7.41-7.31(m,4h),7.17-7.12(m,1h),7.02-7.00(m,1h),6.89-6.84(m,1h),3.66-3.59(m,5h),3.54-3.51(m,2h),3.49-3.38(m,1h),3.19-3.12(m,1h),3.03-2.88(m,2h),2.79-2.53(m,5h)。
实例2
n-((4-(二苯并[b,f][1,4]硫氮杂卓-11-基)-1-(2-(2-羟基乙氧基)乙基)哌嗪-2-基)甲基)-2-(2,5-二氧-2,5-二氢-1h-吡咯-1-基)乙酰胺
向如实例1所述制备的2-(2-(2-(氨基甲基)-4-(二苯并[b,f][1,4]硫氮杂卓-11-基)哌嗪-1-基)乙氧基)乙醇(7.8mg,19.0微摩尔)在410μldmf和8.9μl三丁胺中的溶液加入480μln-(α-马来酰亚胺基乙酸)琥珀酰亚胺酯(amas,10mg/ml,4.8mg,19.0微摩尔)的dmf溶液。所得的溶液在20℃下搅拌60分钟,随后原样用于与硫醇活化蛋白质的缀合反应。
实例3
2-{2-[4-(3-氨基甲基-二苯并[b,f][1,4]硫氮杂卓-11-基)-哌嗪-1-基]-乙氧基}-乙醇
步骤a
11-氧代-10,11-二氢二苯并[b,f][1,4]硫氮杂卓-3-羧酸
将2-氨基-苯基硫醇(1.34ml,12.5毫摩尔)、2-溴代-对苯二甲酸(1.54g,6.3毫摩尔)、氧化亚铜(0.50g,3.5毫摩尔)、喹啉(6.3ml)、和吡啶(0.63ml)的混合物在180℃油浴中,在氮气下加热20小时,随后冷却至室温。缓慢加入浓盐酸(20ml),同时在冷水中搅拌冷却。过滤所得沉淀,用水洗涤,并干燥以提供粗制目标化合物(2g)。lc-ms:m/z270(m-1)。
步骤b
11-氯-二苯并[b,f][1,4]硫氮杂卓-3-碳酰氯
向如之前步骤所述制备的11-氧代-10,11-二氢二苯并[b,f][1,4]硫氮杂卓-3-羧酸(0.41g)在甲苯(6.5ml)中的悬浮液加入dmf(0.125ml)和亚硫酰氯(6.5ml)。在80℃油浴中,在氮气下加热混合物过夜。浓缩所得的溶液至干燥。粗产物用于下一步骤。
步骤c
11-氯-二苯并[b,f][1,4]硫氮杂卓-3-羧酸酰胺
如之前步骤所述制备的11-氯代-二苯并[b,f][1,4]硫氮杂卓-3-碳酰氯(大约1.5毫摩尔)在二氯甲烷(10ml)中的溶液用氨的1,4-二氧戊环溶液(0.5m,9ml)在冰浴中处理。所得的悬浮液在室温下搅拌1小时,并且反应用水猝灭(10ml)。过滤所得的沉淀,用水和二氯甲烷洗涤,并且干燥。滤液的有机层用饱和碳酸氢钠水溶液洗涤并浓缩至附加的灰白色产物,其用于下一步骤,无需另外纯化。lc-ms:m/z289(m+1)。1hnmr(dmso-d6,400mhz):δ(ppm)8.19(br,1h),8.00-7.96(m,2h),7.90(d,1h),7.64(br,1h),7.56(m,1h),7.47(m,1h),7.31(m,2h)。
步骤d
11-{4-[2-(2-羟基-乙氧基)-乙基]-哌嗪-1-基}-二苯并[b,f][1,4]硫氮杂卓-3-羧酸酰胺
向如之前步骤所述制备的11-氯代-二苯并[b,f][1,4]硫氮杂卓-3-羧酸酰胺(0.40g)在dmf(1.5ml)和甲苯(1.5ml)中的溶液加入2-(2-哌嗪-1-基-乙氧基)-乙醇(0.50g,2.9毫摩尔)。溶液在110℃油浴中,在氮气下加热5小时、浓缩、并且纯化(硅胶,包含2-5%甲醇-二氯甲烷的氨洗脱液)以提供为灰白色固体的目标化合物。lc-ms:m/z427(m+1)。
步骤e
2-{2-[4-(3-氨基甲基-二苯并[b,f][1,4]硫氮杂卓-11-基)-哌嗪-1-基]-乙氧基}-乙醇
向如之前步骤所述制备的2-{2-[4-(3-氨基甲基-二苯并[b,f][1,4]硫氮杂卓-11-基)-哌嗪-1-基]-乙氧基}-乙醇(0.24g,0.56毫摩尔)在thf(15ml)中的溶液加入1m氢化铝锂thf溶液(6ml,6毫摩尔)。在70℃油浴中,在氮气下加热白色悬浮液2小时。在冰浴条件下缓慢加入饱和硫酸钠水溶液以猝灭反应悬浮液。分离溶液相,并且固体用thf(5×10ml)提取。合并的有机相经浓缩和纯化(硅胶,包含2-5%甲醇-二氯甲烷的氨洗脱液)以提供为灰白色固体的目标化合物。lc-ms:m/z413(m+1)。1hnmr(cdcl3,400mhz)δ(ppm)7.47(s,1h),7.38(m,1h),7.26(m,2h,与溶剂重叠),7.17(m,1h),7.06(m,1h),6.88(m,1h),3.85(s,2h),3.76-3.46(m,11h,包含可交换质子),2.66-2.57(m,8h)。
实例4
2-(2,5-二氧-2,5-二氢-1h-吡咯-1-基)-n-((11-(4-(2-(2-羟基乙氧基)乙基)哌嗪-1-基)二苯并[b,f][1,4]硫氮杂卓-3-基)甲基)乙酰胺
向如实例3所述制备的2-{2-[4-(3-氨基甲基-二苯并[b,f][1,4]硫氮杂卓-11-基)-哌嗪-1-基]-乙氧基}-乙醇(5.6mg,13.6微摩尔)在295μldmf和6.4μl三丁胺中的溶液加入340μln-(α-马来酰亚胺基乙酸)琥珀酰亚胺酯(amas,10mg/ml,3.4mg,13.6微摩尔)的dmf溶液。所得的溶液在20℃下搅拌60分钟,随后用于与硫醇活化蛋白质发生缀合反应。
实例5
n-((4-(二苯并[b,f][1,4]硫氮杂卓-11-基)-1-(2-(2-羟基乙氧基)乙基)哌嗪-2-基)甲基)-2-(2,5-二氧-2,5-二氢-1h-吡咯-1-基)乙酰胺-牛甲状腺球蛋白-缀合物
步骤a
牛甲状腺球蛋白(btg)与sata反应:
向3.0ml牛甲状腺球蛋白(btg,20.0mg,0.03微摩尔)在100mm磷酸盐缓冲液(ph7.5)中的溶液加入276.0μln-琥珀酰亚胺-s-乙酰硫代乙酸酯(sata,25mg/ml,6.9mg,30.0微摩尔)的dmf溶液。所得的溶液在20℃下辊式搅拌器上温育1小时。反应在sephadexg-25柱上,使用100mm磷酸盐缓冲液,5mmedta,在ph6.0下纯化。向6.0mlbtg-sata(18.0mg,0.027微摩尔)加入600μl2.5m羟胺,50mmedta,ph7.0。所得的溶液在20℃下辊式搅拌器上温育1小时。
步骤b
如之前步骤所述制备的btg-sh溶液的等分试样(6.6ml,0.027微摩尔)加入在实例2中制备的溶液的等分试样(898.9μl,19.0微摩尔)。所得的浑浊混合物在20℃下辊式搅拌器上温育3小时。反应通过0.45μm注射器式过滤器过滤,随后在sephadexg-25柱上使用100mm磷酸盐缓冲液,0.14m氯化钠在ph7.4下纯化。
实例6
2-(2,5-二氧-2,5-二氢-1h-吡咯-1-基)-n-((11-(4-(2-(2-羟基乙氧基)乙基)哌嗪-1-基)二苯并[b,f][1,4]硫氮杂卓-3-基)甲基)乙酰胺-牛甲状腺球蛋白-缀合物
向如实例5,步骤a所述制备的btg-sh溶液的等分试样(3.4ml,0.014微摩尔)加入如实例4所述制备的641.4μl2-(2,5-二氧-2,5-二氢-1h-吡咯-1-基)-n-((11-(4-(2-(2-羟基乙氧基)乙基)哌嗪-1-基)二苯并[b,f][1,4]硫氮杂卓-3-基)甲基)乙酰胺(13.6微摩尔)。所得的浑浊混合物在20℃下辊式搅拌器上温育3小时。反应在sephadexg-25柱上,使用100mm磷酸盐缓冲液,0.14m氯化钠,在ph7.4下纯化。
实例7
n-((4-(二苯并[b,f][1,4]硫氮杂卓-11-基)-1-(2-(2-羟基乙氧基)乙基)哌嗪-2-基)甲基)-2-(2,5-二氧-2,5-二氢-1h-吡咯-1-基)乙酰胺-钥孔
步骤a
钥孔
向3.18ml钥孔
步骤b
如之前步骤所述制备的klh-sh溶液的等分试样(6.9ml,0.133微摩尔)加入在实例2中制备的溶液的等分试样(624.3μl,13.3微摩尔)。所得的浑浊混合物在20℃下辊式搅拌器上温育3小时。反应通过0.45μm注射器式过滤器过滤,随后在sephadexg-25柱上使用100mm磷酸盐缓冲液,0.46m氯化钠在ph7.4下纯化。
实例8
2-(2,5-二氧-2,5-二氢-1h-吡咯-1-基)-n-((11-(4-(2-(2-羟基乙氧基)乙基)哌嗪-1-基)二苯并[b,f][1,4]硫氮杂卓-3-基)甲基)乙酰胺-钥孔
如实例7,步骤a所述制备的klh-sh溶液的等分试样(3.2ml,0.061微摩尔)加入在实例4中制备的溶液的等分试样(283.0μl,6.10微摩尔)。所得的浑浊混合物在20℃下辊式搅拌器上温育3小时。反应在sephadexg-25柱上,使用100mm磷酸盐缓冲液,0.46m氯化钠,在ph7.4下纯化。
实例9
喹硫平的竞争性免疫测定
在用喹硫平免疫原进行一系列免疫后,使用elisa测试小鼠尾巴血液的反应性。也测试杂交瘤上清液,并且如下表1和2所示的elisa数据示出几种杂交瘤的反应性(融合伴侣是nso细胞)。
表1:
表2:
随后通过竞争elisa测试上清液以确定信号是否是喹硫平特异性的。图1和2示出来自代表性杂交瘤的结果。数据示出对喹硫平的特定反应性。
图3示出在侧流测定装置上使用的竞争性免疫测定模式,其中捕获抗体喹硫平克隆连同包含缀合至荧光基团上的喹硫平的检测缀合物一起沉积于芯片上。在如图3所示的这种竞争性模式中,低水平的分析物(喹硫平)导致高信号,而高水平的分析物(喹硫平)导致低信号。样本中的喹硫平的量能够根据与不存在药物的对照样本相比的荧光损耗进行计算。图4示出喹硫平亚克隆89-3、89-13、和89-5产生的典型剂量响应曲线。
- 还没有人留言评论。精彩留言会获得点赞!