抗病毒化合物的合成的制作方法
本申请为国际申请pct/us2013/044148进入中国国家阶段的中国专利申请(申请号为201380029806.7,申请日为2013年6月4日,发明名称为“抗病毒化合物的合成”)的分案申请。
相关申请的交叉引用
本申请要求2012年6月5日提交的美国临时申请序列号61/655,935和2013年3月13日提交美国临时申请序列号13/800,202的优先权,将这两篇申请以全部内容通过引用并入本文中。
背景技术:
本发明总地涉及用于制备抗病毒化合物及其合成的中间体的有机合成方法的领域。
丙肝被认为是一种特征在于肝病的慢性肝脏病毒性疾病。尽管靶向肝脏的药物广泛使用并且已经显示出有效性,但毒性和其他副作用限制了它们的实用性。丙肝病毒(hcv)的抑制剂对于限制hcv感染的建立和进展以及用于hcv的诊断试验中是有用的。
技术实现要素:
在一个实施方案中,本发明提供了用于制备通式i的化合物或其药物学上可接受的盐或溶剂化物的方法:
通式(i)的化合物,也称为ledipasvir,具有化学名称:(1-{3-[6-(9,9-二氟-7-{2-[5-(2-甲氧基羰基氨基-3-甲基-丁酰基)-5-氮杂-螺环[2.4]庚-6-基]-3h-咪唑-4-基}-9h-芴-2-基)-1h-苯并咪唑-2-基]-2-氮杂-二环[2.2.1]庚烷-2-羰基}-2-甲基-丙基)-氨基甲酸甲酯。所述方法包括以下步骤:
(a)在金属催化剂和碱的存在下,耦合式(i)的化合物
和式(ii)的化合物
以产生通式(iii)的化合物或其盐:
(b)将通式(iii)的化合物去保护,以产生通式(iv)的化合物或其盐:
和
(c)将通式(iv)的化合物接触(s)-2-(甲氧基羰基氨基)-3-甲基丁酸:
以产生通式i的化合物。
每个pg独立地是胺保护基团。
取代基y和z独立地选自br和–b(or)(or’)。在一个实施方案中,当y是–b(or)(or’)时,那么z是br,并且在另一个实施方案中,当y是br时,那么z是–b(or)(or’)。
取代基r和r’独立地选自由氢和直链或支链c1-8烷基,或r和r’一起表示直链或支链c1-8-亚烃基、c3-8-环亚烃基或c6-12-亚芳基组成的组中。
本文中限定的任何烷基、亚烃基、环亚烃基或亚芳基可选被一个或多个选自由c1-6-烷基、-c(o)n(c1-6-烷基)2和-c(o)o(c1-6-烷基)组成的组中的取代基取代。
以下描述更特定的实施方案。
附图简述
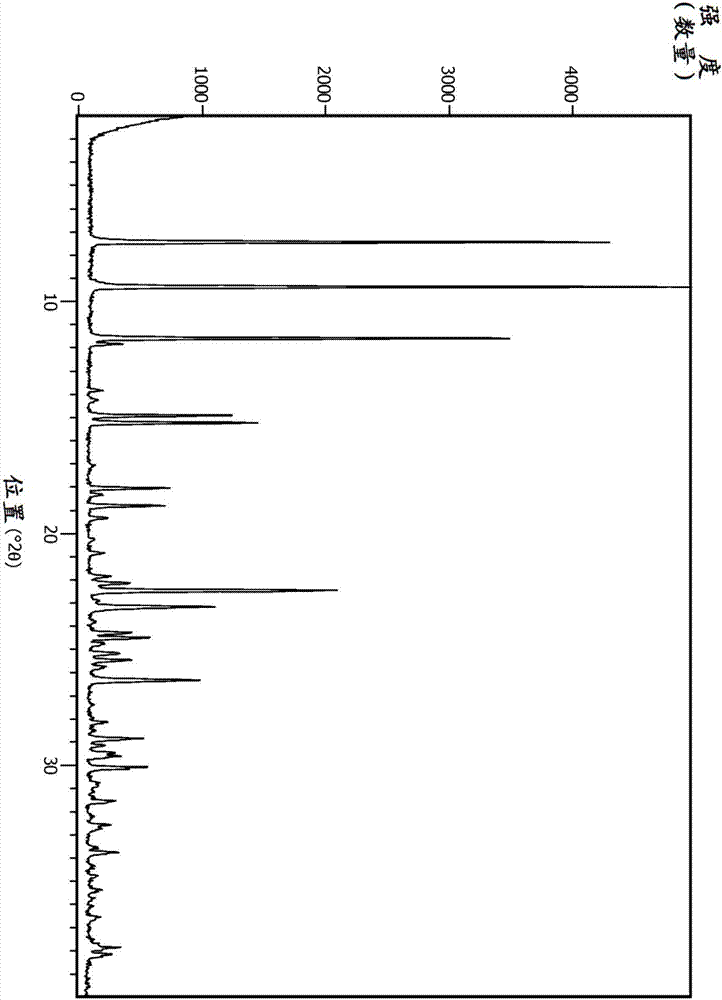
图1是型i的x-射线粉末衍射图,型i是下文所述的化合物30的多晶型物。
图2是型ii的x-射线粉末衍射图,型ii是下文所述的化合物30的多晶型物。
具体实施方式
定义
如本发明的说明书中所用的,以下的词语和短语通常被认为具有如下阐明的含义,除非在使用这些词语或短语的上下文中另有指明。
如本文中使用的术语“烷基”是指具有所示数目的碳原子的直链或支链饱和烃。例如,(c1-c8)烷基表示包括,但不限于甲基、乙基、丙基、异丙基、丁基、仲-丁基、叔-丁基、戊基、异戊基、新戊基、己基、异己基和新己基。烷基基团可以是未取代的或可选被一个或多个本文中所述的取代基取代。
术语“取代的烷基”是指:
1)如上所定义的烷基基团,具有1、2、3、4或5个(在一些实施方案中,1、2或3个取代基)选自以下的取代基:烯基、炔基、烷氧基、环烷基、环烯基、环烷氧基、环烯氧基、酰基、酰氨基、酰氧基、氨基、取代的氨基、氨基羰基、烷氧基羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳基硫、杂芳基硫、杂环基硫、巯基、烷基硫、芳基、芳氧基、杂芳基、氨基磺酰基、氨基羰基氨基、杂芳氧基、杂环基、杂环氧、羟氨基、烷氧基氨基、硝基、-so-烷基、-so-环烷基、-so-杂环基、-so-芳基、-so-杂芳基、-so2-烷基、-so2-环烷基、-so2-杂环基、-so2-芳基和-so2-杂芳基。除非通过定义另外限定,否则所有取代基可以可选地进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、杂环基、芳基、杂芳基和-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2;或
2)如上所定义的烷基基团,被独立地选自以下的1-10个原子(例如,1、2、3、4或5个原子)中断:氧、硫和nra,其中ra选自氢、烷基、环烷基、烯基、环烯基、炔基、芳基、杂芳基和杂环基。所有取代基可以可选进一步被以下基团取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、杂环基、芳基、杂芳基和-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2;或
3)如上所定义的烷基基团,其具有如上所定义的1、2、3、4或5个取代基并且还被如上所定义的1-10个原子(例如,1、2、3、4或5个原子)中断。
术语“亚烃基”是指二价的支链或无支链的饱和烃链,在一些实施方案中,具有1至20个碳原子(例如1-10个碳原子,或1,2,3,4、5或6个碳原子)。该术语通过如亚甲基(-ch2-)、亚乙基(-ch2ch2-)、亚丙基异构体(例如,-ch2ch2ch2-和-ch(ch3)ch2-)等基团加以举例说明。
术语“低级烷基”是指具有1、2、3、4、5或6个碳原子的单价支链或无支链的饱和烃链。该术语通过如甲基、乙基、n-丙基、异丙基、n-丁基、异丁基、t-丁基、n-己基等基团加以举例说明。
术语“饱和的低级烷基”是指如上所定义的具有1至5个取代基(在一些实施方案中,1、2或3个取代基)的低级烷基,如以上定义的被1、2、3、4或5个原子中断的取代烷基或低级烷基基团所定义的,如以上定义的具有1、2、3、4或5个取代基并被如上定义的1、2、3、4或5个原子中断的的以上定义的取代烷基或低级烷基基团所定义的。
术语“亚烃基”是指二价的支链或无支链的饱和烃链,在一些实施方案中,具有1至20个碳原子(例如1-10个碳原子,或1,2,3,4、5或6个碳原子)。该术语通过例如亚甲基(-ch2-)、亚乙基(-ch2ch2-)、亚丙基异构体(例如,-ch2ch2ch2-和-ch(ch3)ch2-)等基团加以举例说明。
术语“低级亚烃基”或“亚烃基”是指二价的支链或无支链饱和烃链,在一些实施方案中,具有1,2,3,4,5或6个碳原子。
术语“取代的亚烃基”是指具有对取代的烷基定义的1至5个取代基(在一些实施方案中,1、2或3个取代基)的如上所定义的亚烃基基团。
术语“芳烷基”是指共价连接亚烃基基团的芳基基团,其中芳基和亚烃基如本文中所定义。“可选取代的芳烷基”是指共价连接可选取代的亚烃基基团的可选取代的芳基基团。这样的芳烷基基团通过苄基、苯乙基、3-(4-甲氧基苯基)丙基等加以举例说明。
术语“芳烷氧基”是指基团-o-芳烷基。“可选取代的芳烷氧基”是指共价连接可选取代的亚烷基基团的可选取代的芳烷基基团。这样的芳烷基基团通过苯甲氧基、苯基乙氧基等加以举例说明。
术语“烯基”是指具有2至20个碳原子(在一些实施方案中,具有2至10个碳原子,例如2至6个碳原子)并具有1至6个碳-碳双键(例如1、2或3个碳-碳双键)的单价支链或无支链的不饱和烃基团。在一些实施方案中,烯基基团包括乙烯基(ethenyl)(或乙烯基(vinyl),即-ch=ch2)、1-丙烯(或烯丙基,即-ch2ch=ch2)、异亚丙基(-c(ch3)=ch2)等。
术语“低级烯基”是指具有2至6个碳原子的如上所定义的烯基。
术语“取代的烯基”是指具有1至5个对取代的烷基定义的取代基(在一些实施方案中,1、2或3个取代基)的如上所定义的烯基基团。
术语“炔基”是指单价的不饱和烃,在一些实施方案中,具有2至20个碳原子(在一些实施方案中,具有2至10个碳原子,例如,2至6个碳原子)并具有1至6个碳-碳三键,例如1、2或3个碳-碳三键。在一些实施方案中,炔基基团包括乙炔基(-c≡ch)、炔丙基(或丙炔基,-c≡cch3)等。
术语“取代的炔基”是指具有1至5个对取代的烷基定义的取代基(在一些实施方案中,1、2或3个取代基)的如上所定义的炔基。
术语“羟基(hydroxy)”或“羟基(hydroxyl)”是指基团-oh。
术语“烷氧基”是指基团r-o-,其中r是烷基或-y-z-,其中y是亚烃基并且z是烯基或炔基,其中烷基、烯基和炔基如本文中所定义。在一些实施方案中,烷氧基基团是烷基-o-,并且包括,例如,甲氧基、乙氧基、n-丙氧基、异丙氧基、n-丁氧基、叔丁氧基、仲丁氧基、n-戊氧基、n-己氧基、1,2-二甲基丁氧基等。
术语“低级烷氧基”是指基团r-o-,其中r是可选取代的低级烷基。该术语通过如甲氧基、乙氧基、n-丙氧基、异丙氧基、n-丁氧基、异丁氧基、t-丁氧基、n-己氧基等基团加以举例说明。
术语“取代的烷氧基”是指基团r-o-,其中r是取代的烷基或-y-z,其中y是取代的亚烷基,并且z是取代的烯基或取代的炔基,其中取代的烷基、取代的烯基和取代的炔基如本文中所定义。
术语“环烷基”是指具有单环或多个稠环的3至20个碳原子的环烷基基团,其具有单环或多稠环。这样的环烷基基团包括例如单环结构,如环丙基、环丁基、环戊基、环辛基等,或多环结构,如金刚烷基和双环[2.2.1]庚烷,或与芳基基团稠合的环烷基基团,例如茚满等,如果连接点是通过环烷基基团。
术语“环烯基”是指具有单环或多稠环并具有至少一个双键并且在一些实施方式中具有1至2个双键的3-20个碳原子的环烷基基团。
术语“取代的环烷基”和“取代的环烯基”是指具有1、2、3、4或5个(在一些实施方案中,为1、2或3个取代基)取代基的环烷基或环烯基基团,所述取代基选自:烷基、烯基、炔基、烷氧基、环烷基、环烯基、环烷氧基、环烯氧基、酰基、酰氨基、酰氧基、氨基、取代的氨基、氨基羰基、烷氧基羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳基硫、杂芳基硫、杂环基硫、巯基、烷基硫、芳基、芳氧基、杂芳基、氨基磺酰基、氨基羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-so-烷基、-so-环烷基、-so-杂环基、-so-芳基、-so-杂芳基、-so2-烷基、-so2-环烷基、-so2-杂环基、-so2-芳基和-so2-杂芳基。术语“取代的环烷基”还包括其中环烷基基团的一个或多个环状碳原子具有与其键合的氧基团的环烷基基团。除非通过定义另外限定,否则所有取代基可以可选进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、杂环基、芳基、杂芳基和-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2。
术语“环烷氧基”是指基团环烷基-o-。
术语“取代的环烷氧基”是指基团取代的环烷基-o-。
术语“环烯氧基”是指基团环烯基-o-。
术语“取代的环烯氧基”是指基团取代的环烯基-o-。
术语“芳基”是指具有单环(例如,苯基)或多环(例如,联苯基)或多稠(稠合)环(例如,萘基、芴基和蒽基)的6至20个碳原子的芳香族碳环基团。在一些实施方案中,芳基包括苯基、芴基、萘基、蒽基等。
除非通过定义对芳基取代基另外限定,否则这样的芳基基团可以可选被1、2、3、4或5个(在一些实施方案中,为1、2或3个取代基)取代基取代,所述取代基选自:烷基、烯基、炔基、烷氧基、环烷基、环烯基、环烷氧基、环烯氧基、酰基、酰氨基、酰氧基、氨基、取代的氨基、氨基羰基、烷氧基羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳基硫、杂芳基硫、杂环基硫、巯基、烷基硫、芳基、芳氧基、杂芳基、氨基磺酰基、氨基羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-so-烷基、-so-环烷基、-so-杂环基、-so-芳基、-so-杂芳基、-so2-烷基、-so2-环烷基、-so2-杂环基、-so2-芳基和-so2-杂芳基。除非通过定义另外限定,否则所有取代基可以可选进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、杂环基、芳基、杂芳基和-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2。
术语“芳氧基”是指基团芳基-o-,其中芳基基团如上所定义,并且包括同样如上所定义的可选取代的芳基基团。术语“芳基硫”是指基团r-s-,其中r是如对芳基所定义的。
本文中的术语“亚芳基”是指二价的如上定义的“芳基”的二自由基,由于从芳基形式去除氢原子而形成。
术语“杂环基”、“杂环”或“杂环的”是指具有单环或多稠环的单价饱和基团,在环内具有1至40个碳原子和1至10个杂原子,和1至4个杂原子(选自氮、硫、磷和/或氧)。
除非通过定义对杂环取代基另外限定,否则这样的杂环基团可以可选被1至5个(在一些实施方案中,为1、2或3个取代基)选自以下的取代基取代:烷基、烯基、炔基、烷氧基、环烷基、环烯基、环烷氧基、环烯氧基、酰基、酰氨基、酰氧基、氨基、取代的氨基、氨基羰基、烷氧基羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳基硫、杂芳基硫、杂环基硫、巯基、烷基硫、芳基、芳氧基、杂芳基、氨基磺酰基、氨基羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-so-烷基、-so-环烷基、-so-杂环基、-so-芳基、-so-杂芳基、-so2-烷基、-so2-环烷基、-so2-杂环基、-so2-芳基和-so2-杂芳基。除非通过定义另外限定,否则所有取代基可以可选进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、杂环基、芳基、杂芳基和-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2。杂环基的实例包括四氢呋喃基、吗啉基、哌啶基等。
术语“杂环氧基”是指基团-o-杂环基。
术语“杂芳基”是指包含单环或多环的基团,在至少一个环内包含1至15个碳源子和1至4个选自氧、氮和硫的杂原子。术语“杂芳基”是“芳香族杂芳基”和“部分饱和的杂芳基”的总称。术语“芳香族杂芳基”是指其中至少一个环是芳香族的杂芳基,与连接点无关。芳香族杂芳基的实例包括吡咯、噻吩、吡啶、喹啉、蝶啶。术语“部分饱和的杂芳基”是指具有等效于在饱和的基础芳香族杂芳基的芳香环中具有一个或多个双键的基础芳香族杂芳基结构的杂芳基。部分饱和的杂芳基的实例包括二氢吡咯、二氢吡啶、色满、2-氧-1,2-二氢吡啶-4-基等。
除非通过定义对杂芳基取代基另外限定,否则这样的杂芳基基团可以可选被1至5个(在一些实施方案中,为1、2或3个取代基)取代基取代,所述取代基选自:烷基、烯基、炔基、烷氧基、环烷基、环烯基、环烷氧基、环烯氧基、酰基、酰氨基、酰氧基、氨基、取代的氨基、氨基羰基、烷氧基羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳基硫、杂芳基硫、杂环基硫、巯基、烷基硫、芳基、芳氧基、杂芳基、氨基磺酰基、氨基羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-so-烷基、-so-环烷基、-so-杂环基、-so-芳基、-so-杂芳基、-so2-烷基、-so2-环烷基、-so2-杂环基、-so2-芳基和-so2-杂芳基。除非通过定义另外限定,否则所有取代基可以可选进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、杂环基、芳基、杂芳基和-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2。这样的杂芳基基团可具有单环(例如,吡啶基或呋喃基)或多稠环(例如,吲嗪基、苯并噻唑或苯并噻吩基)。氮杂环基和杂芳基的实例包括,但不限于,吡咯、咪唑、吡唑、吡啶、吡嗪、嘧啶、哒嗪、吲嗪、异吲哚、吲哚、吲唑、嘌呤、喹嗪、异喹啉、喹啉、酞嗪、萘基吡啶、喹喔啉、喹唑啉、噌啉、蝶啶、咔唑、咔啉、菲啶、吖啶、菲咯啉、异噻唑、吩嗪、异噁唑、吩噁嗪、吩噻嗪、咪唑烷、咪唑啉等以及含有n-烷氧基-氮的杂芳基化合物。
术语“杂芳氧基”是指基团杂芳基-o-。
术语“氨基”是指基团-nh2。
术语“取代的氨基”是指是指基团-nrr,其中每个r独立地选自由氢、烷基、环烷基、芳基、杂芳基以及杂环基组成的组中,如果两个r基团不都是氢或基团-y-z,其中y是可选取代的亚烷基并且z是烯基、环烯基或炔基。除非通过定义另外限定,否则所有取代基可以可选进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、芳基、杂芳基和-s(o)nra,其中ra是烷基、芳基、或杂芳基并且n是0、1或2。
术语“烷基胺”是指r-nh2,其中r是可选取代的烷基。
术语“二烷基胺”是指r-nhr,其中每个r独立地是可选取代的烷基。
术语“三烷基胺”是指nr3,其中每个r独立地是可选取代的烷基。
术语“氰基”是指基团-cn。
术语“叠氮基”是指基团
术语“酮基”或“氧”是指基团=o。
术语“羧基”是指基团-c(o)-oh。
术语“酯”或“羧基酯”是指基团-c(o)or,其中r是烷基、环烷基、芳基、杂芳基或杂环基,其可以可选进一步被以下基团取代:烷基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基或-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2。
术语“酰基”表示基团-c(o)r,其中r是氢、可选取代的烷基、可选取代的环烷基、可选取代的杂环基、可选取代的芳基或可选取代的杂芳基。
术语“羧基烷基”是指基团-c(o)o-烷基、-c(o)o-环烷基,其中烷基和环烷基如在本文中所定义并且可以可选进一步被以下基团取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基或-s(o)nra,其中ra是烷基、芳基或杂芳基并且n是0、1或2。
术语“氨基羰基”是指基团-c(o)nrr,其中每个r独立地是氢、烷基、环烷基、芳基、杂芳基或杂环基,或其中两个r基团连接形成杂环基团(例如,吗啉代)。除非通过定义另外限定,否则所有取代基可以可选进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基和-s(o)nra,其中ra是烷基、芳基或杂芳基并且n是0、1或2。
术语“酰氧基”是指基团-oc(o)-烷基、-oc(o)-环烷基、-oc(o)-芳基、-oc(o)-杂芳基和-oc(o)-杂环基。除非通过定义另外限定,否则所有取代基可以可选进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、杂环基、杂芳基和-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2。
术语“酰氨基”是指基团-nrc(o)r,其中每个r独立地是氢、烷基、环烷基、芳基、杂芳基和杂环基。除非通过定义另外限定,所有取代基可以可选进一步被选自以下的取代基取代:烷基、烯基、炔基、羧基、羧基烷基、氨基羰基、羟基、烷氧基、卤素、cf3、氨基、取代的氨基、氰基、环烷基、杂环基、杂芳基和-s(o)nra,其中ra是烷基、芳基或杂芳基,并且n是0、1或2。
术语“烷氧基羰基氨基”是指基团-n(rd)c(o)or,其中r是可选取代的烷基,并且rd是氢或可选取代的烷基。
术语“氨基羰基氨基”指基团-nrcc(o)nrr,其中rc是氢或可选取代的烷基,并且每个r独立地选自氢、烷基、环烷基、芳基、杂芳基或杂环基。除非通过定义另外限定,所有取代基可以可选进一步被1、2或3个选自以下的取代基取代:烷基、烯基、炔基、烷氧基、环烷基、环烯基、环烷氧基、环烯基氧、酰基、酰基氨基、酰氧基、氨基、取代的氨基、氨基羰基、烷氧基羰基氨基、叠氮基、氰基、卤素、羟基、酮、硫代羰基、羧基、羧烷基、芳基硫、杂芳基硫、杂环基硫、巯基、烷基硫、芳基、芳氧基、杂芳基、氨基磺酰基、氨基羰基氨基、杂芳氧基、杂环基、杂环氧、羟氨基、烷氧基氨基、硝基、-so-烷基、-so-环烷基、-so-杂环基、-so-芳基、-so-杂芳基、-so2-烷基、-so2-环烷基、-so2-杂环基、-so2-芳基和-so2-杂芳基。
术语“巯基”是指基团-sh。
术语“硫代羰基”是指基团=s。
术语“烷基硫”是指基团-s-烷基。
术语“取代的烷基硫”是指基团-s-取代的烷基。
术语“杂环硫”是指基团-s-杂环基。
术语“芳基硫”是指基团-s-芳基。
术语“杂芳基巯基”是指-s-杂芳基,其中杂芳基基团如上定义,包括可选取代的杂芳基基团,也如上定义。
术语“亚砜”是指基团-s(o)r,其中r是烷基、环烷基、杂环基、芳基或或杂芳基。“取代的亚砜”是指基团-s(o)r,其中r是如本文中所定义的取代的烷基、取代的环烷基、取代的杂环基、取代的芳基或取代的杂芳基。
术语“砜”是指基团-s(o)2r,其中r是烷基、环烷基、杂环基、芳基或杂芳基。“取代的砜”是指基团-s(o)2r,其中r是如本文中所定义的取代的烷基、取代的环烷基、取代的杂环基、取代的芳基或取代的杂芳基。
术语“氨基磺酰基”是指基团-s(o)2nrr,其中每个r独立地选自由氢、烷基、环烷基、芳基、杂芳基或杂环基组成的组中。除非通过定义另外限定,否则所有取代基可以可选进一步被1、2或3个选自以下组成的组中的取代基取代:烷基、烯基、炔基、烷氧基、环烷基、环烯基、环烷氧基、环烯基氧、酰基、酰基氨基、酰氧基、氨基、取代的氨基、氨基羰基、烷氧基羰基氨基、叠氮基、氰基、卤素、羟基、酮、硫代羰基、羧基、羧烷基、芳基硫、杂芳基硫、杂环基硫、巯基、烷基硫、芳基、芳氧基、杂芳基、氨基磺酰基、氨基羰基氨基、杂芳氧基、杂环基、杂环氧、羟氨基、烷氧基氨基、硝基、-so-烷基、-so-环烷基、-so-杂环基、-so-芳基、-so-杂芳基、-so2-烷基、-so2-环烷基、-so2-杂环基、-so2-芳基和-so2-杂芳基。
术语“羟基氨基”是指基团-nhoh。
术语“烷氧基氨基”是指基团-nhor,其中r是可选取代的烷基。
术语“卤素(halogen)”或“卤素(halo)”是指氟、溴、氯和碘。
“可选的”或“可选地”是指随后描述的事件或情况可能发生或可能不发生,并且该描述包括其中所述事件或情况发生的情况以及其中它不发生的情况。
“取代”的基团包括其中单价取代基结合至取代的基团的单个原子(例如,形成分支)的实施方案,并且还包括其中所述取代基可以是结合至取代的基团的两个相邻原子上的二价桥接基团的实施方案,由此在取代的基团上形成稠环。
在给定基团(部分)在本文中描述为与第二个基团连接并且并未指明连接位点的情况下,给定基团可在给定基团的任何可利用位点处与第二个基团的任何可利用位点连接。例如,“低级烷基-取代的苯基”,在连接位点未指明的情况下,可以使低级烷基基团的任何可利用位点连接至苯基基团的任何可利用位点。在这点上,“可利用位点”是该基团的氢可以被取代基代替的基团位点。
将理解在以上定义的所有取代的基团中,本文中不打算包括用自身更多的取代基来定义取代基获得的聚合物(例如,具有取代的芳基基团作为取代基(其自身被取代的芳基基团等取代)的取代的芳基)。也不包括无限的取代基数量,不管取代基是相同的或是不同的。在这样的情况中,这样的取代基的最大数量为三个。因此以上的每个限定通过例如取代的芳基基团限于-取代的芳基-(取代的芳基)-取代的芳基的限制来解释。
给定通式的化合物(例如,通式i的化合物)旨在涵盖本发明的化合物以及这类化合物的药物学上可接受的盐、药物学上可接受的酯、异构体、互变异构体、溶剂化物、同位素、水合物和前药。此外,本发明的化合物可以具有一个或多个非对称中心,并且可以生产为外消旋混合物或单个对映异构体或非对映异构体。在给定通式的任何给定的化合物中存在的立体异构体数目取决于存在的非对称中心的数目(存在2n种可能的立体异构体,其中n是非对称中心的数目)。在合成的某些合适阶段通过拆分中间体的外消旋或非消旋混合物,或者通过常规方法通过拆分该化合物,可以获得单独的立体异构体。单独的立体异构体(包括单独的对映异构体和非对映异构体)以及立体异构体的外消旋体和非外消旋体混合物都包含在本发明的范围内,除非另外明确说明,否则所有这些都旨在通过本说明书的结构加以描述。
“异构体”是具有相同分子式的不同化合物。异构体包括立体异构体、对映异构体和非对映异构体。
“立体异构体”是差别仅在于原子在空间的排列方式不同的异构体。
“对映异构体”是一对立体异构体,其彼此是不能重叠的镜像。一对对映异构体的1∶1混合物是“外消旋”混合物。在适宜的情况下,术语“(±)”用来表示外消旋混合物。
“非对映异构体”是具有至少两个非对称原子,但彼此不是镜像的立体异构体。
绝对立体化学是根据cahn-ingold-prelogr-s体系确定的。当化合物是纯对映异构体时,在每个手性碳的立体化学可以通过r或s加以说明。根据它们在钠d线的波长下旋转偏振光平面的方向(右旋或左旋),将绝对构型未知的拆分化合物可以表示为(+)或(-)。
术语“胺保护基团”是合成有机化学领域的技术人员充分了解的,作为可以选择性地安置在合适的胺官能团上并从其移除的部分。保护基团方法的领域是充分发展的,并且许多胺保护基团及其使用方法,是本领域技术人员公知的,如关于权威论述中所述的那些,p.g.m.wuts和t.w.greene,greene'sprotectivegroupsinorganicsynthesis,第4版,(wiley,2006)。
术语“硼化(borylation)剂”也是有机合成领域充分了解的,作为用于将多种硼酸盐部分中的任何一种安置在合适底物上的试剂。硼化剂的非限制性实例和相关合成方法列于t.ishiyama等,j.org.chem.1995,60,7508-7510中。
术语“羟基(hydroxy)”或“羟基(hydroxyl)”是指基团-oh。
如果在所绘结构和给予该结构的名称之间存在矛盾,以所绘结构为准。此外,如果结构或结构一部分的立体化学没有用例如粗体、楔形或虚线表示,所述结构或结构的一部分解释为包括其所有的立体异构体。
术语“溶剂化物”是指通过结合通式i或本文中公开的任何其他通式的化合物和溶剂形成的复合物。
术语“水合物”是指通过结合通式i或本文中公开的任何其他通式的化合物和水形成的复合物。
术语“前药”是指通式i或本文中公开的任何通式的化合物,其包括在体内可被转化和/或可从分子的剩余部分上分离以提供活性药物、其药学上可接受的盐或其生物活性代谢物的化学基团。
本文中给出的任何通式或结构,包括通式i或本文中公开的任何通式,还旨在表示化合物的未标记形式以及同位素标记的形式。同位素标记的化合物具有由本文中给出的通式所述的结构,除了一个或多个原子被具有选定的原子质量或质量数的原子代替。可以结合到本发明化合物中的同位素的实例包括氢、碳、氮、氧、磷、氟和氯的同位素,如,但不限于2h(氘,d)、3h(氚)、11c、13c、14c、15n、18f、31p、32p、35s、36cl和125i。本发明的各种不同同位素标记的化合物,例如其中结合了放射性同位素如3h、13c和14c的那些。这样的同位素标记的化合物可以用在代谢研究、反应动力学研究、检测或成像技术中,如正电子断层成像术(pet)或单光子发射计算机断层成像术(spect),包括药物或底物组织分布测定,或用在病人的放射性治疗中。
本发明还包括通式i或本文中公开的任何通式的化合物,其中连接碳源子的1至“n”个氢被氘替代,其中n是分子中氢的数量。这样的化合物呈现处提高的抗代谢性,并且因此用于给药于哺乳动物时提高通式i的任何化合物的半衰期。参见,例如,foster,“氘同位素在药物代谢研究中的作用(deuteriumisotopeeffectsinstudiesofdrugmetabolism)”,trendspharmacol.sci.5(12):524-527(1984)。这样的化合物通过本领域公知的方法来合成,例如,通过使用其中一个或多个氢原子已经被氘替代的起始材料。
氘标记的或取代的本发明的治疗化合物可以具有提高的dmpk(药物代谢和药物动力学)特性,涉及吸收、分布、代谢和排泄(adme)。用较重的同位素如氘的取代可以提供某些治疗优点(源于更好的代谢稳定性),例如提高的体内半衰期或减少的剂量需求。18f标记的化合物可用于pet或spect研究。通过用容易得到的同位素标记试剂取代非同位素标记的试剂,通常可以通过实施以下所述方案中或以下所述实施例和制备中公开的程序来制备本发明的同位素标记化合物及其前药。此外,用较重的同位素,特别是氘(即,2h或d)取代,可以提供某些治疗优点(源于更好的代谢稳定性),例如,提高的体内半衰期或减少的剂量需求或提高的治疗指数。应当理解的是在上下文中的氘被认为是通式(i)或本文中公开的任何通式的化合物中的取代基。
这样的较重的同位素(具体地氘)的浓度,可以通过同位素富集因子来定义。在本发明的化合物中,未明确指示为特定同位素的任何原子意味着表示该原子的任何稳定同位素。除非另有说明,当一个位置被明确指定为“h”或“氢”时,认为该位置具有以其天然丰度同位素组成的氢。因此,在本发明的化合物中,明确地指定为氘(d)的任何原子意味着表示氘。
在许多情况中,本发明的化合物借助于氨基和/或羧基基团或与其类似基团的存在能够形成酸式盐和/或碱式盐。
术语给定化合物的“药物学上可接受的盐”是指保留给定化合物的生物有效性和特性的盐,并且所述盐不是在生物学上或在其他方面不期望的。参见:p.heinrichstahl和camilleg.wermuth(编辑),pharmaceuticalsalts:properties,selection,anduse(internationalunionofpureandappliedchemistry),wiley-vch;2ndrevisededition(2011年5月16日)。药物学上可接受的碱式加成盐可以从无机碱和有机碱制得。衍生自无机碱的盐包括(仅举例说明)钠盐、钾盐、锂盐、铵盐、钙盐以及镁盐。衍生自有机碱的盐包括,但不限于,伯胺、仲胺以及叔胺盐,如烷基胺、二烷基胺、三烷基胺、取代的烷基胺、二(取代的烷基)胺、三(取代的烷基)胺、烯基胺、二烯基胺、三烯基胺、取代的烯基胺、二(取代的烯基)胺、三(取代的烯基)胺、环烷基胺、二(环烷基)胺、三(环烷基)胺、取代的环烷基胺、二取代的环烷基胺、三取代的环烷基胺、环烯基胺、二(环烯基)胺、三(环烯基)胺、取代的环烯基胺、二取代的环烯基胺、三取代的环烯基胺、芳基胺、二芳基胺、三芳基胺、杂芳基胺、二杂芳基胺、三杂芳基胺、杂环胺、二杂环胺、三杂环胺、混合的二胺和三胺,其中胺上的至少两个取代基是不同的并且选自烷基、取代的烷基、烯基、取代的烯基、环烷基、取代的环烷基、环烯基、取代的环烯基、芳基、杂芳基、杂环等。还包括其中两个或三个取代基与氨基氮一起形成杂环或杂芳基基团的胺。胺具有通式结构n(r30)(r31)(r32),其中单取代的胺在氮上的3个取代基(r30、r31和r32)有2个是氢,二取代的胺在氮上的3个取代基(r30、r31和r32)有1个是氢,而三取代的胺在氮上的3个取代基(r30、r31和r32)没有一个是氢。r30、r31和r32选自多种取代基,如氢、可选取代的烷基、芳基、杂芳基、环烷基、环烯基、杂环基等。以上提及的胺是指其中在氮上的一个、两个或三个取代基以名称列出的化合物。例如,术语“环烯基胺”是指环烯基-nh2,其中“环烯基”如本文中所定义。术语“二杂芳基胺”是指nh(杂芳基)2,其中“杂芳基”如本文中所定义,以此类推。
合适胺的具体实例包括(仅以举例说明)异丙胺、三甲胺、二乙胺、三(异丙)胺、三(正丙)胺、乙醇胺、2-二甲基氨基乙醇、缓血酸胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、海巴明、胆碱、甜菜碱、乙二胺、葡糖胺、n-烷基葡糖胺、可可碱、嘌呤、哌嗪、哌啶、吗啉、n-乙基哌啶等。
药物学上可接受的酸式加成盐可以从无机酸和有机酸制得。从无机酸衍生的盐包括盐酸、氢溴酸、硫酸、硝酸、磷酸等。从有机酸衍生的盐包括乙酸、丙酸、乙醇酸、丙酮酸、草酸、苹果酸、丙二酸、琥珀酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。
此外,本文中使用的缩写具有如下各自的含义:
方法
如以上概括地描述,在一些实施方案中,本发明提供了用于制备通式i的化合物的方法。步骤a,涉及分别根据通式(i)和(ii)的化合物的耦合,提供了另外的实施方案。例如,在一个实施方案中,通式(i)的化合物是硼酸盐耦合伴侣,其中y是-b(or)(or’),并且因此在通式(ii)中,取代基z是br。
在另一个实施方案中,提供了本发明的一个优势,藉此在原位产生通式(i)的化合物,由此允许随后在一个坩埚中进行耦合步骤a。在这个实施方案中,该方法包括在第二种碱的存在下,按序将通式(a)的化合物
接触钯源以及随后的包含
在用于制备通式(i)的化合物的方法的另一个实施方案中,卤化物x是br,并且保护基团pg是叔-丁氧基羰基。
在上述方法的一些实施方案中,金属催化剂选自pd(0)和pd(ii)化合物。pd的精确氧化钛不是关键,只要根据非常确定的用于suzuki耦合的条件生产催化活性pd(0)物质。因此,例如,在一些实施方案中,金属催化剂是pdcl2[p(t-bu)2ph]2。在其他实施方案中,催化剂是pd(oac)2/2-二环己基膦基-2’-甲基联苯。再在另一个实施方案中,催化剂是二氯[1,1’-双(联苯膦基)二茂铁]钯(ii)二氯甲烷加合物。
其他金属催化剂是可接受的,如结合加入反应混合物中的配体从pd或ni形成的那些。典型的配体包括1,1'-双(联苯膦基)二茂铁、三苯膦基、三(2-甲氧基苯基)磷化氢、三环己基磷化氢、2-(二环己基膦基)联苯、2-二环己基膦基-2'-甲基联苯、2-(二环己基膦基)-2'-(n,n-二甲基氨基)联苯、2-(二-叔-丁基膦基)-2'-(n,n-二甲基氨基)联苯、二环己基(2,2-联苯-1-甲基乙烯基)磷化氢、双(2-二环己基膦基苯基)醚、二环己基(4-(n,n-二甲基氨基)苯基)磷化氢、2-二环己基膦基-2'-氟代联苯、2-二环己基膦基-2',6'-二氟代联苯。
或者,可以使用预制的金属/配体系统,如二氯[1,1'-双(联苯膦基)二茂铁]钯(ii)、双[二-叔-丁基(4-二甲基氨基苯基)膦基]钯(ii)氯化物和双[二-(叔-丁基)(4-三氟甲基苯基)膦基]钯(ii)氯化物。本发明中考虑了所有这些可能性。
在第二种碱的存在下进行上述制备通式(i)的化合物的硼化过程,所述第二种碱不必定与用于步骤a的碱相同。因此,在一个实施方案中,第二种碱是丙酸盐,如丙酸钾。其他碱也适用于这一目的,并且它们包括醋酸盐,如醋酸钠、醋酸钾或醋酸铯;以及磷酸盐,如磷酸钠或磷酸钾。
另一个实施方案提供了再一种用于制备通式i的化合物的方法:
或其药物学上可接受的盐。在这个实施方案中,该方法包括在丙酸钾的存在下,将通式(a’)的化合物
按序接触催化有效量的pdcl2[p(t-bu)2ph]2和双(新戊二醇)二硼,产生包含通式(ia)的化合物的反应混合物:
方法的步骤(2)是将来自步骤(1)的反应混合物接触通式(ii’)的化合物:
和磷酸钾,产生通式(iii’)的化合物:
在一些实施方案中,可选将通式(iii’)的化合物接触草酸,产生根据通式(iii”)的草酸盐:
方法的步骤(3)是将通式(iii’)或通式(iii”)的化合物接触hcl,产生通式(iv’)的化合物:
最后,步骤(4)是将通式(iv’)的化合物接触(s)-2-(甲氧基羰基氨基)-3-甲基丁酸:
产生通式i的化合物。在以上所绘结构中,每种情况中的“boc”表示叔-丁氧基羰基。对应于化合物iv’的其他盐可以用于这一反应的变化中,从本文中限定的盐的产生开始。在一些实施方案中,步骤(4)使用化合物iv’的游离碱进行。
在可替换的实施方案中,就在上面所述的方法可以通过在步骤(1)中使用通式(ib)的硼化中间化合物替代(ia)来进行:
在催化有效量的pdcl2[p(t-bu)2ph]2和丙酸钾的存在下,在以上定义的化合物(a’)和双(频哪醇)二硼之间的反应中制备化合物(ib)。
化合物
在其他实施方案中,本发明提供了用于本文中所述方法中的中间体化合物。因此,例如,一个实施方案是通式(ii)的化合物:
其中pg是如上定义的胺保护基团。定义了通式(ii)的示例性化合物,其中pg表示叔-丁氧基羰基。
在另一个实施方案中,本发明提供了通式(iii’)的化合物:
或其根据通式(iii”)的草酸盐:
在另一个实施方案中,本发明提供了通式(iv)的化合物:
或其盐、水合物和/或溶剂化物。例如,特定的实施方案是通式(iv’)的化合物,四盐酸盐:
另一个实施方案是根据以下通式的通式(iv’)的化合物的水合物:
其中q是数字,是小数的或其他,在0至7之间。换句话说,水合物是可以具有整数或小数当量的水存在的化合物。例如,通常的水合物是其中q是0至6之间的数字,如2至6,或5至6。
本发明的范围不受实施例中公开的特定实施方案的限制,其用于说明本发明的少数实施方案,并且本发明也不受本发明内功能上等价的任何实施方案的限制。实际上,除了本文中所示和所述的那些,本发明的各种改变将是本领域技术人员显而易见的,并且其落入了所附权利要求的范围内。为此,应当注意到可以从与公认的这样的有机化合物的简化符号相一致的所绘结构省略一个或多个氢原子或甲基基团,并且有机化学领域的技术人员将容易地认识到它们的存在。
实施例
i.起始材料的合成
a.环丙烷化,制备2
向室温下的dcm(1.5l)和n-庚烷(0.32l)的溶液中加入二乙基锌(800ml,n-庚烷中1.0m)。将反应混合物冷却至0℃,并且将dcm(250ml)中的化合物1(45.0g)溶液在10min内加入。完成添加时,将反应混合物冷却至-5℃,并且通过注射泵在3.5h内加入氯碘甲烷(176g)。将反应混合物在-5℃下再搅拌16h,并且通过缓慢添加(1h)1n含水hcl(1.4l)来淬灭。温热至20℃后,分离相,并且用dcm(0.5l)反提取含水层。用10%含水nacl(1.2l)洗涤合并的有机层,分离相,并且将有机层真空浓缩,以提供粗油,通过硅胶快速色谱(50%乙酸乙酯/n-庚烷)纯化。作为化合物2和3的混合物分离所需产物(46.6g,67.5wt%化合物2,62%折算的产量)。
在可替换的实施方案中,还可以使用各种溶剂中的二乙基锌和二碘甲烷来实现环丙烷化。例如,二氯甲烷、二氯乙烷、甲苯、己烷及其组合,适用于这一目的。此外,尽管典型的温度为-5℃至0℃,但是可以在约-20℃至约20℃的温度下进行环丙烷化。
b.水解/碘内酯化
水解/碘内酯化,制备4:
将化合物2和3的混合物(161.8g,59wt%化合物2)溶解于meoh(1.2l)中。加入水,将混合物冷却至15℃,并且加入固体lioh·h2o(32.8g)。将反应混合物温热至25℃,并且搅拌13.5h。然后将反应混合物在真空下浓缩,以除去meoh,并加入dcm(1l)和水(200ml)。将所得到的混合物冷却至10℃,并加入2n含水hcl(375ml)。相分离后,用dcm(2×500ml,然后250ml)提取含水层。将合并的有机层通过na2so4干燥,过滤并真空浓缩至1.2l。向该溶液中加入水(305ml)、nahco3(136g)和i2(90.7g)。将反应混合物在25℃下搅拌40h,并且用8%含水nahco3(750ml)、水(750ml)和dcm(300ml)稀释。相分离后,用水(1l)提取合并的有机层。然后用乙酸异丙酯(300ml)洗涤合并的含水层,冷却至0℃,并且通过加入2n含水hcl(1.1l)酸化。用dcm提取水相(3x1l),并且用10%含水nahso3(2l)和10%含水nacl(1.5l)洗涤合并的有机层。将有机层通过na2so4干燥,过滤并真空浓缩。将所得到的固体两次溶解于乙酸异丙酯(1l),并从其再浓缩。将另外的乙酸异丙酯(100ml)加入固体中,将溶液加热至50℃,并加入n-庚烷(800ml)。在4h内冷却至20℃后,将浆液冷却至5℃,老化2h。通过过滤收集产物,用n-庚烷(2x150ml)洗涤,并且干燥,获得作为浅黄色固体的化合物4(66.5g,来自化合物2的74%产量)。1hnmr(400mhz,d6-dmso,δ):12.5(s,1h)4.23–4.17(m,1h),3.32–3.16(m,2h),2.28–2.22(m,1h),1.74(dd,j=12.7,4.3hz,0.6h旋转异构体1),1.67(dd,j=12.7,3.7hz,0.4h旋转异构体2),1.39(s,4h旋转异构体1),1.35(s,5h旋转异构体2),0.59–0.45(m,4h).13cnmr(100mhz,d6-dmso,δ):173.9,173.5,153.4,153.0,78.7,78.6,59.1,58.8,53.7,53.4,38.2,37.5,28.1,27.9,20.5,19.9,12.2,11.5,8.8,8.3。
在一些实施方案中,通过使用其他碱,如氢氧化钾或氢氧化钠,来实现水解。在其他实施方案中,可替换的溶剂组合适用于这一目的,如乙醇/水、异丙醇/水和thf/水。
可以在约0℃至约80℃的温度下进行水解。典型的温度是环境温度,如22℃。
其他溶剂和溶剂组合适用于碘内酯化。例如,这些包括二氯乙烷、甲苯、醚、thf或2-甲基thf、乙酸乙酯和乙酸异丙酯。
可接受的碘内酯化温度范围为约0℃至约50℃。典型和方便的温度为约22℃。
为其他碱,如碳酸氢钾(khco3)、碳酸二钾(k2co3)和碳酸二钠(na2co3),提供了碘内酯化反应的一些实施方案。
c.二醇6的碘化
1.6的碘化,制备7a:
将三苯基磷化氢(257.2g)和咪唑(66.7g)加入反应器中。加入dcm(490ml),启动搅拌,并且将溶液冷却至0℃。作为固体在1h内分部分加入碘(249.2g),通式维持内部温度低于10℃。完成添加时,将dcm(113ml)中的6(50g)的溶液在0.5h内缓慢加入反应器中,同时维持内部温度低于10℃。搅拌2.5h后,将水(225ml)中的nacl(25g)水溶液加入反应器中。相分离后,用n-庚烷(550ml)稀释底部有机层。用水(190ml)中的亚硫酸钠(21g)水溶液洗涤有机层。层分离后,经由真空蒸馏,将有机相浓缩至600ml。加入其他的n-庚烷(550ml),并且将混合物再次经由真空蒸馏浓缩至600ml。将所得到的浆液通过已经浆液充填了n-庚烷的硅胶塞(85g)过滤。用另外的n-庚烷(1l)冲洗硅胶塞,并且随后将滤液经由真空蒸馏浓缩,以提供作为无色液体的所需产物7a(114g,70%)。1hnmr(400mhz,cdcl3)δ3.33(s,2h),0.95(s,2h).13cnmr(75mhz,cdcl3):19.1,22.7,26.0。
根据其他实施方案,用乙腈中的三甲基甲硅烷基氯化物和碘化钠实现碘化,也是可能的。对于这一反应的合适温度范围为约-10至约30℃。
2.可替换的程序
将1,1-双(羟甲基)环丙烷(40.00g,388mmol)加入烧瓶中,接着加入丙酮(400ml,15vol),将反应冷却至0℃。将三乙胺(87.16g,861mmol,2.2eq.)加入反应中,然后缓慢加入甲烷磺酰氯(98.68g,861mmol,2.2eq),使得内部温度升高没有高于10℃。加入甲烷磺酰氯的过程中形成了白色沉淀物。添加完成后,使反应在0℃下搅拌1h,然后温热至20℃,并搅拌2h。
一旦判断反应完成,加入800ml(30体积)水,并且将反应搅拌15分钟。然后过滤反应,并且用100ml水洗涤。在滤器上分离作为白色固体的产物。在20℃下真空干燥,产生85.5g,86%。1hnmr(400mhz,cdcl3)δ4.16(s,2h),3.06(s,3h),0.83(s,2h)。
将双-甲磺酸酯化合物(26.5g,102.5mmol)和碘化钠(46.1g,307.5mmol,3eq.)加入圆底烧瓶中,使用顶部搅拌和温度探针,接着加入丙酮(400ml)。将烧瓶加热至内部35℃。反应变成黄色/橙色,并随着时间形成沉淀。典型的反应时间为6-7h。一旦判断反应完成,将反应过滤,并且用100ml丙酮彻底洗涤。然后将液体浓缩至~150ml,并且加入300ml含水5%亚硫酸钠溶液。加入己烷(200ml),并且将混合物搅拌最少15分钟。使层分离,并将顶部有机层通过硫酸钠(20g)干燥。然后将有机层过滤,除去硫酸钠,并且浓缩成油。产量31.0g,94%。
d.8的烷化,制备9
将氢化钠(60.0g,3eq,矿物油中的60%分散体)和二甲基乙酰胺(600ml)装入烧瓶中,并且将反应温度降至0-10℃。一旦内部温度为大约5℃,将化合物7a(191.6g,1eq)加入nah溶液中。在3.5h内加入dmac(600ml)中的化合物8a(121.0g,1eq)的溶液,保持内部温度在0-11℃之间。将溶液在0-10℃下搅拌,并且在1h后,取样测试反应完成。当8a的剩余含量低于3%时,认为反应完成。完成时,在2-3h内缓慢加入acoh(50ml,1.5eq),同时将温度保持在4-9℃。将溶液在0-10℃下搅拌12h。将mtbe(1000ml)和水(700ml)加入至淬灭的溶液中。分离层,并且用mtbe(400ml)提取含水层。将有机层合并,并且用15%nacl溶液(600ml)洗涤一次,用5%碳酸氢钠溶液(900ml)洗涤一次,并用盐水溶液(600ml)洗涤一次。将mtbe溶液浓缩至最小体积。将油重新溶解于can(400ml)中,并用己烷(200ml)洗涤。分离相,并且将can层浓缩至最小体积,并且丢弃己烷层。作为黄色油分离产物9a(98g,61%)。1hnmr(400mhz,cdcl3)δ4.45(dd,j=8.5,3.7hz,0.5h旋转异构体1),4.35(dd,j=8.4,4.4hz,0.5h旋转异构体2),4.27–4.11(m,2h),3.44–3.29(m,2h),2.26(ddd,j=12.7,8.4,4.1hz,1h),1.80(ddd,j=23.5,12.6,4.0hz,1h),1.58,1.48–1.40(m,9h),1.32–1.21(m,3h),0.68–0.44(m,4h)。
在一些实施方案中,使用其他合适的非亲核碱。这些包括醇盐,如锂、钠和钾的叔-丁氧金属。
除了dmac以外的溶剂也是可接受的。例如,这些包括n-甲基吡咯烷、二甲基甲酰胺和1,3-二甲基-3,4,5,6-四氢-2-嘧啶酮。
在以上实施例中,boc是胺保护基团。然而,在一些实施方案中,使用boc以外的其他保护基团,如甲氧基和异丙氧基羰基。保护基团也可以是cbz。
用于进行反应的合适温度范围为约-10℃至约40℃。
可替换的烷化顺序
向n,n-二甲基甲酰胺(50ml)中的n-boc-甘氨酸t-丁酯8b(10.66g;46mmol)和二溴化物7b(10.1g;44.3mmol)的冷却溶液(0℃)中,加入t-丁氧钾(13.79g;122.8mmol)。然后将所得到的浆液温热至20℃,并且在该温度下搅拌4h。然后将反应物倒入methf(100ml)和水(100ml)的搅拌溶液中。随后将所得到的有机溶液在真空下干燥并浓缩,以产生琥珀油。然后通过硅胶色谱纯化粗制材料(90:10己烷:乙酸乙酯),以获得作为无色油的产物t-丁酯9b(5.5g,42%产量)。rf:0.18(sio2,9:1己烷:乙酸乙酯).1hnmr(400mhz,cdcl3):4.33(旋转异构体#1:dd,j=8.4,2.9hz,0.35h);4.24(旋转异构体#2:dd,j=8.6,3.3hz,0.65h);3.42(旋转异构体#2:d,j=10.2hz,0.65h);3.36(旋转异构体#1:d,j=10.2hz,0.35h);3.28(旋转异构体#2:d,j=10.2hz,0.65h);3.22(旋转异构体#1:d,j=10.2hz,0.35h);2.31(旋转异构体#2:dd,j=12.7,8.6hz,0.65h);2.26(旋转异构体#1:dd,j=12.7,8.6hz,0.35h);1.70(m,1h);1.46(m,18h);0.54(m,4h).13cnmr(100mhz,cdcl3,δ):172.0,153.9,80.8,79.6,79.4,60.3,60.1,54.1,53.7,39.2,38.3,28.4,28.3,27.9,20.5,19.8,13.4,13.3,8.3。
在一些实施方案中,使用其他反应温度。反应温度可以为-50℃至50℃。
e.乙酯9的水解。
将水(910ml)、氢氧化锂(284g,2.0eq)和2-methf(2.0l)加入装备有顶部搅拌、内部温度计和氮导管(nitrogenline)的烧瓶中。将2-methf(1.0l)中的化合物9a(911g)的溶液转移至含有氢氧化锂的烧瓶中。将反应加热至50℃,认为直至反应完成,如通过hplc分析测定的。将反应冷却至22℃,并且将水(3.6l)加入反应中。分层,并且保留底部含水层,而除去上部有机层。将2-methf(4l)和浓hcl(420ml)加入含水层。分层,并且除去底部含水层。将上部有机层浓缩,并且作为白色固体分离产物17(596g,71%)。17的表征数据与上述化合物4的相同。
或者,可以使用lioh以外的其他碱。因此,在一些实施方案中,碱是氢氧化钾、氢氧化钠或硅醇钾。
在其他实施方案中,所述溶剂可以改变。合适的溶剂包括,例如,二烷基醚和环醚、甲苯和二氯甲烷。
典型的反应温度范围为约0℃至约80℃。在以上的实施例中,温度为50℃。
f.经典的溶解
经典溶解成4:
将外消旋羧酸17(596g)溶解于2-methf(6l)中,然后将均匀的溶液加热至55℃。将(1s,2r)-氨基-茚满醇(221g,0.6eq)以10分钟间隔分3个相等部分加入反应中。加入第一部分后,给溶液接种盐18a(0.6g)。加入最后一部分胺后,将溶液在55℃下老化1h。然后以~15度/小时的速率将浆液冷却至22℃。一旦浆液已经达到室温,过滤,并且用2-methf(1.2l)将滤饼洗涤一次。将固体在真空炉中在45℃下干燥24h。分离作为白色固体的化合物18a(320g,33%)。
将固体18a溶解于methf(1.5l)中,加入1mhcl(1.0l),并且将两相混合物搅拌30min,直至固体溶解。除去下部的含水层,并且用1mhcl(1l)洗涤有机层,然后用h2o(500ml)洗涤。将有机层通过mgso4(每次250g)干燥20min,过滤,并用methf洗涤滤饼。将这种相同的干燥程序重复第二次,然后将溶液浓缩成油,产生4(197g,100%)。
在经典溶解途径的其他实施方案中,溶解剂选自作为两个实例的(s)-(-)-1-甲基苄胺和(1s,2r)-(+)-降麻黄碱。可替换的溶剂包括二烷基醚和环醚、二氯甲烷和烷基乙酸酯,如乙酸乙酯。合适的反溶剂包括,例如,己烷和庚烷。在一些实施方案中,反应温度范围为约0℃至约75℃。
经典溶解的可替换实施例:
向2-甲基四氢呋喃(47wt%17;52.3g,217mmol)中的外消旋羧酸17的溶液中加入2-甲基四氢呋喃(520ml)。然后向该稀释的溶液中加入(r)-2-氨基-1-丁醇(13.5g,152mmol),并且将所得到的浆液在20℃下搅拌最小20h。然后过滤反应物,并且用庚烷(100ml)洗涤固体,在40℃下真空干燥,获得作为白色晶体固体的产物羧酸铵18b(22.6g,32%产量)。1hnmr(400mhz,cdcl3,4.90(s,宽,4h);4.25(旋转异构体#1:dd,j=8.4,4.5hz,0.5h);4.21(旋转异构体#2:dd,j=8.2,5.7hz,1h);3.76(dd,j=11.7,3.7hz,1.5h);3.55(dd,j=11.7,6.6hz,1.5h);3.43(旋转异构体#2:d,j=10.3hz,1h);3.34(旋转异构体#1:m,1h);3.26(旋转异构体#2:d,j=10.2hz,1h);3.10(dddd,j=6.8,6.8,6.8,3.7hz,1.5h);2.19(旋转异构体#1:dd,j=12.5,8.6hz,0.5h);2.14(旋转异构体#2:dd,j=12.3,8.2hz,1h);1.91(旋转异构体#2:dd,j=12.5,5.7hz,1h);1.84(旋转异构体#1:dd,j=12.5,4.7hz,0.5h);1.67(m,3h);1.46(m,12h);1.04(t,j=7.4hz,4.5h);0.58(m,6h).13cnmr(100mhz,cdcl3,δ):180.4,156.5,80.8,80.5,63.5,63.0,62.0,55.9,55.6,55.0,40.8,40.2,28.9,28.8,23.7,21.8,21.4,12.5,11.5,10.9,10.2,9.9。
g.乙酯19的模拟移动床(smb)色谱和水解
smb和水解成4
使用
将水(910ml)、氢氧化锂(284g,2.0eq)和2-methf(2.0l)加入装备有顶部搅拌、内部温度计和氮线的烧瓶中。将2-methf(1.0l)中的19(911g)的溶液转移至含有氢氧化锂的烧瓶中。将反应加热至50℃,直至认为反应完成,如通过hplc分析测定的。将反应冷却至22℃,将水(3.6l)加入反应中。分层,并且保留底部含水层,同时除去上部有机层。将2-methf(4l)和浓hcl(420ml)加入含水层中。分层,并且除去底部含水层。将上部有机层浓缩,并且分离作为白色固体的产物(596g,71%)。
用于以上smb步骤的合适手性相是本领域公知的。两个实例是
在一些实施方案中,水解剂选自可替换的物质,如氢氧化钾、氢氧化钠和硅醇钾。溶剂系统也可以改变并且选自二烷基醚和环醚、甲苯和二氯甲烷,作为一些实例。合适的反应温度范围为约0℃至约80℃。
h.酶溶解
酶溶解成4
向0.2mph7磷酸盐缓冲剂(104g)的溶液中加入
其他酶试剂对于进行溶解是可接受的。例如,南极假丝酵母(candidaantarctica)脂酶b的任何可替换脂酶形式对于这种转化是有效的。为溶剂的变化,提供了一些实施方案,所述溶剂包括二烷基醚、环醚、丙酮和二甲亚砜(dmso)。反应温度可以在约22℃至约50℃之间变化。
在另一个实施方案中,本发明提供了之前制备化合物4的程序的替换方案。以下的合成略图说明了这一实施方案:
i.环丙烷化
环丙烷化成12
因此,将化合物1(40.0g,1.0eq)、bnn(me)3cl(2.3g,0.07eq)、溴仿(45ml,3.0eq)和dcm(280ml)加入烧瓶中。将所得到的溶液在33℃下搅拌,并且在1.5-2h内加入50%氢氧化钠溶液(120ml)(内部温度不超过38℃)。将溶液在33℃下老化,直至认为反应完成,如通过hplc分析测定的。将烧瓶的内含物冷却至22℃,加入水(100ml),并且使层静置2h。除去底部含水层,并且用4mhcl(120ml)洗涤上部有机层。保留底部有机层,并且除去上部含水层。然后用水(80ml)洗涤有机层。用硅胶(12g)将下部有机层形成浆液,持续1h。将硅胶滤出,并且用dcm(80ml)将废物饼洗涤一次。减少dcm溶液的体积,并且将溶液的温度调至35℃。将己烷经由计量泵在1.5h的时间段内加入反应器中。将化合物12的种子晶体加入反应器中,在中速下搅拌浆液至少60分钟。将浆液在1h内冷却至20℃(15-25℃),并且在该温度下老化12h。将浆液在合适的滤器中在20℃下过滤。用庚烷(64ml)和dcm(16ml)溶液洗涤滤饼。将产物在40℃下干燥,以获得作为浅棕色固体的12(47g,68%,作为85:15的非对映异构体混合物)。
1hnmr(400mhz,cdcl3,δ):4.64-4.53(m,1h),3.93-3.87(m,1h),3.50(d,j=11.1hz,0.4h),3.29(d,j=11.1hz,0.6h),2.84(d,j=9.6hz,0.25h),2.66(dd,j=13.2,8.8hz,0.75h),2.24(d,j=13.4hz,1h),2.07–1.69(m,2h),1.47(m,9h)。
为了使用氯仿,提供了可替换的实施方案,其将产生化合物12的二氯类似物,其然后可以通过如下所述的随后步骤来进行。
naoh以外的其他碱也是合适的。这些包括作为两个实例的氢氧化钾和叔-丁氧钾。
溶剂也可以改变。例如,合适的溶剂包括甲苯、苯、二烷基醚和环醚。
典型的反应温度范围为约0℃至约60℃。
j.氢化
还原成4
将化合物12(20.0g)溶解于异丙醇(160ml)中,然后将均匀的混合物温热至40℃。将koh(17.0g,6eq)饼加入溶液中,并且搅拌直至固体溶解。用n2气冲洗溶液,然后加入pd/c10%装载degussae101ne/w(4.0g)。用h2气重新冲洗系统,并在1atmh2下在40℃下搅拌。通过hplc分析确定反应完成。完成时,将溶液冷却至约22℃,并且用n2气冲洗。通过硅藻土垫过滤除去固体。用h2o(100ml)冲洗固体。然后将清澈的溶液浓缩至其初始体积的一半。搅拌混合物,然后分层。用mtbe(40ml)提取含水层,然后合并有机层,并用水(40ml)洗涤。将溶液浓缩,以提供作为白色固体的4(9.9g,82%)。
实现氢化的反应条件和试剂的变化也是熟练化学家公知的。例如,可以使用其他pd/c来源,如氢氧化钯碳。碱也可以改变,如选自碳酸钾、碳酸钠、氢氧化钠、t-丁氧钾、磷酸钠和磷酸钾。
溶剂的合适替换物包括甲醇、乙醇、甲苯、苯以及二烷基醚和环醚。
氢化温度可以在约20℃至约80℃的范围中。
k.钾盐形成
钾盐形成成10
将羧酸4(219g)溶解于2-methf(880ml)中,然后将溶液加热至约35℃。缓慢加入thf(1.05l)中的1.0mtbuok,使得内部温度不超过40℃。将浆液搅拌约30分钟,然后在约2小时内缓慢冷却至约20℃。将浆液在20℃下老化1h,然后过滤。用2-methf(715ml)洗涤滤饼。将固体在40℃下在真空炉中干燥24h。作为白色固体(212g,86%)分离最终产物10。1hnmr(400mhz,cdcl3)δ4.07(t,j=7.3hz,1h),3.44(d,j=10.4hz,1h),3.35(s,1h),3.10(d,j=10.4hz,1h),2.03(dd,j=12.3,6.9hz,1h),1.89(dd,j=12.3,8.0hz,1h),1.38(s,9h),0.71–0.27(m,4h).1hnmr(400mhz,d6-dmso,δ):3.89(dd,j=8.6,4.1hz,0.4h旋转异构体1),3.85(dd,j=8.6,4.3hz,0.6h旋转异构体2),3.21–3.07(m,2h),2.00–1.92(m,1h),1.75–1.71(m,1h)1.36(s,4h旋转异构体1),1.32(s,5h旋转异构体2),0.46–0.37(m,4h).13cnmr(100mhz,d6-dmso)δ174.5,174.4,154.1,153.4,77.2,76.9,62.3,62.0,54.1,53.8,38.7,28.4,28.3,20.6,19.9,11.8,11.6,10.5,10.2。
其他溶剂适用于盐形成。例如,这些包括二烷基醚和环醚。
ii.到中间体22的途径
a.中间体20的合成
将3-颈烧瓶中装满2-溴代芴(100g)和乙酸(2100g)。将内容物加热至40-45℃,并且搅拌大约30分钟,以获得清澈的溶液。调节内部温度至20-30℃后,加入20%(v/v)aq.h2so4(200g,用64.0gh2so4和136g水制得),接着加入i2(53.0g,0.512摩尔当量),接着加入kio3(17.5g,0.200摩尔当量)。将浆液在58℃(56-60℃)下加热约4h。然后将浆液冷却至20-25℃,并且将9%na2so3溶液(na2so3,47.0g;水,500g)加入反应混合物中,同时保持内部温度在20-30℃。将浆液在25℃下搅拌1h,并过滤。用85wt%hoac(200g,用170ghoac和30g水制得)冲洗滤饼,接着用水(200g,2.0wt当量)冲洗。排出滤饼,并且在水(1500g)中洗涤浆液约1h,然后过滤,并用水冲洗,直至冲洗液的ph为6-7,并且进一步用庚烷(200g)冲洗。将固体在真空下干燥,产生143g作为白色固体的产物20(95%产量,通过hplc96%an纯度)。
反应温度范围可以为约20℃至100℃。典型的温度范围为约20℃至约60℃。
b.中间体21的合成
将起始材料(20,100g)和n-氟代苯磺酰亚胺(nfsi,251g,2.95摩尔当量)作为固体加入烧瓶中。向混合物中加入thf(1000g),并且使用搅拌,使固体溶解。通过缓慢施加真空,接着用氮破坏真空,将溶液脱气三次。将溶液在-78℃浴中冷却至-68℃的内部温度。冷却时,形成了白色至灰白色浆液。以使得内部温度保持在低于-55℃的速率加入碱溶液(thf中的1.0mlihmds,720g,3.00摩尔当量)。对于大部分的添加,内部温度<-60℃,总添加时间为约1h。通过hplc分析监控反应完成。通过加入nh3/meoh(meoh中的7nnh3,8g)淬灭反应,并且除去冷浴。内部温度温热至-20℃后,hplc分析显示出过量的n-氟代苯磺酰亚胺完全消耗。将内部温度调节至0℃。加入庚烷(342g),并且将溶液搅拌10分钟。如果需要,将温度调节至20-25℃。将浆液过滤,并且用thf/庚烷混合物将固体冲洗两次(对于每次冲洗:thf,89.0g;庚烷,205g)。将滤液在5℃(2-8℃)下存储大约20h。然后将溶液滤至烧瓶中,并且在35℃的最大内部温度下真空浓缩至2.5-3.0体积。加入ch2cl2(1500g),并且在回流(大约40℃)下搅拌浆液30分钟。调节内部温度值20-25℃后,将浆液通过硅藻土垫过滤,并且用dcm(400g,4.0wt当量)冲洗滤饼。在真空下将滤液浓缩至约3体积。加入甲醇(600g),并且将混合物浓缩至约4体积,加入另外的甲醇(300g),并且将混合物再次浓缩至约4.0体积(300体积)。将浆液过滤,并且用甲醇冲洗两次(对于每次冲洗,100g)。将产物21在真空下干燥,产生90g作为灰白色至浅黄色固体的产物(82%产量,通过hplc97-98%an纯度)。1hnmr(400mhz,cdcl3,δ):7.94(d,j=1.2hz,1h),7.81(d,j=7.8hz,1h),7.74(d,j=1.4hz,1h),7.60(d,j=8.3hz,1h),7.41(d,j=8.1hz,1h),7.29(d,j=8.0hz,1h).19fnmr(376mhz,cdcl3)-111.0(s,2f)。
在一些实施方案中,本发明提供了使用其他碱用于合成21。这些包括,例如,六甲基二硅氮烷钠(nahmds)、khmds和二异丙基酰胺锂(lda)。
c.中间体22的合成
将3-颈烧瓶装满21(100g)和thf(800ml)。通过缓慢施加真空,接着用氮气破坏真空,将溶液脱气三次。将溶液冷却至-10℃内部温度。缓慢加入thf(125g,1.04摩尔当量)中的2ni-prmgcl溶液,通式将内部温度维持在-10℃至0℃。然后将所得到的混合物在-10℃下搅拌30分钟,直至反应完全。将2-氯-n-甲氧基-n-甲基乙酰胺(40.6g,1.20摩尔当量)溶解于mtbe(122g,1.22wt当量)中,并且通过1μm滤器过滤。然后将乙酰胺的mtbe溶液缓慢加入烧瓶中,维持内部温度在-10℃至0℃。添加完成时,将内部温度调至0℃,并且搅拌2h。反应完成后,将1nhcl(750g)缓慢加入,使得内部温度没有超过20℃。如果需要,将内部温度调至20℃。分层,并且用mtbe(410g)提取含水层。合并有机层,并且通过mgso4干燥。滤掉mgso4,并且用thf(200g)冲洗。在真空下将滤液和冲洗液浓缩10体积(1000ml)。加入异丙醇(785g),并且开始形成少量晶体。将该浆液在真空下再次浓缩至10体积(1000ml)。将内部温度调至20-25℃,并且搅拌大约30分钟。将浆液过滤,并且用异丙醇(100g)冲洗,然后在真空下干燥,以提供62.28g作为灰白色至浅黄色固体的产物22(70.8%,通过hplc98%纯度)。1hnmr(400mhz,cdcl3,δ):8.19(s,1h),8.12(d,j=7.8hz,1h),7.82(s,1h),7.67(d,j=8.0hz,2h),7.52(d,j=7.8hz,1h),4.71(s,2h).19fnmr(376mhz,cdcl3)-111.4(s,2f)。
在一些实施方案中,溶剂是2-methf。
iii.中间体24的合成
a.23的制备
将化合物22(10.8g,1.05eq)和化合物10(8.0g,1.0eq)溶解于丙酮(106ml)中。将异质混合物加热至55℃,并且老化直至认为反应完成,如通过hplc测定的。缓慢加入水(22ml),并且将溶液在55℃保持30分钟。将溶液冷却至50℃,并且加入23的晶种。缓慢加入另一部分的水(11ml)。将溶液在50℃老化1h,然后在2h的时间段内冷却至20℃(15-25℃)。将浆液在20℃(15-25℃)下过滤,并且用丙酮(18ml)和水(6ml)的混合物洗涤滤饼。将产物干燥,获得作为黄色固体的23(12.8g,95%)。1hnmr(400mhz,cdcl3,旋转异构体的混合物,δ):8.13(s,1h),8.07–7.97(m,1h),7.79(s,1h),7.67–7.56(m,2h),7.53–7.44(m,1h),5.61(d,j=16.3hz,0.5h),5.47(d,j=16.2hz,0.5h),5.29(d,j=16.2hz,0.5h),5.15(d,j=16.3hz,0.5h),4.62(dd,j=8.7,3.5hz,0.5h),4.55(dd,j=8.7,4.0hz,0.5h),3.48–3.28(m,2h),2.43–2.35(m,1h),2.17–2.07(m,1h),1.48(s,9h)0.77–0.55(m,4h);13cnmr(100mhz,cdcl3)δ190.8,190.3,172.2,172.0,154.4,153.7,143.7–143.4(m),140.3(t,j=25.9hz),138.2(t,j=25.4hz),136.9–136.5(m),135.5,135.4,134.7,134.6,132.4,127.7,124.2,124.1,123.2,123.2,122.7,121.6(t,j=244hz),120.8,120.8,80.1,80.0,66.0,65.9,59.4,59.0,54.3,53.7,38.9,38.0,28.4,28.3,20.7,20.0,12.9,12.3,8.8,8.3.19fnmr(376mhz,cdcl3)δ-111.41(s),-111.43(s)。
在一些实施方案中,用化合物4取代化合物10。在这些实施方案中,在碱的存在下进行以上所述的合成,所述碱例如选自碳酸钾、碳酸钠和叔胺碱。
在以上所示反应的另一个实施方案中,将化合物4的(1s,2r)-氨基-茚满醇盐(化合物18a)或化合物4的2-氨基丁醇盐(化合物18b)与化合物22直接反应,产生化合物23。
在其他实施方案中,反应溶剂是芳香烃,如甲苯或苯;脂族醚,如二烷基醚,其的一个实例是二乙醚;环醚,如四氢呋喃;烷基乙酸酯,如乙酸乙酯;极性杂环溶剂,如n-甲基吡咯烷酮和1,3-二甲基-3,4,5,6-四氢-2-嘧啶酮;以及极性质子惰性有机溶剂,如二甲基甲酰胺和二甲基乙酰胺。
合适的反应温度范围为约20℃至约75℃。
b.咪唑24形成
向化合物23(7.0g)和醋酸铵(4.8g,5.0eq)中加入甲苯(62ml)和2-甲氧基乙醇(3.5ml)。将异质/两相混合物加热至90℃,并且老化直至认为反应完成,如通过hplc分析测定的。将溶液冷却至55℃,并且搅拌,直至形成24的浆液(如果需要,可以加入种子)。在55℃下在1h内加入庚烷(104ml),然后将浆液在3h内冷却至22℃。一旦浆液达到室温,将其老化1h。将浆液过滤并用庚烷(15ml)洗涤。然后将固体溶解于dmac(42ml)中。将溶液加热至45℃,并且将水(7ml)加入溶液中。将溶液的温度提高至50℃,并且加入24的晶种。将浆液老化30min,然后在1h内加入第二部分的水(9.1ml)。完成时,将浆液在3h内冷却至22℃,并且在室温下老化1h。滤出固体,并且用dmac(5ml)和水(2ml)溶液洗涤。使用最终的庚烷(23ml)洗涤,以置换出dmac和水。将固体在真空炉中在45℃下干燥。分离作为棕色固体的最终产物24(5.2g,77%)。1hnmr(400mhz,dmso,旋转异构体的混合物,δ):12.31–11.78(m,1h),8.15–8.03(m,1h),8.02–7.84(m,2h),7.84–7.43(m,4h),5.04–4.84(m,1h),3.62–3.21(m,2h),2.42–2.09(m,1h),2.08–1.78(m,1h),1.40(s,4h),1.17(s,5h),0.75–0.31(m,4h);19fnmr(376mhz,cdcl3)δ-103.85(s),-104.03(s).ms-esi+:[m+h]+c27h27brf2n3o2的分析计算值,542.1,544.1;实测值,542.1,544.1。
在一些实施方案中,通过使用较大链碳水化合物的铵盐来实现咪唑形成,rco2-,其中r是直链或支链c1-c20-烷基。
在其他实施方案中,溶剂选自甲苯、苯、二烷基醚和环醚,以及烷基乙酸酯,如乙酸乙酯。溶剂添加剂包括乙酸和醇(roh)。
合适的反应温度范围为约50℃至约120℃。
iv.中间体28的合成
a.25的合成
b.26和27的合成
向烧瓶中加入25(20.00g,0.083mmol)、4-溴-1,2-苯二胺(16.74g,0.089mmol,1.08eq.)、羟基苯并三唑(hobt)(13.96g,0.091mol,1.1eq.)和1-乙基-3-(3-二甲基氨基丙基)碳二亚胺hcl(edc.hcl)(17.48g,0.091mmol,1.1eq.)。使用搅拌使反应冷却至大约10℃。在5分钟内加入n-甲基吗啉(nmm)(27.34ml,0.249mol,3eq.),保持内部温度低于20℃。将反应在室温下搅拌20h。反应完成时,将反应混合物加入分液漏斗中的mtbe(200ml)和水(600ml)中,并且温和振荡。使层分离,并且取出含水层。用mtbe(50ml)提取含水层两次,并且合并有机提取物。然后用水(500ml)提取合并的有机提取物,形成没有充分分离的混合物。将混合物通过合适的固体支持物过滤,并且分离层。将有机相在真空下浓缩,并且将所得到的残余物溶解于二异丙醚(100ml)中。使用搅拌将溶液冷却至大约5℃。缓慢加入乙酸(5.22ml,1.1eq.),保持内部温度低于10℃,并且将所得到的悬浮液在5℃下搅拌2h。然后将浓稠悬浮液过滤,并且用二异丙醚(100ml)冲洗固体,接着用庚烷(100ml)冲洗。将滤饼在真空下干燥,以获得作为区域异构体26和27混合物的浅米色固体的产物(28.19g,72%,>99%an)。1hnmr(400mhz,dmso)26&27的混合物(数据是针对主要的区域异构体的两种旋转异构体的):δ9.25(s,0.5h),9.13(s,0.5h),7.08(d,j=8.3hz,0.5h);7.06(d,j=8.2hz,0.5h),6.92(d,j=2.2hz,0.5h),6.89(d,j=2.1hz,0.5h),6.71(dd,j=8.4,2.2,0.5h),6.66(dd,j=8.4,2.2,0.5h),5.10(brs,1h),5.05(brs,1h),4.15(brs,0.5h),4.10(brs,0.5h),3.76(s,1h),2.64(brs,1h),1.96-1.88(m,1h),1.77-1.67(m,1h),1.67-1.19(m,4h),1.41(s,4.5h),1.33(s,4.5h).ms-esi+:[m+h]+c18h25bro3n3的分析计算值,410.1,412.1;实测值,410.0,412.0。
在一些实施方案中,本发明提供了其他耦合剂的使用。这些包括但不限于n,n’-二环己基碳二亚胺(dcc)、n,n’-二异丙基碳二亚胺(dic)、6-氯-2,4-二甲氧基-s-三嗪(cdmt)、o-苯并三唑-n,n,n’,n’-四甲基-脲-六氟-磷酸酯(hbtu)和2-(7-氮杂-1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸酯(hatu)。
胺碱也可以改变或完全省略。例如,胺可以选自叔胺(r3n)、2,6-卢剔啶、吡啶、二环己基甲胺和n-甲基吗啉(nmm)。
合适的溶剂替换物选自dmf、nmp、二烷基醚和环醚r2o、thf、2-methf、dcm、dce、甲苯、etoac、ipac、丙酮、mibk和mek。
反应的合适温度范围约-20℃至80℃。
c.中间体28的合成
向反应器中加入26/27混合物(50.0g,0.106mol)。加入mtbe(200ml,4v),并且向悬浮液中,加入冰醋酸(30.4ml,0.532mol,5eq.)。将混合物加热至55℃,形成棕色均匀的溶液,并且在该温度下搅拌18h。通过hplc测定反应完成时,将溶液冷却至大约10℃,然后用含水koh(200mlh2o中35g,)淬灭,保持内部温度低于20℃。将两相混合物强烈搅拌15min。停止搅拌,并使层分离。排出含水层,并且用mtbe(50ml)再次反提取。将有机提取物合并,加入h2o(300ml),并且将两相混合物强烈搅拌15min。停止搅拌,并使层分离。排出含水层,将棕褐色有机层精制过滤。将溶剂蒸馏至大约50ml的体积。加入二异丙醚(ipe,150ml),同时保持内部温度高于48℃,将溶液蒸馏至大约80ml的总体积。再次加入ipe(150ml),并将溶液蒸馏至大约120ml的总体积。将该过程持续至溶剂主要是二异丙醚,如通过约69℃的蒸馏过程中内部温度所示的或通过1hnmr测定的。然后将总体积调至大约120ml,并且使溶液过夜缓慢冷却(10℃/h)至0℃,导致浆液形成。然后将浆液过滤,并且用冷ipe(100ml)冲洗。收集固体,并且在真空炉中干燥,以获得28(39.23g,94%产量,>99.5%an)。1hnmr(400mhz,cdcl3,δ):10.70(s,1h),7.86(s,0.5h),7.58(d,j=8.6hz,0.5h),7.54(s,0.5h),7.30(d,8.3hz,1h),7.25(d,j=8.0hz,0.5h),4.52(d,j=3.6hz,1h),4.15(s,1h),3.43(d,j=3.2hz,1h),2.03–1.94(m,1h),1.93–1.81(m,1h),1.80–1.55(m,4h),1.52(s,9h).ms-esi+:[m+h]+c18h23bro2n3的分析计算值,392.1,394.1;实测值,392.1,393.9
典型的反应温度范围为约20℃至100℃。
在一个实施方案中,用甲苯替代ipe和/或mtbe。
v.通式i的化合物的合成(化合物31)
a.化合物29的合成
1a.使用双(频哪醇)二硼的pdcl2[p(t-bu)2ph]2实例
将化合物28(24.98g)、双(频哪醇)二硼(19.40g)、丙酸钾(21.40g)和pdcl2[p(t-bu)2ph]2(2.04g)加入反应器中,并且将反应器惰化。加入乙酸异丙酯(250ml),开始搅拌,并且将反应器再惰化。将反应混合物加热至75℃,并且搅拌3.5h。冷却至25℃后,将化合物24(29.31g)加入反应混合物中,并且将反应器惰化。将脱气的含水1mk3po4(223ml)加入反应器中,并且将反应混合物加热至75℃。将反应混合物在该温度下保持1h,然后冷却至35-40℃。加入n-乙酰-l-半胱氨酸(6.27g),并且将混合物在35-40℃下搅拌15h。将反应混合物冷却至20℃,停止搅拌,并且使层分离。分离相,并且将n-乙酰-l-半胱氨酸(6.27g)加入有机层中。将反应混合物加热至45-50℃。将混合物在45-50℃下搅拌2h,将反应冷却至20℃,并且加入5%含水naoh(250ml)。分离相,并且用5%含水nacl(125ml)洗涤有机层。然后用5%含水nacl(125ml)处理有机相,并且经由过滤通过滤纸转移至分液漏斗中。分离层。将有机相转移至反应器中,并且通过真空蒸馏浓缩至大约160ml。加入iprac(20ml),使终体积为大约180ml。加入乙醇(100ml),并且将内含物加热至大约50℃。然后将乙醇(40ml)中的草酸(100ml)溶液加入混合物中。将溶液接种29草酸盐(200mg),并且在50℃下老化72h。在5h内加入乙酸异丙酯(240ml)。通过过滤收集产物,并用乙酸异丙酯中的乙醇溶液(48mletoh,191mlipac)洗涤,并且在真空下45℃干燥,提供作为灰白色固体的29草酸盐(41.46g,81%产量)。1hnmr(400mh,dmso-d6,δ)11.80(brs,4h),8.11(d,j=1.2hz,1h),8.00(d,j=9.2hz,1h),7.98(s,1h),7.90(s,2h),7.87,(d,j=9.2hz,1h),7.85(s,1h),7.80(s,1h),7.60(dd,j=8.4,1.2hz,1h),7.56(dd,j=7.6,1.6hz,1h),5.03(m,0.5h),4.99(m,0.5h),4.52(s,0.5h),4.50(s,0.5h),4.28(brs,0.5h),4.19(brs,0.5h),3.48(m,1h),3.34(m,1h),2.66(brd,j=12.7hz,1h),2.38(m,0.5h),2.26(m,0.5h),2.04(m,1h),1.96(m,0.5h),1.86(d,j=11.6hz,0.5h),1.77(m,1h),1.70(m,1h),1.64(2h,m),1.43(s,6h)1.41(s,3h),1.35(m,1h),1.19(s,5h),1.14(s,4h),0.65(m,2h)0.54(m,1h),0.42(m,1h).hrms-esi+:[m+h]+c45h49o4n6f2的分析计算值,775.3778;实测值,775.3773。
1b.使用双(新戊二醇)二硼的pdcl2[p(t-bu)2ph]2实例
将化合物28(20.1g)、双(新戊二醇)二硼(13.2g)、丙酸钾(17.1g)和pdcl2[p(t-bu)2ph]2(1.6g)加入反应器中,并且将反应器惰化。加入乙酸异丙酯(200ml),开始搅拌,并且将反应器再惰化。将反应混合物加热至72℃,并且搅拌2h。冷却至20℃后,将化合物24(24.9g)加入反应混合物中,并且将反应器惰化。将脱气的含水1mk3po4(186ml)加入反应器中,并且将反应混合物加热至72℃。将反应混合物在该温度下保持1h,然后冷却至20℃。停止搅拌,并且分离相。用5%含水nacl(300ml)洗涤有机层。加入n-乙酰-l-半胱氨酸(6g),并且将混合物在20℃下搅拌16h。加入
2.pd(oac)2/mephos实施例
将化合物28(69.96g)、双(频哪醇)二硼(45.33g)、醋酸钾(69.96g)和mephos(2-二环己基膦基-2’-甲基联苯,6.53g)加入夹套反应器中,并且将容器惰化。加入新鲜脱气的t-戊醇(700ml),并且开始搅拌。将醋酸钯(1.99g)作为固体一次性地加入,并且将反应混合物在环境温度下搅拌0.5h,加热至85℃,并且保持1h。冷却至25℃后,加入化合物24(82.27g)和脱气的含水k3po4(625ml,h2o中1.0m)。将反应容器惰化,并且将反应混合物加热至20℃。相分离后,用5%含水nacl(2x700ml)洗涤有机层,并且真空浓缩,提供溶解于乙酸异丙酯(1.62l)中的油。持续真空蒸馏,直至获得最小可搅拌体积(大约300ml)。加入另外的乙酸异丙酯(700ml),并且将所得到的浆液通过硅藻土(28g)过滤。用乙酸异丙酯(500ml)洗涤滤饼后,用n-乙酰-l-半胱氨酸(17.5g)处理滤液,并且将混合物在环境温度下搅拌3.5h。将混合物冷却至15℃,并且加入5%含水naoh(700ml)。温热至25℃后,将混合物过滤,并且分离相。用5%含水naoh(700ml)和5%含水nacl(2x700ml)洗涤有机层。用另外的n-乙酰-l-半胱氨酸(17.5g)处理所得到的有机相,并且将浆液在环境温度下搅拌14h。将混合物冷却至15℃,并且加入5%含水naoh(700ml)。温热至25℃后,分离相;并过滤有机层。用乙酸异丙酯(160ml)洗涤滤器,并且用5%含水naoh(700ml)和5%含水nacl(2x700ml)洗涤滤液。将有机相过滤,并且经由真空蒸馏浓缩至500ml。加入另外的乙酸异丙酯(250ml),并且持续蒸馏直至获得最终500ml的体积。加入乙醇(335ml),并且将溶液加热至50℃。在15min内加入乙醇(110ml)中的草酸(24.51g,136mmol)溶液。加入乙醇冲洗(25ml)。然后将溶液接种29草酸盐(527mg)。将浆液在50℃下老化20h。在3h内加入乙酸异丙酯(620ml),并且在3h内将浆液冷却至15℃。通过过滤收集固体,并且用乙酸异丙酯(2x300ml)洗涤产物饼。干燥后,分离作为浅黄色固体的29(117.53g,76.9%产量)。
根据另一个实施方案,如以下图中所示的相反反应顺序来合成化合物29。
b.化合物29的两-boc去保护
在65℃下,向mecn(324ml)中的29(92.5g,119mmol)的溶液中,加入1.5n含水hcl溶液(398ml,5.0eq)。将反应混合物在65℃下搅拌约2h,并且通过hplc分析监控完成。确定消耗起始材料后,将反应混合物的温度调至45℃。在≥30min的过程中加入乙腈(648ml),以维持40-50℃的内部温度。这种反溶剂添加完成后,加入30盐酸盐的种晶(0.103g)。将浆液在45℃下老化≥1h。在≥30min的过程中加入另外的mecn(1480ml),以维持40-50℃的内部温度。将浆液在≥2h的过程中冷却至20℃,然后过滤。将湿饼干燥,提供84.6g的30(作为四-hcl盐,还包括~6%h2o含量,80.4%产量)。典型的含水量范围为约4%至约13%。1hnmr(400mhz,dmso-d6,δ):10.83(brs,2h),10.44(brs,2h),10.33(brs,1h),9.33(brs,1h),8.37(s,1h),8.36(s,1h),8.26(d,j=8.0hz,1h),8.08(d,j=0.8hz,1h),8.06(d,j=8.0hz,1h),8.03(d,j=0.8hz,1h),8.01(d,j=8.4hz,1h),7.98(dd,j=8.0,1.2hz,1h),7.79(dd,j=8.4,0.4hz,1h),7.75(dd,j=8.4,1.2hz,1h),5.29(dd,j=8.0,7.6hz,1h),4.82(d,j=3.6hz,1h),4.19(s,1h),3.65(d,j=10.8hz,1h),3.14(s,1h),3.12(d,j=10.8hz,1h),2.85(dd,j=13.2,9.6hz,1h),2.23(dd,j=12.8,7.6hz,1h),2.11(m,1h),1.99(d,j=11.2hz,1h),1.83(m,1h),1.76(m,1h),1.71(d,j=10.8hz,1h),1.67(m,1h),0.84(m,2h),0.70(m,2h).hrms-esi+:[m+h]+c35h33n6f2的分析计算值,575.2729;实测值,575.2729。
从ch3cn和含水hcl的混合物分离作为晶体固体的化合物30。在一个实施方案中,化合物30是通过x-射线粉末衍射(xprd)表征的晶体多晶型物,型i。x-射线粉末衍射图显示于图1中。
在一个实施方案中,型i通过包括7.1,8.2,10.8°2θ±0.2°2θ的xprd峰来表征,如使用
在另一个实施方案中,型i通过包括7.1、8.2、10.8、11.1、12.8、14.1、14.8、16.1、18.9、24.5、24.9和25.9°2θ±0.2°2θ的xprd峰来表征。
在一个实施方案中,化合物30是通过x-射线粉末衍射(xprd)表征的晶体多晶型物,型ii。x-射线粉末衍射图显示于图2中。
在一个实施方案中,型ii通过包括7.4、9.4、11.6°2θ±0.2°2θ的xprd峰来表征,如使用
在另一个实施方案中,型ii通过包括7.4、7.5、9.4、11.6、14.9、15.2、22.5、23.2和26.3°2θ±0.2°2θ的xprd峰来表征。
根据其他实施方案,可以通过使用其他试剂来进行去保护。这些包括,但不限于,hcl、hbr、磷酸、p-甲苯磺酸、硫酸、苯磺酸和tfa。
合适的溶剂替换物包括醇,如异丙醇、乙醇和n-丁醇;极性质子惰性有机溶剂,如n,n-二甲基乙酰胺;极性杂环溶剂,如n-甲基吡咯烷酮;环醚,如四氢呋喃和2-甲基四氢呋喃;脂族醚,如二乙醚和二异丙醚;烷基乙酸酯,如乙酸乙酯和乙酸异丙酯;以及芳香族烃,如苯和甲苯。
典型的反应温度范围为约20℃至约85℃。
c.酰胺耦合
将edc-hcl(4.39g)、hobt(2.06g)、moc-缬氨酸(4.02g)和dmf(50ml)加入烧瓶中。将反应混合物在23℃下搅拌20min。然后将溶液冷却至0℃。将30-hcl盐(5.0g)和n-甲基吗啉(5.03ml)加入反应混合物中。将内含物温热至室温,并且在23℃下搅拌4h。将水(2.5ml)加入反应混合物中,并且分离层。向有机层中加入etoac(50ml)和水(50ml),将层混合,然后分离。用5%含水nahco3(50ml)和水(2x25ml)洗涤有机层。然后将有机层蒸馏至2.5vol(12.5ml),并且冷却至23℃。将丙酮(70ml)加入有机层中。将反应内含物接种化合物31(丙酮溶剂化物),并且搅拌15h。将内含物过滤,用丙酮(5ml)洗涤湿饼,将饼干燥,提供4.78g作为丙酮溶剂化物的31(73%)。1hnmr(400mhz,dmso-d6,δ):12.29(s,0.1h),12.19(d,j=4.0hz,1h),12.14(s,0.2h),11.85(s,1h),8.10(s,0.1h),8.08(s,1h),8.01(s,0.1h),7.963(m,1h),7.955(s,1h),7.89(d,j=6.4hz,1h),7.87(s,1h),7.83(dd,j=8.4,2.4hz,1h),7.79(dd,j=7.2,2.8hz,1h),7.78-7.90(misc.,0.9h),7.70(s,1h),7.61(d,j=8.4hz,1h),7.55(s,1h),7.51(dd,j=8.8,1.6hz,1h),7.44(m,0.1h),7.31(d,j=8.4hz,1h),7.21(d,j=8.4hz,1h),6.91(d,j=8.0hz,0.2h),6.77(m,0.2h),5.34(d,j=7.6hz,0.1h),5.20(dd,j=8.0,5.2hz,1h),5.18(m,0.1h),4.88(s,0.1h),4.67(d,j=6.4hz,1h),4.55(s,1h),4.17(dd,j=8.0,8.0hz,1h),4.10(m,0.2h),4.01(dd,j=8.4,8.0hz,1h),3.97(m,0.1h),3.82(d,j=9.6hz,1h),3.77(s,0.2h),3.71(d,j=9.6hz,1h),3.554(s,3h),3.548(s,3h),3.43(s,0.4h),3.20(d,j=7.6hz,0.3h),2.77(s,0.1h),2.66(s,1h),2.41(d,j=8.8hz,1h),2.22(dd,j=12.4,8.0hz,1h),2.13(m,0.4h),2.08(s,6h),2.05(dd,j=13.2,5.2hz,1h),1.99(m,2h),1.92(m,1h),1.77(m,2h),1.61(m,0.3h),1.56(m,1h),1.46(d,j=9.2hz,1h),1.33(d,j=10.0hz,0.1h),0.97(dd,j=6.4,2.0hz,3h),0.93(d,j=6.8hz,3h),0.88(d,j=6.4hz,3h),0.87(d,j=6.4hz,3h),0.80-1.05(misc.,2h),0.70(m,1h),0.59(m,2h),0.54(m,1h),0.33(m,0.1h).hrms-esi+:[m+h]+c49h55o6n8f2的分析计算值,889.4207;实测值,889.4205。
在一些实施方案中,耦合剂选自dcc、dic、cdmt、hbtu和hatu。
根据其他实施方案,合适的碱包括叔胺r3n、2,6-卢剔啶、吡啶、二环己基甲胺和nmm。
用于上述耦合的可替换溶剂包括dmac、can、etoac、乙酸异丙酯(ipac)、methf、ipa和t-buoh。
典型的耦合反应温度范围为约-30℃至约50℃。
d.酒石酸盐形成
将化合物31(作为丙酮溶剂化物,4.8g)加入烧瓶中,接着加入etoac(36ml),并加热至50℃。然后加入etoh(35ml)中的d-酒石酸(816mg)。将溶液接种31·d-酒石酸晶体,并且在50℃下搅拌16h。将溶液在3h内冷却至23℃,然后过滤。用1:1的etoac:etoh溶液(9ml)冲洗湿饼,然后干燥固体,提供4.33g(82%)作为d-酒石酸盐的31。1hnmr(400mhz,dmso-d6,δ):12.2(brs,2h),8.08(s,1h),7.97(s,1h),7.95(d,j=8.4,1h),7.89(d,j=8.4,1h),7.88(s,1h),7.85(d,j=8.4,1h),7.82(d,j=8.0,1h),7.68(s,1h),7.58(d,j=8.4,1h),7.53(d,j=8.4,1h),7.30(d,j=8.8,1h),7.20(d,j=8.4,1h),5.21(dd,j=8.0,5.2,1h),4.67(s,1h),4.55(s,1h),4.33(s,2h),4.17(dd,j=8.0,8.4,1h),4.01(dd,j=8.0,8.4,1h),3.82(d,j=10.0,1h),3.72(d,j=9.6,1h),3.55(s,3h),2.67(s,1h),2.41(d,j=9.2,1h),2.21(dd,j=12.4,8.0,1h),2.05(dd,j=12.4,5.2,1h),1.98(m,2h),1.92(m,1h),1.77(m,2h),1.56(m,1h),1.46(d,j=9.2,1h),0.97(d,j=6.8,3h),0.93(d,j=6.4,3h),0.88(d,j=6.4,3h),0.86(d,j=6.4,3h),0.70(m,1h),0.54(m,1h),0.55-0.62(m,2h).hrms-esi+:[m+h]+c49h55o6n8f2的分析计算值,889.4207;实测值,889.4229。
在另一个实施方案中,从无溶剂形式的化合物31形成酒石酸盐。
- 还没有人留言评论。精彩留言会获得点赞!