改性酵母细胞壁及其制备方法和应用与流程
本发明涉及微生物应用
技术领域:
,具体涉及一种改性酵母细胞壁及其制备方法和应用。
背景技术:
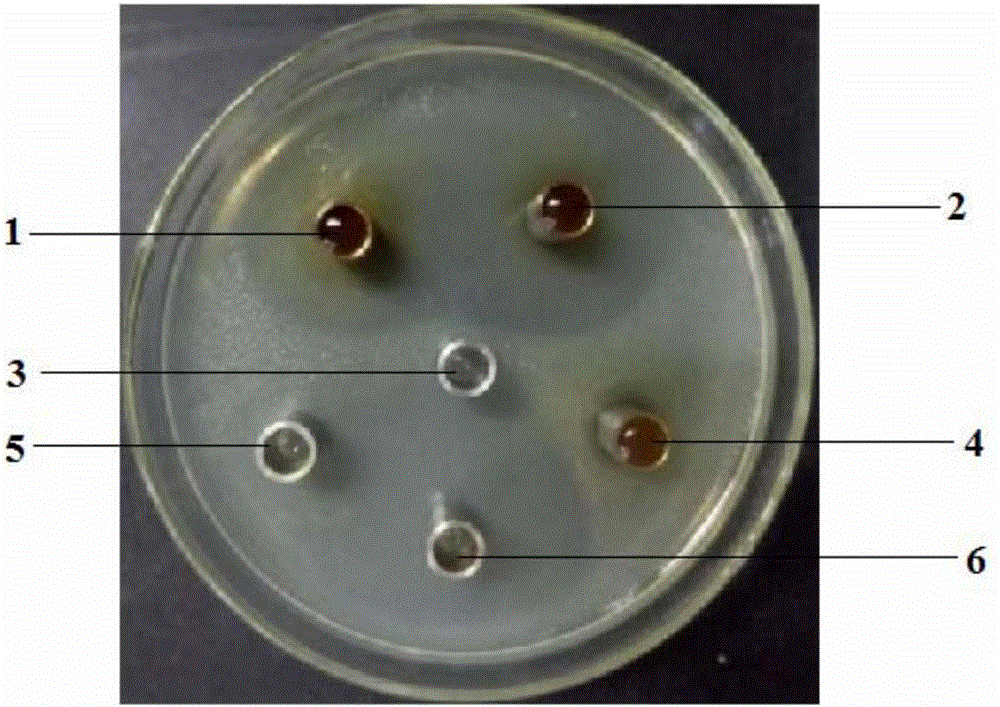
:集约化养殖中,畜禽发病率和死亡率较高,抗生素作为饲料药物添加剂和兽药广泛应用于饲料及养殖现场。然而,长期使用抗生素造成的药物残留、病菌耐药性、动物机体双重感染等问题,引起社会的广泛关注,因而对饲用抗生素的反对意见日趋强烈。2015年7月和9月,国家相继出台“抗菌药综合整治5年计划”和“2292号公告”禁用四种沙星类抗生素。无论是替代饲料中的抗生素还是减少养殖现场用药,都会给养殖成绩带来一定影响,市场上迫切需要开发有效替代饲用抗生素的产品。酵母细胞壁是以酿酒酵母经液体发酵后得到的菌体,再经自溶或外源酶催化水解、或机械破碎后,分离获得的细胞壁浓缩、干燥得到的产品。酵母细胞壁中的功能性成分主要为甘露聚糖、β-葡聚糖。国内外大量研究均已表明,酵母细胞壁具有增强动物机体免疫能力、吸附霉菌毒素和病原菌的效果。酵母细胞壁中的β-葡聚糖作用于巨噬细胞能激发一连串免疫反应,释放下游信号分子,刺激机体产生更多的巨噬细胞、t细胞、中性粒细胞等,诱导机体产生非特异性和特异性免疫应答反应。酵母细胞壁中的甘露聚糖能与病原菌的外源凝集素结合,阻碍病原菌在肠壁上的黏附,防止病原菌在肠道繁殖。同时,基于特异的空间结构,酵母细胞壁能通过氢键和范德华力等分子间作用力稳固吸附多种霉菌毒素。基于酵母细胞壁的生物安全性和功能性,农业部已将酵母细胞壁自《饲料添加剂品种目录》移至《饲料原料目录(2013)》,为其更广泛地应用于畜牧养殖业奠定了政策基础。酵母细胞壁提升免疫、促进动物机体健康的使用效果已逐步被人们接受,是一种比较理想的饲用抗生素替代品。由于酵母细胞壁具有特殊的三股螺旋结构,不溶于水,呈聚集颗粒状,稍溶于二甲基亚砜(dmso)中。由于其不溶性,使其使用受到很大限制,目前市面上的酵母细胞壁产品以未深加工的酵母细胞壁为主。为了扩大酵母细胞壁的应用范围,国内外学者对其进行了大量的物理、化学以及生物修饰改性等方面的研究。酵母细胞壁的物理改性法主要是在不破坏酵母细胞壁多糖基本分子结构的基础上,应用外力方式将其主链打断,使其变为可溶性的小分子,以增加其溶解性,目前主要使用超声波解聚和辐照处理等;生物改性技术主要是酶法改性,通过相应的多糖酶作用,使其空间结构发生相应的改变,使长的分子链水解为短的分子链,使多糖部分地转化为低聚糖或寡糖;化学修饰改性是通过在酵母细胞壁多糖分子链上引入或脱掉一些基团,使其分子结构发生改变,得到具有多种特殊性能的衍生物。通过改性修饰,酵母细胞壁的溶解度、免疫能力都能得到一定程度的改善,扩大了其应用范围。技术实现要素:本发明所解决的现有技术问题是:现有的酵母细胞壁溶解度不高,而且不具有抑菌效果,限制了其在饲料添加领域中的应用。本发明通过对酵母细胞壁改性,提高酵母细胞壁的溶解度及抑菌效果,使得酵母细胞壁用作饲料添加领域时可以提高动物的免疫能力,同时提高酵母细胞壁的溶解度。本发明通过提供一种新的酵母细胞壁的制备方法,使得酵母细胞壁的溶解度增加,并具有抑菌效果。本发明提供的酵母细胞壁,含有效成分β-葡聚糖的含量为25-50%,甘露聚糖≥20%,溶解率为30~50%,并能特异性抑制大肠杆菌和金黄色葡萄球菌的生长。相比较于现有的酵母细胞壁,使得细胞壁的溶解度提高,并具备抑菌效果,因此,改性了常规的酵母细胞壁的性质,得到一种经过改性的更适宜作为饲料原料使用的产品。具体来说,本发明提出了如下技术方案。第一方面,本发明提供了一种酵母细胞壁,所述酵母细胞壁中β-葡聚糖的含量为25-50%,其中99%以上的β-葡聚糖的相对分子量为3.0×105-1.0×106;所述酵母细胞壁中甘露聚糖的含量≥20%,其中99%以上的甘露聚糖的相对分子量为8.0×105-2.0×106。第二方面,本发明提供了一种溶解度提高的酵母细胞壁,所述酵母细胞壁中β-葡聚糖的含量为25-50%,其中99%以上的β-葡聚糖的相对分子量为3.0×105-1.0×106;所述酵母细胞壁中甘露聚糖的含量≥20%,其中99%以上的甘露聚糖的相对分子量为8.0×105-2.0×106,酵母细胞壁的溶解率为30%-50%,优选为35%-50%。第三方面,本发明提供了一种具有抑菌效果的酵母细胞壁,所述酵母细胞壁中β-葡聚糖的含量为25-50%,其中99%以上的β-葡聚糖的相对分子量为3.0×105-1.0×106;所述酵母细胞壁中甘露聚糖的含量≥20%,其中99%以上的甘露聚糖的相对分子量为8.0×105-2.0×106,酵母细胞壁对于大肠杆菌和金黄色葡萄球菌表现出抑菌作用。优选的,根据以上所述的酵母细胞壁,所述酵母细胞壁对于大肠杆菌和金黄色葡萄球菌的最小抑菌浓度均为5%酵母细胞壁干物质质量浓度。优选的,根据以上所述的酵母细胞壁,所述酵母细胞壁通过甘露聚糖酶、碱性蛋白酶、木瓜蛋白酶、纤维素酶和β-葡聚糖酶酶解得到。优选的,根据以上所述的酵母细胞壁,所述酵母细胞壁依次通过甘露聚糖酶,碱性蛋白酶和木瓜蛋白酶,纤维素酶和β-葡聚糖酶酶解得到。更优选的,根据以上所述的酵母细胞壁,所述酵母细胞壁依次通过甘露聚糖酶、碱性蛋白酶、木瓜蛋白酶、纤维素酶和β-葡聚糖酶酶解得到。第四方面,本发明还提供了一种酵母细胞壁的制备方法,包括以下步骤:(1)将含酵母的原料进行自溶破壁,分离得到酵母细胞壁乳;(2)将酵母细胞壁乳通过甘露聚糖酶、碱性蛋白酶、木瓜蛋白酶、纤维素酶和β-葡聚糖酶酶解,得到酵母细胞壁;优选依次通过甘露聚糖酶,碱性蛋白酶和木瓜蛋白酶,纤维素酶和β-葡聚糖酶酶解得到;进一步优选依次通过甘露聚糖酶、碱性蛋白酶、木瓜蛋白酶、纤维素酶和β-葡聚糖酶酶解得到。优选的,根据以上所述的制备方法,所述的自溶破壁是在盐浓度3-5%、ph值5.5-6.5、温度55-75℃条件下进行;优选自溶处理的时间为20-30h。优选的,根据以上所述的制备方法,以酵母细胞壁干物质的质量计,所述的甘露聚糖酶、碱性蛋白酶、木瓜蛋白酶、纤维素酶和β-葡聚糖酶的添加质量分别为3-5‰、2-6‰、0.1-0.7‰、0.2-1‰和0.2-1‰。优选的,根据以上所述的制备方法,以酵母细胞壁干物质的质量计,每克酵母细胞壁干物质,对应的甘露聚糖酶、碱性蛋白酶、木瓜蛋白酶、纤维素酶和β-葡聚糖酶的添加量分别为(0.06u-0.1u)、(0.1u-0.3u)、(0.005u-0.035u)、(0.001u-0.005u)和(0.0016u-0.008u)。优选的,根据以上所述的制备方法,所述甘露聚糖酶的酶解温度为35-60℃,ph7.0-11.0;所述碱性蛋白酶的酶解温度为40-70℃,ph为6.5-8.5;所述木瓜蛋白酶的酶解温度为40-52℃,酶解ph为4.0-6.0;所述纤维素酶的酶解温度为50-68℃,ph为4.0-5.5;所述β-葡聚糖酶的酶解温度为40-67℃,ph为4.5-6.5。优选的,根据所述的制备方法,所述甘露聚糖酶的酶解时间为10-15h;所述碱性蛋白酶的酶解时间为7-10h;所述木瓜蛋白酶的酶解时间为3-8h;所述纤维素酶的酶解时间为3-8h;所述β-葡聚糖酶的酶解时间为6-12h。优选的,根据以上所述的制备方法,步骤(2)中,将酵母细胞壁乳配制成以酵母细胞壁干物质计,浓度为8-20%(w/v)的悬浮溶液,然后分别采用甘露聚糖酶、碱性蛋白酶和木瓜蛋白酶进行酶解,然后再采用纤维素酶和β-葡聚糖酶进行酶解。优选的,根据以上所述的制备方法,步骤(2)中,采用纤维素酶和β-葡聚糖酶酶解之前,进行灭酶操作,优选将反应物在85-100℃温度下处理0.5-1.5小时。优选的,根据以上所述的制备方法,步骤(1)中自溶破壁之前,对酵母以糖蜜为碳源,硫酸铵为氮源,进行发酵处理,优选以25%-35%总糖浓度的糖蜜为碳源。优选的,根据以上所述的制备方法,发酵处理的温度为25-35℃,优选为28-30℃,ph值为4.0-6.0。优选的,根据以上所述的制备方法,所述酵母为酿酒酵母z2.2(saccharomycescerevisiaehansenz2.2),保藏编号为cctccno:m205128;酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418;酿酒酵母z2.4(saccharomycescerevisiaehansenz2.4),保藏编号为cctccno:m205130;均保藏于中国典型培养物保藏中心;优选为酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418。第五方面,本发明还提供了采用以上任一项所述的制备方法制备得到的酵母细胞壁,所述酵母细胞壁的溶解率提高,并具有抑菌效果。优选的,根据以上所述的酵母细胞壁,所述酵母细胞壁的溶解率为30-50%,β-葡聚糖的含量为25-50%,甘露聚糖的含量≥20%,所述酵母细胞壁对于大肠杆菌和金黄色葡萄球菌的最小抑菌浓度均为5%干物质浓度。第六方面,本发明还提供了一种饲料,包含以上任一项所述的酵母细胞壁。第七方面,本发明还提供了以上任一项所述的酵母细胞壁在饲料添加剂领域中的应用。本发明所取得的有益效果是:本发明制得的改性酵母细胞壁产品相比较于现有的普通的未经改性的酵母细胞壁产品,可以提高酵母细胞壁的溶解度,并增强抑菌效果,可以饲喂于任何动物,包括畜禽,水产,反刍动物等。当和饲料混合或作为添加剂饲喂时,该物质具有提高动物机体免疫力、有效抑制大肠杆菌和金黄色葡萄球菌的效果,从而提高动物生产力和健康状况,减少饲用抗生素的使用。菌株保藏信息本发明所用的菌种酿酒酵母fx-2(saccharomycescerevisiaefx-2)于2016年8月1日保藏在中国典型培养物保藏中心(cctcc),保藏编号为cctccno:m2016418,保藏地址:中国.武汉.武汉大学,邮政编码:430072;电话:(027)-68754052。本发明所用的菌种酿酒酵母z2.2(saccharomycescerevisiaehansenz2.2)于2005年10月25日保藏在中国典型培养物保藏中心(cctcc),保藏编号为cctccno:m205128,保藏地址:中国.武汉.武汉大学,邮政编码:430072;电话:(027)-68752319。本发明所用的菌种酿酒酵母z2.4(saccharomycescerevisiaehansenz2.4)于2005年10月25日保藏在中国典型培养物保藏中心(cctcc),保藏编号为cctccno:m205130,保藏地址:中国.武汉.武汉大学,邮政编码:430072;电话:(027)-68752319。附图说明图1为实施例一、实施例二、对比例一、对比例二制备得到的酵母细胞壁以及庆大霉素和生理盐水对于大肠杆菌的抑菌效果图,其中标号1为实施例一制备得到的酵母细胞壁,标号2为实施例二制备得到的酵母细胞壁,标号3为生理盐水,标号4为对比例一制备得到的酵母细胞壁,标号5为对比例二制备得到的酵母细胞壁,标号6为庆大霉素。图2为实施例三、对比例三、对比例四、对比例五制备得到的酵母细胞壁以及庆大霉素和生理盐水对于大肠杆菌的抑菌效果图,其中标号7为对比例三制备得到的酵母细胞壁,标号8为实施例三制备得到的酵母细胞壁,标号9为生理盐水,标号10为对比例四制备得到的酵母细胞壁,标号11为对比例五制备得到的酵母细胞壁,标号12为庆大霉素。图3为实施例一、实施例二、对比例一、对比例二制备得到的酵母细胞壁以及庆大霉素和生理盐水对于金黄色葡萄球菌的抑菌效果图,其中标号1为实施例一制备得到的酵母细胞壁,标号2为实施例二制备得到的酵母细胞壁,标号3为生理盐水,标号4为对比例一制备得到的酵母细胞壁,标号5为对比例二制备得到的酵母细胞壁,标号6为庆大霉素。图4为实施例三、对比例三、对比例四、对比例五制备得到的酵母细胞壁以及庆大霉素和生理盐水对于大肠杆菌的抑菌效果图,其中标号7为对比例三制备得到的酵母细胞壁,标号8为实施例三制备得到的酵母细胞壁,标号9为生理盐水,标号10为对比例四制备得到的酵母细胞壁,标号11为对比例五制备得到的酵母细胞壁,标号12为庆大霉素。具体实施方式如上所述,本发明提供了一种改性酵母细胞壁的制备方法制备得到的酵母细胞壁,相较于现有的酵母细胞壁,其溶解率增加,而且抑菌效果也增强。本发明提供了一种改性的酵母细胞壁,溶解度提高,并具有抑菌效果,所述酵母细胞壁中β-葡聚糖的含量为25-50%,其中99%以上的β-葡聚糖的相对分子量为3.0×105-1.0×106,优选为3.3×105-1.0×106;甘露聚糖≥20%,其中99%以上的甘露聚糖的相对分子量为8.0×105-2.0×106,优选为8.6×105-2.0×106。所述酵母细胞壁可以作为饲料添加剂应用,从而减少饲料中抗生素的使用。不受理论限制,本发明提供的酵母细胞壁表现出溶解度提高和抑菌效果,与酵母细胞壁中β-葡聚糖的分子量以及甘露聚糖的分子量以及含量等是相关的。改性后的酵母细胞壁中β-葡聚糖和甘露聚糖的分子量较小,将极大的提高溶解度,而且表现出优异的抑菌效果。本发明的酵母细胞壁的制备方法,通过自溶破壁,然后多种酶进行复合酶解处理。通过自溶盐,优选为氯化钠和/或乙酸乙酯。在偏酸性环境下处理,能够保持无菌环境,激发酵母的内源酶活性,促进酵母细胞裂解,达到除去酵母细胞中的内容物,使剩下的酵母细胞壁乳含有较高的多糖成分的目的。然后将经过自溶处理后的物质进行分离,除去酵母自溶物,得到酵母细胞壁乳,将酵母细胞壁乳采用多种酶进行复合酶解,包括甘露聚糖酶、碱性蛋白酶、木瓜蛋白酶、纤维素酶和β-葡聚糖酶进行酶解处理。酵母细胞壁的结构从外层到内层依次为磷酸化的甘露聚糖、甘露聚糖、蛋白质和葡聚糖,因此,发明人经过实验探究发现,首先采用甘露聚糖酶处理,用来破坏酵母细胞壁的结构,使得甘露聚糖成分分离;然后采用碱性蛋白酶和木瓜蛋白酶处理,能够破坏酵母细胞壁的结构,使蛋白质成分分离;最后采用纤维素酶和β-葡聚糖酶进行处理,降解细胞壁中的葡聚糖使其变成小分子片段,从而暴露出功能位点。碱性蛋白酶和木瓜蛋白酶的作用为进一步破坏经过甘露聚糖酶处理后的细胞壁乳中细胞壁的结构,使得蛋白质成分分离,因此碱性蛋白酶和木瓜蛋白酶可以同时加入,进行酶解处理,也可以分别加入进行酶解处理。纤维素酶和β-葡聚糖酶的作用均是为了使得经过甘露聚糖酶以及蛋白酶处理后的酵母细胞壁中的葡聚糖进一步变为小分子的片段,从而暴露出功能位点,因此,纤维素酶和β-葡聚糖酶可以同时加入进行酶解处理,也可以分别加入进行酶解处理。同时,本发明提供了一种改性酵母细胞壁的制备方法,其中在本发明的一种优选实施方式中,所述制备方法包括以下步骤:(1)自溶破壁将含酵母的原料在盐质量浓度为3-5%、ph值5.5-6.5、温度55-75℃的条件下自溶处理,分离得到酵母细胞壁乳;(2)酶解处理a.将酵母细胞壁乳加水稀释成干物质质量浓度为8-20%,加入质量浓度为3-5‰甘露聚糖酶(所述酶的含量均以酵母细胞壁干物质的质量计,以下均同),控制温度35-60℃,ph至7.0-11.0,水解10-15小时;然后加入质量浓度为2-6‰的碱性蛋白酶,控制温度40-70℃,ph至6.5-8.5,水解时间7-10小时;然后调节温度40-52℃,加入0.1-0.7‰(干物质含量)的木瓜蛋白酶,水解3-8小时;b.在85-100℃进行灭酶处理,时间为0.5-1.5小时;(3)二次酶解处理c.将上一步骤所得的经过灭酶处理的酶解反应物配制成干物质质量浓度8-20%的溶液,加入质量浓度为0.2-1‰的纤维素酶,控制温度40-60℃,ph为4.0-5.5,水解3-8小时;然后加入质量浓度为0.2-1‰的β-葡聚糖酶,控制温度40-67℃,ph为4.5-6.5,水解时间为6-12小时后得到酶解产物;(4)离心干燥将步骤(3)得到的酶解产物升温到90℃保温30min-1h,干燥得到改性酵母细胞壁。在本发明的又一种优选实施方式中,在自溶处理之前,采用酿酒酵母菌种,以糖蜜为碳源,硫酸铵为氮源,发酵ph值4.0-6.0、温度28-30℃、发酵16-24小时,获得最佳酵母细胞壁多糖含量的酵母原料。在一种优选实施方式中,所述酿酒酵母菌株为酿酒酵母z2.2(saccharomycescerevisiaehansenz2.2),保藏编号为cctccno:m205128;酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418;酿酒酵母z2.4(saccharomycescerevisiaehansenz2.4),保藏编号为cctccno:m205130,均保藏在中国典型培养物保藏中心。更优选的,所述酿酒酵母菌种为酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418。下面对本实施例所用的原料及设备的生产厂家,以及产品分析使用的设备和分析方法进行说明如下,其中所述的化学物质没有标明的均为常规试剂的化学纯级别。其中,实施例和对比例中所用到的原料的信息如下表所示。表1本发明所用到的原料的信息原料厂家甘露聚糖酶(20万u/g)山东西唐生物科技有限公司碱性蛋白酶(50万u/g)南宁庞博生物工程有限公司木瓜蛋白酶(50万u/g)南宁东恒华道生物科技有限责任公司纤维素酶(5万u/g)南宁庞博生物工程有限公司β-葡聚糖酶(8万u/g)德国英联酶制剂公司核酸酶(10万u/g)安琪酵母股份有限公司细菌蛋白酶(10万u/g)诺维信生物技术有限公司(天津)蛋白胨(货号fp101)安琪酵母股份有限公司酵母浸粉(货号fm888)安琪酵母股份有限公司糖蜜(总糖含量45%-80%)赤峰蓝天糖业有限公司mh肉汤北京陆桥技术有限责任公司mh琼脂培养基北京陆桥技术有限责任公司大肠杆菌(atcc25922)美国菌种保藏中心(atcc)金黄色葡萄球菌(atcc29213)美国菌种保藏中心(atcc)牛津杯宜昌西隆化工有限公司庆大霉素北京万佳首化生物科技有限公司实施例一(一)改性酵母细胞壁的制备采用如下方法制备得到改性酵母细胞壁:(1)采用酿酒酵母菌种酿酒酵母z2.2(saccharomycescerevisiaehansenz2.2),保藏编号为cctccno:m205128,该菌株的来源及制备方法记载在专利申请号为200710135740.6,公开号为cn101361524a的中国专利申请中。通过光学显微镜观察,该酿酒酵母菌株细胞直径约4-6μm,呈椭球形,以出芽方式无性繁殖;在固体培养基平板上28℃培养24h后,为乳白色,不透明,圆形菌落。将菌株斜面以2环的接种量至100ml摇瓶液体培养基中,放置摇床培养,设置转速250r/min,温度30℃,培养18h。其中该100ml的液体摇瓶培养基的配方为:水100ml,蛋白胨2g,酵母浸粉1g,葡萄糖2g,调节ph值为(5.0±0.2)。将摇瓶活化培养的菌株接种到50l发酵罐,设置转速400r/min,发酵温度30℃,发酵时间16h,得到酵母初级原料。其中,发酵培养基的配方为:总糖浓度为30%的糖蜜(加水稀释,参照中华人民共和国轻工行业标准qbt2684-2005测定总糖的浓度为30%,以下实施例也按照相同的方法进行测定),10l;(nh4)2so4,500g;nh4h2po4,80g,mgso4,56g;znso4,28g;h2o,20l,ph值为4.0。(2)将上述酵母初级原料进行自溶处理,加入氯化钠,使得氯化钠的质量浓度为3%,ph值6.5,温度55℃,自溶20小时后,5000rpm离心处理,得到位于上层的酵母自溶物和位于下层的酵母细胞壁乳,收集酵母细胞壁乳进行酶解处理。(3)酶解:a.将步骤(2)得到的酵母细胞壁乳加水稀释成为15%的浓度,加入3‰质量浓度的甘露聚糖酶(以酵母细胞壁干物质计,以下同),控制温度55℃,ph值8.0,水解15小时;b.继续加入3‰质量浓度的碱性蛋白酶和0.5‰质量浓度的木瓜蛋白酶,控制温度55℃,ph值8.5,水解时间控制在7小时;c.将步骤b所得反应物于90℃保温1h,进行灭活处理,得到灭酶后的溶液;d.然后调节将灭酶后的溶液的温度为60℃,ph值为5.5,加入0.5‰质量浓度的纤维素酶和0.5‰质量浓度的β-葡聚糖酶,水解8小时;e.将步骤d得到的溶液升温至90℃保温处理1h,然后进行喷雾干燥处理,得到经过改性的酵母细胞壁粉末。(二)改性酵母细胞壁的产品测定1.酵母细胞壁中β-葡聚糖和甘露聚糖的测定1.1检测原理根据葡聚糖和甘露糖在流动相和液相色谱柱的固定相之间具有不同的分配系数,将水解后的样品注入液相色谱,用纯水做流动相,糖类分子流出后,经示差检测器检测,用外标法定量。在β-葡聚糖和甘露聚糖水解时,由于样品可能存在水解不彻底,以及水解产生的葡萄糖和甘露糖由于高温造成部分发生其它副反应,导致检测结果比产品中实际含有的β-葡聚糖和甘露聚糖偏低。检测中采用葡聚糖对照品对上述水解过程引起的误差进行修正。1.2仪器a)水浴锅;b)旋涡混合器;c)电炉;d)压力蒸汽灭菌器;e)高效液相色谱仪:带示差检测器和糖柱(6.5mm×300mmwaterssugarpak-1)。1.3试剂a)纯水;b)盐酸:37%左右;c)葡萄糖:ar;d)甘露糖:ar;e)氢氧化钠:ar;f)葡萄糖和甘露糖混合标液(2g/l):分别称取葡萄糖和甘露糖各0.2000g,用纯水定容至100ml。g)葡聚糖对照品(curdlanfromalcaligenesfaecalis):sigma产品,货号c7821。h)氢氧化钠溶液:300g/l。1.4样品处理准确称取400mg(精确至0.1mg)样品放入一个20ml的耐热玻璃制的带螺帽的小试管中,加入6.0ml盐酸(37%),小心的将小瓶盖紧后用旋涡混合器混合,得到均一的悬浮液。将小瓶放入30℃水浴中处理45min,每15min用旋涡混合器振荡混合一次。然后将悬浮物定量的转移到200ml杜氏瓶中,用约100ml~120ml的水,分几次洗涤小试管,洗涤液并入杜氏瓶中。将杜氏瓶放入高压灭菌锅,121℃下处理60min。取出后冷却,用氢氧化钠溶液将溶液调ph到6~7,然后定容至200ml。使用0.45微米孔径的醋酸纤维素膜过滤备用。同时准确称取葡聚糖对照品(见1.3(g))200mg,按样品处理方法进行同样的处理。1.5色谱条件采用纯水做为流动相,流速为0.5ml/min,柱温80℃,待仪器基线平稳后再进样。1.6标准曲线的绘制分别吸取甘露糖/葡萄糖标液(见a.3(f))1、2、3、4、5ml到10ml容量瓶中,用高纯水定容到刻度,得到甘露糖、葡萄糖各为200、400、600、800、1000mg/l的混合标样。在上述色谱条件下准确进样20ul,得到色谱峰面积和标准物质量浓度之间的回归方程,绘制标准曲线。1.7样品及对照品的测定在同样的色谱条件下,将处理好的样品和葡聚糖对照品分别注入色谱仪中,记录各色谱峰的保留时间和峰面积。用糖标样色谱峰的保留时间定性,用糖标样色谱峰的峰面积来定量。1.8结果计算β-葡聚糖或甘露聚糖的含量按下式计算:x=(a1×0.2×100)÷(m1×1000)×0.9×f…………………………………..(1)f=p×(100-w)÷[(a2×0.2×100)÷(m2×1000)×0.9]………………………(2)式中:x---样品中β-葡聚糖或甘露聚糖的含量,%;a1---根据样品溶液的峰面积,在标准曲线上查得的样品溶液的葡萄糖或甘露糖的含量,mg/l;a2---根据葡聚糖对照品溶液的峰面积,在标准曲线上查得的样品溶液的葡萄糖的含量,mg/l;m1---称取样品的质量,g;m2---称取葡聚糖对照品的质量,g;0.2---样品/葡聚糖对照品处理后定容的体积,l;0.9---将葡萄糖或甘露糖换算成β-葡聚糖或甘露聚糖的系数;f---样品酸水解中葡萄糖和甘露糖被破坏造成结果偏低的经验补偿系数;p---葡聚糖对照品的纯度(依据试剂厂家提供的检测报告);w---葡聚糖对照品的水分(依据试剂厂家提供的检测报告)。备注:在同一个实验室内,一般1~2个月检测f值即可。f值在1.25左右,实验室定期对f值进行修正。1.9允许误差在重复性检测条件下获得的两次独立测定结果的相对相差不得超过下表中所规定的数值:表2允许的误差值2.溶解率的测定方法2.1测定原理使样品溶解于水,通过离心收集沉淀,计算出溶出物质重量占总重的比例。2.2试剂与仪器a)蒸馏水;b)离心机(5000g);c)水分测定仪;d)分析天平;2.3测定步骤准确称取样品10g(精确到0.1mg),记为m0,溶解于200ml蒸馏水中,使其充分溶解后全部转入离心杯中,5000g离心5min,准确测定沉淀重量,记为m1,并测定沉淀干物质含量(按照gb5009.3-2010第一法检测),沉淀干物质含量记为d。2.4结果计算样品溶解率为:x=(m0-m1×d)÷m0×100%x——样品溶解率,%;m0——称取样品重量,g;m1——离心后沉淀重量,g;d——离心后沉淀干物质含量,%。计算结果保留至小数点后1位。3.按照如下方法检测葡聚糖的分子量和甘露聚糖的分子量:测定方法:将步骤(一)制备得到的改性酵母细胞壁产品配制成溶液,利用高相液相色谱法测定葡聚糖和甘露聚糖的分子量。分析条件:shodexohpaksb-805hq凝胶柱(8mm×300mm);检测器:示差检测器(optilabrex),十八角静态激光散射仪(dawnhellos),紫外检测器;检测波长:658nm(葡聚糖),280nm(甘露聚糖);流动相:0.5mo1/lnacl溶液;柱温:25℃;流速:0.5ml/min;进样量:20μl。高效液相色谱仪:型号gpc/ri/malls,waters515泵,美国waters公司制。检测得到实施例一制备得到的酵母细胞壁产品溶解率为48.5%,含有β-葡聚糖的质量含量为35%,甘露聚糖的质量含量为30%。检测到酵母细胞壁中葡聚糖的分子量为8.45×105,占葡聚糖总量的98.12%,甘露聚糖的分子量为1.98×106,占甘露聚糖总量的99.45%。.(三)改性酵母细胞壁的抑菌效果将步骤(一)制备得到的改性酵母细胞壁样品配制成溶液,然后取出500ml到1000ml,于5000-6000g,离心10-20min,取上清,用旋转蒸发仪在75-80℃下蒸发浓缩至改性酵母细胞壁干物质浓度为40%左右(即1ml水中酵母细胞壁干物质为0.4g,即酵母细胞壁的浓度为0.4g/ml),用于后续的抑菌性实验和mic(最小抑菌浓度)实验。具体的实验过程和实验结果如下:1.抑菌试验样品制备将步骤(一)制备得到的改性酵母细胞壁样品配制成干物质浓度10%的溶液,取500ml,于5000g,离心20min,取上清,用旋转蒸发仪在80℃温度下蒸发浓缩,至干物质浓度为40%,用于后续的抑菌性试验。2.抑菌性试验方案分别从抑菌圈大小和mic实验检验本发明制备得到的改性酵母细胞壁与普通的酵母细胞壁的抑菌效果的差异。实验过程包括培养基的准备、菌种培养、抑菌圈试验和mic试验。2.1培养基的准备。将mh肉汤、mh琼脂培养基121℃,高压灭菌20min中,并制作mh琼脂平板备用。2.2菌种培养将保存好的大肠杆菌、金黄色葡萄球菌接种于mh肉汤,37℃,恒温摇床孵育12-14h。将复苏后的大肠杆菌和金黄色葡萄球菌重新接种mh肉汤,培养16-20h左右。经分光光度计检测,od值在0.4-0.7之间。活菌数约为1010cfu/ml(cfu/ml表示的是每ml样品中含有的细菌菌落总数)。2.3抑菌圈试验采用牛津杯法进行抑菌圈实验,其测定原理为将培养基灭菌,然后以无菌操作在培养基表面直接垂直放上牛津杯(内径6mm、外径8mm、高10mm的圆形小管,管的两端要光滑,也可用玻璃管、瓷管),轻轻加压,使其与培养基接触无空隙,在杯中加入待检样品,牛津杯一般可以装240微升,勿使其外溢。加满后置一定温度下培养一定时间,观察可以发现以牛津杯为中心呈现透明的圆圈。这是因为在培养过程中,一方面试验菌开始生长,另一方面待测样品呈球面扩散,离杯越近,待测样品的浓度越大,离杯越远待测样品的浓度越小。随着待测样品的浓度减小,有一条最低抑菌浓度带,在该带范围内,菌不能生长,而呈透明的圆圈,称作“抑菌圈”。待测样品的浓度越高,抑菌圈越大。可以用尺子直接测定抑菌圈的大小。2.3.1含菌平皿的制作用生理盐水(经121℃,高压灭菌20min),将步骤2.2中的纯培养菌液稀释1000倍,制作菌悬液;将灭菌后的mh琼脂倾倒平皿,等mh平皿凝固后,每个平皿滴加200μl菌悬液;用灭菌后的玻璃棒,快速将菌液均匀涂布整个平皿,制作含菌平皿。2.3.2将制备好的酵母细胞壁样品调整到相同的浓度。2.3.3将牛津杯放入制备好的含菌平皿。2.3.4将酵母细胞壁样品加入牛津杯(每个加250μl左右),使液面与牛津杯相平。2.3.5将2.3.4中的平皿置于恒温培养箱,37℃培养14h左右,观察结果。实验过程中,以实施例一制备得到的改性酵母细胞壁作为待测样品,以庆大霉素作为阳性对照品,以生理盐水作为阴性对照品。其中,庆大霉素是一种氨基糖苷类抗生素,对于大肠杆菌和金黄色葡萄球菌均有良好的抑菌作用。其中,结果如图1和图3所示。其中图1为酵母细胞壁对于大肠杆菌的抑菌效果图,图3为酵母细胞壁对于金黄色葡萄球菌的抑菌效果图。从图1和图3不难看出,实施例一制备得到的酵母细胞壁对大肠杆菌和金黄色葡萄球菌有明显的抑菌效果。其中庆大霉素对于大肠杆菌的抑菌圈大小为35mm,对于金黄色葡萄球菌的抑菌圈的大小为30mm,实施例一制备得到的改性后的酵母细胞壁对于大肠杆菌的抑菌圈的大小为28mm,对于金黄色葡萄球菌的抑菌圈的大小为21mm,实验结果表明实施例一制备得到的酵母细胞壁对于大肠杆菌和金黄色葡萄球菌的抑菌效果仅次于庆大霉素。2.4.mic试验最小抑菌浓度通常用来表示在特定环境下孵育一定的时间,可以抑制某种微生物出现明显增长的最低药物浓度。在本发明中是用在37℃条件下孵育12-14h,抑制大肠杆菌和金黄色葡萄球菌的明显增长的最低的酵母细胞壁的浓度。其具体的实验过程和实验结果如下:大肠杆菌mic实验的测定:2.4.1菌悬液的制备:将步骤2.2中的纯培养的大肠杆菌菌液,用mh肉汤稀释100倍,摇匀,使得大肠杆菌菌悬液的活菌数为108cfu/ml。2.4.2将10支试管放在试管架,分别标号为1-10,其中标号为1的试管不加入任何东西,标号为2-10的试管分别加入1mlmh肉汤。2.4.3取1ml酵母细胞壁样品(干物质的浓度为40%)加入标号为1的试管,取1ml酵母细胞壁样品加入标号为2的试管中,摇匀后,从标号为2的试管中取出1ml溶液加入到标号为3的试管中,摇匀后,从标号为3的试管中取出1ml溶液加入到标号为4的试管中,依次类推至标号为10的试管。从标号为10的试管中取出1ml溶液弃掉,通过逐级稀释法使得编号为1-10的试管中酵母细胞壁干物质的浓度分别为40%,40%×2-1,40%×2-2,40%×2-3,40%×2-4,40%×2-5,40%×2-6,40%×2-7,40%×2-8,和40%×2-9。2.4.4分别向以上10支试管中加入1ml制备好的大肠杆菌菌悬液,混合均匀。2.4.5完成后,置于37℃恒温培养箱,孵育12-14h左右,观察结果。结果显示,实施例一制备得到的酵母细胞壁能有效抑制大肠杆菌的生长,且对大肠杆菌的最小抑菌浓度为5%干物质浓度(即0.05g/ml)。金黄色葡萄球菌mic实验的测定:按照以上大肠杆菌mic实验的相同的测定方法,实验测得实施例一制备得到的酵母细胞壁能有效抑制金黄色葡萄球菌的生长,且对金黄色葡萄球菌的最小抑菌浓度为5%干物质浓度(即0.05g/ml)。实施例二采用如下方法制备酵母细胞壁,并对制备得到的酵母细胞壁进行含量测定,对其抑菌效果和溶解度进行测定。(一)改性酵母细胞壁的制备采用如下方法制备得到改性酵母细胞壁:(1)采用酿酒酵母菌种酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418。该菌株来自于发酵面团,发酵面团中含有多种野生菌,以发酵面团为样品,制备面团浸出液,经过稀释涂布平板分离法分离得到纯种的菌株,经鉴定确认该菌株属于酿酒酵母,其中菌株的鉴定方法为:采用5.8srrna测序进行鉴定,结果表明序列同源性大于99%,从而确定本发明分离得到的菌株属于酿酒酵母,生物学分类为酿酒酵母fx-2。通过光学显微镜观察,该酿酒酵母菌株细胞直径约4-6μm,呈椭球形,以出芽方式无性繁殖;在固体培养基平板上28℃培养24h后,为乳白色,不透明,圆形菌落。将菌株斜面以2环的接种量至100ml摇瓶液体培养基中,放置摇床培养,设置转速250r/min,温度30℃,培养18h。其中液体摇瓶培养基的配方为:水100ml,蛋白胨2g,酵母浸粉1g,葡萄糖2g,调节ph值为(5.0±0.2)。将摇瓶活化培养的菌株接种到50l发酵罐,设置转速400r/min,发酵温度28℃,发酵时间24h,得到酵母初级原料。其中,发酵培养基的配方为:总糖浓度为28%的糖蜜,10l;(nh4)2so4,500g;nh4h2po4,80g,mgso4,56g;znso4,28g;h2o,20l,ph值为6.0。(2)将上述酵母初级原料进行自溶处理,加入氯化钠,使得氯化钠的质量浓度为5%,ph值5.5,温度75℃,自溶25小时后,5000rpm离心处理,得到位于上层的酵母自溶物和位于下层的酵母细胞壁乳,收集酵母细胞壁乳进行酶解处理。(3)酶解:a.将步骤(2)得到的酵母细胞壁乳加水稀释成为20%的浓度,加入5‰质量浓度的甘露聚糖酶(以酵母细胞壁干物质计,以下同),控制温度45℃,ph值10.0,水解10小时;b.继续加入6‰质量浓度的碱性蛋白酶,控制温度50℃,ph值7.5,水解时间为10小时;c.调节步骤b处理后的溶液的温度为58℃,ph值为7,然后继续加入0.3‰质量浓度的木瓜蛋白酶,酶解5小时;d.调节步骤c处理后的溶液的温度为85℃,保温处理1.5h,得到灭活后的溶液;e.调节灭酶后的溶液温度为50℃,ph值为4.5,然后加入1‰质量浓度的纤维素酶,酶解5小时;f.向步骤e处理后的溶液的中加入1‰质量浓度的β-葡聚糖酶,水解12小时;g.将步骤f得到的溶液升温至85℃保温处理1.5h,然后进行喷雾干燥处理,得到经过改性的酵母细胞壁粉末。(二)改性酵母细胞壁的产品测定按照实施例一相同的方法,对实施例二制备得到的改性酵母细胞壁的溶解度、含量进行测定。检测得到实施例二制备得到的酵母细胞壁产品溶解率为50.0%,含有β-葡聚糖的质量含量为48.6%,甘露聚糖的质量含量为35.2%。其中,葡聚糖的分子量为3.35×105,占葡聚糖总量的99.91%,甘露聚糖的分子量为8.64×105,占甘露聚糖总量的99.25%。.(三)改性酵母细胞壁的抑菌效果按照与实施例一相同的方法对改性后的酵母细胞壁进行抑菌效果的测定。测定结果如图1和图3所示。其中图1为酵母细胞壁对于大肠杆菌的抑菌效果图,图3为酵母细胞壁对于金黄色葡萄球菌的抑菌效果图。从图1和图3不难看出,实施例二制备得到的酵母细胞壁对大肠杆菌和金黄色葡萄球菌有明显的抑菌效果。其中庆大霉素对于大肠杆菌的抑菌圈大小为35mm,对于金黄色葡萄球菌的抑菌圈的大小为30mm,实施例二制备得到的改性后的酵母细胞壁对于大肠杆菌的抑菌圈的大小为28mm,对于金黄色葡萄球菌的抑菌圈的大小为35mm,实验结果表明实施例二制备得到的酵母细胞壁对于大肠杆菌的抑菌效果仅次于庆大霉素,对于金黄色葡萄球菌的抑菌效果还要优于庆大霉素。mic实验结果显示,实施例二制备得到的酵母细胞壁能有效抑制大肠杆菌和金黄色葡萄球菌的生长,且对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度均为5%干物质浓度(即0.05g/ml)。实施例三采用如下方法制备酵母细胞壁,并对制备得到的酵母细胞壁进行含量测定,对其抑菌效果和溶解度进行测定。(一)改性酵母细胞壁的制备采用如下方法制备得到改性酵母细胞壁:(1)采用酿酒酵母菌种酿酒酵母z2.4(saccharomycescerevisiaehansenz2.4),保藏编号为cctccno:m205130,该菌株的来源及制备方法记载在专利申请号为200810105972.1,公开号为cn101575578a的中国专利申请中。通过光学显微镜观察,该酿酒酵母菌株细胞直径约4-6μm,呈椭球形,以出芽方式无性繁殖;在固体培养基平板上28℃培养24h后,为乳白色,不透明,圆形菌落。将菌株斜面以2环的接种量至100ml摇瓶液体培养基中,放置摇床培养,设置转速250r/min,温度25℃,培养25h。其中液体摇瓶培养基的配方为:水100ml,蛋白胨2g,酵母浸粉1g,葡萄糖2g,调节ph值为(5.0±0.2),得到活化培养的菌液。将摇瓶活化培养的菌液接种到50l发酵罐,设置转速400r/min,发酵温度30℃,发酵时间20h,得到酵母初级原料。其中,发酵培养基的配方为:总糖浓度为35%的糖蜜,10l;(nh4)2so4,500g;nh4h2po4,80g,mgso4,56g;znso4,28g;h2o,20l,ph值为5.0。(2)将上述酵母初级原料进行自溶处理,加入氯化钠,使得氯化钠的质量浓度为4%,ph值6,温度60℃,自溶30小时后,5000rpm离心处理,得到位于上层的酵母自溶物和位于下层的酵母细胞壁乳,收集酵母细胞壁乳进行酶解处理。(3)酶解:a.将步骤(2)得到的酵母细胞壁乳加水稀释成为8%的浓度,加入4‰质量浓度的甘露聚糖酶(以酵母细胞壁干物质计,以下同),控制温度60℃,ph值7.0,水解10小时;b.继续加入2‰质量浓度的碱性蛋白酶,控制温度70℃,ph值9.5,水解时间为8小时;c.调节步骤b处理后的溶液的温度为50℃,ph值为6,然后继续加入0.7‰质量浓度的木瓜蛋白酶,酶解3小时;d.调节步骤c处理后的溶液的温度为100℃,保温处理0.5h,得到灭活后的溶液;e.调节灭酶后的溶液的温度为40℃,ph值为4.0,然后加入0.2‰质量浓度的纤维素酶,酶解3小时;f.调节步骤e处理后的溶液的温度为67℃,ph值为6.5,然后加入0.2‰质量浓度的β-葡聚糖酶,水解10小时;g.将步骤f得到的溶液升温至100℃保温处理0.5h,然后进行喷雾干燥处理,得到经过改性的酵母细胞壁粉末。(二)改性酵母细胞壁的产品测定按照实施例一相同的方法,对实施例三制备得到的改性酵母细胞壁的溶解度、含量进行测定。检测得到实施例三制备得到的酵母细胞壁产品溶解率为35.0%,含有β-葡聚糖的质量含量为35.5%,甘露聚糖的质量含量为28.5%。其中,葡聚糖的分子量为9.66×105,占葡聚糖总量的99.9%,甘露聚糖的分子量为1.06×106,占甘露聚糖总量的99.57%。.(三)改性酵母细胞壁的抑菌效果按照与实施例一相同的方法对改性后的酵母细胞壁进行抑菌效果的测定。测定结果如图2和图4所示。其中图2为酵母细胞壁对于大肠杆菌的抑菌效果图,图4为酵母细胞壁对于金黄色葡萄球菌的抑菌效果图。从图2和图4不难看出,实施例三制备得到的酵母细胞壁对大肠杆菌和金黄色葡萄球菌有明显的抑菌效果。其中庆大霉素对于大肠杆菌的抑菌圈大小为35mm,对于金黄色葡萄球菌的抑菌圈的大小为30mm,实施例三制备得到的改性后的酵母细胞壁对于大肠杆菌的抑菌圈的大小为24mm,对于金黄色葡萄球菌的抑菌圈的大小为15mm,实验结果表明实施例三制备得到的酵母细胞壁对于大肠杆菌和金黄色葡萄球菌的抑菌效果仅次于庆大霉素。mic实验结果显示,实施例三制备得到的酵母细胞壁能有效抑制大肠杆菌和金黄色葡萄球菌的生长,且对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度均为5%干物质浓度(即0.05g/ml)。对比例一采用如下方法制备酵母细胞壁,并对制备得到的酵母细胞壁进行含量测定,对其抑菌效果和溶解度进行测定。(一)酵母细胞壁的制备采用如下方法制备得到改性酵母细胞壁:(1)采用酿酒酵母菌种酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418。将菌株斜面以2环的接种量至100ml摇瓶液体培养基中,放置摇床培养,设置转速250r/min,温度30℃,培养18h,得到活化培养的菌液。其中,液体摇瓶培养基的配方为:水100ml,蛋白胨2g,酵母浸粉1g,葡萄糖2g,调节ph值为(5.0±0.2)。将摇瓶活化培养的菌液接种到50l发酵罐,设置转速400r/min,发酵温度30℃,发酵时间16h,得到酵母初级原料。其中,发酵培养基的配方为:总糖浓度为30%的糖蜜,10l;(nh4)2so4,500g;nh4h2po4,80g,mgso4,56g;znso4,28g;h2o,20l,ph值为4.0。(2)将上述酵母初级原料进行自溶处理,加入氯化钠,使得氯化钠的质量浓度为3%,ph值6.5,温度55℃,自溶20小时后,5000rpm离心处理,得到位于上层的酵母自溶物和位于下层的酵母细胞壁乳,收集酵母细胞壁乳进行酶解处理。(3)酶解:a.将步骤(2)得到的酵母细胞壁乳加水稀释成为15%的浓度,加入3‰质量浓度的甘露聚糖酶(以酵母细胞壁干物质计,以下同),控制温度55℃,ph值8.0,水解15小时;b.继续加入3‰质量浓度的碱性蛋白酶,控制温度55℃,ph值8.5,水解时间为7小时;c.调节步骤b处理后的溶液的温度为90℃,保温处理1h,得到灭活后的溶液;d.调节灭酶后的溶液的温度为60℃,ph值为5.5,然后加入0.5‰质量浓度的纤维素酶,酶解8小时;e.调节步骤d处理后的溶液的ph值为6.0,温度为55℃,然后向溶液中加入0.5‰质量浓度的β-葡聚糖酶,水解5小时;f.将步骤e得到的溶液升温至90℃保温处理1h,然后进行喷雾干燥处理,得到酵母细胞壁粉末。(二)酵母细胞壁的产品测定按照实施例一相同的方法,对对比例一制备得到的酵母细胞壁的溶解度、含量进行测定。检测得到对比例一制备得到的酵母细胞壁产品溶解率为32.0%,含有β-葡聚糖的质量含量为30.0%,甘露聚糖的质量含量为25.0%。其中,β-葡聚糖的分子量为4.45×106,占葡聚糖总量的99.92%,甘露聚糖的分子量为8.5×105,占甘露聚糖总量的99.25%。.(三)改性酵母细胞壁的抑菌效果按照与实施例一相同的方法对对比例一制备得到的酵母细胞壁进行抑菌效果的测定。测定结果如图1和图3所示。其中图1为酵母细胞壁对于大肠杆菌的抑菌效果图,图3为酵母细胞壁对于金黄色葡萄球菌的抑菌效果图。从图1和图3不难看出,对比例一制备得到的酵母细胞壁对大肠杆菌和金黄色葡萄球菌未有明显的抑菌效果。mic实验结果同样表明,对比例一制备得到的酵母细胞壁未能有效抑制大肠杆菌和金黄色葡萄球菌的生长。对比例二采用如下方法制备酵母细胞壁,并对制备得到的酵母细胞壁进行含量测定,对其抑菌效果和溶解度进行测定。(一)酵母细胞壁的制备采用如下方法制备得到酵母细胞壁:(1)采用酿酒酵母菌种酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418。将菌株斜面以2环的接种量至100ml摇瓶液体培养基中,放置摇床培养,设置转速250r/min,温度30℃,培养18h,得到活化培养的菌液。其中液体摇瓶培养基的配方为:水100ml,蛋白胨2g,酵母浸粉1g,葡萄糖2g,调节ph值为(5.0±0.2)。将摇瓶活化培养的菌液接种到50l发酵罐,设置转速400r/min,发酵温度30℃,发酵时间16h,得到酵母初级原料。其中,发酵培养基的配方为:总糖浓度为30%的糖蜜,10l;(nh4)2so4,500g;nh4h2po4,80g,mgso4,56g;znso4,28g;h2o,20l,ph值为4.0。(2)将上述酵母初级原料进行自溶处理,加入氯化钠,使得氯化钠的质量浓度为5%,ph值5.5,温度75℃,自溶25小时后,5000rpm离心处理,得到位于上层的酵母自溶物和位于下层的酵母细胞壁乳,收集酵母细胞壁乳进行酶解处理。(3)酶解:a.将步骤(2)得到的酵母细胞壁乳加水稀释成为15%的浓度,加入3‰质量浓度的甘露聚糖酶(以酵母细胞壁干物质计,以下同),控制温度55℃,ph值8.0,水解15小时;b.调节步骤a处理后的溶液的ph值为6,控制温度为55℃,然后继续加入0.5‰质量浓度的木瓜蛋白酶,酶解7小时;c.调节步骤c处理后的溶液的温度为90℃,保温处理1h,得到灭活后的溶液;d.调节灭酶后的溶液的温度为60℃,ph值为5.5,然后加入0.5‰质量浓度的纤维素酶,酶解8小时;e.调节步骤d处理后的溶液的温度为55℃,ph值为6.0,然后加入0.5‰质量浓度的β-葡聚糖酶,水解5小时;f.将步骤e得到的溶液升温至90℃保温处理1h,然后进行喷雾干燥处理,得到酵母细胞壁粉末。(二)酵母细胞壁的产品测定按照实施例一相同的方法,对对比例二制备得到的酵母细胞壁的溶解度、含量进行测定。检测得到对比例二制备得到的酵母细胞壁产品溶解率为32.0%,含有β-葡聚糖的质量含量为28.0%,甘露聚糖的质量含量为32.0%。其中,葡聚糖的分子量为1.15×106,占葡聚糖总量的99.05%,甘露聚糖的分子量为1.0×106,占甘露聚糖总量的99.45%。.(三)酵母细胞壁的抑菌效果按照与实施例一相同的方法对对比例二得到的酵母细胞壁进行抑菌效果的测定。测定结果如图1和图3所示。其中图1为酵母细胞壁对于大肠杆菌的抑菌效果图,图3为酵母细胞壁对于金黄色葡萄球菌的抑菌效果图。从图1和图3不难看出,对比例二制备得到的酵母细胞壁对大肠杆菌和金黄色葡萄球菌未呈现出明显的抑菌效果。mic实验结果显示,对比例二制备得到的酵母细胞壁未能有效抑制大肠杆菌和金黄色葡萄球菌的生长。对比例三采用如下方法制备酵母细胞壁,并对制备得到的酵母细胞壁进行含量测定,对其抑菌效果和溶解度进行测定。(一)酵母细胞壁的制备采用如下方法制备得到改性酵母细胞壁:(1)采用酿酒酵母菌种酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418。将菌株斜面以2环的接种量至100ml摇瓶液体培养基中,放置摇床培养,设置转速250r/min,温度30℃,培养18h,得到活化培养的菌液。其中液体摇瓶培养基的配方为:水100ml,蛋白胨2g,酵母浸粉1g,葡萄糖2g,调节ph值为(5.0±0.2)。将摇瓶活化培养的菌液接种到50l发酵罐,设置转速400r/min,发酵温度30℃,发酵时间16h,得到酵母初级原料。其中,发酵培养基的配方为:总糖浓度为30%的糖蜜,10l;(nh4)2so4,500g;nh4h2po4,80g,mgso4,56g;znso4,28g;h2o,20l,ph值为4.0。(2)将上述酵母初级原料进行自溶处理,加入氯化钠,使得氯化钠的质量浓度为3%,ph值6.5,温度55℃,自溶20小时后,5000rpm离心处理,得到位于上层的酵母自溶物和位于下层的酵母细胞壁乳,收集酵母细胞壁乳进行酶解处理。(3)酶解:a.将步骤(2)得到的酵母细胞壁乳加水稀释成为15%的浓度,加入3‰质量浓度的甘露聚糖酶(以酵母细胞壁干物质计,以下同),控制温度55℃,ph值8.0,水解15小时;b.继续加入3‰质量浓度的碱性蛋白酶,控制温度55℃,ph值8.5,水解时间为7小时;c.调节步骤b处理后的溶液的ph值为6,控制温度为55℃,然后继续加入0.5‰质量浓度的木瓜蛋白酶,酶解7时;d.调节步骤c处理后的溶液的温度为90℃,保温处理1h,得到灭活后的溶液;e.调节灭酶后的溶液的温度为60℃,ph值为5.5,然后加入0.5‰质量浓度的纤维素酶,酶解8小时;f..将步骤e得到的溶液升温至90℃保温处理1h,然后进行喷雾干燥处理,得到酵母细胞壁粉末。(二)改性酵母细胞壁的产品测定按照实施例一相同的方法,对对比例三制备得到的酵母细胞壁的溶解度、含量进行测定。检测得到对比例三制备得到的酵母细胞壁产品溶解率为30.4%,含有β-葡聚糖的质量含量为25.5%,甘露聚糖的质量含量为30.2%。其中,葡聚糖的分子量为4.7×106,占葡聚糖总量的99.90%,甘露聚糖的分子量为8.72×105,占甘露聚糖总量的99.57%。.(三)酵母细胞壁的抑菌效果按照与实施例一相同的方法对对比例三制备得到的酵母细胞壁进行抑菌效果的测定。测定结果如图2和图4所示。其中图2为酵母细胞壁对于大肠杆菌的抑菌效果图,图4为酵母细胞壁对于金黄色葡萄球菌的抑菌效果图。从图2和图4不难看出,对比例三制备得到的酵母细胞壁对大肠杆菌和金黄色葡萄球菌未有明显的抑菌效果。mic实验结果显示,对比例三制备得到的酵母细胞壁未能有效抑制大肠杆菌和金黄色葡萄球菌的生长。对比例四采用如下方法制备酵母细胞壁,并对制备得到的酵母细胞壁进行含量测定,对其抑菌效果和溶解度进行测定。(一)酵母细胞壁的制备采用如下方法制备得到改性酵母细胞壁:(1)采用酿酒酵母菌种酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418。将菌株斜面以2环的接种量至100ml摇瓶液体培养基中,放置摇床培养,设置转速250r/min,温度30℃,培养18h得到活化培养的菌液。其中液体摇瓶培养基的配方为:水100ml,蛋白胨2g,酵母浸粉1g,葡萄糖2g,ph值为(5.0±0.2)。将摇瓶活化培养的菌液接种到50l发酵罐,设置转速400r/min,发酵温度30℃,发酵时间16h,得到酵母初级原料。其中,发酵培养基的配方为:总糖浓度为30%的糖蜜,10l;(nh4)2so4,500g;nh4h2po4,80g,mgso4,56g;znso4,28g;h2o,20l,ph值为4.0。(2)将上述酵母初级原料进行自溶处理,加入氯化钠,使得氯化钠的质量浓度为3%,ph值6.5,温度55℃,自溶20小时后,5000rpm离心处理,得到位于上层的酵母自溶物和位于下层的酵母细胞壁乳,收集酵母细胞壁乳进行酶解处理。(3)酶解:a.将步骤(2)得到的酵母细胞壁乳加水稀释成为15%的浓度,加入3‰质量浓度的甘露聚糖酶(以酵母细胞壁干物质计,以下同),控制温度55℃,ph值8.0,水解15小时;b.继续加入3‰质量浓度的碱性蛋白酶,控制温度55℃,ph值8.5,水解时间为7小时;c.调节步骤b处理后的溶液的ph值为6,控制温度为55℃,然后继续加入0.5‰质量浓度的木瓜蛋白酶,酶解7小时;d.调节步骤c处理后的溶液的温度为90℃,保温处理1h,得到灭活后的溶液;e.调节灭酶后的溶液的温度为55℃,ph值为6.0,然后加入0.5‰质量浓度的β-葡聚糖酶,酶解16小时;f.将步骤e得到的溶液升温至90℃保温处理1h,然后进行喷雾干燥处理,得到酵母细胞壁粉末。(二)酵母细胞壁的产品测定按照实施例一相同的方法,对对比例四制备得到的酵母细胞壁的溶解度、含量进行测定。检测得到对比例四制备得到的酵母细胞壁产品溶解率为32.0%,含有β-葡聚糖的质量含量为32.8%,甘露聚糖的质量含量为29.7%。其中,葡聚糖的分子量为4.47×106,占葡聚糖总量的99.50%,甘露聚糖的分子量为9.65×105,占甘露聚糖总量的99.65%。.(三)酵母细胞壁的抑菌效果按照与实施例一相同的方法对对比例四制备得到的酵母细胞壁进行抑菌效果的测定。测定结果如图2和图4所示。其中图2为酵母细胞壁对于大肠杆菌的抑菌效果图,图4为酵母细胞壁对于金黄色葡萄球菌的抑菌效果图。从图2和图4不难看出,对比例四制备得到的酵母细胞壁对大肠杆菌和金黄色葡萄球菌均未有明显的抑菌效果。mic实验结果显示,对比例四制备得到的酵母细胞壁均未能有效抑制大肠杆菌和金黄色葡萄球菌的生长。对比例五采用如下方法制备酵母细胞壁,并对制备得到的酵母细胞壁进行含量测定,对其抑菌效果和溶解度进行测定。(一)酵母细胞壁的制备首先利用酿酒酵母菌种酿酒酵母fx-2(saccharomycescerevisiaefx-2),保藏编号为cctccno:m2016418,参照中国发明专利申请,申请号为201210025279.x,公开号为cn103243028a实施例中记载的方法,按照干物质比10质量%的比例(酵母干物质和水的质量比例1∶9)调配成酵母乳20kg,然后在89℃煮1小时,然后降温至65℃、按照酵母干物质添加量2‰的比例加入木瓜蛋白酶、调ph至5.5,作用6小时;然后再调节ph5.0,温度为68℃、按照酵母干物质添加量1.0‰的比例加核酸酶,作用8小时后,再降温至50℃,调节ph5.6,按照酵母干物质添加量0.2‰的比例添加细菌蛋白酶,作用5小时;然后通过85℃下灭酶30分钟,最后通过离心处理,离心后取重相,进行喷粉干燥,即得酵母细胞壁。(二)酵母细胞壁的产品测定按照实施例一相同的方法,对对比例五制备得到的改性酵母细胞壁的溶解度、含量进行测定。检测得到对比例五制备得到的酵母细胞壁产品溶解率为22.50%,含有β-葡聚糖的质量含量为20.0%,甘露聚糖的质量含量为60%。其中,葡聚糖的分子量为1.07×107,占葡聚糖总量的99.8%,甘露聚糖的分子量为4.6×106,占甘露聚糖总量的99.50%。.(三)酵母细胞壁的抑菌效果按照与实施例一相同的方法对对比例五制备得到的酵母细胞壁进行抑菌效果的测定。测定结果如图2和图4所示。其中图2为酵母细胞壁对于大肠杆菌的抑菌效果图,图4为酵母细胞壁对于金黄色葡萄球菌的抑菌效果图。从图2和图4不难看出,对比例五制备得到的酵母细胞壁对大肠杆菌和金黄色葡萄球菌未有明显的抑菌效果。mic实验结果显示,对比例五制备得到的酵母细胞壁均未能有效抑制大肠杆菌和金黄色葡萄球菌的生长。从以上实施例不难看出,利用酵母菌株进行自溶处理,然后利用甘露聚糖酶、碱性蛋白酶、木瓜蛋白酶、纤维素酶和β-葡聚糖酶进行酶解处理,得到改性后的酵母细胞壁,主要表现在该改性后的酵母细胞壁相比较于对比例中得到的酵母细胞壁,表现出明显的抑菌效果,仅次于庆大霉素,甚至对于金黄色葡萄球菌的抑制效果还有优于庆大霉素。而且,实施例一到实施例三制备得到的β-葡聚糖中,将近99%以上的β-葡聚糖的相对分子质量为3.3×105-1.0×106,所制备得到的甘露聚糖中,99%以上的甘露聚糖的相对分子质量为8.6×105-2.0×106,与对比例一到五相比,β-葡聚糖和甘露聚糖的分子量要更小,与此同时,溶解率也要更高。对比例一到对比例四在制备酵母细胞壁的过程中,采用四种酶进行酶解,未表现出抑菌效果。对比例五利用木瓜蛋白酶、核酸酶和细菌蛋白酶进行酶解处理,所得到的酵母细胞壁也未表现出抑菌效果。畜牧养殖业中,普通环境下饲养的畜禽肠道栖生着大量的正常细菌,这些细菌主要包括杆菌、球菌、乳酸菌、双歧杆菌、梭菌等,它们构成了肠道的微生物屏障。当养殖动物抵抗力下降时,肠道微生物菌群数量和菌群之间的平衡被打破,致病微生物就会使动物生病,若不及时治疗,疾病容易在养殖动物中扩散,严重影响动物健康。长期以来,兽用抗生素在防治动物疫病、保障公共卫生安全中发挥着重要作用。畜牧业养殖过程中添加的抗生素通过选择性作用于微生物特定的部位(靶位),干扰细菌的生长繁殖,杀灭或抑制微生物。抗生素的作用机制可分为4类:干扰细菌细胞壁合成、损伤细菌细胞膜渗透性、抑制细菌蛋白质合成、抑制细菌核酸合成。然而,抗生素残留也引发了一系列食品安全、环境污染、超级细菌风险等严重问题。农业部在2016年7月发布的2428号公告,已决定在2017年4月30日前全面停止硫酸粘杆菌素作为饲料添加剂用于动物促生长。总的而言,抗生素替代产品成为市场热点以及行业变革的趋势。通过本发明的方法制备得到的酵母细胞壁β-葡聚糖和甘露聚糖的分子量范围更小,溶解率更高,而且对于肠道典型性致病菌,例如大肠杆菌和金黄色葡萄球菌都表现出明显的抑菌效果。应用在饲料添加领域,将可以提升动物的免疫力,增强动物的机体健康,可以被作为一种理想的饲用抗生素的替代品。以上所述,仅是本发明实施的较佳实施例,并非对本发明做任何形式上的限制,凡在本发明的精神和原则之内所做的修改、等同替换和改进等,均需要包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1