一种毛囊干细胞的制备方法与流程
本发明属于生物化学技术领域,尤其涉及一种毛囊干细胞的制备方法。
背景技术:
皮肤是人体中表面积最大的器官,在抵御微生物入侵,紫外线辐射以及防止水分的丢失、调节体温方面起重要作用,当皮肤组织遭到缺损,传统的治疗方法是自体断层皮片移植,但存在供皮量有限和造成额外损伤的障碍。
利用体外培养的人工皮肤即组织工程皮肤作为移植的来源可以从根本上解决这个问题,但是如何获得种子细胞却一直困扰着人们。随着医学生物学的发展,皮肤组织工程的深入,毛囊干细胞作为一种新的种子细胞逐渐受到人们的关注,越来越多的研究表明,毛囊干细胞存在具有多向分化的潜能。然而,现有技术中,毛囊干细胞的制备方法存在着:获得困难以及无法满足伦理学要求的技术缺陷。
因此,研发出一种毛囊干细胞的制备方法,用于解决现有技术中,毛囊干细胞的制备方法存在着原材料获得困难以及无法满足伦理学要求的技术缺陷,成为了本领域技术人员亟待解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种毛囊干细胞的制备方法,用于解决现有技术中,毛囊干细胞的制备方法存在着原材料获得困难以及无法满足伦理学要求的技术缺陷。
本发明提供了一种毛囊干细胞的制备方法,所述制备方法为:
步骤一、收集尿液细胞;
步骤二、尿液细胞重编程:表达转录调控因子导入尿液细胞后,在培养基中培养,得诱导多功能细胞;
步骤三、诱导多功能细胞诱导培养:所述诱导多功能细胞消化后,培养至融合度大于70%后进行诱导培养,形变得间充质干细胞;
步骤四、间充质干细胞诱导培养;所述间充质干细胞消化后,培养至融合度大于80%后进行诱导培养,形变得毛囊干细胞。
优选地,所述毛囊干细胞的制备方法还包括:
步骤五、毛囊干细胞的扩增:毛囊干细胞于培养液e中培养;
所述培养液e包括:dmem基础培养基、fbs、0.001~0.1%t-β、1~100ng/mlhegf、1-100ng/mlvegf以及1~10mmol/ll-谷氨酰胺;
其中,dmem基础培养基与fbs的体积比为9:1。
优选地,步骤一所述尿液细胞的收集方法为:尿液与青霉素/链霉素双抗混合后离心弃上清液后,再与含有青霉素/链霉素的pbs溶液混合后离心弃上清液,将剩余液体置于0.1%明胶包被的孔中,加入含primocinregm培养基进行培养。
优选地,步骤一所述尿液细胞的融合度大于80%。
优选地,步骤二所述表达转录调控因子选自:oct4、sox2、nanog、klf4以及lin28中的一种或多种。
优选地,步骤二所述尿液细胞重编程的方法为:表达转录调控因子导入尿液细胞后,用培养液a培养一天后,更换培养基为ips培养基mtesr培养六天后,挑选与人胚胎干细胞形态相近的单克隆,所述单克隆接种于matrigel包被的培养环境中,培养基mtesr培养得多功能细胞;
所述培养液a包括:regm与mef。
优选地,步骤三所述多功能细胞诱导培养的方法为:所述诱导多功能细胞融合度消化后,培养至融合度大于70%后,加入培养液b培养至细胞发生形变后,更换培养液c进行培养,得间充质干细胞;
所述培养液b包括:dmem基础培养基、fbs、1~160pm胰岛素、1~10mml-谷氨酰胺、50~200ug/lbfgf、5~50ug/lscf以及2~5×10-8mol/l地塞米松,其中,dmem基础培养基与fbs的体积比为9:1;
所述培养液c包括:dmem基础培养基、fbs、1~100ng/mlhegf、1~100ng/mlbfgf、1~50ng/mlhgf、、2~20ng/mlpdgf以及1~25ng/mltgf-β,其中,dmem基础培养基与fbs的体积比为9:1。
优选地,培养液b的培养时间为5~7天。
优选地,所述间充质干细胞消化后,培养至融合度大于80%后,加入培养液d培养,得毛囊干细胞;
所述培养液d包括:dmem基础培养基、fbs、1~115ng/mlhegf、0.05~100ng/mligf、0.01~10ug/l氢化可的松、1~150ng/ml亚油酸、0.5~10ug/mlhgf、30~200ng/mlwnt3a以及10~65ug/mlkgf-7,其中,,dmem基础培养基与fbs的体积比为9:1。
优选地,培养液d的培养时间为7~8天。
综上所述,本发明提供了一种毛囊干细胞的制备方法,所述制备方法为:步骤一、收集尿液细胞;步骤二、尿液细胞重编程:表达转录调控因子导入尿液细胞后,在培养基中培养,得诱导多功能细胞;步骤三、诱导多功能细胞诱导培养:所述诱导多功能细胞消化后,培养至融合度大于70%后进行诱导培养,形变得间充质干细胞;步骤四、间充质干细胞诱导培养;所述间充质干细胞消化后,培养至融合度大于80%后进行诱导培养,形变得毛囊干细胞。通过本发明提供的技术方案制得的毛囊干细胞,毛囊干细胞的阳性标志物ck15在多数毛囊组织来源的铺路石样细胞中呈阳性表达;同时,通过流式细胞仪分析显示,在毛囊干细胞中ck15、ck19、cd200、β1表达为阳性,符合毛囊干细胞表面标记物的表达结果。本发明提供的一种毛囊干细胞的制备方法,解决了现有技术中,毛囊干细胞的制备方法存在着原材料获得困难以及无法满足伦理学要求的技术缺陷。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1为本发明实施例中,一种毛囊干细胞的制备方法的流程示意图;
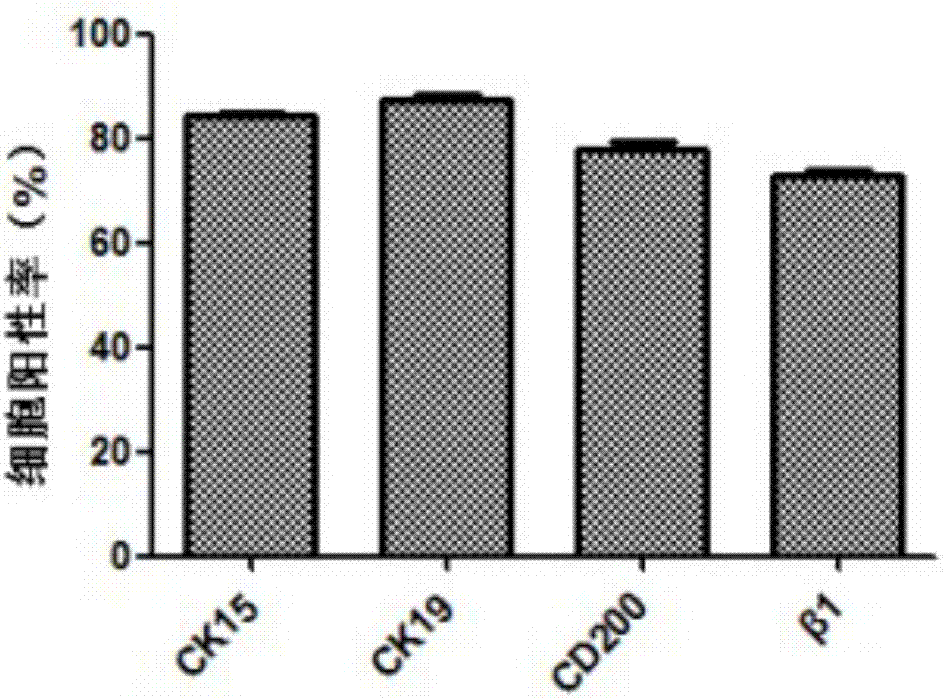
图2为本发明实施例提供的一种毛囊干细胞的制备方法中,所制得的毛囊干细胞表面标记物流式检测结果图。
具体实施方式
本发明实施例提供了一种毛囊干细胞的制备方法,用于解决现有技术中,毛囊干细胞的制备方法存在着获得原材料困难以及无法满足伦理学要求的技术缺陷。
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
为了更详细说明本发明,下面结合实施例对本发明提供的一种毛囊干细胞的制备方法,进行具体地描述。
实施例1
培养基a:regm与mef培养基按体积比为1:1混合。
培养基b:450mldmem基础培养基、50mlfbs、80pm胰岛素、5mml-谷氨酰胺、85ug/lbfgf、15ug/lscf以及3×10-8mol/l地塞米松。
培养基c:450mldmem基础培养基、50mlfbs、10ng/mlhegf、10ug/lbfgf、3ng/mlhgf、5ng/mlpdgf以及5ng/mltgf-β。
培养基d:450mldmem基础培养基、50mlfbs、15ng/mlhegf、10ng/mligf、0.5ug/l氢化可的松、100ng/ml亚油酸、4ug/mlhgf、150ng/mlwnt3a以及13ug/mlkgf-7。
培养基e:450mldmem基础培养基、50mlfbs、0.015%t-β、10ng/mlhegf、10ng/mlvegf以及2.5mmol/ll-谷氨酰胺。
步骤一、收集尿液细胞
1)收集杯每个加2ml青霉素/链霉素双抗。
2)收集尿液,如不立刻进行后续操作,则将尿液存储于4℃冰箱并于当天完成后续操作。
3)每份尿液准备六孔板1孔,将此孔用0.1%明胶包被20min以上,使用前吸去孔内液体。
4)把尿液倒到合适数量的50ml离心管里,离心400g,10min。
5)吸去上清,每管留下约1-5ml,混合到一个离心管内。
6)加入含有青霉素/链霉素的pbs(pbs95ml加入5ml青霉素/链霉素混匀)约10-30ml。轻轻混匀。
7)离心400g,10min。
8)吸去上清至剩余0.5-1ml液体。
9)把剩余的液体加入包被好的孔中,加入2mlregm培养基加入3μlprimocin。
10)将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后,吸去培养基,用pbs洗一遍,再进行换液处理。
11)当尿液细胞融合度达到80%,则可进行传代培养。
步骤二、尿液细胞重编程
1)将表达转录调控因子oct4、sox2、nanog、klf4和lin28共同导入尿液细胞,将细胞分至预先用matrigel包被的6孔板中,用培养液a培养。
2)转染后第2天,将培养基更换为ips培养基mtesr,每天更换新鲜培养基;使克隆继续增殖。
3)转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,培养基mtesr培养获得诱导多能干细胞。
步骤三、诱导多功能细胞诱导培养
1)将制备好的诱导多能干细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,mtesr培养基进行培养。
2)待六孔板中的诱导多能干细胞融合度达到70%时,pbs清洗将培养基清除干净,加入培养液b进行诱导培养,每天更换培养液。
3)培养5-7d细胞发生形变,更换培养液c进行培养。
步骤四、间充质干细胞诱导培养
1)将制备好的间充质干细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,培养基c进行培养。
2)待六孔板中的间充质干细胞融合度达到80%时,pbs清洗将培养基c清除干净,加入培养液d进行诱导培养7-8d,每天更换培养液。
步骤五、毛囊干细胞的扩增:毛囊干细胞于培养液e中培养。
实施例2
培养基a:regm与mef培养基按体积比为1:1混合。
培养基b:450mldmem基础培养基、50mlfbs、1pm胰岛素、1mml-谷氨酰胺、50ug/lbfgf、5ug/lscf以及2×10-8mol/l地塞米松。
培养基c:450mldmem基础培养基、50mlfbs、1ng/mlhegf、100ug/lbfgf、1ng/mlhgf、10ng/mlpdgf以及10ng/mltgf-β。
培养基d:450mldmem基础培养基、50mlfbs、10ng/mlhegf、1ng/mligf、1ug/l氢化可的松、1ng/ml亚油酸、5ug/mlhgf、30ng/mlwnt3a以及10ug/mlkgf-7。
培养基e:450mldmem基础培养基、50mlfbs、0.001%t-β、1ng/mlhegf、100ng/mlvegf以及1mmol/ll-谷氨酰胺。
步骤一、收集尿液细胞
1)收集杯每个加2ml青霉素/链霉素双抗。
2)收集尿液,如不立刻进行后续操作,则将尿液存储于4℃冰箱并于当天完成后续操作。
3)每份尿液准备六孔板1孔,将此孔用0.1%明胶包被20min以上,使用前吸去孔内液体。
4)把尿液倒到合适数量的50ml离心管里,离心400g,10min。
5)吸去上清,每管留下约1-5ml,混合到一个离心管内。
6)加入含有青霉素/链霉素的pbs(pbs95ml加入5ml青霉素/链霉素混匀)约10-30ml。轻轻混匀。
7)离心400g,10min。
8)吸去上清至剩余0.5-1ml液体。
9)把剩余的液体加入包被好的孔中,加入2mlregm培养基加入3μlprimocin。
10)将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后,吸去培养基,用pbs洗一遍,再进行换液处理。
11)当尿液细胞融合度达到80%,则可进行传代培养。
步骤二、尿液细胞重编程
1)将表达转录调控因子oct4、sox2、nanog、klf4和lin28共同导入尿液细胞,将细胞分至预先用matrigel包被的6孔板中,用培养液a培养。
2)转染后第2天,将培养基更换为ips培养基mtesr,每天更换新鲜培养基;使克隆继续增殖。
3)转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,培养基mtesr培养获得诱导多能干细胞。
步骤三、诱导多功能细胞诱导培养
1)将制备好的诱导多能干细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,mtesr培养基进行培养。
2)待六孔板中的诱导多能干细胞融合度达到70%时,pbs清洗将培养基清除干净,加入培养液b进行诱导培养,每天更换培养液。
3)培养5-7d细胞发生形变,更换培养液c进行培养。
步骤四、间充质干细胞诱导培养
1)将制备好的间充质干细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,培养基c进行培养。
2)待六孔板中的间充质干细胞融合度达到80%时,pbs清洗将培养基c清除干净,加入培养液d进行诱导培养7-8d,每天更换培养液。
步骤五、毛囊干细胞的扩增:毛囊干细胞于培养液e中培养。
实施例3
培养基a:regm与mef培养基按体积比为1:1混合。
培养基b:450mldmem基础培养基、50mlfbs、100pm胰岛素、10mml-谷氨酰胺、200ug/lbfgf、50ug/lscf以及2.5×10-8mol/l地塞米松。
培养基c:450mldmem基础培养基、50mlfbs、100ng/mlhegf、1ug/lbfgf、50ng/mlhgf、20ng/mlpdgf以及25ng/mltgf-β。
培养基d:450mldmem基础培养基、50mlfbs、115ng/mlhegf、100ng/mligf、10ug/l氢化可的松、150ng/ml亚油酸、10/mlhgf、200ng/mlwnt3a以及65ug/mlkgf-7。
培养基e:450mldmem基础培养基、50mlfbs、0.1%t-β、100ng/mlhegf、1ng/mlvegf以及10mmol/ll-谷氨酰胺。
步骤一、收集尿液细胞
1)收集杯每个加2ml青霉素/链霉素双抗。
2)收集尿液,如不立刻进行后续操作,则将尿液存储于4℃冰箱并于当天完成后续操作。
3)每份尿液准备六孔板1孔,将此孔用0.1%明胶包被20min以上,使用前吸去孔内液体。
4)把尿液倒到合适数量的50ml离心管里,离心400g,10min。
5)吸去上清,每管留下约1-5ml,混合到一个离心管内。
6)加入含有青霉素/链霉素的pbs(pbs95ml加入5ml青霉素/链霉素混匀)约10-30ml。轻轻混匀。
7)离心400g,10min。
8)吸去上清至剩余0.5-1ml液体。
9)把剩余的液体加入包被好的孔中,加入2mlregm培养基加入3μlprimocin。
10)将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后,吸去培养基,用pbs洗一遍,再进行换液处理。
11)当尿液细胞融合度达到80%,则可进行传代培养。
步骤二、尿液细胞重编程
1)将表达转录调控因子oct4、sox2、nanog、klf4和lin28共同导入尿液细胞,将细胞分至预先用matrigel包被的6孔板中,用培养液a培养。
2)转染后第2天,将培养基更换为ips培养基mtesr,每天更换新鲜培养基;使克隆继续增殖。
3)转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,培养基mtesr培养获得诱导多能干细胞。
步骤三、诱导多功能细胞诱导培养
1)将制备好的诱导多能干细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,mtesr培养基进行培养。
2)待六孔板中的诱导多能干细胞融合度达到70%时,pbs清洗将培养基清除干净,加入培养液b进行诱导培养,每天更换培养液。
3)培养5-7d细胞发生形变,更换培养液c进行培养。
步骤四、间充质干细胞诱导培养
1)将制备好的间充质干细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,培养基c进行培养。
2)待六孔板中的间充质干细胞融合度达到80%时,pbs清洗将培养基c清除干净,加入培养液d进行诱导培养7-8d,每天更换培养液。
步骤五、毛囊干细胞的扩增:毛囊干细胞于培养液e中培养。
实施例4
本实施例为验证实施例1~实施例3制得的细胞产品细胞活力的具体实施例。
采用mtt法,对各实施例制得细胞的活率进行检测,由于mtt法为本领域技术人员都熟知的现有技术,在此不再赘述。
实验结果表明,实施例1~3制得毛囊干细胞的活力依次为95.77%、92.57%、93.68%,实施例1~3制得的干细胞的活力无显著性差异,说明均能达到预期效果。
实施例5
本实施例为检测实施例1~3制得的细胞产品是否为毛囊干细胞的具体实施例。
5.1免疫荧光鉴定毛囊干细胞表面标志物
①0.25%胰酶消化实施例制得的细胞,以1×105的接种量接种于12孔板中,待其贴壁,4%的多聚甲醛固定2h,pbs洗三遍;
②加200μl的一抗稀释液(pbs+10%血清+0.3%tritonx-100)常温封闭1-2h;
③弃去一抗稀释液,加入200μl鼠源ck15一抗抗体(稀释度为1:100),4℃孵育过夜,pbs冲洗三次3次,每次5min;
④加200μlfitc标记抗鼠二抗(1:400),常温避光反应1h,pbs冲洗;上机检测前用pi染核;
结果判定:荧光倒置显微镜下观察结果可见,毛囊干细胞的阳性标志物ck15在多数毛囊组织来源的铺路石样细胞中呈阳性表达。荧光素fitc标记抗体与ck15单克隆抗体结合,在胞浆中表现为绿色荧光,pi试剂染毛囊组织来源细胞的胞核为红色。
5.2流式细胞仪检测毛囊干细胞表面标志物
①0.25%胰酶消化实施例制得的细胞并收集细胞,使其细胞数为2×105个/每例样本;
②细胞胞重悬于1mldpbs中洗涤2次,200g,离心5min;
③每管样本加入1ml70%预冷的酒精重悬固定2h;
④离心弃去固定液,加入200μl鼠源ck15、ck19、cd200、β1一抗抗体(稀释度为1:100)常温下孵育30min;
⑤1mlpb洗涤后,分别与fitc标记二抗(稀释度为1:200)常温避光孵育1h;
⑥pbs洗两次后,弃去pbs,根据细胞量加入适量的pbs重悬细胞,利用流式细胞仪检测。
结果判定:通过流式细胞仪分析显示,所得具体实验结果可参阅图2,在毛囊干细胞中ck15、ck19、cd200、β1表达为阳性,符合毛囊干细胞表面标记物的表达结果。
从上述技术方案可以得出,本发明提供的一种毛囊干细胞的制备方法,具有以下优点:
1、毛囊干细胞是经诱导多能干细胞分化出的间充质干细胞诱导分化而来的,与获得骨髓或脐带间充质相比,来源广泛,操作方便;
2、有效地回避了胚胎干细胞所面临的伦理学困扰,为干细胞的研究指明了方向,奠定了基础;
3、诱导多能干细胞是经尿液细胞重编程获得的,取材方便,不会给患者带来不必要的痛苦。
综上所述,本发明提供了一种毛囊干细胞的制备方法,所述制备方法为:步骤一、收集尿液细胞;步骤二、尿液细胞重编程:表达转录调控因子导入尿液细胞后,在培养基中培养,得诱导多功能细胞;步骤三、诱导多功能细胞诱导培养:所述诱导多功能细胞消化后,培养至融合度大于70%后进行诱导培养,形变得间充质干细胞;步骤四、间充质干细胞诱导培养;所述间充质干细胞消化后,培养至融合度大于80%后进行诱导培养,形变得毛囊干细胞。通过本发明提供的技术方案制得的毛囊干细胞,毛囊干细胞的阳性标志物ck15在多数毛囊组织来源的铺路石样细胞中呈阳性表达;同时,通过流式细胞仪分析显示,在毛囊干细胞中ck15、ck19、cd200、β1表达为阳性,符合毛囊干细胞表面标记物的表达结果。本发明提供的一种毛囊干细胞的制备方法,解决了现有技术中,毛囊干细胞的制备方法存在着原材料获得困难以及无法满足伦理学要求的技术缺陷。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 从人胎盘羊膜制备羊膜间充质干细胞的方法及其应用与流程
- 一种脐疗贴的制备方法及应用与流程
- 一种干细胞制剂及其在制备治疗慢性肾炎的药物中的应用的制作方法与工艺
- 脐带间充质干细胞在制备治疗角膜损伤的干细胞制剂中的应用的制作方法与工艺
- 脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用的制作方法与工艺
- 由脐带间充质干细胞制备CD34阳性细胞的方法与流程
- 基因重组干细胞制剂的制备方法及其在皮肤损伤修复、瘢痕抑制中的应用与流程
- 一种大规模制备人脐带间充质干细胞因子用诱导分泌培养基的制作方法与工艺
- 一种人母乳干细胞的制备方法及其应用与流程
- 间充质干细胞联合维生素E在制备肾脏组织细胞修复药物中的应用的制作方法与工艺